2. 合肥诺明药物安全研究有限公司, 安徽 合肥 230031;
3. 合肥合源药业有限公司, 安徽 合肥 230031
2. Hefei Blooming Drug Safety Evaluation, Co. LTD., Hefei 230031, China;
3. Hefei Cosource Pharmaceuticals Inc., Hefei 230031, China
(R)-1-(3-(4-amino-3-(4-phenoxyphenyl)-1H-pyrazolo[3, 4-d]pyrimidin-1-yl)piperidin-1-yl)-2-(dimethylamino)ethanone (实验室代号: CHMFL-FLT3-122, 以下简称HYML-122)是治疗急性髓性白血病(acute myelocytic leukemia, AML)的小分子酪氨酸激酶抑制剂, 由依鲁替尼结构修饰优化得到, 已被证实能够有效抑制FMS样的酪氨酸激酶3 (Fms-liketyrosinekinase, FLT3)介导的下游信号通路并使细胞停留在G0/G1周期诱导其凋亡[1-3]。与上市药物舒尼替尼(Sunitinib, Sutent®)、Midosturin (RYDAPT®, 2017年由FDA批准上市)相比, 具有特异性高、不良反应小的优势, 是治疗AML的潜力药物[4, 5]。为进一步探索药物在动物体内吸收、分布和清除过程, 并为临床前实验提供有力参考, 根据早期体外结果选取大鼠灌胃给予[14C]HYML-122, 采用同位素示踪技术检测体内药物含量, 并鉴定代谢产物, 为进一步研究提供物质基础和理论依据。
材料与方法药品与试剂 HYML-122 (合肥合源药业有限公司, 批号: 20151002, 含量: 99.5%), [14C]HYML-122 (Moravek Biochemicals, 批号: 490-044-054-A-20160115-JSU, 纯度: 98.8%, 放射性比活度: 2.14 GBq·mmol-1), 乙腈、甲酸、氨水、异丙醇(上海凌峰化学试剂有限公司, 分析纯), 甲醇(Merck公司, 色谱纯), 羟丙甲纤维素(简称HPMC, Sigma公司, 分析纯), 超纯水(Millipore公司)。
仪器 液体闪烁计数仪、固体闪烁计数仪(Perkin Elmer仪器公司); 在线放射性同位素检测仪(AIM研究公司); 氧化燃烧仪(R.J. Harvey公司); CBM-20A UFLC系统: LC-20AD XR泵、SIL-20A XR自动采样器、SCL-20A系统控制器及LC Solution数据采集处理软件(岛津仪器公司); 自动馏分收集仪(ISCO公司); LTQ Orbitrap XL液质联用仪(Thermo公司); 电子天平(Mettler Toledo公司); 离心机(Eppendorf公司)。
动物 Sprague Dawley大鼠52只(雌雄各半)购自北京维通利华实验动物技术有限公司(许可证号: SCXK (京) 2012-0001), 8~11周龄, 雌性192.6~238.2 g, 雄性211.1~265.1 g, 本实验通过南京美新诺医药科技有限公司的实验动物伦理委员会批准, 动物福利和实验过程遵循AAALAC规定(实验室动物饲养管理和使用标准)。
给药剂量 静脉给药(iv): 5 mg·kg-1 (放射性为3.7×106 Bq, 比活度为7.4×105 Bq·mg-1); 灌胃给药(ig): 50 mg·kg-1 (放射性为3.7×106 Bq, 比活度为7.4×104 Bq·mg-1)。
药代动力学研究(1组) 12只颈静脉插管大鼠(雌雄各半)分为iv和ig两组, 于给药前(0 h)和给药后0.083 h (iv), 0.25、0.5、1、2、4、6、8、12、24和48 h (ig)取血约0.3 mL于含抗凝剂(EDTA-2K)采血管中, 1 800 ×g离心5 min分离血浆, 另有雌雄大鼠各一只于灌胃给药后2、4、6、8和12 h取血约0.75 mL, 分离血浆作为代谢物鉴定补充样品, 检测前置于−20 ℃冰箱保存。
分布研究(2组) 24只大鼠(雌雄各半)分为4组, 灌胃给药后0.5、4、24和48 h各取一组取全血、骨骼肌(股骨)、体脂(腹腔)、脑、心、肺、肝、脾、肾、胃壁、肠道壁和生殖腺(雌性卵巢子宫、雄性睾丸附睾), 全血分装0.5 mL, 剩余1 800 ×g离心5 min分离血浆, 检测前置于−20 ℃冰箱保存。
排泄、代谢研究(3组) 12只大鼠(雌雄各半), 分为整体和胆插管(bile duct cannulated, BDC)两组, 灌胃给药。整体大鼠给药后收集0~8、8~24 (粪便0~24 h)、24~48、48~72、72~96、96~120、120~144和144~168 h尿液、粪便、笼具清洗液样品, BDC大鼠给药后收集0~4、4~8 (粪便、尿液0~8 h)、8~24、24~48和48~72 h胆汁、尿液、粪便、笼具清洗液样品, 检测前置于−20 ℃冰箱保存。
空白对照 雌雄大鼠各一只灌胃给予空白溶媒(0.5% HPMC)收集全血、血浆和组织作为对照, 使用前置于−20 ℃冰箱保存。
样品处理 吸收、分布、排泄样品:粪便加适量异丙醇水溶液(1:1, v/v)、组织加4倍体积纯水匀浆处理, 血浆、胆汁、尿液和笼具清洗液检测前涡旋混匀。代谢样品:按AUC[6]方法分别混合1组(ig组)雌雄大鼠0~12 h血浆样品, 加3倍体积甲醇提取并分离上清, 残渣以甲醇提取两次, 合并提取液吹干, 以甲醇水(1:1, v/v)复溶; 按相同体积或重量占比分别混合2组BDC雌雄大鼠0~48 h胆汁样品、整体雌雄大鼠0~24 h尿液样品和0~48 h粪便样品。粪便加3倍体积甲醇提取并分离上清, 残渣以甲醇提取3次, 合并提取液吹干, 以甲醇水(1:1, v/v)复溶, 胆汁和尿液样品10 000 r·min-1离心10 min分离上清。
放射性检测 取血浆、胆汁、尿液约0.1 g, 笼具清洗液约1 g, 分别加入5~10 mL闪烁液混匀后由液体闪烁计数仪测定放射性; 取粪便、全血和组织器官处理后样品约0.1 g充分燃烧, 由液闪计数仪测定闪烁液捕捉的[14C]CO2放射性。
色谱条件 HydroBondAQ柱(5.0 µm, 250 mm×4.6 mm), 柱温30 ℃, 流速为0.7 mL·min-1, A相为0.4%甲酸水溶液(NH4OH调至pH 3.2), B相为乙腈, 梯度洗脱程序: 0~5 min, 100% A; 5~10 min, 100%~75% A; 10~15 min, 75% A; 15~50 min, 75%~55% A; 50~55 min, 55%~0% A; 55~60 min, 100% B; 60~62 min, 0%~100% A; 62~77 min, 100% A。
质谱条件 离子化电压为4.5 kV, 毛细管温度为350 ℃, 鞘气、辅助气、吹扫气压力分别为40、20和15 psi (1 psi≈6.9 kPa), 碰撞器压力为23~27 eV, 毛细管电压为35 V, Tube Lens Offset为80 V。
药代动力学分析 应用WinNonlin软件(6.3版, Pharsight)按照非房室模型分析血浆总药物浓度数据, 统计药代动力学参数, 使用Excel 2016统计胆汁、尿液、粪便和笼具清洗液中放射性排泄率。
结果 1 雌雄大鼠静脉/口服给药后药代动力学特征单次静脉注射给予雌雄大鼠5 mg·kg-1 [14C]HYML-122后, 血浆中药物快速消除, 24 h浓度低于定量下限(图 1a)。单次灌胃给予雌雄大鼠50 mg·kg-1 [14C]HYML-122后, 总药物浓度均于2 h达峰, 随后消除, 12 h检测到少量放射性, 24 h浓度低于定量下限(图 1b)。经计算雌雄大鼠口服生物利用分别为50.92%和45.83%, 药代动力学参数详见表 1。
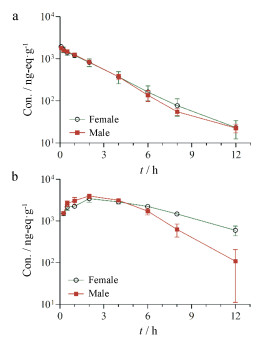
|
Figure 1 The total radioactivity-time profile in plasma after intravenous injection of 5 mg·kg-1 (a) or oral administration of 50 mg·kg-1 (b) [14C]HYML-122 to rats |
| Table 1 Pharmacokinetic parameters of total radioactivity in plasma. aIn the calculation of Cmax, AUC, CL and Vss, 1 g plasma was equivalent to 1 mL. bF(%) = [AUC0-12 h (po)/Dose (po)]/[AUC0-12 h (iv)/Dose (iv)]×100%. −: Not applicable |
HYML-122分布广泛(图 2)。相同组织以雌雄均值计算, 给药后0.5 h胃壁、肠道壁、肝、肺、肾、脾、心和卵巢子宫的平均总药物浓度是血浆的2.01 (卵巢子宫)~77.12倍(胃壁), 其余组织均低于或近似于血浆, 按浓度从高到低依次为骨骼肌、体脂、全血、睾丸附睾和全脑(BLQ)。给药后4 h, 除骨骼肌、体脂、脾和生殖腺外, 各组织总药物浓度均开始下降, 以胃壁、肝和肺最为明显, 分别下降了74.71%、44.40%和44.18%。给药后24 h, 药物明显消除, 仅在肠道壁、肝、肾、脾、肺、胃壁和睾丸附睾中检测到少量。末次采集时间点(48 h)各组织中药物消除完全。
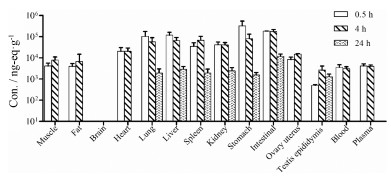
|
Figure 2 Total radioactivity concentration in tissues at 0.5, 4 and 24 h after oral administration |
液质联用(LC-MS/MS)方法对大鼠血浆、胆汁、尿液和粪便样品中的代谢产物进行结构鉴定, 除原形药外, 共鉴定了14个主要代谢产物, 包括Ⅰ相代谢产物10个, Ⅱ相代谢产物4个。分别指定为M386 (酰胺水解产物)、M402 (酰胺水解、单氧化产物)、M443 (N-去二甲基产物)、M444 (N-去二甲基、氧化脱氨产物)、M457 (N-去甲基产物)、M473 (N-去甲基、单氧化产物)、M482 (酰胺水解、单氧化、硫酸结合产物)、M487 (单氧化产物)、M503a~M503c (双氧化产物)、M553 (N-去甲基、单氧化、硫酸结合产物)、M567 (单氧化、硫酸结合产物)和M679 (双氧化、葡萄糖醛酸结合产物), 代谢产物主要质谱数据见表 2。HYML-122在大鼠体内主要经历N-去烃基、氧化和酰胺水解, 进一步与硫酸或葡萄糖醛酸结合形成Ⅱ相代谢产物, 代谢路径详见图 3。
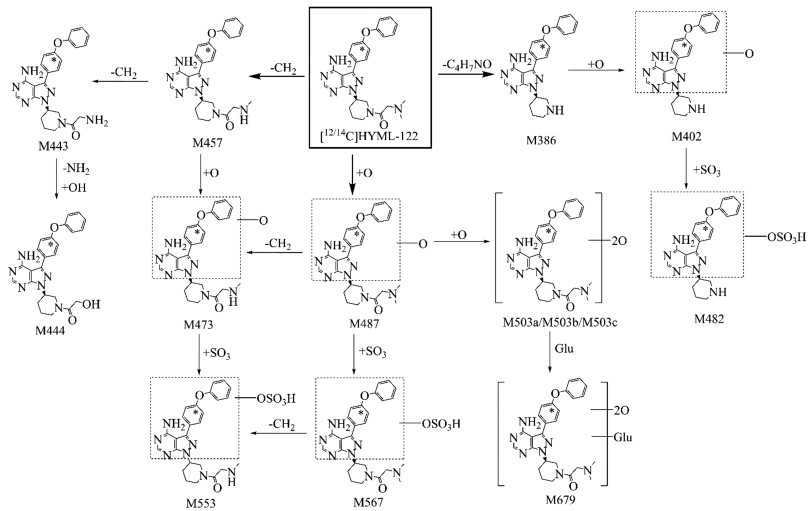
|
Figure 3 Main metabolic pathways of HYML-122 in rats. *Where [14C] labelled |
| Table 2 Key mass spectral data for HYML-122 metabolites. P: Plasma; U: Urine; B: Bile; F: Feces |
[12C]HYML-122在高分辨质谱中准分子离子峰为[M+H]+ m/z 472.245 8, 在(+)CID模式下, 主要有两条裂解途径: ① C-N键断裂脱去二甲胺C2H6N (44)形成m/z 427碎片离子。②哌啶环N-支链裂解重排形成m/z 399碎片离子, 吡唑环N-C键断裂失去哌啶环剩余结构C6H10N (96)形成m/z 304碎片离子, 二级质谱图见图 4。
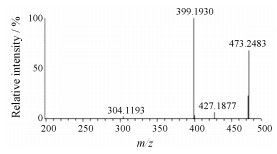
|
Figure 4 Daughter irons of HYML-122 |
在高分辨质谱中准分子离子峰为[M+H]+ m/z 458.230 7, 比原形相对分子质量低14为其N-去甲基产物, 分子式为C25H28O2N7。在(+)CID模式下, 酰胺键断裂重排失去碎片C3H5ON (71)形成m/z 387碎片离子, m/z 427、m/z 399和m/z 304碎片离子产生途径与原形相同。
3.3 M487在高分辨质谱中准分子离子峰为[M+H]+ m/z 488.240 2, 比原形相对分子质量高16为其单氧化产物, 分子式为C26H30O3N7。在(+)CID模式下, 哌啶环N-支链裂解脱去二甲胺C2H6N (44)形成m/z 443, 进一步裂解重排失去CO (28)得到m/z 415碎片离子, 连接哌啶环的碳氮σ键断裂脱去C6H10N (96)形成m/z 320碎片离子, 均比原形相应碎片离子高16, 推测氧化位置在m/z 320碎片离子的嘧啶并吡唑环或二苯醚结构上, 具体位点可由核磁共振分析方法确认。
3.4 M473在高分辨质谱中准分子离子峰为[M+H]+ m/z 474.225 1, 比M457相对分子质量高16为其单氧化物, 分子式为C25H28O3N7。在(+)CID模式下, M473脱去1分子H2O (18)形成m/z 456碎片离子; M473哌啶环N-支链裂解脱去CH4N (30)形成m/z 443, 或脱去C2H4OH (58)形成m/z 415碎片离子; M473酰胺键断裂失去C3H5NO (71)结构形成m/z 403碎片离子, 连接哌啶环的碳氮σ键断裂形成m/z 320碎片离子。m/z 443、415、403、320均比M457相应碎片离子高16, 提示氧化位置在m/z 320碎片离子的嘧啶并吡唑环或二苯醚结构上, 具体位点可由核磁共振分析方法确认。
3.5 M567在高分辨质谱中准分子离子峰为[M+H]+ m/z 568.197 9, 比M487相对分子质量高80为其硫酸结合产物, 分子式为C26H30O6N7S。在(+)CID模式下, 哌啶环N-支链裂解形成m/z 523和m/z 495碎片离子; M567丢失磺酸基SO3 (80)形成m/z 488碎片离子, 酰胺键断裂形成m/z 403碎片离子, m/z 443、415、320碎片离子产生途径与M487相同。
3.6 M553在高分辨质谱中准分子离子峰为[M+H]+ m/z 554.181 9, 比M473相对分子质量高80为其硫酸结合产物, 分子式为C25H28O6N7S。在(+)CID模式下, M553哌啶环N-支链裂解形成m/z 523和m/z 495碎片离子, 酰胺键断裂形成m/z 483碎片离子; M553丢失磺酸基(80)形成m/z 474碎片离子, m/z 443和m/z 403碎片离子产生途径与M473相同。
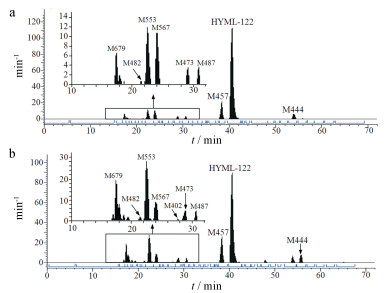
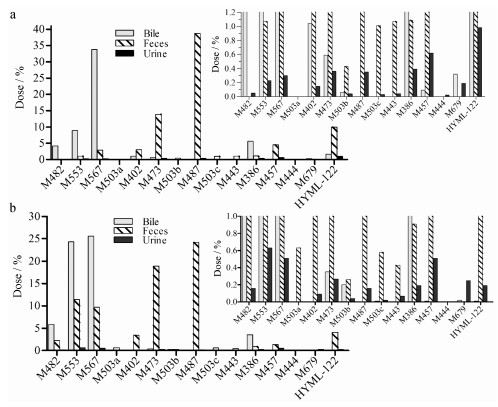
3.7 代谢产物分布经相同液相方法连接放射性检测器分析, 各基质中雌雄大鼠代谢产物种类无明显差异。血浆中以原形为主, 分别占雌雄大鼠AUC0-12 h的70.65%和49.23%, 主要代谢产物为M553和M457, 次要代谢产物为M482、M567、M402、M473、M487、M444和M679, 放射性代谢物色谱图见图 5。尿液中主要代谢产物为M553、M567和M457, 含量均较低。胆汁中主要代谢产物为M553和M567, 次要代谢产物为M482、M402和M386。粪便中原形含量较高, 分别占雌雄大鼠给药量的9.93%和4.09%, 主要代谢产物为M553、M473和M487, 次要代谢产物为M482、M567、M402、M503c、M443、M386和M457。各代谢产物在雌雄大鼠尿液、胆汁和粪便中含量占比见图 6。
|
Figure 5 [14C]-Radiochromatograms showing metabolite profiles of female (a) and male (b) plasma |
|
Figure 6 Percentage of metabolites in female (a) and male (b) bile, urine and feces (% dose) |
整体大鼠给药后0~168 h, 粪便、尿液和笼具清洗液放射性回收率分别为92.34%、3.99%和0.97%, 总回收率为97.30%。排泄主要发生在给药后0~48 h, 占给药量的96.46%; BDC大鼠给药后0~72 h, 胆汁、粪便、尿液和笼具清洗液放射性回收率分别为59.44%、33.22%、4.78%和0.79%, 总回收率为98.23%。胆汁排泄主要发生在给药后0~48 h, 占给药量的59.25%。表明药物吸收后主要经胆汁、少量经尿液排泄。
讨论新药临床前体内药代动力学研究的目的是探索药物吸收、分布、代谢和排泄情况, 推测药物的体内转化途径和经时过程, 对可能出现的毒性反应提供合理预测。为考察HYML-122在大鼠体内的代谢情况, 应用放射性标记法, 对物质平衡进行评价, 采用线性离子阱串联高分辨轨道离子阱质谱鉴定代谢产物结构[7-10], 反映体内药物的总体含量和转化过程。
HYML-122口服生物利用度良好, 以胆汁和尿液回收药量计算, 至少有64.22%药物吸收入血, t1/2、CL和MRT结果则表明血浆中总药物清除较快。药物吸收后组织分布广泛, 胃肠壁、肝、肺最多, 其次是肾、脾、心和卵巢子宫, 脑中未检测到。肠壁于给药后24 h药物含量仍较高, 多次给药可能存在刺激作用, 各组织药物于给药后48 h消除完全, 表明药物在体内无明显蓄积, 毒理实验可关注主要分布组织的器官毒性。
药物在大鼠体内以肝脏代谢为主, 代谢产物种类无明显雌雄差异。血浆中主要代谢产物为M553 (硫酸结合产物)和M457 (N-去烃基产物), M457可发生氧化并与硫酸结合得到M553, 次要代谢产物为M482、M567、M402、M473、M487、M444和M679, 其中M482、M567为Ⅱ相硫酸结合代谢产物, M402、M473、M487可与硫酸结合分别转化为M482、M553、M567, 这与胆汁中代谢产物分布结果相符。酶表型实验可确定参与相关代谢的CYP酶, 并进一步进行抑制和诱导研究以完善药物安全性信息, 为临床联合用药提供参考依据, 但由于存在物种差异, 不能完全预测人体血浆中主要代谢产物种类和分布情况。
药物吸收后主要经胆汁少量经尿液排泄, 以硫酸结合产物为主, 代谢产物分布无明显雌雄差异, 雄性大鼠粪便中M553、M473 (N-去烃基、氧化产物)和M487 (单氧化产物)含量分别为雌性大鼠的10.65倍、1.36倍和0.63倍, 可能是雌雄肠道菌群差异导致[11, 12]。
| [1] | Li X, Wang A, Yu K, et al. Discovery of (R)-1-(3-(4-amino-3-(4-phenoxyphenyl)-1H-pyrazolo[3, 4-d]pyrimidin-1-yl)piperidin-1-yl)-2-(dimethylamino)ethanone (CHMFL-FLT3-122) as a potent and orally available FLT3 kinase inhibitor for FLT3-ITD positive acute myeloid leukemia[J]. J Med Chem, 2015, 58: 9625–9638. DOI:10.1021/acs.jmedchem.5b01611 |
| [2] | Griffith J, Black J, Faerman C, et al. The structural basis for autoinhibition of FLT3 by the juxtamembrane domain[J]. Mol Cell, 2004, 13: 169–178. DOI:10.1016/S1097-2765(03)00505-7 |
| [3] | Wilhelm SM, Carter C, Tang LY, et al. BAY 43-9006 exhibits broad spectrum oral antitumor activity and targets the RAF/MEK/ERK pathway and receptor tyrosine kinases involved in tumor progression and angiogenesis[J]. Cancer Res, 2004, 64: 7099–7109. DOI:10.1158/0008-5472.CAN-04-1443 |
| [4] | O'Farrell AM, Abrams TJ, Yuen HA, et al. SU11248 is a novel FLT3 tyrosine kinase inhibitor with potent activity in vitro and in vivo[J]. Blood, 2003, 101: 3597–3605. DOI:10.1182/blood-2002-07-2307 |
| [5] | US Food and Drug Administrtion. Midostaurin[EB/OL]. 2017[2018-12-10]. https://www.fda.gov/Drugs/InformationOnDrugs/ApprovedDrugs/ucm555756.htm. |
| [6] | Hop CE, Wang Z, Chen Q, et al. Plasma-pooling methods to increase throughput for in vivo pharmacokinetic screening[J]. J Pharm Sci, 2010, 87: 901–903. |
| [7] | Wang HH, Li G, Peng XP, et al. Secondary metabolites from Colletotrichum fioriniae F18, an endophytic fungus isolated from the medicinal plant Mahonia fortunei[J]. Acta Pharm Sin (药学学报), 2018, 53: 1862–1867. |
| [8] | Qiao S, Xu HS, Shi XW, et al. Identification of major bioactive components and their metabolites in rat plasma after oral administration of Zhikebao tablet by UHPLC-QTOF-MS[J]. Acta Pharm Sin (药学学报), 2018, 53: 1536–1544. |
| [9] | Wang CX, Wang L, Qian DW, et al. Identification of metabolites of Reduning injection in rat plasma, bile, urine and feces after intravenous administration[J]. Acta Pharm Sin (药学学报), 2018, 53: 1148–1155. |
| [10] | Li J, Hua ZD, Wang YM. Analysis of metabolites and metabolic pathway of 5F-AMB in vitro using UPLC-HR-MS[J]. Acta Pharm Sin (药学学报), 2017, 52: 1743–1747. |
| [11] | Kaminsky LS, Zhang QY. The small intestine as a xenobiotic-metabolizing organ[J]. Drug Metab Dispos, 2003, 31: 1520–1525. DOI:10.1124/dmd.31.12.1520 |
| [12] | Lin JH. Is the role of the small intestine in first-pass metabolism overemphasized?[J]. Pharmacol Rev, 1999, 51: 135–157. |
 2019, Vol. 54
2019, Vol. 54


