血脑屏障(blood brain barrier, BBB)是介于血液和脑组织之间的动态屏障, 由脑部毛细血管内皮细胞及其细胞间紧密连接的基底膜、周皮细胞和星形胶质细胞围成的神经胶质膜构成。其中, 能够起到屏障作用的主要是脑部毛细血管内皮细胞, 这种细胞膜的表面没有孔道, 细胞间闭锁的小带和稀疏的细胞吞饮泡能阻滞一般的外来物质通过此屏障进入脑内[1]。纳米级脑靶向递药系统(nano brain-targeted drug delivery system, NBTDDS)是一种新型纳米给药系统, 它能将药物富集定位于病变组织、器官甚至细胞内, 具有用药量少、疗效高、毒副作用小的特点, 且给药方式和速度也易于控制[2]。
本文将从被动脑靶向、主动脑靶向和双级脑靶向三个层面对脑靶向纳米递药系统的类型及其向脑内递送药物的机制进行总结, 并对降低载体粒径、打开血脑屏障细胞间紧密连接的途径、于载体表面键合亲水性基团以及采用鼻腔给药等提高药物脑内递送效率的策略进行展望。
1 血脑屏障的生理学基础BBB是一种脂质膜, 其毛细血管内皮细胞紧密连接处的“有效”孔径仅为1.4~1.8 nm, 相关结构见图 1。鉴于该膜的亲脂特性和形态结构, 外周血管中的脂溶性小分子物质可以直接通过与脂质膜融合进入脑内, 水溶性小分子药物也可以直接经膜表面的细胞间隙扩散入脑, 而大分子物质如蛋白质、多肽和基因药物则无法借助被动扩散穿过BBB进入脑内, 只能依靠其他转运方式如特异载体通道、吸附介导或特异受体介导的吞饮等途径进入脑内[3]。脑毛细血管内皮细胞间紧密结合的神经胶质带负电荷, 因此, 带正电荷或电中性的药物比带负电荷的更容易透过BBB。BBB不是一个被动性的保护屏障, 它不仅能选择性地将脑组织新陈代谢所需的多种营养物质转运至脑内, 还能将脑内有害或过剩的物质转运到脑外, 以此来保持脑内的环境稳定[4]。不同物质通过BBB进入脑内的途径可由图 2来表示。
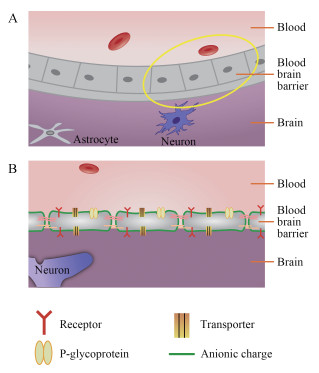
|
Figure 1 Structure of blood brain barrier (BBB) (A). Magnified yellow circle area of picture A (B) |
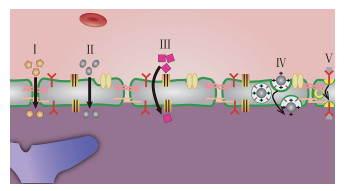
|
Figure 2 Different routes for drug delivery across the BBB: Penetrating through the tight junctions for hydrophilic molecules (Ⅰ); passive diffusion across the endothelial cells for hydrophobic molecules (Ⅱ); carrier-mediated transport for peptides and specific small molecules (Ⅲ); increased uptake by adsorption mediated transcytosis or endocytosis for cationic carriers (Ⅳ); receptor-mediated transcytosis for larger molecules (Ⅴ) |
被动脑靶向递药系统主要包括脂质体、非离子表面活性剂囊泡及微乳, 具有特殊的材料组成和结构形态, 通过与机体的相互作用来将药物从外周转运入脑。例如, 由磷脂组成的脂质体与BBB膜有良好的生物相容性, 可以直接将药物递送入脑[5]; 非离子表面活性剂囊泡则通过抑制BBB膜上的P-糖蛋白(P-glycoprotein, P-gp)对外来物质的外排来实现药物向脑内靶向递送[6]; 由油相、水相和表面活性剂组成的微乳则结合了脂质体和囊泡的优点, 更容易促进药物从外周血液进入脑内。被动脑靶向递药系统从外周血液进入脑内的机制见图 3。
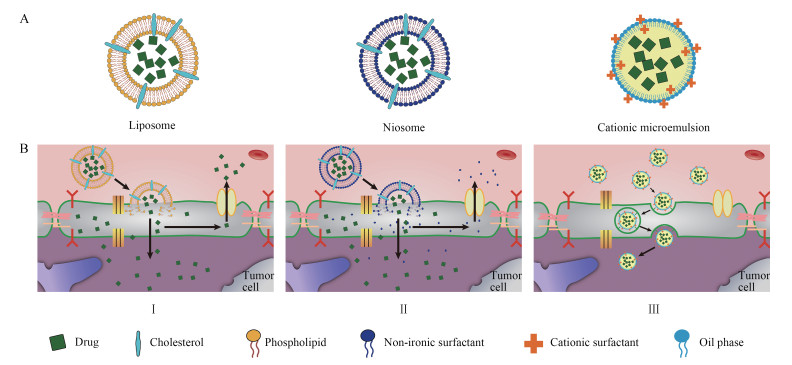
|
Figure 3 Structure and mechanism for various passive brain targeting carriers across BBB: liposome (Ⅰ); niosome (Ⅱ); cationic microemulsion (Ⅲ) |
脂质体(liposome)是由磷脂和胆固醇构成的类似于生物膜双分子层的囊泡状物质, 它的免疫原性小且组织相容性好, 因此安全性更高, 常作为向脑内递送药物的靶向系统[5]。
盐酸多柔比星(doxorubicin, DOX)是治疗脑胶质瘤的一种药物, Zhan等[7]根据人脑肿瘤及其周围正常组织的磁共振图像, 利用3D打印技术构建了脑肿瘤模型, 然后将多柔比星溶液和脂质体混悬液分别持续注入到肿瘤细胞周围。给药12 h后发现, 给予溶液剂的脑肿瘤细胞中的药物质量浓度仅为0.5 μg·mL-1, 而脂质体混悬液则高达30 μg·mL-1, 相比提高了60倍。反式白藜芦醇(trans-resveratrol, RSV)是一种脂溶性药物, 常用于治疗脑胶质瘤和头颈部癌症。Vijayakumar等[8]借助β-环糊精的增溶作用来将其制成注射液, 并将此注射液和脂质体分别经大鼠尾静脉注入体内。药代动力学结果表明:在给药90 min时, 脂质体组的脑内药物浓度高达7.5 μg·g-1, 而溶液组则仅为1.0 μg·g-1; 脂质体组的平均滞留时间为(3.34±0.29) h, 而溶液组仅为(0.45±0.10) h, 两者相差7.4倍。
2.1.2 非离子型表面活性剂囊泡非离子型表面活性剂囊泡(niosome)是由水合非离子表面活性剂和胆固醇组成的类脂质体[9]。与脂质体不同, 囊泡中的主要成分是非离子表面活性剂而不是容易氧化变性的磷脂, 因此较磷脂构成的脂质体稳定性更好。
Wang等[6]比较了栀子提取物(含栀子苷64.2%)制备的混悬液和由Span-60、Span-80及胆固醇组成的囊泡经大鼠灌胃后脑内药物浓度的变化。在连续7天、每天给药1次并在末次给药1 h后处死大鼠, 结果表明:囊泡剂组脑组织中的栀子苷浓度高达(792.1±204.8) ng·g-1, 而溶液组仅为(60.6±16.6) ng·g-1, 相差13倍之多。其原因可能是, 非离子表面活性剂与脑组织毛细血管内皮细胞上的P-gp亲和力较大而先被泵出细胞膜外, 与P-gp亲和力较小的栀子苷则留在了细胞内。灌胃后的囊泡, 是以完整形态经消化道吸收入血直接穿过BBB进入脑内, 还是促进了药物吸收, 依靠更高的血药浓度通过被动扩散促进药物向脑内递送, 更深层次的机制还需要进行研究。
2.1.3 微乳或纳米乳微乳(microemulsion, ME), 又称纳米乳(nanoemulsion, NE), 是由水相、油相、表面活性剂和助表面活性剂以适当比例自发形成的一种纳米级递药系统[10]。油相成分如中长链甘油三酯和植物油脂能增加药物与脑部毛细血管内皮细胞的亲和性, 表面活性剂和助表面活性剂能抑制或降低BBB上的P-gp对药物外排[11]。
丙戊酸(valproic acid, VA)是治疗癫痫的水溶性前体药物, Tan等[12]制备了丙戊酸微乳, 经小鼠腹腔注射后的半衰期为(94.03±12.54) min, 较溶液组的37.61 min延长了约1.5倍。微乳组的药物清除率为(89.40±1.96) mL·h-1, 较溶液组的(391.39±11.68) mL·h-1降低了约77%。此外, 腹腔注射丙戊酸微乳后, 脑部的AUC0-∞为溶液组的4.38倍, 而血浆中的AUC0-∞仅为溶液组的3.50倍。腹腔注射微乳虽然能同时提高血液和脑内的药物浓度, 但幅度不同, 这一结果说明, 微乳中的药物向脑内递送不仅是基于血液中药物向脑内被动扩散, 还有可能依赖于微乳与BBB的特殊亲和作用。利培酮(risperidone, RP)是一种治疗急性和慢性精神分裂症的脂溶性药物, Đorđević等[11]经大鼠腹腔分别注射利培酮微乳和溶液后的结果表明:微乳组脑组织的Cmax为(292.96±106.76) ng·g-1, 而溶液组仅为(158.09±27.17) ng·g-1; 微乳组脑组织的AUC0-3 h为(277.06±155.49) ng·h·g-1, 而溶液组仅为(135.57±29.62) ng·h·g-1, 都相差1倍左右。需要注意的是, 被动脑靶向递药系统在促进药物向脑部递送的同时, 也促进了肝肾等器官对药物的摄入, 并由此增大了药物对相应器官的毒性。微乳中的表面活性剂在抑制脑组织细胞或肿瘤细胞上的P-gp对药物外排时, 也抑制了胃肠道下段、睾丸、肝细胞的胆管侧膜和肾近曲小管刷状缘等部位正常细胞上的P-gp对药物的外排。因此, 有必要在被动靶向递药系统上连接可以与脑组织特异结合的靶头, 提高其脑靶向性。
2.2 主动脑靶向递药系统BBB内皮细胞上存在一些特殊受体, 如转铁蛋白受体、乳铁蛋白受体、表皮生长因子受体、N-乙酰胆碱受体、氨基酸转运体、谷胱甘肽转运体和葡萄糖转运体[13-19], 如果能把这些受体的特异性蛋白多肽类配体、糖类配体或核酸类配体“安装”在递药系统上, 那么就可以借助这些受体的介导, 来使连接了内源性配体的递药系统顺利跨过BBB实现药物的脑靶向递送。
2.2.1 蛋白或多肽类主动靶向分子转铁蛋白受体(transferrin receptor, TfR)虽然在各类细胞中均有表达, 但是在肿瘤细胞和病理条件下BBB中的表达更为丰富。TfR能介导乳铁蛋白(lactoferrin, Lf)通过胞吞来实现后者从外周血液到脑组织的单向转运。Li等[14]研究并比较了普通型PEG-PLGA紫草纳米粒和连接了Lf的Lf-PEG-PLGA紫草纳米粒经大鼠尾静脉给药后的脑靶向递送效果。给药2 h后, Lf-PEG-PLGA紫草纳米粒的血浆AUC0-24 h为75.4 μg·h·mL-1, 仅较未连接Lf的普通PEG-PLGA紫草纳米粒的64.9 μg·h·mL-1高16%, 然而, Lf-PEG-PLGA紫草纳米粒脑中药物浓度却达到0.41 μg·g-1, 与PEG-PLGA紫草纳米粒的0.09 μg·g-1相比高出了3.56倍, 说明递药系统上连接Lf能有效促进药物向脑内靶向递送。此外, 以BBB上的特殊受体为抗原, 利用相应抗体作为主动靶向分子, 也有助于药物向脑部递送[15, 20]。
通过噬菌体展示技术获得的TGN是一个由12个氨基酸组成的多肽, 它可以和BBB上的氨基酸转运体特异性结合。Zhang等[16]将TGN-PEG-PLA纳米粒与无靶头的PEG-PLA纳米粒经大鼠尾静脉注射后的药代动力学结果表明:前者血浆中的AUC0-24 h为378.2 ng·h·g-1, 后者为402.7 ng·h·g-1, 比值为0.94;然而, 前者脑部的AUC0-24 h达到了653.6 ng·h·g-1, 为后者292.2 ng·h·g-1的2.24倍。RVG短肽可与神经细胞中的N-乙酰胆碱受体特异性结合[17]; 小分子T7肽的稳定性高、空间位阻小, 可与转铁蛋白受体结合, 同时转铁蛋白与受体的结合也促进了T7肽的转运[21]; 谷胱甘肽是一种内源性三肽, 显示出积极的跨BBB转运特性, 但具体的分子机制仍待研究[18], 详见表 1[13-29]。
| Table 1 Examples of active nanodrug delivery system. BBB: Blood brain barrier; PEG: Polyethylene glycol; PLGA: Poly(lactic-co-glycolic acid); PLA: Polylactic acid; RGD: Arginine-glycine-aspartic acid |
葡萄糖是维持脑功能正常运转不可缺少的营养物质, 外源性葡萄糖转运入脑需要脑毛细血管内皮细胞上的葡萄糖转运蛋白参与。葡萄糖转运蛋白1 (glucose transporter type 1, GLUT1)在脑毛细血管内皮细胞的细胞膜上高度表达, 转运效率最高。人类中枢系统消耗的葡萄糖相当于机体消耗总量的30%, 大脑内皮细胞每分钟转运至脑内的葡萄糖是其自身重量的数十倍, 因此, 经葡萄糖修饰的药物分子也应当会有良好的脑靶向性[19]。多西他赛是一种治疗头颈部癌的药物, Qu等[19]将葡萄糖分子上的残基与含有多西他赛的脂质体连接, 把连接了葡萄糖残基的脂质体(GLU-docetaxel-LIP)与普通脂质体(docetaxel-LIP)经大鼠尾静脉注射后的药代动力学结果表明:前者血浆中AUC0-25 h为9.62 μg·h·mL-1, 后者仅为4.32 μg·h·mL-1, 比值为2.23;前者脑部的AUC0-25 h为20.53 μg·h·g-1, 后者仅为6.04 μg·h·g-1, 比值为3.40。脑组织和血液中的药物非同步升高这一现象说明, 在脂质体上连接葡萄糖残基能进一步提高多西他赛向脑内的递送效率。
2.2.3 核酸类主动靶向分子核酸类适配体是一段能促进药物靶向递送的寡核苷酸, 这类物质易于化学合成且与靶位亲和性高, 能特异性识别蛋白质、磷脂、糖和核酸等靶点分子。FB4是一段RNA, 能与转铁蛋白受体特异性结合。Mu等[22]将FB4与负载氟比洛芬的胶束结合, 用小鼠脑微血管内皮细胞系的bEND5细胞进行的体外实验结果表明, 含有FB4配体的胶束给药后, 与不含配体的胶束相比, 脑细胞内的药物浓度提高了1.67倍。有关主动脑靶向递药系统的类型见表 1。
2.3 双级脑靶向递药系统双级脑靶向通常是指在被动靶向递药系统上修饰两种功能配基, 一种靶向于BBB, 促进递药系统的跨BBB转运, 另一种靶向于病变组织并将进入脑内的药物进一步富集于病变部位, 从而使脑部的病变部位获得更高的药物浓度。即两个靶头分别靶向不同靶位[30]。另外一种双级脑靶向是指在被动递药系统上连接一种具有双重靶向作用的功能基, 如转铁蛋白受体、低密度脂蛋白受体和乳铁蛋白受体, 这些受体在BBB、神经胶质瘤和脑转移瘤上均高度表达。即一个靶头靶向两个靶位[30]。相比单一脑靶向递药系统, 双级脑靶向递药系统能使更多的药物进入脑内发挥治疗作用, 此外, 还能减少药物对非靶器官的毒副作用。
Gao等[29]制备了由转铁蛋白和叶酸双重修饰的多柔比星脂质体(Tf-F-DOX-Lip), 并以未经修饰的多柔比星脂质体(DOX-Lip)以及仅单一修饰的叶酸-多柔比星脂质体(F-DOX-Lip)和转铁蛋白-多柔比星脂质体(Tf-DOX-Lip)为参比, 经大鼠尾静脉注射后进行了脑靶向递送药物实验, 给药4 h的结果表明:经双重修饰的Tf-F-DOX-Lip脑内药物浓度分别为仅单一修饰的F-DOX-Lip和Tf-DOX-Lip的3倍和2.6倍, 与未经修饰的DOX-Lip相比则高出6倍。双级靶向递药系统虽然能更精准地将药物递送至脑内, 然而, 在将其成功用于临床试验以至于投放到市场之前, 需要做的主要工作包括: ①选择靶向性更高的功能基团和靶点; ②在递药系统上连接多个功能基团; ③对递药系统的工艺质量和安全性进行评价。
3 进一步提高脑靶向药物递送效率的策略 3.1 降低递药系统粒径肝、脾及血液中的网状内皮系统可以选择性吞噬血液中异物微粒。一般情况下, 粒径位于200~800 nm区间的微粒, 粒径越小, 与吞噬细胞之间的空间位阻就越小, 越容易被吞噬[31]。而当粒径小于200 nm时, 随着粒径变小, 载体表面局部区域的曲率也会变小。因此, 与调理素结合的位点也减少, 反而能避免被吞噬细胞表面的受体所吸附, 从而逃脱吞噬细胞的吞噬和清除[32]。
Wan等[31]分别将粒径为200 nm和800 nm的酒石酸长春瑞滨脂质体放在含有小鼠单核巨噬细胞RAW264.7和荧光素的培养基中进行培养, 培养12 h后的结果显示:粒径为200 nm的脂质体被吞噬的概率为13%, 而粒径800 nm的则仅为8%。
Bi等[32]分别将粒径为70 nm和200 nm的姜黄素纳米混悬剂经小鼠尾静脉注入体内。给药5 min时, 前者在脑部的浓度就达到了15.18 ng·g-1, 而后者在脑部的浓度尽管此时已达到其峰值, 但也仅为7.09 ng·g-1。给药20 min时, 前者脑内的药物浓度上升到18 ng·g-1, 而后者则下降为5.45 ng·g-1。此外, 还发现:粒径为200 nm的脑部AUC0-60 min为209 ng·min·g-1, 而粒径为70 nm的则高达539 ng·min·g-1, 相差2.58倍。更为可喜的是, 当姜黄素的粒径由200 nm降低至70 nm后, 肝脏药物的AUC0-60 min也从8 491 ng·min·g-1降低至2 300 ng·min·g-1。这说明, 粒径从200 nm减低至70 nm, 不仅可以促进药物向脑部递送, 还能降低肝脏对药物的摄取, 这对脑部疾病的治疗以及降低药物对肝脏的毒副作用均具有重要意义。然而, 随着载体粒径的进一步降低, 药物的脑靶向性出现了一些新变化。虽然粒径20 nm的姜黄素混悬剂给药5 min后脑内浓度便达到了21.63 ng·g-1, 同一时间点70 nm和200 nm组仅分别为15.18 ng·g-1和7.09 ng·g-1, 然而, 此值在10 min时便降至8.63 ng·g-1, 虽高于同期200 nm组的4.72 ng·g-1, 但也仅相当于70 nm组13.27 ng·g-1的65%。20 nm组的AUC0-60 min为234 ng·min·g-1, 与70 nm组的539 ng·min·g-1相比降低了56.59%, 仅勉强较200 nm组的209 ng·min·g-1高出11.96%。究其原因, 20 nm的姜黄素因粒径过小, 易溶于水相形成溶液后经肾脏滤过排出体外, 其体内浓度自然也就变低。
值得注意的是, Fu等[33]将不同粒径的尼莫地平微粒经比格犬口服给药后发现, 当粒径从16 μm减小至833 nm时, 药物的生物利用度几乎呈线性增加; 当粒径从833 nm再降至148.7 nm时, 药物的生物利用度增加变缓。原因是, 粒径小于148.7 nm的递药系统, 因肝脏吸收处的膜转运蛋白达到饱和, 继续降低粒径已无法进一步提高药物的生物利用度, 这一现象是否也会在脑靶向药物递送中出现, 值得进一步研究。
3.2 改变BBB通透性 3.2.1 生化试剂作用冰片类芳香类物质能发挥“芳香开窍、引药上行”的功效, 通过提高血脑屏障通透性来增加脑部的药物摄取量。Lv等[34]制备了含有冰片的银杏内酯脂质体, 经小鼠尾静脉注射给药后, 脑组织中的AUC0-∞为272.12 μg·min·mL-1, 与不含冰片的普通脂质体的136.85 μg·min·mL-1相比, 脑内药物递送量提高了近1倍, 与注射液的41.65 μg·min·mL-1相比更是提高了5.3倍。原因是经冰片修饰的脂质体能够可逆性打开BBB内皮细胞间的紧密连接, 使部分药物在给药后的一段时间内通过细胞间隙进入脑内。此外, 在冰片的作用下, 脂质体还能被BBB内皮细胞以胞吞方式转运入脑, 相关机制见图 4。与冰片的功效相似, 甘露醇也能可逆性地打开血脑屏障, 促进药物向脑部递送[35]。
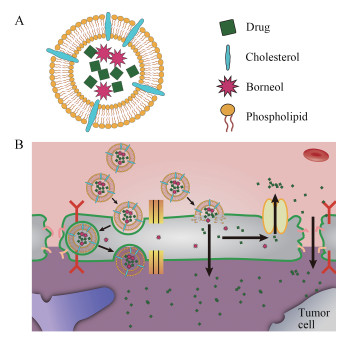
|
Figure 4 Structure of liposome with borneol (A). Mechanism for liposome with borneol across BBB (B) |
超声微泡(ultrasound microbubble)是由壳膜包裹核心气体构成的气泡, 粒径一般在微米级至纳米级。对微泡进行超声处理时, 在声波的作用下, 液体中的微气核空化泡将进行振动、生长和破裂等一系列动力学过程, 当此物理效应作用于周围组织的细胞界面时, 可使细胞间的紧密连接变得疏松并出现可逆性的小孔, 便提高了细胞的胞吞作用[36]。此外, 超声振动还能提高细胞膜的通透性, 以及破坏网状内皮细胞使钙离子内流增加, 这些因素都有利于促进细胞对药物的摄取[37]。
Chen等[38]对成功移植肿瘤细胞的大鼠脑部进行超声处理。实验以伊文思蓝(Evans blue, EB)为标记物, 这种物质经静脉注射后可立即与血浆白蛋白结合形成EB-白蛋白复合物。此复合物分子量大, 正常情况下不能透过完整的BBB。而在超声作用下, BBB的细胞间隙变大而能使复合物得以通过, 且通过量与BBB的开放程度呈正相关。在分别给大鼠注射脂质微泡溶液和生理盐水后, 两组都先用频率为1.0 MHz的超声波处理大鼠脑瘤部位, 然后立即注射EB溶液, 并于4 h后对大鼠断头摘取脑组织, 72 h后摘取脑瘤组织。在激光共聚焦显微镜下, 对照组仅见稀疏点状红色荧光, 而在实验组的辐照区可见到大量红色荧光, 这说明, 超声微泡可以促进EB穿过BBB进入脑胶质瘤组织。
超声微泡介导的靶向治疗目前仍处于实验阶段, 在将该技术应用于脑瘤的临床治疗前需要做的主要工作包括: ①选用合适的超声参数以得到最佳的药物透过量; ②密切监控超声破坏血脑屏障后潜在的出血、脑损伤和炎症等不良反应。尽管如此, 随着新型靶向治疗超声微泡的研发及超声参数的不断优化, 相信这一技术会对药物向脑内靶向递送以及对脑部疾病的治疗带来突破性进展。
3.3 亲水性基团修饰在递药系统表面键合羧甲基壳聚糖、聚乙二醇(polyethylene glycol, PEG)等亲水性基团, 能通过降低其与调理素之间的相互作用来促进药物向脑内递送[39, 40]。
亲水性基团具有较高的柔顺性和较强的空间位阻效应, 可通过降低递药系统与调理素之间的范德华力、静电引力和疏水作用来减弱它们之间的相互作用, 从而逃逸吞噬细胞的捕获, 延长其在血液中的循环时间, 使更多的药物靶向递送于病变细胞。Liu等[39]用羧甲基壳聚糖对卡马西平纳米粒进行了包衣, 并以未包衣的作为参比进行动物实验, 结果表明, 小鼠鼻腔给药4 h后, 前者在血浆中AUC0-∞为36.28 μg·min·mL-1, 后者仅为13.88 μg·min·mL-1, 相比提高了1.6倍。包衣组脑部的AUC0-∞达到了93.01 μg·min·mL-1, 而后者仅为7.51 μg·min·mL-1, 两者相差11.38倍, 虽然经羧甲基壳聚糖包衣后的卡马西平纳米粒在血液和脑组织中的药物吸收都得到提升, 但包衣后更容易进入脑组织这一结果说明, 经亲水性基团修饰的纳米粒具有更高的脑靶向性。
亲水性基团修饰的纳米粒不仅能使药物靶向于脑部, 还能减弱药物对肝脏等部位的损害。Cole等[40]制备了PEG化的氧化铁纳米粒, 并以未经PEG修饰的作为参比进行了动物实验。大鼠静脉注射给药1 h后, 前者脑部的铁浓度为16 nmol·g-1, 而后者仅为1.7 nmol·g-1, 相差8.4倍。前者在肝脏中的铁浓度仅为0.35 μmol·g-1, 而后者则高达3.30 μmol·g-1, 相差9倍之多。这是因为通常情况下吞噬细胞将载药纳米粒吞噬后先将其转运至肝脏, 然后在此处进行降解。然而, 在添加了PEG后载药纳米粒因不易被吞噬, 而相应地聚集在肝脏的几率也就大大降低, 一直在血液中长循环直至穿过BBB进入脑部。值得注意的是, Vijayakumar等[8]发现, 将反式白藜芦醇(trans-resveratrol, RSV)普通脂质体和PEG化脂质体分别经尾静脉注入大鼠体内90 min后, PEG-RSV脂质体组肝脏中的药物浓度为0.5 μg·g-1, 非PEG化的RSV脂质体组却高达3.5 μg·g-1, 两者相差7倍。PEG-RSV脂质体组脑中的药物浓度为7.30 μg·g-1, 非PEG化的RSV脂质体为6.95 μg·g-1, 相比仅仅提高了5%, 此升高幅度远低于Cole等[40]的结果。因此, 纳米递药系统经PEG化后促进药物进入脑内的深层机制还有待进一步研究, 以确保新型脑靶向递药系统既能降低药物对肝脏等部位的毒性, 又能促进药物向脑内靶向递送。
3.4 改变给药途径 3.4.1 鼻腔给药鼻腔给药后, 有一部分药物经鼻腔呼吸部的黏膜吸收入血, 再经大循环透过BBB进入脑组织, 还有一部分药物直接通过嗅黏膜或嗅神经绕开BBB进入脑组织, 相对于外周静脉给药, 鼻腔给药能使更多的药物进入脑部[41-45]。
Zhang等[41]将β-细辛醚微乳分别通过鼻腔和尾静脉注射对大鼠给药, 结果发现: β-细辛醚微乳经鼻腔给药后药物迅速吸收, 2 min时在血液和脑组织中都能检测到药物, 但进入脑内的药物更多, AUC脑0-2 min/AUC血浆0-2 min为1.49, 脑组织的药物较血浆中高出近50%。而同期经尾静脉给药后的AUC脑0-2 min/AUC血浆0-2 min之比仅为0.83, 脑部的药物较血液中明显偏低。无论是静脉给药还是鼻腔给药, 脑组织中的药物都在5 min时达到最大浓度, 但是, 相对于鼻腔给药后的脑内药物浓度0.755 8 μg·mL-1, 血液给药后的脑内药物浓度0.429 7 μg·mL-1仅为前者的56.85%。由于β-细辛醚是一个亲脂性小分子药物, 因此, 随着时间的推移, 血液中药物可以通过BBB进入脑内, 使得脑内的药物浓度不断升高, 而鼻腔给药后初期较高的脑内药物浓度也随着时间推移以及药物在脑组织中的代谢而不断降低, 以至于在45 min时低于血液中的浓度。尽管如此, 鼻腔给药仍在促进药物向脑内递送方面显示了其独特的优势。依法韦仑脂质体[42]、氟哌啶醇微乳[43]和利培酮脂质体[44]等均可通过鼻腔给药提高药物脑靶向性。Khan等[45]对近年来鼻腔给药促进药物脑靶向的例子进行了详细总结。
啮齿类和犬类动物连接嗅觉区的鼻黏膜范围高达50%, 而人类只有3%~10%。作为静脉注射给药的替代途径, 鼻腔给药后药物实际吸收剂量的重现性需要认真考虑。此外, 长期鼻腔给药还会对鼻黏膜及纤毛产生一定的毒副作用。
3.4.2 鞘内注射鞘内注射是将药物注射到椎管, 进入蛛网膜下腔到达脑脊液发挥药效, 适用于预防或治疗脑膜病变或恶性肿瘤转移等疾病[46]。鞘内注射具有给药剂量少、靶向给药等优点, 可通过单次穿刺给药或鞘内置管后多次给药。鞘内注射给药后, 药物不需要穿过BBB就能直接到达靶部位, 起效迅速。Etminan等[47]采用尼莫地平微球进行鞘内注射, 结果表明其能延长药物释放时间, 增强治愈效果, 降低药物毒性。值得注意的是, 鞘内给药后药物直接作用在脊髓和脑的表层, 容易引起脊髓神经的毒性损伤, 严重的会导致患者瘫痪。鞘内注射是一种介入性和反复性的操作, 必须严格采取无菌操作和把控注入剂量[48]。
4 结语相对于口服和静脉注射给药这样全身用药方式, 靶向定位治疗因用药量少、疗效高和毒副作用小的优点而具有十分广阔的应用前景。在回顾靶向递药系统的发展历程时不难发现, 无论是肝靶向、肾靶向、肺靶向、骨髓靶向、胃内滞留还是结肠定位制剂, 其中的药物对器官或组织的靶向性无一不是基于递药系统的剂型特点与机体的生理或病理学特异结构之间的相互作用。据此, 对未来靶向制剂的深入研究提出以下3点建议:
首先, 如同深入了解肝脏中网状内皮系统的结构特点对纳米递药载体的吞噬机制和影响因素有助于提高药物的肝靶向效率, 在研究药物的脑靶向递送时, 也应当关注有关BBB的结构特点、组成成分以及通透性等基础研究方面的最新进展, 这对提高药物的脑靶向递送效率具有重要意义。
其次, 鉴于递药系统的形态结构变化会影响药物的肝靶向递送效率[49], 这一因素是否也会影响药物向脑部或其他靶器官的递送, 对此应进一步研究与评价, 以期获得更新和更有价值的脑靶向递送效率。
最后, 基于生理状态下不同器官之间以及生理和病理状态下同一器官之间, 在组织结构、血液供应等诸多方面都存在着一定差异这一靶向制剂存在的基石, 有理由认为, 通过努力不仅可以将现有的脑靶向递药系统提高到一个更高的层次, 以实现对脑部疾病更精准的治疗, 还可以在现有的靶向递药系统之外, 设计出疾病治疗所需但迄今尚未出现的全新靶向递药系统。
| [1] | Canfield SG, Stebbins MJ, Morales BS, et al. An isogenic blood-brain barrier model comprising brain endothelial cells, astrocytes, and neurons derived from human induced pluripotent stem cells[J]. J Neurochem, 2017, 140: 874–888. DOI:10.1111/jnc.2017.140.issue-6 |
| [2] | Liu Y, Jiang C. Research advances in brain-targeted nanoscale drug delivery system[J]. Acta Pharm Sin (药学学报), 2013, 48: 1532–1543. |
| [3] | Alexander JJ. Blood-brain barrier (BBB) and the complement landscape[J]. Mol Immunol, 2018, 102: 26–31. DOI:10.1016/j.molimm.2018.06.267 |
| [4] | Khan AI, Liu J, Dutta P. Iron transport kinetics through blood-brain barrier endothelial cells[J]. Biochim Biophys Acta, 2018, 1862: 1168–1179. DOI:10.1016/j.bbagen.2018.02.010 |
| [5] | Agrawal M, Ajazuddin, Tripathi DK, et al. Recent advancements in liposomes targeting strategies to cross blood-brain barrier (BBB) for the treatment of Alzheimer's disease[J]. J Control Release, 2017, 260: 61–77. DOI:10.1016/j.jconrel.2017.05.019 |
| [6] | Wang JP, Wang W, Zhang WY. Study on distribution and targeting of Gardenia jasminoides extract niosomes in rats[J]. China Pharm (中国药房), 2016, 27: 473–475. |
| [7] | Zhan WB, Wang CH. Convection enhanced delivery of liposome encapsulated doxorubicin for brain tumor therapy[J]. J Control Release, 2018, 285: 212–229. DOI:10.1016/j.jconrel.2018.07.006 |
| [8] | Vijayakumar MR, Kosuru R, Vuddanda PR, et al. Trans resveratrol loaded DSPE PEG 2000 coated liposomes:an evidence for prolonged systemic circulation and passive brain targeting[J]. J Drug Deliv Sci Technol, 2016, 33: 125–135. DOI:10.1016/j.jddst.2016.02.009 |
| [9] | Pardakhty A, Moazeni E. Nano-niosomes in drug vaccine and gene delivery:a rapid overview[J]. Nanomed J, 2013, 1: 1–13. |
| [10] | Callender SP, Mathews JA, Kobernyk K, et al. Microemulsion utility in pharmaceuticals:implications for multi-drug delivery[J]. Int J Pharm, 2017, 526: 425–442. DOI:10.1016/j.ijpharm.2017.05.005 |
| [11] | ĐorđevićSM, CekićND, SavićMM, 等. Parenteral nanoemulsions as promising carriers for brain delivery of risperidone:design, characterization and in vivo pharmacokinetic evaluation[J]. Int J Pharm, 2015, 493: 40–54. |
| [12] | Tan SF, Kirby BP, Stanslas J, et al. Characterization in-vitro and in-vivo evaluation of valproic acid-loaded nanoemulsion for improved brain bioavailability[J]. J Pharm Pharmacol, 2017, 69: 1447–1457. DOI:10.1111/jphp.2017.69.issue-11 |
| [13] | Chen ZL, Huang M, Wang XR, et al. Transferrin-modified liposome promotes α-mangostin to penetrate the blood-brain barrier[J]. Nanomedicine, 2016, 12: 421–430. DOI:10.1016/j.nano.2015.10.021 |
| [14] | Li HM, Tong YN, Bai L, et al. Lactoferrin functionalized PEG-PLGA nanoparticles of shikonin for brain targeting therapy of glioma[J]. Int J Biol Macromol, 2018, 107: 204–211. DOI:10.1016/j.ijbiomac.2017.08.155 |
| [15] | Mortensen JH, Jeppesen M, Pilgaard L, et al. Targeted antiepidermal growth factor receptor (cetuximab) immunoliposomes enhance cellular uptake in vitro and exhibit increased accumulation in an intracranial model of glioblastoma multiforme[J]. J Drug Deliv, 2013, 2013: 209205. |
| [16] | Zhang C, Wan X, Zheng X, et al. Dual-functional nanoparticles targeting amyloid plaques in the brains of Alzheimer's disease mice[J]. Biomaterials, 2014, 35: 456–465. DOI:10.1016/j.biomaterials.2013.09.063 |
| [17] | Kim JY, Choi WI, Kim YH, et al. Brain-targeted delivery of protein using chitosan-and RVG peptide-conjugated, pluronic-based nano-carrier[J]. Biomaterials, 2013, 34: 1170–1178. DOI:10.1016/j.biomaterials.2012.09.047 |
| [18] | Rotman M, Welling MM, Bunschoten A, et al. Enhanced glutathione PEGylated liposomal brain delivery of an anti-amyloid single domain antibody fragment in a mouse model for Alzheimer's disease[J]. J Control Release, 2015, 203: 40–50. DOI:10.1016/j.jconrel.2015.02.012 |
| [19] | Qu B, Li X, Guan M, et al. Design, synthesis and biological evaluation of multivalent glucosides with high affinity as ligands for brain targeting liposomes[J]. Eur J Med Chem, 2014, 72: 110–118. DOI:10.1016/j.ejmech.2013.10.007 |
| [20] | Liu ZD, Zhang L, He QS, et al. Effect of Baicalin-loaded PEGylated cationic solid lipid nanoparticles modified by OX26 antibody on regulating the levels of baicalin and amino acids during cerebral ischemia-reperfusion in rats[J]. Int J Pharm, 2015, 489: 131–138. DOI:10.1016/j.ijpharm.2015.04.049 |
| [21] | Kuang YY, An S, Guo YB, et al. T7 peptide-functionalized nanoparticles utilizing RNA interference for glioma dual targeting[J]. Int J Pharm, 2013, 454: 11–20. DOI:10.1016/j.ijpharm.2013.07.019 |
| [22] | Mu C, Dave N, Hu J, et al. Solubilization of flurbiprofen into aptamer-modified PEG-PLA micelles for targeted delivery to brain-derived endothelial cells in vitro[J]. J Microencapsul, 2013, 30: 701–708. DOI:10.3109/02652048.2013.778907 |
| [23] | Gao HL, Yang Z, Zhang S, et al. Glioma-homing peptide with a cell-penetrating effect for targeting delivery with enhanced glioma localization, penetration and suppression of glioma growth[J]. J Control Release, 2013, 172: 921–928. DOI:10.1016/j.jconrel.2013.10.002 |
| [24] | Ruan SB, Yuan MQ, Zhang L, et al. Tumor microenvironment sensitive doxorubicin delivery and release to glioma using angiopep-2 decorated gold nanoparticles[J]. Biomaterials, 2015, 37: 425–435. DOI:10.1016/j.biomaterials.2014.10.007 |
| [25] | Huang JC, Cai HR, Jiang YQ. Construction of RGD-TAT modified liposomes and evaluation of its targeting on glioma[J]. Chin J Biochem Pharm (中国生化药物杂志), 2014, 34: 1–3. |
| [26] | Han LJ, Guo W, Liu W, et al. Primary evaluation on inhibiting effects of hyaluronic acid modified paclitaxel loaded liposome against brain tumor stem cells[J]. Chin J Hosp Pharm (中国医院药学杂志), 2015, 35: 773–776. |
| [27] | Byeon HJ, Thao LQ, Lee S, et al. Doxorubicin-loaded nanoparticles consisted of cationic-and mannose-modified-albumins for dual-targeting in brain tumors[J]. J Control Release, 2016, 225: 301–313. DOI:10.1016/j.jconrel.2016.01.046 |
| [28] | Gao HL, Qian J, Cao SJ, et al. Precise glioma targeting of and penetration by aptamer and peptide dual-functioned nanoparticles[J]. Biomaterials, 2012, 33: 5115–5123. DOI:10.1016/j.biomaterials.2012.03.058 |
| [29] | Gao JQ, Lv Q, Li LM, et al. Glioma targeting and blood-brain barrier penetration by dual-targeting doxorubincin liposomes[J]. Biomaterials, 2013, 34: 5628–5639. DOI:10.1016/j.biomaterials.2013.03.097 |
| [30] | Gao HL. Progress and perspectives on targeting nanoparticles for brain drug delivery[J]. Acta Pharm Sin B, 2016, 6: 268–286. DOI:10.1016/j.apsb.2016.05.013 |
| [31] | Wan F, You J, Sun Y, et al. Studies on PEG-modified SLNs loading vinorelbine bitartrate (I):preparation and evaluation in vitro[J]. Int J Pharm, 2008, 359: 104–110. DOI:10.1016/j.ijpharm.2008.03.030 |
| [32] | Bi C, Miao XQ, Chow SF, et al. Particle size effect of curcumin nanosuspensions on cytotoxicity, cellular internalization, in vivo pharmacokinetics and biodistribution[J]. Nanomedicine, 2017, 13: 943–953. DOI:10.1016/j.nano.2016.11.004 |
| [33] | Fu Q, Kou L, Gong C, et al. Relationship between dissolution and bioavailability for nimodipine colloidal dispersions:the critical size in improving bioavailability[J]. Int J Pharm, 2012, 427: 358–364. DOI:10.1016/j.ijpharm.2012.02.022 |
| [34] | Lv ZY, Yang YW, Wang J, et al. Optimization of the preparation conditions of borneol-modified ginkgolide liposomes by response surface methodology and study of their blood brain barrier permeability[J]. Molecules, 2018, 23: 303. DOI:10.3390/molecules23020303 |
| [35] | Youn SW, Jung KH, Chu K, et al. Feasibility and safety of intraarterial pericyte progenitor cell delivery following mannitol-induced transient blood brain barrier opening in a canine model[J]. Cell Transplant, 2015, 24: 1469–1479. DOI:10.3727/096368914X682413 |
| [36] | Bazan-Peregrino M, Rifai B, Carlisle RC, et al. Cavitation-enhanced delivery of a replicating oncolytic adenovirus to tumors using focused ultrasound[J]. J Control Release, 2013, 169: 40–47. DOI:10.1016/j.jconrel.2013.03.017 |
| [37] | Yoon YI, Yoon TJ, Lee HJ. Optimization of ultrasound parameters for microbubble-nanoliposome complex-mediated delivery[J]. Ultrasonography, 2015, 34: 297–303. DOI:10.14366/usg.15009 |
| [38] | Chen LJ, Lu CT, Zhao YZ, et al. Ultrasonic microbubbles for glioma-targeted drug delivery[J]. Acta Pharm Sin (药学学报), 2015, 50: 99–103. |
| [39] | Liu S, Yang S, Ho PC. Intranasal administration of carbamazepine-loaded carboxymethyl chitosan nanoparticles for drug delivery to the brain[J]. Asian J Pharm Sci, 2018, 13: 72–81. DOI:10.1016/j.ajps.2017.09.001 |
| [40] | Cole AJ, David AE, Wang J, et al. Magnetic brain tumor targeting and biodistribution of long-circulating PEG-modified, cross-linked starch coated iron oxide nanoparticles[J]. Biomaterials, 2011, 32: 6291–6301. DOI:10.1016/j.biomaterials.2011.05.024 |
| [41] | Zhang LK, Xu RX, Jiang M, et al. Evaluation of brain-targeting of β-asarone microemulsion by intranasal administration[J]. Chin Tradit Herb Drugs (中草药), 2014, 45: 86–89. |
| [42] | Pokharkar V, Patil-Gadhe A, Palla P. Efavirenz loaded nanostructured lipid carrier engineered for brain targeting through intranasal route:in-vivo pharmacokinetic and toxicity study[J]. Biomed Pharmacother, 2017, 94: 150–164. DOI:10.1016/j.biopha.2017.07.067 |
| [43] | El-Setouhy DA, Ibrahim AB, Amin MM, et al. Intranasal haloperidol-loaded miniemulsions for brain targeting:evaluation of locomotor suppression and in-vivo biodistribution[J]. Eur J Pharm Sci, 2016, 92: 244–254. DOI:10.1016/j.ejps.2016.05.002 |
| [44] | Narayan R, Singh M, Ranjan O, et al. Development of risperidone liposomes for brain targeting through intranasal route[J]. Life Sci, 2016, 163: 38–45. DOI:10.1016/j.lfs.2016.08.033 |
| [45] | Khan AR, Liu M, Khan MW, et al. Progress in brain targeting drug delivery system by nasal route[J]. J Control Release, 2017, 268: 364–389. DOI:10.1016/j.jconrel.2017.09.001 |
| [46] | Nair A. Implications of intrathecal chemotherapy for anaesthesiologists:a brief review[J]. Scientifica, 2016, 2016: 3759845. |
| [47] | Etminan N, Macdonald RL, Davis C, et al. Intrathecal application of the nimodipine slow-release microparticle system eg-1962 for prevention of delayed cerebral ischemia and improvement of outcome after aneurysmal subarachnoid hemorrhage[J]. Acta Neurochir Suppl, 2015, 120: 281–286. |
| [48] | Song Y, Fu XL, Lan TL, et al. Local irritation study of repeated lumbar intrathecal injection of ziconotide acetate[J]. Drug Eval Res (药物评价研究), 2017, 40: 54–58. |
| [49] | Li L, Liu T, Fu C, et al. Biodistribution, excretion, and toxicity of mesoporous silica nanoparticles after oral administration depend on their shape[J]. Nanomedicine, 2015, 11: 1915–1924. DOI:10.1016/j.nano.2015.07.004 |
 2019, Vol. 54
2019, Vol. 54


