近年来, 人类于肿瘤早期发现、早期诊断、早期治疗甚至在预防方面均取得显著进展, 但肺癌作为全球发病率及致死率最高的恶性肿瘤, 发病率和致死率分别可达11.6%和18.4%[1]。非小细胞肺癌(non-small cell lung cancer, NSCLC)是肺癌最为常见的组织学类型, 占所有肺癌的80%~85%。且患者就诊时多处于中晚期并错失手术治疗时机, 其5年生存率仅为15%[2]。目前, 常规传统肿瘤治疗方式作为治疗晚期NSCLC患者的治疗手段之一, 但其治疗效果欠佳。同样, 铂类化疗等传统化疗虽然作为无驱动致癌基因突变晚期NSCLC患者一线治疗策略, 其客观缓解率(objective response rate, ORR)为25%~35%, 中位总生存期(overall survival, OS)和中位无进展生存期(progression-free survival, PFS)分别为8~10个月和4~6个月。近些年, 有关NSCLC的传统治疗方案的疗效无明显提高, 晚期NSCLC的生存率依然裹足不前[3]。因此为了提高晚期NSCLC的治疗疗效和改善其生活质量, 寄希望于特异、高效的新型抗癌药物的研发和应用上。伴随着对致癌驱动基因和肿瘤信号转导通路在NSCLC的深入研究和基因检测技术的应运而生, 使NSCLC迈入精准化与个体化的靶向治疗时代。其中约5% NSCLC患者体内携带间变淋巴瘤激酶(anaplastic lymphoma kinase, ALK)基因融合, 该基因已被证实是一种NSCLC驱动致癌基因[4], 在2007年由Soda等[5]在NSCLC患者体内通过蛋白组学技术首次发现。此外, ALK与5'末端棘皮动物微管结合蛋白(echinoderm microtubule associated protein-like 4, EML4)形成融合基因最为常见[4]。ALK基因融合发生率并不存在显著种族差异, EML4-ALK多见于少量吸烟或从不吸烟及其他驱动基因为野生型的年轻肺腺癌女性患者[6, 7]。c-ros原癌基因1酪氨酸激酶(c-ros oncogene 1, receptor tyrosine kinase, ROS1)融合基因作为一类新的NSCLC驱动基因亚型, 其发生频率较低, 约占NSCLC的1%~2%, 且存在一定的种族差异, 多见于吸烟较少者或不吸烟的年轻腺癌者。其中CD74-ROS1是最常见的ROS1融合基因型基因序列[7, 8]。另外, 研究表明, ROS1与ALK在激酶催化区的ATP结合位点上可达77%的高度同源性[9, 10]。因此, ALK抑制剂可应用于治疗ROS1基因阳性的NSCLC患者。迄今为止, 已在NSCLC治疗领域研发多种ALK抑制剂。Ⅲ期临床研究PROFILE 1007[9, 11]和PROFILE 1029[12]等通过比较克唑替尼(crizotinib)与化疗在ALK阳性NSCLC患者中的临床疗效, 进一步证明了克唑替尼(crizotinib)在靶向治疗中具有卓越的疗效与安全性, 显著延长患者PFS, 两项研究两组中位PFS分别为7.7个月vs 3.0个月和11.1个月vs 6.8个月; ORR分别为65% vs 20%和88% vs 46%。以上研究结果奠定了crizotinib作为ALK阳性NSCLC患者一线治疗的地位。但不可避免的是, 几乎所有患者在接受crizotinib治疗后通常于1~2年出现耐药问题, 并且中枢神经系统(central nervous system, CNS)复发或进展较为常见[13]。因此, 第二代ALK抑制剂如ceritinib[14]、alectinib[15, 16]和brigatinib[14, 17]为crizotinib耐药和无法耐受的ALK阳性NSCLC患者提供了替代治疗方式。根据近期研究结果, 第二代ALK抑制剂较crizotinib作为ALK阳性NSCLC患者一线治疗可能更为高效[18-20]。当前临床试验数据均显示, crizotinib在治疗ROS1基因阳性的NSCLC患者中具有优异的治疗疗效[9, 21-23]。2015年和2018年美国食品药品监督管理局(Food and Drug Administration, FDA)和中国FDA分别批准crizotinib治疗ROS1重排的晚期NSCLC患者。然而继发性耐药突变的不可避免产生、血脑屏障穿透能力弱和其他致癌信号通路激活等在很大程度上削弱第一、二代ALK抑制剂的临床疗效[24-26]。
为此, 第三代新型ALK抑制剂-lorlatinib应运而生, 它具有强大的颅内治疗活性和高选择双重抑制ALK与ROS1等优点[27]。NCT01970865研究(Ⅰ期)结果显示, lorlatinib在既往接受2种以上ALK抑制剂(包括第二代ALK抑制剂)治疗ALK阳性NSCLC患者中已显示出卓越的抗肿瘤优越性; 其ORR为42%和中位PFS为9.2个月; ROS1阳性NSCLC患者ORR为50% [95%可信区间(confidence interval, CI), 21%~79%]和中位PFS为7.0个月(95% CI, 1.4~13.9个月), 其中60% (3/5) ROS1阳性NSCLC患者获得颅内客观缓解[28]。Elleraas等[29]研究结果表明, lorlatinib对目前已知的几乎所有耐药突变(除L1198F突变外)均有效(表 1)[30, 31]。本文就其化学结构、作用机制、药效动力学、药代动力学、用法和用量、临床研究、安全性和未来的发展方向进行综述。
1 化学结构Lorlatinib (PF-06463922);分子式: C21H19FN6O2; 化学名: 7-amino-12-fluoro-2, 10, 16-trimethyl-15-oxo-10, 15, 16, 17-tetrahydro-2H-8, 4-(metheno)pyrazolo(4, 3-h)(2, 5, 11)benzoxadiazacyclotetradecine-3-carbonitrile[13, 32, 33]。结构见图 1。Lorlatinib基于优化化学结构和增加亲脂性效率(lipophilic efficiency, LipE)等药物设计策略, 并成为强效ATP-竞争性ALK与ROS双重抑制的酰胺类大环化合物[34]。
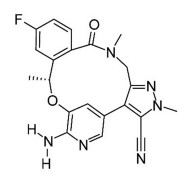
|
Figure 1 The structure of lorlatinib |
ALK融合基因通过EML4中的卷曲螺旋结构域与ALK激酶结构域融合, 赋予二聚化和组成型活化, 从而激活多条信号转导通路(如RAS-RAF-MEK-MAPK、PI3K/AKT和JAK/STAT等), 导致肿瘤发生(图 2)[31, 35]。Lorlatinib作为一个针对多种突变位点抑制剂, 对于ALK和ROS1具有高选择性。Gainor等[36]研究表明lorlatinib对已知几乎所有耐药突变(如L1196M、G1202R和G1269A)均有效并抑制ALK磷酸化。此外, 由于ROS1融合蛋白均保留其激酶结构域, 且大多数具有二聚化结构域, 可能导致ROS1酪氨酸激酶活化。Lorlatinib通过抑制ROS1磷酸化, 从而阻止PI3K-AKT、PLCγ-PKC和RAS-RAF-MEK-MAPK等信号通路的激活从而抑制ROS1驱动的细胞增殖与凋亡失控[37, 38]。同许多靶向药物类似, ROS1阳性NSCLC患者经历开始阶段的crizotinib治疗后不可避免地出现获得性耐药。研究表明, crizotinib治疗ROS1阳性NSCLC的耐药机制, 包括以下两类: ①获得性ROS1继发性突变, 约占50%~60%, 远高于ALK (20%~25%), 其中ROS1基因上的G2032R点突变作为最常见的突变之一, 通过影响P-loop区域妨碍crizotinib与ROS1结合[39], 从而导致耐药性的产生; ROS1基因的其他点突变包括D2033N、S1986Y/F、L2026M等。②替代旁路激活途径:如KIT突变活化、D816G、EGFR信号通路上调、上皮细胞间质转化(epithelial-mesenchymal transition, EMT)[40]及其他驱动基因突变影响(如KRAS、NRAS和RAS)等[41]。相比crizotinib, lorlatinib还显示出对crizotinib耐药ROS1突变的有效抑制, 其可以抑制S1986Y/F双突变[42]。体外实验lorlatinib能有效抑制crizotinib的L2026M、S1986Y/F和D2033N基因突变[40]。Facchinetti等[42]报道了1例EZR-ROS1重排、S1986Y/F突变NSCLC患者接受lorlatinib治疗后生存效益显著。此外, lorlatinib能够减少发生如crizotinib和ceritinib因血脑屏障和肿瘤细胞表面的P-糖蛋白(P-glycoprotein, P-gp)介导的药物外排, 降低透过血脑屏障的药物浓度。因此, lorlatinib具有高中枢神经系统渗透性, 对ALK基因驱动的脑转移患者具有强大的颅内治疗活性[43]。
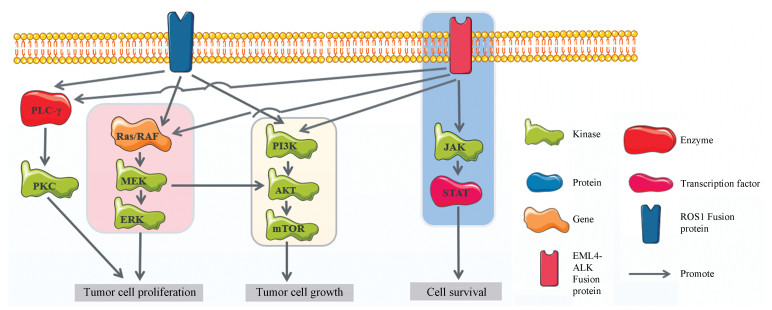
|
Figure 2 ALK and ROS1 mediates signaling in non-small cell lung cancer (NSCLC) |
Lorlatinib作为一种高效和强效的第三代ALK抑制剂。激酶实验中, lorlatinib对EML4-ALK融合突变的IC50值为2.3 nmol·L-1 (crizotinib为38.6 nmol·L-1); 对EML4-ALK V1、F1174C、E1210K、G1202del、D1203N和G1202R中的IC50值均较ceritinib、alectinib和brigatinib低(表 2)[44]。在Ba/F3细胞中, lorlatinib显示出对F1174I和F1174L突变位点有效, IC50值分别为1.2±0.3和4.9±2.6 nmol·L-1 (crizotinib的IC50分别为195±22.0和274±14.2 nmol·L-1)[45]。Zou等[43]报道lorlatinib、crizotinib、ceritinib和alectinib对G1202R突变的的平均IC50值分别为80、560、309和595 nmol·L-1, 同时lorlatinib在野生型ALK、L1196M、G1269A和1151Tins的平均Ki分别为0.07和0.1~0.9 nmol·L-1。以上研究结果均表明, lorlatinib对包括G1202R在内的几乎所有耐药突变具有较好的抗癌活性。此外, lorlatinib在抑制ROS1融合突变上也显示出优越性。近期几项研究结果表明, 其对ROS1抑制活性较ALK更为显著[43, 46, 47]。细胞水平的研究表明, lorlatinib对ROS1融合基因磷酸化的抑制程度较ceritinib和foretinib的作用强10倍; 较ceritinib和alectinib强100倍[47]。
| Table 2 IC50 values (nmol·L-1) of main ALK inhibitors on various ALK resistance mutants[44]. aIn Ba/F3 cells, ALK F1174C and ALK I1171T appear sensitive to ceritinib and alectinib, respectively; however, these mutations may not be susceptible to these agents in vivo based upon prior clinical reports. NA: Not available |
Lorlatinib作为一种低血浆清除率、中等分布容积、中度诱导CYP3A4酶的药物, 其药物消除半衰期(t1/2)为20~28 h, 并且血浆暴露量与剂量成比例, 口服10~75 mg剂量的lorlatinib后, 口服生物利用度为100%[48]。现有临床试验表明, 口服为lorlatinib的最佳给药途径, 同时将100 mg每日两次(BID)作为Ⅰ期临床试验的推荐剂量[47, 49, 50]。然而, 目前关于lorlatinib的药代动力学情况仍需大量药代动力学模型来探索体内代谢模式, 在Ⅰ期剂量递增实验中, 两项研究对于PK参数研究结果不同, Kwak等[51]进行的Ⅰ期剂量递增临床试验中PK分析结果表明, 当剂量大于100 mg每日一次(QD)时, PK参数呈非线性关系。相反的是, Bauer等[52]试验表明, 在剂量为10~75 mg QD, PK参数呈线性关系, 而剂量大于75 mg QD的PK参数呈非线性关系。
5 用法和用量Lorlatinib Ⅱ期临床试验的推荐剂量为100 mg QD; 最大耐受剂量(maximal tolerable dose, MTD)为250 mg QD[28, 51, 53]。Shaw等[28]在纳入54名ALK阳性或ROS1阳性晚期NSCLC的Ⅰ期剂量递增临床试验中发现, 仅有1例剂量限制性毒性(dose-limiting toxicity, DLT)为2级神经认知不良事件。截至目前, 100 mg QD仍作为Ⅱ期临床研究的推荐剂量, 研究结果表明, 不同患者对于lorlatinib的剂量耐受程度可能存在一定差异, 对于最佳剂量仍需更多大样本多中心的随机临床研究进行探索。
6 临床研究 6.1 Ⅰ期临床研究一项针对lorlatinib的国际、多中心、非盲、单臂Ⅰ期临床试验(NCT01970865)[28], 由美国、西班牙、澳大利亚、法国的5个研究中心共同开展, 共招募54例患者进行剂量递增研究, 41例(77%) ALK阳性, 12例(23%) ROS1阳性和1例ALK与ROS1状态未确定的NSCLC患者。其中20例(37%)患者既往接受过1种ALK抑制剂的治疗, 28例(52%)患者既往接受过2种或以上ALK抑制剂治疗。给药剂量为10~200 mg QD或35~100 mg BID。在此项临床试验中未检测出MTD; 在200 mg剂量组出现了1例DLT。结果显示, 在总体肿瘤应答中: ① ALK阳性NSCLC队列中, 46% (19/41)获得客观缓解, 其中3例(7%)完全缓解(complete response, CR), 16例(39%)部分缓解(partial response, PR), 8例(20%)达到疾病稳定(stable disease, SD), 中位持续缓解时间(duration of response, DOR)为9.3个月(95% CI, 6.8个月~未达到); ② ROS阳性患者, 获得客观缓解的患者比例为50% (6/12), 2例(17%)达到SD; ③既往接受过1种ALK抑制剂治疗患者, 57% (8/20)获得客观缓解; ④既往接受过≥2种ALK抑制剂治疗患者, 42% (11/26)达到客观缓解, 平均有效持续时间为11.7个月(95% Cl, 2.7个月~未达到)。针对脑转移的分析结果显示: ①具有颅内转移病灶的24例患者中, 11例(46%)达到颅内客观缓解, 7例(29%)获得颅内CR, 4例(17%)获颅内PR; ②在ALK阳性且颅内转移患者, 42% (8/19)获得颅内客观缓解; ③ ROS1阳性且颅内转移患者中, 60% (3/5)获得颅内客观缓解; ④可测量和/或不可测量的CNS转移灶的32例ALK阳性患者, 10例(31%)获CR或PR, 中位PFS为9.6个月(95% CI, 3.4~16.6个月), 其中14例ALK阳性患者既往接受过1种ALK抑制剂治疗; 既往接受过1种ALK抑制剂治疗和既往接受过≥2种ALK抑制剂患者中位PFS分别为13.5个月(95% CI, 1.6个月~未达到)和9.2个月(95% CI, 1.5个月~未达到)。53例患者的中位随访时间为17.4个月(95% CI, 16.1~22.1个月, 四分位数间距15.6%~23.2%)。由于19例患者发生数据删除, 剩余患者评估中位PFS为9.6个月(95% CI, 3.9 ~13.5个月)。
6.2 Ⅱ期临床试验Ⅱ期临床研究(NCT01970865)正在开展进行中, 截止至2018年2月12日, 该试验共招募367例ALK或ROS1阳性NSCLC患者进行100 mg QD给药剂量的研究。该研究主要终点是由独立中央审查证实的ORR和颅内ORR (IC-ORR)。Solomon等[54]阶段性报道了此项研究数据, 共纳入275例患者。截止至2017年10月15日, 227例ALK阳性患者评估了ORR, 其中包括140例患者考察了颅内应答。结果显示, 219例患者检测出ALK突变, 其中46例(21%)患者在循环游离DNA (cfDNA)检测出≥1突变位点, 其中27例获得客观缓解, ORR为59% (27/46)。根据治疗情况分队列进行分析: ① ALK抑制剂初治患者: ORR为90% (27/30), IC-ORR为75% (6/8); ② ALK阳性且既往仅接受过克唑替尼治疗患者: ORR为74% (20/27), IC-ORR为59% (10/17); ③ ALK阳性且既往接受过1种ALK抑制剂患者: ORR为51% (30/59), IC-ORR为63% (20/32); ④ ALK阳性且既往接受过2种ALK抑制剂患者: ORR为42% (27/65), IC-ORR为56% (25/45); ⑤ ALK阳性且既往接受过3种ALK抑制剂患者: ORR为35% (16/46), IC-ORR为39% (15/38)。Ou等[55]报道了该Ⅱ期研究结果, 共纳入47例ROS1阳性NSCLC患者, 其中25例患者检测出基线CNS转移, 34例患者已接受crizotinib治疗, 13例患者未经crizotinib治疗。对于ROS1阳性患者, ORR为36% (17/47, 95% CI: 23%~52%), IC-ORR为56% (14/25; 95% CI: 35%~76%); 对于既往接受crizotinib治疗患者, ORR为26.5% (95% CI: 13%~44%), IC-ORR为53% (95% CI: 29%~76%); 未经crizotinib治疗有8例获得CR, ORR为62% (95% CI: 32%~86%), IC-ORR为67% (95% CI: 22%~96%)。以上3组的中位PFS分别为9.9个月(95% CI: 6~21个月)、8.5个月(95% CI: 4~18个月)和21.0个月(95% CI: 4~27个月)。Bauer等[56]基于Ⅰ/Ⅱ期临床试验(NCT01970865), 通过测定lorlatinib在脑脊液与血浆的浓度比, 从而评估lorlatinib颅内活性。研究结果表明, 5例患者脑脊液与血浆的浓度比例为0.73 (SD 0.14), 说明lorlatinib能够高效穿透血脑屏障发挥其在脑转移患者中颅内治疗作用。研究同时纳入198例患者, 分别评估6个月和12个月的累积发病率(cumulative incidence rate, CIR) (表 3)[56]。
| Table 3 Cumulative incidence probability in NSCLC patients in a phase 1/2 study (NCT01970865)[56]. aPatients in expansion cohorts EXP2-5 from the phase 2 study; CNS: Central nervous system; NE: Not evaluable; TKI: Tyrosine kinase inhibitors |
另一项开放标签、剂量发现的Ⅰb/Ⅱ期临床研究(NCT02584634)正在开展以评估lorlatinib安全性、有效性、药效学、药动学等特性。试验计划招募晚期或脑转移NSCLC患者[57]。Shaw等[58]率先报道部分Ⅰb期试验数据, 该研究的主要终点是DLT, 次要研究终点分别为治疗不良反应事件(treatment-related adverse events, TRAEs)和ORR。截止至2017年10月27日, 12例ALK阴性患者接受avelumab (10 mg·kg-1 Q2W)与crizotinib (250 mg BID)联合治疗方案, 28例ALK阳性患者接受了avelumab (10 mg·kg-1 Q2W)与lorlatinib (100 mg QD)联合治疗方案, 其中所有ALK阳性患者平均已接受过2种(平均范围: 1~3种, 1例ALK阳性患者未纳入此研究) ALK抑制剂治疗。对于ALK阴性患者, DLT发生率为41.7%, ORR为16.7% (95% CI, 2.1%~48.4%), 2例获得PR; 对于ALK阳性患者, 无DTL现象发生, ORR为46.4% (95% CI, 27.5%~66.1%), 12例获得PR, 1例获得CR。
6.3 Ⅲ期临床研究一项随机、开放、国际多中心的Ⅲ期临床研究(NCT03052608)[59]已于2017年12月启动并开始招募患者, 旨在探索lorlatinib对比克唑替尼应用于晚期ALK阳性NSCLC患者一线治疗的安全性和有效性, 但尚无相关数据报道。
7 安全性Shaw等[28]开展的Ⅰ期临床研究对服用lorlatinib的54例患者进行安全性评估。结果表明, 最常见治疗不良反应事件(treatment emergent adverse events, TEAEs)为高胆固醇血症[72% (39/54)]、高甘油三酯血症[39% (21/54)]、外周神经病变[39% (21/54)]以及外周水肿[39% (21/54)]。3级及以上TEAEs主要为高胆固醇血症(13%)、高甘油三酯血症(6%)、体重增加(6%)、脂肪酶升高(4%)、影响认知(2%)和天冬氨酸转氨酶升高(2%)。在200 mg剂量治疗组中发现1例DTL, 为2级神经认知毒性事件, 表现为语表达缓慢、应答迟缓以及获得提取词语存在障碍。Solomon等[54]在Ⅱ期临床研究发现, 最常见的3/4级的TEAEs主要包括高胆固醇血症(81%/16%)、高甘油三酯血症(60%/16%)。发生TEAEs后, 30%和22%患者分别在暂停用药和减少剂量后恢复。7例(3%)患者因TEAEs停止治疗, 但无致命的不良反应事件发生。此外, Ou等[55]在Ⅱ期试验中评价了47例ROS1阳性患者最常见TEAEs高胆固醇血症(83%)和高甘油三酯血症(60%)。发生TEAEs后, 36%和23%患者分别在暂停用药和减少剂量后恢复。无患者因不良事件中止治疗。然而, 一些十分罕见的不良反应, 如结节病[60]、肾病综合征[61]、重症肌无力[62]、肺动脉高压[63]可能与lorlatinib治疗有关。
基于上述研究结果, 证明了lorlatinib耐受性良好, 安全可控。高胆固醇血症和高甘油三酯血症是其治疗过程中最常见的不良反应事件。其余主要表现为1~2级不良事件, 如周围神经病变、情绪认知影响、肝酶升高、视力障碍、便秘、恶心、水肿、疲乏和腹泻等(表 4)[28, 54, 55]。这些不良事件类似于其他ALK抑制剂, 可以通过减量或停药从而恢复正常。
| Table 4 Characteristics of treatment emergent adverse events (TRAEs) observed with lorlatinib use in several clinical trials[28, 54, 55]. TRAEs: Treatment-related adverse events; AST: Aspartate transaminase |
自2017年4月来, FDA授予lorlatinib治疗既往接受ALK抑制剂治疗ALK阳性转移性NSCLC突破性药物资格后, 全球各个研究中心逐渐开展关于lorlatinib的临床研究。作为新型、高效率、高选择、高脑渗透性的第三代ALK抑制剂, lorlatinib在ALK阳性和(或) ROS1阳性NSCLC靶向治疗中显示出初步优异的抗肿瘤疗效。它能使接受多种ALK抑制剂治疗失败及ALK驱动颅内转移NSCLC患者获得良好的生存效益, 显著延长生存时长[43, 64]。Lorlatinib与alectinib和ceritinib类似, 较crizotinib在治疗ALK阳性NSCLC中具有更为优越的临床疗效[20]。然而, 目前lorlatinib于临床试验中作为三线治疗选择的同时, 第三代表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitors, EGFR-TKI)较第一代EGFR-TKIs (gefitinib)于EGFR突变NSCLC患者中更为优越的临床疗效[65], 已被FDA推荐作为EGFR突变NSCLC患者一线治疗选择。此外, 关于ALK抑制剂的临床研究缺乏成熟的总生存数据。因此, lorlatinib能否作为ALK阳性NSCLC患者的一线治疗选择, 以及关于使用ALK抑制剂最佳的药物治疗序列等问题尚需探索。通过明确最佳药物治疗顺序, 不但为NSCLC患者提供持久有效的生存获益, 而且能进一步减轻患者经济负担。目前, 尽管lorlatinib对几乎已知所有ALK抑制剂产生的耐药突变均有效, 但继发性耐药问题日益凸显, 如L1198F突变能恢复C1156Y突变对第一代ALK抑制剂crizotinib的敏感性[66-68]。同样, 关于在使用第二代ALK抑制剂(如alectinib或ceritinib)后使用lorlatinib的序贯治疗方式的重要性仍不明确。临床前研究表明, alectinib和ceritinib均对lorlatinib耐药突变位点抵抗。Fan等[69]研究比较alectinib在ALK-TKI初治组与crizotinib组的临床疗效, 结果显示ALK抑制剂初治组的ORR显著优于crizotinib组(87% vs 52%)。此外, Ⅲ期ALUR研究(NCT02604342)比较了经crizotinib治疗后的ALK阳性肺癌患者在alectinib和化疗的临床疗效, 两组患者中位PFS分别为9.6个月(95% CI, 6.9~12.2个月)和1.4个月(95% CI, 1.3~1.6个月)[70]。另一项Ⅲ期J-ALEX试验比较alectinib作为初治与接受crizotinib后治疗选择的临床疗效, 两组中位PFS分别为20.3个月(95% CI, 20.3个月~未达到)和8.2个月(95% CI, 6.4~15.7个月)[18]。以上临床研究均提示, 于crizotinib治疗后使用alectinib可能有损其临床疗效。然而, 是否预先接受化疗对于alectinib的临床疗效似乎未产生影响[18]。因此, 通过借鉴alectinib临床试验并探索lorlatinib在靶向治疗的用药顺序起着至关重要的作用。
8.2 联合治疗策略近年来, 免疫治疗为NSCLC患者开辟了一个全新的领域, 通过增强人体自身免疫系统来清除肿瘤细胞。另外, 一项旨在比较avelumab联合crizotinib或lorlatinib治疗方案在晚期NSCLC患者中的临床疗效的Ⅰb/Ⅱ期临床研究(NCT02584634)正在开展[58]。此外, 另一项Ⅰ/Ⅱ临床试验(CheckMate 370)将nivolumab联合crizotinib的组合治疗作为NSCLC患者的一线治疗选择[71]。一项Ⅰ/Ⅱ期临床试验(NCT02898116)关于PD-L1抑制(durvalumab)与ensartinib联合治疗ALK阳性NSLCLC临床疗效正在开展[72]。然而, 关于免疫治疗与ALK抑制剂的联合治疗能否成为NSCLC全新高效的治疗策略, 这仍需大量临床试验进一步证实。
另外, ALK抑制剂与旁路(如包括EGFR突变、KRAS突变、KIT扩增、ErbB、MET扩增及下游信号通路IGF-1R等ALK非依赖型耐药信号通路)[44]抑制剂联合治疗手段也可能成为另一种克服耐药的全新治疗策略。这些联合治疗方案极大丰富了ALK阳性NSCLC患者的用药选择。
8.3 潜在疗效标志物目前, 有关评估lorlatinib的临床疗效潜在标志物的研究十分有限。一项研究表明, EML4-ALK变体3较EML4-ALK变体1患者发生ALK耐药突变率显著增加(57% vs 30%, P=0.023);其中ALK G1202R突变在EML4-ALK变体3中较变体1中更为常见(32% vs 0);此外, 在29例接受lorlatinib治疗患者中EML4-ALK变体3较EML4-ALK变体1患者的中位PFS显著延长(11.0个月vs 3.3个月; HR=0.31, P=0.011)。这表明EML4-ALK变体3可能与ALK耐药突变(尤其是G1202R突变)发生发展相关[73]。由于缺乏足够的临床样本量, EMLK-ALK融合变体亚型与临床转归和(或)耐药机制的关联仍需基础与临床研究不断深入探索。这一研究初步表明, 特异性EMLK-ALK融合变体亚型可能作为lorlatinib疗效评估的潜在生物标志物, 进一步明确ALK阳性患者的变体亚型, 为NSCLC患者治疗提供“个体化”指导。
9 结语伴随ALK、ROS1和EGFR等肺癌驱动致癌突变相继确定和相应靶向药物的研发与应用, 靶向治疗标志着肿瘤治疗正迈入基于分子标记物的医学时代。继第一、二代ALK抑制剂后, 第三代ALK抑制剂lorlatinib显著改善了ALK阳性NSCLC患者靶向治疗现状, 将NSCLC靶向治疗推向新的征程。当前临床研究数据均显示, lorlatinib具有高效性、安全性和抗肿瘤优越性。因此, 研究者拭目以待通过更多临床试验以阐明lorlatinib治疗优势及最佳治疗策略, 期望将靶向治疗精准化、高效化、个体化, 进而提高生存受益, 延缓生存时长, 改善生存质量, 减轻经济负担。
| [1] | Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68: 394–424. DOI:10.3322/caac.v68.6 |
| [2] | Rosell R, Karachaliou N. Large-scale screening for somatic mutations in lung cancer[J]. Lancet, 2016, 387: 1354–1356. DOI:10.1016/S0140-6736(15)01125-3 |
| [3] | Hsu WH, Yang JC, Mok TS, et al. Overview of current systemic management of EGFR-mutant NSCLC[J]. Ann Oncol, 2018, 29: i3–i9. DOI:10.1093/annonc/mdx702 |
| [4] | Tsao AS, Scagliotti GV, Bunn PA, et al. Scientific advances in lung cancer 2015[J]. J Thorac Oncol, 2016, 11: 613–638. DOI:10.1016/j.jtho.2016.03.012 |
| [5] | Soda M, Choi YL, Enomoto M, et al. Identification of the transforming EML4-ALK fusion gene in non-small-cell lung cancer[J]. Nature, 2007, 448: 561–566. DOI:10.1038/nature05945 |
| [6] | Gainor JF, Varghese AM, Ou SHI, et al. ALK rearrangements are mutually exclusive with mutations in EGFR or KRAS:an analysis of 1, 683 patients with non-small cell lung cancer[J]. Clin Cancer Res, 2013, 19: 4273–4281. DOI:10.1158/1078-0432.CCR-13-0318 |
| [7] | Camidge DR, Kono SA, Flacco A, et al. Optimizing the detection of lung cancer patients harboring anaplastic lymphoma kinase (ALK) gene rearrangements potentially suitable for ALK inhibitor treatment[J]. Clin Cancer Res, 2010, 16: 5581–5590. DOI:10.1158/1078-0432.CCR-10-0851 |
| [8] | Ogura H, Nagatake-Kobayashi Y, Adachi J, et al. TKI-addicted ROS1-rearranged cells are destined to survival or death by the intensity of ROS1 kinase activity[J]. Sci Rep, 2017, 7: 5519. DOI:10.1038/s41598-017-05736-9 |
| [9] | Shaw AT, Bang YJ. Crizotinib in ROS1-rearranged non-small-cell lung cancer[J]. N Engl J Med, 2015, 372: 683–684. DOI:10.1056/NEJMc1415359 |
| [10] | Chin LP, Soo RA, Soong R, et al. Targeting ROS1 with anaplastic lymphoma kinase inhibitors:a promising therapeutic strategy for a newly defined molecular subset of non-small-cell lung cancer[J]. J Thorac Oncol, 2012, 7: 1625–1630. DOI:10.1097/JTO.0b013e31826baf83 |
| [11] | Shaw AT, Kim DW, Nakagawa K, et al. Crizotinib versus chemotherapy in advanced ALK-positive lung cancer[J]. N Engl J Med, 2013, 368: 2385–2394. DOI:10.1056/NEJMoa1214886 |
| [12] | Nishio M, Kim DW, Wu YL, et al. Crizotinib versus chemotherapy in Asian patients with ALK-Positive advanced non-small cell lung cancer[J]. Cancer Res Treat, 2018, 50: 691–700. DOI:10.4143/crt.2017.280 |
| [13] | Solomon BJ, Mok T, Kim DW, et al. First-line crizotinib versus chemotherapy in ALK-positive lung cancer[J]. N Engl J Med, 2014, 371: 2167–2177. DOI:10.1056/NEJMoa1408440 |
| [14] | Shaw AT, Kim DW, Mehra R, et al. Ceritinib in ALK-rearranged non-small-cell lung cancer[J]. N Engl J Med, 2014, 370: 2537–2539. DOI:10.1056/NEJMc1404894 |
| [15] | Ou SHI, Ahn JS, De Petris L, et al. Alectinib in crizotinib-refractory ALK-rearranged non-small-cell lung cancer:a phase Ⅱ global study[J]. J Clin Oncol, 2016, 34: 661–668. DOI:10.1200/JCO.2015.63.9443 |
| [16] | Shaw AT, Gandhi L, Gadgeel S, et al. Alectinib in ALK-positive, crizotinib-resistant, non-small-cell lung cancer:a single-group, multicentre, phase 2 trial[J]. Lancet Oncol, 2016, 17: 234–242. DOI:10.1016/S1470-2045(15)00488-X |
| [17] | Kim DW, Tiseo M, Ahn MJ, et al. Brigatinib in patients with crizotinib-refractory anaplastic lymphoma kinase-positive non-small-cell lung cancer:a randomized, multicenter phase Ⅱ trial[J]. J Clin Oncol, 2017, 35: 2490–2498. DOI:10.1200/JCO.2016.71.5904 |
| [18] | Hida T, Nokihara H, Kondo M, et al. Alectinib versus crizotinib in patients with ALK-positive non-small-cell lung cancer (J-ALEX):an open-label, randomised phase 3 trial[J]. Lancet, 2017, 390: 29–39. DOI:10.1016/S0140-6736(17)30565-2 |
| [19] | Soria JC, Tan DSW, Chiari R, et al. First-line ceritinib versus platinum-based chemotherapy in advanced ALK-rearranged non-small-cell lung cancer (ASCEND-4):a randomised, open-label, phase 3 study[J]. Lancet, 2017, 389: 917–929. DOI:10.1016/S0140-6736(17)30123-X |
| [20] | Peters S, Camidge DR, Shaw AT, et al. Alectinib versus crizotinib in untreated ALK-positive non-small-cell lung cancer[J]. N Engl J Med, 2017, 377: 829–838. DOI:10.1056/NEJMoa1704795 |
| [21] | Bergethon K, Shaw AT, Ou SH, et al. ROS1 rearrangements define a unique molecular class of lung cancers[J]. J Clin Oncol, 2012, 30: 863–870. DOI:10.1200/JCO.2011.35.6345 |
| [22] | Wu YL, Yang JCH, Kim DW, et al. Phase Ⅱ study of crizotinib in East Asian patients with ROS1-positive advanced non-small-cell lung cancer[J]. J Clin Oncol, 2018, 36: 1405–1411. DOI:10.1200/JCO.2017.75.5587 |
| [23] | Davies KD, Le AT, Theodoro MF, et al. Identifying and targeting ROS1 gene fusions in non-small cell lung cancer[J]. Clin Cancer Res, 2012, 18: 4570–4579. DOI:10.1158/1078-0432.CCR-12-0550 |
| [24] | Sullivan I, Planchard D. Targeting ALK-rearranged non-small-cell lung cancer:an update[J]. Future Oncol, 2017, 13: 1213–1217. DOI:10.2217/fon-2017-0127 |
| [25] | Avrillon V, Pérol M. Alectinib for treatment of ALK-positive non-small-cell lung cancer[J]. Future Oncol, 2017, 13: 321–335. DOI:10.2217/fon-2016-0386 |
| [26] | Le T, Gerber DE. ALK alterations and inhibition in lung cancer[J]. Semin Cancer Biol, 2017, 42: 81–88. DOI:10.1016/j.semcancer.2016.08.007 |
| [27] | Collier TL, Normandin MD, Stephenson NA, et al. Synthesis and preliminary PET imaging of 11C and 18F isotopologues of the ROS1/ALK inhibitor lorlatinib[J]. Nat Commun, 2017, 8: 15761. DOI:10.1038/ncomms15761 |
| [28] | Shaw AT, Felip E, Bauer TM, et al. Lorlatinib in non-small-cell lung cancer with ALK or ROS1 rearrangement:an international, multicentre, open-label, single-arm first-in-man phase 1 trial[J]. Lancet Oncol, 2017, 18: 1590–1599. DOI:10.1016/S1470-2045(17)30680-0 |
| [29] | Elleraas J, Ewanicki J, Johnson TW, et al. Conformational studies and atropisomerism kinetics of the ALK clinical candidate lorlatinib (PF-06463922) and desmethyl congeners[J]. Angew Chem Int Ed Engl, 2016, 55: 3590–3595. DOI:10.1002/anie.201509240 |
| [30] | Peters S, Zimmermann S. Management of resistance to first-line anaplastic lymphoma kinase tyrosine kinase inhibitor therapy[J]. Curr Treat Option Oncol, 2018, 19: 37. DOI:10.1007/s11864-018-0553-x |
| [31] | Sharma GG, Mota I, Mologni L, et al. Tumor resistance against ALK targeted therapy-where it comes from and where it goes[J]. Cancers, 2018. DOI:10.3390/cancers10030062 |
| [32] | Takeuchi K, Soda M, Togashi Y, et al. RET, ROS1 and ALK fusions in lung cancer[J]. Nat Med, 2012, 18: 378–381. DOI:10.1038/nm.2658 |
| [33] | Choi YL, Lira ME, Hong M, et al. A novel fusion of TPR and ALK in lung adenocarcinoma[J]. J Thorac Oncol, 2014, 9: 563–566. DOI:10.1097/JTO.0000000000000093 |
| [34] | Zou HY, Li QH, Engstrom LD, et al. PF-06463922 is a potent and selective next-generation ROS1/ALK inhibitor capable of blocking crizotinib-resistant ROS1 mutations[J]. Proc Natl Acad Sci U S A, 2015, 112: 3493–3498. DOI:10.1073/pnas.1420785112 |
| [35] | Mano H. Non-solid oncogenes in solid tumors:EML4-ALK fusion genes in lung cancer[J]. Cancer Sci, 2008, 99: 2349–2355. DOI:10.1111/cas.2008.99.issue-12 |
| [36] | Gainor JF, Chi AS, Logan J, et al. Alectinib dose escalation reinduces central nervous system responses in patients with anaplastic lymphoma kinase-positive non-small cell lung cancer relapsing on standard dose alectinib[J]. J Thorac Oncol, 2016, 11: 256–260. DOI:10.1016/j.jtho.2015.10.010 |
| [37] | Bansal P, Osman D, Gan GN, et al. Recent advances in targetable therapeutics in metastatic non-squamous NSCLC[J]. Front Oncol, 2016, 6: 112. |
| [38] | Hardin C, Wang F, Cheng HY. Precision drug development in ROS1-positive lung cancer[J]. Expert Rev Precis Med Drug Dev, 2017, 2: 99–107. DOI:10.1080/23808993.2017.1322899 |
| [39] | Sun HY, Li YY, Tian S, et al. P-loop conformation governed crizotinib resistance in G2032R-mutated ROS1 tyrosine kinase:clues from free energy landscape[J]. PLoS Comput Biol, 2014, 10: e1003729. DOI:10.1371/journal.pcbi.1003729 |
| [40] | Lin JJ, Shaw AT. Recent advances in targeting ROS1 in lung cancer[J]. J Thorac Oncol, 2017, 12: 1611–1625. DOI:10.1016/j.jtho.2017.08.002 |
| [41] | Song A, Kim TM, Kim DW, et al. Molecular changes associated with acquired resistance to crizotinib in ROS1-rearranged non-small cell lung cancer[J]. Clin Cancer Res, 2015, 21: 2379–2387. DOI:10.1158/1078-0432.CCR-14-1350 |
| [42] | Facchinetti F, Loriot Y, Kuo MS, et al. Crizotinib-resistant ROS1 mutations reveal a predictive kinase inhibitor sensitivity model for ROS1-and ALK-rearranged lung cancers[J]. Clin Cancer Res, 2016, 22: 5983–5991. DOI:10.1158/1078-0432.CCR-16-0917 |
| [43] | Zou HY, Friboulet L, Kodack DP, et al. PF-06463922, an ALK/ROS1 inhibitor, overcomes resistance to first and second generation ALK inhibitors in preclinical models[J]. Cancer Cell, 2015, 28: 70–81. DOI:10.1016/j.ccell.2015.05.010 |
| [44] | Gainor JF, Dardaei L, Yoda S, et al. Molecular mechanisms of resistance to first-and second-generation ALK inhibitors in ALK-rearranged lung cancer[J]. Cancer Discov, 2016, 6: 1118–1133. DOI:10.1158/2159-8290.CD-16-0596 |
| [45] | Guan J, Tucker ER, Wan H, et al. The ALK inhibitor PF-06463922 is effective as a single agent in neuroblastoma driven by expression of ALK and MYCN[J]. Dis Model Mech, 2016, 9: 941–952. DOI:10.1242/dmm.024448 |
| [46] | Johnson TW, Richardson PF, Bailey S, et al. Discovery of (10R)-7-amino-12-fluoro-2, 10, 16-trimethyl-15-oxo-10, 15, 16, 17-tetrahydro-2H-8, 4-(metheno)pyrazolo[4, 3-h] [2, 5, 11] -benzoxadiazacyclotetradecine-3-carbonitrile (PF-06463922), a macrocyclic inhibitor of anaplastic lymphoma kinase (ALK) and c-ros oncogene 1(ROS1) with preclinical brain exposure and broad-spectrum potency against ALK-resistant mutations[J]. J Med Chem, 2014, 57: 4720–4744. DOI:10.1021/jm500261q |
| [47] | Basit S, Ashraf Z, Lee K, et al. First macrocyclic 3rd-generation ALK inhibitor for treatment of ALK/ROS1 cancer:clinical and designing strategy update of lorlatinib[J]. Eur J Med Chem, 2017, 134: 348–356. DOI:10.1016/j.ejmech.2017.04.032 |
| [48] | Shaw AT, Bauer TM, Felip E, et al. Clinical activity and safety of PF-06463922 from a dose escalation study in patients with advanced ALK+ or ROS1+ NSCLC[J]. J Clin Oncol, 2015, 33: 8018. DOI:10.1200/jco.2015.33.15_suppl.8018 |
| [49] | Yamazaki S, Lam JL, Zou HY, et al. Mechanistic understanding of translational pharmacokinetic-pharmacodynamic relationships in nonclinical tumor models:a case study of orally available novel inhibitors of anaplastic lymphoma kinase[J]. Drug Metab Dispos, 2015, 43: 54–62. |
| [50] | Versteeg R, George RE. Targeting ALK:the ten lives of a tumor[J]. Cancer Discov, 2016, 6: 20–21. DOI:10.1158/2159-8290.CD-15-1411 |
| [51] | Kwak EL, Camidge DR, Clark J, et al. Clinical activity observed in a Phase Ⅰ dose escalation trial of an oral c-met and ALK inhibitor, PF-02341066[J]. J Clin Oncol, 2009, 27: 3509. |
| [52] | Bauer T, Solomon BJ, Besse B, et al. Clinical activity and safety of the ALK/ROS1 TK inhibitor PF-06463922 in advanced NSCLC[J]. J Thorac Oncol, 2015, 10: S239. |
| [53] | Solomon BJ, Bauer TM, Felip E, et al. Safety and efficacy of lorlatinib (PF-06463922) from the dose-escalation component of a study in patients with advanced ALK+ or ROS1+ non-small cell lung cancer (NSCLC)[J]. J Clin Oncol, 2016, 34: 9009. DOI:10.1200/JCO.2016.34.15_suppl.9009 |
| [54] | Solomon B, Shaw A, Ou S, et al. Phase 2 study of lorlatinib in patients with advanced ALK+/ROS1+ non-small-cell lung cancer[J]. J Thorac Oncol, 2017, 12: S1756. DOI:10.1016/j.jtho.2017.09.351 |
| [55] | Ou S, Shaw A, Riely G, et al. Clinical activity of lorlatinib in patients with ROS1+ advanced non-small cell lung cancer:phase 2 study cohort EXP-6[J]. J Thorac Oncol, 2018, 13: S322–S323. |
| [56] | Bauer T, Shaw A, Johnson M, et al. Brain penetration of lorlatinib and cumulative incidence rates for CNS and non CNS progression from a phase 1/2 study[J]. J Thorac Oncol, 2018, 13: S382–S383. |
| [57] | Pfizer. A Phase 1b/2, open-label, dose-finding study to evaluate safety, efficacy, pharmacokinetics and pharmacodynamics of avelumab (msb0010718c) in combination with either crizotinib or Pf-06463922in patients with advanced or metastatic non-small cell lung cancer. (2018-12-17)[2019-01-07]. https://clinicaltrials.gov/ct2/show/NCT02584634. |
| [58] | Shaw AT, Lee SH, Ramalingam SS, et al. Avelumab (anti-PD-L1) in combination with crizotinib or lorlatinib in patients with previously treated advanced NSCLC:phase 1b results from JAVELIN Lung 101[J]. J Clin Oncol, 2018, 36: 9008. DOI:10.1200/JCO.2018.36.15_suppl.9008 |
| [59] | Pfizer. A phase 3, randomized, open-label study of lorlatinib (Pf-06463922) monotherapy versus crizotinib monotherapy in the first-line treatment of patients with advanced ALK-positive non-small cell lung cancer[EB/OL]. (2018-12-25)[2019-01-07]. https://clinicaltrials.gov/ct2/show/NCT03052608. |
| [60] | Facchinetti F, Gnetti L, Balestra V, et al. Sarcoid-like reaction mimicking disease progression in an ALK-positive lung cancer patient receiving lorlatinib[J]. Invest New Drugs, 2018. DOI:10.1007/s10637-018-0652-3 |
| [61] | Betton M, Gounant V, Sannier A, et al. Minimal change disease induced by lorlatinib[J]. J Thorac Oncol, 2018, 13: e154–e156. DOI:10.1016/j.jtho.2018.03.033 |
| [62] | Desai A, Sriwastava S, Gadgeel SM, et al. New onset myasthenia gravis in a patient with non small cell lung cancer treated with lorlatinib a novel anti-cancer agent[J]. J Neurol Sci, 2018, 392: 100–101. DOI:10.1016/j.jns.2018.06.024 |
| [63] | Chabrol A, Mayenga M, Hamid AM, et al. Lorlatinib-induced pulmonary arterial hypertension[J]. Lung Cancer, 2018, 120: 60–61. DOI:10.1016/j.lungcan.2018.03.023 |
| [64] | Infarinato NR, Park JH, Krytska K, et al. The ALK/ROS1 inhibitor PF-06463922 overcomes primary resistance to crizotinib in ALK-driven neuroblastoma[J]. Cancer Discov, 2016, 6: 96–107. DOI:10.1158/2159-8290.CD-15-1056 |
| [65] | Soria JC, Ohe Y, Vansteenkiste J, et al. Osimertinib in untreated EGFR-mutated advanced non-small-cell lung cancer[J]. N Engl J Med, 2018, 378: 113–125. DOI:10.1056/NEJMoa1713137 |
| [66] | Shaw AT, Friboulet L, Leshchiner I, et al. Resensitization to crizotinib by the lorlatinib ALK resistance mutation L1198F[J]. N Engl J Med, 2016, 374: 54–56. DOI:10.1056/NEJMoa1508887 |
| [67] | Yoda S, Lin JJ, Lawrence MS, et al. Sequential ALK inhibitors can select for lorlatinib-resistant compound ALK mutations in ALK-positive lung cancer[J]. Cancer Discov, 2018, 8: 714–729. DOI:10.1158/2159-8290.CD-17-1256 |
| [68] | Chong CR, Bahcall M, Capelletti M, et al. Identification of existing drugs that effectively target NTRK1 and ROS1 rearrangements in lung cancer[J]. Clin Cancer Res, 2017, 23: 204–213. DOI:10.1158/1078-0432.CCR-15-1601 |
| [69] | Fan JS, Xia ZF, Zhang XL, et al. The efficacy and safety of alectinib in the treatment of ALK+ NSCLC:a systematic review and meta-analysis[J]. Onco Targets Ther, 2018, 11: 1105–1115. DOI:10.2147/OTT |
| [70] | Novello S, Mazières J, Oh IJ, et al. Alectinib versus chemotherapy in crizotinib-pretreated anaplastic lymphoma kinase (ALK)-positive non-small-cell lung cancer:results from the phase Ⅲ ALUR study[J]. Ann Oncol, 2018, 29: 1409–1416. DOI:10.1093/annonc/mdy121 |
| [71] | Spigel DR, Reynolds C, Waterhouse D, et al. Phase 1/2 study of the safety and tolerability of nivolumab plus crizotinib for the first-line treatment of anaplastic lymphoma kinase translocation-positive advanced non-small cell lung cancer (CheckMate 370)[J]. J Thorac Oncol, 2018, 13: 682–688. DOI:10.1016/j.jtho.2018.02.022 |
| [72] | Ludwig Institute for Cancer Research. A phase1/2 study of ALK inhibitor, ensartinib (X-396), and anti-PD-L1, durvalumab (MEDI 4736), in subjects with ALK-rearranged (ALK-positive) non-small cell lung cancer (NSCLC)[EB/OL]. (2018-11-21)[2019-01-07]. https://clinicaltrials.gov/ct2/show/NCT02898116. |
| [73] | Lin JJ, Zhu VW, Yoda S, et al. Impact of EML4-ALK variant on resistance mechanisms and clinical outcomes in ALK-positive lung cancer[J]. J Clin Oncol, 2018, 36: 1199–1206. DOI:10.1200/JCO.2017.76.2294 |
 2019, Vol. 54
2019, Vol. 54


