血管内皮是血液与间质之间的单层细胞层, 能够限制血管内部与间质之间水分子、蛋白质分子、脂质分子和细胞的交换。血管内皮屏障由内皮细胞、细胞间连接和基膜组成, 血管壁内皮细胞的排列及细胞间连接是形成血管内皮屏障的基础[1], 二者都受到细胞骨架的精密调控。其中, 紧密连接(tight junctions, TJ)具有连接作用和封闭细胞间隙的作用, 蛋白质等大分子不能通过紧密连接, 而小分子如水、离子可选择性地通过, 是血管内皮屏障的基础。TJ由跨膜的整合蛋白和闭锁小带(zonula occludens, ZOs)组成, ZOs直接受到F肌动蛋白(F-actin)的调节[2]。黏合连接(adjective junction, AJ)有点状及稳定线性两种状态, 能响应外界刺激在两种状态间转换从而调节血管内皮屏障完整性。AJ主要由钙黏蛋白(cadherins)组成, 钙黏蛋白在胞质尾部与连环蛋白结合, 锚定肌动蛋白丝, 封闭细胞旁间隙[3], 血管内皮钙黏蛋白(vascular epithelium, VE-cadherin)是血管内皮细胞AJ复合物形成的重要因子[4]。
毛细血管的通透性受到血管内外化学刺激及机械应力的影响, 血管内皮完整性的变化是炎症反应或血管修复的必要基础[5], 但当血管内皮屏障受损时, 可能出现一系列由渗漏引起的疾病如肺水肿、脑卒中、脓毒血症、动脉粥样硬化及糖尿病[6]。可溶性炎症介质如凝血酶破坏血管内皮屏障有两个重要靶点, 一个是细胞间连接连续性的破坏引起血管内外物质交换的异常, 另一个则是肌动蛋白细胞骨架的收缩使得内皮细胞不能紧密排列[7]。
2 Rho-GTP酶(Rho-GTPase)家族Rho-GTP酶是小G蛋白的一个家族, 也是Ras超家族的一部分, 它能够调节肌动蛋白, 参与细胞骨架重排、囊泡运输和细胞黏附等生理过程[8]。在哺乳动物中目前已经发现20种Rho-GTP酶, 被分为8个亚家族(表 1)[9]。Rho-GTP酶与GTP结合时有活性, 与GDP结合时无活性; 这一过程受到鸟嘌呤核苷酸交换因子(guanine nucleotide exchange factor, GEF)、GTP酶活化蛋白(GTPase activating protein, GAP)和鸟嘌呤核苷酸解离抑制剂(guanine nucleotide dissociation inhibitor, GDI)的调节[10]。此外, Rho-GTP酶也受到翻译后修饰的调控, 如磷酸化、泛素化和SUMO化。
| Table 1 Members of the Rho-GTPase family |
Rho-GTP酶及其调节剂是细胞骨架与细胞间连接的重要调节因子。RhoA (Ras homolog gene family, member A)及下游分子Rho相关激酶1 (Rho-associated protein kinase, ROCK1)[11]可以使肌球蛋白轻链磷酸酶(myosin light chain phosphatase, MLCP)失活[12], MLCP的作用为促进肌球蛋白轻链(myosin light chain, MLC)去磷酸化失活[13], 故RhoA/ROCK1通路激活MLC, 活化微丝的动力蛋白——肌球蛋白Ⅱ (myosin-Ⅱ)[14], 诱导微丝聚集。ROCK1是目前功能研究最为详尽的Rho下游靶效应分子, 在调控血管内皮细胞骨架中起重要作用[15]。
Rac1 (Ras-related C3 botulinum toxin substrate 1)激活p21相关的丝苏氨酸激酶(p21-associated serine/threonine kinase, PAK), 磷酸化LIM激酶1 (LIM domain kinase 1, LIMK1), 促使肌动蛋白切断蛋白(cofilin, CFL)失活, 从而抑制F肌动蛋白解聚, 阻断微丝重构[16]。
Cdc42活化丝氨酸/苏氨酸蛋白激酶MRCKβ (serine/threonine-protein kinase MRCK beta, MRCKβ)及非肌肉肌球蛋白Ⅱ (non-muscle myosin Ⅱ, NM-Ⅱ), 刺激局部周围肌动蛋白束(circumferential actin bundles, CAB)形成并稳定VE钙黏蛋白带, 促进AJ重组装[17]。
3 Rho-GTP酶参与血管内皮屏障功能调节Rho-GTP酶家族分子对血管内皮屏障的完整性具有双重影响。一方面Rho-GTP酶参与炎性因子诱导的血管内皮稳定性丧失的过程, 另一方面参与维持血管内皮屏障稳定性, 并且在受损后诱导血管内皮完整性的修复。Rho-GTP酶的双重作用与其亚细胞定位密切相关[17]。当GEF响应炎性因子的刺激而广泛分布于细胞各处时, 微丝聚集产生急性细胞收缩, 引起血管内皮屏障的破坏[18], 而当GEF被募集到细胞膜附近时, 激活的RhoA能促进微丝生成, 参与细胞间连接的产生、成熟[19], 激活的Rac1或Cdc42则能够减少细胞膜附近微丝重构, 与血管内皮的稳定密切相关[20] (图 1)。
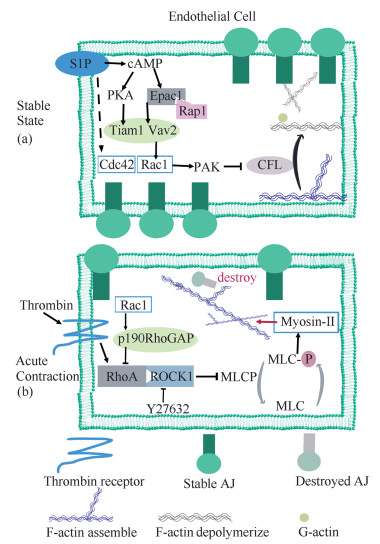
|
Figure 1 Rho-GTPase regulation of the endothelial barrier. In a stable vascular endothelial barrier (a), Rac1 and Cdc42 would inhibit cofilin, which is an important actin-severing protein. Thus, they help maintain the integrity of vascular endothelial barrier. While the vascular endothelial barrier is destructed (b), RhoA/ROCK1 responses to thrombin and results in the activation of myosin-Ⅱ. It leads to the acute contraction and causes endothelial barrier disruption. Y-27632, an inhibitor of ROCK, could counteracting the disruption of endothelial barrier. S1P: Sph-1-P; cAMP: Cyclic adenosine monophosphate; PKA: Protein kinase A; Epac1: Exchange proteins directly activated by cAMP; Rap1: Ras-related protein 1; Tiam1: T-cell lymphoma invasion and metastasis-inducing protein 1; Vav2: Guanosine nucleotide exchange factor Vav2; Cdc42: Cell division control protein 42; Rac1: Ras-related C3 botulinum toxin substrate 1; PAK: P21-associated serine/threonine kinase; CFL: Cofilin; RhoA: Ras homolog gene family, member A; ROCK1: Rho-associated protein kinase 1; MLCP: Myosin light chain phosphatase; MLC: Myosin light chain; AJ: Adjective junction |
经典理论认为RhoA介导血管内皮屏障完整性的丧失, RhoA响应炎性分子活化NM-Ⅱ引起细胞收缩破坏血管内皮屏障; 而Rac1会拮抗这一过程, Rac1激活p190RhoGAP (RhoA的GAP)抑制RhoA活化[21]。近期研究表明, Rho-GTP酶对血管内皮屏障的调节作用远不止如此, Rac1及Cdc42是静息状态下血管内皮稳定性维持的重要环节[22], 且与受损后屏障功能的恢复相关, RhoB和RhoC可能是血管内皮屏障的负性调节因子[23]。
3.1 RhoARhoA的主要功能是调节微丝细胞骨架, 是最早报道的与血管内皮屏障相关的Rho-GTP酶[24]。当炎症因子刺激时, RhoA的GEF广泛分布于细胞各处, 活化的RhoA及NM-Ⅱ引起细胞内微丝聚集, 这一反应会产生急性的细胞收缩且促使AJ由稳定带状转为不连续点状分布[18]。21世纪前, 人们应用凝血酶诱导血管内皮屏障的破坏, 在其中观察到RhoA的活化和MLC的磷酸化[25], 并且发现RhoA的抑制剂C3转移酶(C3 transferase)能完全阻断凝血酶诱导人脐带静脉内皮细胞屏障破坏的过程, 提出MLC的活化是引起细胞收缩与血管内皮屏障功能丧失的重要步骤[12]。Monickaraj等[18]将组织蛋白酶D (cathepsin D, CD)加入人视网膜微血管内皮细胞中, 模拟糖尿病中视网膜血管内皮屏障的破坏, 在其中观察到F肌动蛋白密度显著增加及外周VE钙黏蛋白带的破坏, 且ROCK抑制剂Y27632阻断了这一过程, 证实RhoA/ROCK1是通过急性细胞收缩及改变AJ连续性来破坏血管内皮屏障的。RhoA/ROCK1通路也是炎症性疾病治疗的重要靶点, 这部分将在后文进行描述。
另一方面, RhoA具有稳定血管内皮屏障的作用。当新生血管内皮细胞完成复制时, RhoA的GEF即p114RG及Arhgef11 (也称PDZ-RhoGEF)被招募到TJ附近, 促进此处RhoA的活性, 同时下调细胞其他部位的RhoA活性, 在TJ附近活化的NM-Ⅱ促进了TJ分子与微丝连接, 有助于TJ成熟并形成完整的细胞间连接分子网络[19]。RhoA还能在血管生成素1 (angiopoietin 1, Ang1)的刺激下, 阻断血管内皮生长因子(vascular endothelial growth factor, VEGF)对血管内皮稳定性的破坏。其作用机制是, RhoA被Ang1激活后能够促进mDia与Src的结合, 竞争性抑制Src与VEGFR2结合, 使得VEGF与受体结合后不能激活下游的通路, 抵抗VEGF对血管内皮屏障的破坏[26]。
3.2 Rac1Ras相关蛋白1 (Ras-related protein 1, Rac1)具有调节细胞生长、调节细胞骨架和激活蛋白激酶等多重作用。在凝血酶的刺激下, Rac1可以拮抗RhoA, 减少血管内皮屏障破坏[21], 而在静息条件下能够维持血管内皮屏障稳定[20]。Birukova等[21]发现, Rac1可以通过产生活性氧, 抑制低分子量磷酸酪氨酸蛋白磷酸酶(low molecular weight phosphotyrosine protein phosphatase, LMWPTP), 从而促进p190RhoGAP磷酸化激活, 使RhoA失活, 抵消RhoA/ROCK1通路对血管内皮屏障的破坏[27]。研究证实, 敲低p190RhoGAP会增强凝血酶诱导的血管内皮屏障破坏, 并延迟血管内皮屏障的恢复。
此外, 在静息条件下, Rac1作为鞘氨醇1-磷酸(Sph-1-P, S1P)或血管生成素/Tie2 (Ang/Tie2)下游效应分子, 能够减少细胞骨架重排维持血管内皮屏障[20]。Garcia等[28]在S1P处理的牛肺动脉上皮细胞中, 观察到Rac1介导的F肌动蛋白在血管内皮细胞皮质处的聚集, 其可能的机制如下, PAK及CFL响应S1P刺激聚集在细胞皮质, S1P通过刺激环磷酸腺苷(cyclic adenosine monophosphate, cAMP)活化, 激活蛋白激酶A (protein kinase A, PKA)通路, PKA可以直接或者间接通过血管扩张刺激磷蛋白(vasodilator-stimulated phosphoprotein, VASP)激活Tiam1和Vav2, 另一方面, cAMP激活鸟嘌呤核苷酸转化因子交换蛋白(exchange proteins directly activated by cAMP, Epac1)通路, 在小G蛋白Rap1的参与下激活Tiam1和Vav2[29], T细胞淋巴瘤侵袭和转移诱导蛋白1 (T-cell lymphoma invasion and metastasis-inducing protein 1, Tiam1)及鸟嘌呤核苷酸交换因子Vav2 (guanine nucleotide exchange factor Vav2, Vav2)均是Rac1的GEF, 活化的Rac1激活PAK, 使LIM及CFL失活[30, 31], 减少胞膜附近微丝的重排、稳定细胞间连接。最近的研究证明, 在人微血管内皮细胞中沉默ArhGAP45 (Rac1的GAP), 在细胞膜附近F肌动蛋白和VE钙黏蛋白明显增加且内皮稳定性升高, 这表明Rac1的活化是静息状态下血管内皮屏障完整性维持的重要节点[32]。
与之相对的是, 在VEGF刺激下, Rac1参与血管内皮屏障完整性破坏。VEGFR2与Src结合激活Rac1的GEF即Vav2, 被激活的Rac1促进PAK介导的VE钙黏蛋白磷酸化。磷酸化的VE钙黏蛋白与β抑制蛋白结合, 进入细胞内囊泡, 使得AJ的稳定带状结构破坏, 破坏血管内皮屏障[33]。
3.3 Cdc42细胞分裂控制蛋白42 (cell division control protein 42, Cdc42)参与静息状态下血管内皮屏障完整性的维持以及屏障功能的恢复[22]。Cdc42与Rac1有共用的通路, 它可以响应S1P激活PAK, 减少血管内皮细胞皮质处细胞骨架重构从而维持屏障完整性, 且Cdc42也可以在炎症刺激下磷酸化p190RhoGAP促使RhoA失活从而保护内皮[34]。Amado-Azevedo等[35]通过筛选确认, Cdc42可能由FARP1 (Cdc42的GEF)及TIAM2 (Rac1的GEF)激活, 而受到SYDE1 (Cdc42的GAP)的负调控, 下游则通过PAK7稳定血管内皮屏障。
Cdc42参与屏障功能的恢复。cAMP-Epac1通路除激活Rac1外, 还可以激活小G蛋白Rap1, 将FGD5 (Rho GTPase的GEF)招募到细胞连接处, 激活Cdc42, 活化Cdc42能通过活化CAB稳定VE钙黏蛋白带, 促进AJ重组装从而恢复内皮屏障功能[36]。Reinhard等[37]的研究表明, 作为S1P的下游信号分子, Cdc42的早期激活是受破坏的血管内皮屏障完整性能够快速增加的重要调控环节。此外, Cdc42参与内皮细胞TJ的形成与成熟。其GEF Ect2与TJ衔接蛋白Par3-Par6-aPKC结合, 聚集于TJ附近, 激活的Cdc42在TJ附近与Par6结合, 活化aPKC, 促使血管内皮细胞TJ成熟, 参与新生血管中血管内皮屏障的形成[38]。
3.4 RhoB和RhoC近年来, RhoA的同源蛋白RhoB和RhoC在血管内皮屏障中的作用也逐渐受到了重视。前文已经描述炎症因子如肿瘤坏死因子、凝血酶可以引起RhoA/ROCK1介导的急性细胞收缩破坏血管内皮屏障, 而Rac1及Cdc42参与血管内皮屏障功能的早期恢复。Pronk等[23]的研究表明, 应用siRNA沉默RhoB后的内皮细胞, 经肿瘤坏死因子处理后与对照组相比具有更完整的细胞间连接, 且沉默RhoB和RhoC的细胞, 其屏障恢复的速度均增加。这表明RhoB可能是血管内皮完整性的负性调节因子。
RhoB对血管内皮屏障的调节可能与急性细胞收缩有关, 这一过程会受到RhoB泛素化降解的调节。Kovačević等[39]的研究表明, 在人脐静脉内皮细胞中耗尽泛素连接酶3 (cullin-3)后, 无法被泛素化降解的RhoB通过ROCK1/2通路引起F肌动蛋白纤维形成增加, 产生细胞收缩, 使得血管内皮的稳定性下降, 这一过程与RhoA类似。RhoB同样对血管内皮完整性的恢复起负性作用, 在RhoB过表达的细胞中, 定位到细胞边界处的Rac1明显下降, 不利于细胞急性收缩后血管内皮完整性后的修复, 与之相对, RhoB沉默的细胞中细胞连接处VE钙黏蛋白显著增加, 血管内皮屏障稳定性提高[40]。
4 Rho-GTP酶及药物Rho-GTP酶家族在血管内皮屏障的调节中起重要作用, 而血管内皮屏障的破坏血管内的物质向外渗漏则是许多疾病如肺水肿、脑卒中、脓毒血症的重要病理过程[5]。其中RhoA/ROCK1通路是研究最为详尽的部分, 多年来针对ROCK的抑制剂已经被广泛应用于临床, 在治疗脑血管病、减轻炎性血管内皮屏障障碍、抗肿瘤方面都有一定的作用[41], 本文主要介绍ROCK抑制剂的作用。
4.1 脑血管病及心血管病根据化学结构特征可将ROCK抑制剂分为异喹啉类、吡啶类、吲唑类、吡唑类和其他类, 它们主要通过与ROCK上ATP结合位点结合抑制其磷酸化来抑制其活化[42]。法舒地尔(HA1077, Y-27632)作为首个ROCK抑制剂于1995年上市, 最初用于改善和预防蛛网膜下腔出血后的脑血管痉挛。脑血管痉挛是脑出血后常见的致命性并发症, 在这一病理过程中, 炎性因子如内皮素1、白介素1、凝血酶等均可以激活Rho/ROCK1通路, ROCK1增加MLC磷酸化使血管平滑肌细胞收缩, 引起脑血管痉挛[43], Sato等[44]的研究发现, 在出血打击诱发脑血管痉挛7天的动物身上局部应用Y-27632阻断ROCK, 观察到了磷酸化MLC的减少与基底动脉剂量依赖性扩张, 证明在脑出血诱发的脑血管痉挛过程中, 阻断ROCK可以有效扩张血管。后续研究表明, ROCK抑制剂对减轻冠状动脉痉挛可能同样有效, 冠状动脉痉挛是缺血性心肌病的一种, 冠状动脉受到节前纤维分泌的乙酰胆碱(acetylcholine, Ach)刺激收缩从而引起心肌缺血, 患者常以不稳定心绞痛就医, 可用Ach或麦角激发实验确诊。在冠状动脉痉挛的患者中进行Ach激发实验, 冠状动脉内输注法舒地尔使发生胸痛和缺血性心电图改变的比例明显降低, 提示法舒地尔可以被用于治疗冠状动脉痉挛性心绞痛[45]。
4.2 减轻炎症因子诱导的血管内皮屏障功能障碍在炎症渗出性疾病如肺水肿和糖尿病视网膜病变的发病过程中, Rho-GTP酶参与的血管内皮屏障功能障碍是其中重要一环。例如在肺水肿发生时, 炎性因子分泌激活Rho/ROCK1通路, 引起血管内皮细胞收缩, 血管内皮屏障被破坏, 进而出现血管内物质渗漏[46]。随着法舒地尔在脑血管疾病中的安全性和有效性被证实, 很多人致力于研究阻断Rho/ROCK1通路是否能够治疗炎症渗出性疾病、减轻渗出引起的症状并保护靶器官延缓病情发展。
在2005年, Tasaka等[11]证实法舒地尔在脂多糖诱导的肺急性损伤中具有保护作用。在以法舒地尔预处理的小鼠中, 应用脂多糖引起的肺血管内皮屏障功能障碍较对照组明显减轻, 表现为单层血管内皮细胞内外蛋白转移的减少、肺组织间隙蛋白渗出的减少及中性粒细胞迁移减少。近期研究表明, 这一过程与水通道蛋白5相关[47]。
ROCK抑制剂Y-39983已经被证明具有降低眼内压的作用[48]。近期研究提示, ROCK抑制剂在糖尿病视网膜并发症治疗中也可能是一个潜在靶点。糖尿病视网膜病变是糖尿病患者的远期并发症之一, 其发病机制尚不明确, 既往研究表明VEGF诱导的、Rho-GTPase参与的血管内皮屏障功能障碍会引起白细胞渗漏, 是糖尿病性黄斑水肿与视网膜病变的重要病理过程[49]。Monickaraj等[18]研究表明, 单核细胞分泌的组织蛋白酶D在患有糖尿病的小鼠视网膜中显著升高, 且组织蛋白酶D通过RhoA/ROCK1介导的急性细胞收缩破坏了视网膜血管内皮屏障的完整性。应用ROCK抑制剂Y-27632处理后, 在视网膜血管内皮细胞中观察到了急性期肌动蛋白丝形成减少, 且细胞间隙的形成比未经Y-27632处理的细胞明显减少, 证明ROCK抑制剂在糖尿病患者中可以保护视网膜血管内皮细胞, 有望延缓糖尿病视网膜病变进展。
研究者也探寻了ROCK抑制剂治疗严重感染性疾病的可能, 埃博拉病毒感染会引起严重的休克、出血, 病毒引起的血管内皮屏障破坏是埃博拉出血热的标志之一[50]。研究者推测同其他炎症性疾病一样, RhoA/ROCK1通路参与了埃博拉出血热血管内皮屏障破坏的过程, 提出逆转这一过程可能纠正埃博拉病毒引起的血管通透性缺陷[51]。
5 小结Rho GTP酶与血管内皮屏障的完整性有密切的关系, 这一过程主要通过对细胞骨架及细胞间连接的调节完成。它们不仅参与到静息状态内皮完整性的维持, 而且响应细胞外刺激诱导的血管内皮屏障的破坏或抵抗血管内皮屏障的破坏, 同时与血管内皮屏障受损后的屏障完整性的恢复密切相关。不同的分子响应不同的刺激, 产生其特定的亚细胞定位, 并激活其下游的通路, 这都使得Rho GTP酶对血管内皮屏障完整性的调节变得复杂。
关于Rho GTP酶介导内皮损伤与病理生理变化关系的研究涉及到肺水肿、黄斑水肿、糖尿病视网膜病变等多种疾病, 因此提出, 有效地阻断在炎症发生中起作用的Rho GTP酶、提高Rac1、Cdc42的活性以增加血管内皮屏障抗性, 也许能够有效缓解炎症渗出性疾病的症状并改善其预后。
| [1] | Rodrigues SF, Granger DN. Blood cells and endothelial barrier function[J]. Tissue Barriers, 2015, 3: e978720. DOI:10.4161/21688370.2014.978720 |
| [2] | Gonzalez-Mariscal L, Tapia R, Chamorro D. Crosstalk of tight junction components with signaling pathways[J]. Biochim Biophys Acta, 2008, 1778: 729–756. DOI:10.1016/j.bbamem.2007.08.018 |
| [3] | Bazzoni G, Dejana E. Endothelial cell-to-cell junctions:molecular organization and role in vascular homeostasis[J]. Physiol Rev, 2004, 84: 869–901. DOI:10.1152/physrev.00035.2003 |
| [4] | Vestweber D, Winderlich M, Cagna G, et al. Cell adhesion dynamics at endothelial junctions:VE-cadherin as a major player[J]. Trends Cell Biol, 2009, 19: 8–15. DOI:10.1016/j.tcb.2008.10.001 |
| [5] | Aman J, Weijers EM, van Nieuw Amerongen GP, et al. Using cultured endothelial cells to study endothelial barrier dysfunction:challenges and opportunities[J]. Am J Physiol Lung Cell Mol Physiol, 2016, 311: L453–L466. DOI:10.1152/ajplung.00393.2015 |
| [6] | Knapp M, Tu X, Wu R. Vascular endothelial dysfunction, a major mediator in diabetic cardiomyopathy[J]. Acta Pharmacol Sin, 2019, 40: 1–8. DOI:10.1038/s41401-018-0042-6 |
| [7] | Oldenburg J, de Rooij J. Mechanical control of the endothelial barrier[J]. Cell Tissue Res, 2014, 355: 545–555. DOI:10.1007/s00441-013-1792-6 |
| [8] | Hodge RG, Ridley AJ. Regulating Rho GTPases and their regulators[J]. Nat Rev Mol Cell Biol, 2016, 17: 496–510. DOI:10.1038/nrm.2016.67 |
| [9] | Heasman SJ, Ridley AJ. Mammalian Rho GTPases:new insights into their functions from in vivo studies[J]. Nat Rev Mol Cell Biol, 2008, 9: 690–701. DOI:10.1038/nrm2476 |
| [10] | Laurin M, Cote JF. Insights into the biological functions of dock family guanine nucleotide exchange factors[J]. Genes Dev, 2014, 28: 533–547. DOI:10.1101/gad.236349.113 |
| [11] | Tasaka S, Koh H, Yamada W, et al. Attenuation of endotoxin-induced acute lung injury by the Rho-associated kinase inhibitor, Y-27632[J]. Am J Respir Cell Mol Biol, 2005, 32: 504–510. DOI:10.1165/rcmb.2004-0009OC |
| [12] | Essler M, Amano M, Kruse HJ, et al. Thrombin inactivates myosin light chain phosphatase via Rho and its target Rho kinase in human endothelial cells[J]. J Biol Chem, 1998, 273: 21867–21874. DOI:10.1074/jbc.273.34.21867 |
| [13] | Somlyo AP, Somlyo AV. Ca2+ sensitivity of smooth muscle and nonmuscle myosin Ⅱ:modulated by G proteins, kinases, and myosin phosphatase[J]. Physiol Rev, 2003, 83: 1325–1358. DOI:10.1152/physrev.00023.2003 |
| [14] | Martino F, Perestrelo AR, Vinarsky V, et al. Cellular mechanotransduction:from tension to function[J]. Front Physiol, 2018, 9: 824. DOI:10.3389/fphys.2018.00824 |
| [15] | Han JY, Yi Y, Liang AH, et al. Research progress of Rho/ROCK signal pathway[J]. Acta Pharm Sin (药学学报), 2016, 51: 853–859. |
| [16] | Tong H, Qi D, Guan X, et al. c-Abl tyrosine kinase regulates neutrophil crawling behavior under fluid shear stress via Rac/PAK/LIMK/cofilin signaling axis[J]. J Cell Biochem, 2018, 119: 2806–2817. DOI:10.1002/jcb.26453 |
| [17] | Ando K, Fukuhara S, Moriya T, et al. Rap1 potentiates endothelial cell junctions by spatially controlling myosin Ⅱ activity and actin organization[J]. J Cell Biol, 2013, 202: 901–916. DOI:10.1083/jcb.201301115 |
| [18] | Monickaraj F, McGuire PG, Nitta CF, et al. Cathepsin D:an Mϕ -derived factor mediating increased endothelial cell permeability with implications for alteration of the blood-retinal barrier in diabetic retinopathy[J]. FASEB J, 2016, 30: 1670–1682. DOI:10.1096/fj.15-279802 |
| [19] | Yamada S, Nelson WJ. Localized zones of Rho and Rac activities drive initiation and expansion of epithelial cell-cell adhesion[J]. J Cell Biol, 2007, 178: 517–527. DOI:10.1083/jcb.200701058 |
| [20] | David S, Ghosh CC, Mukherjee A, et al. Angiopoietin-1 requires IQ domain GTPase-activating protein 1 to activate Rac1 and promote endothelial barrier defense[J]. Arterioscler Thromb Vasc Biol, 2011, 31: 2643–2652. DOI:10.1161/ATVBAHA.111.233189 |
| [21] | Birukova AA, Zebda N, Cokic I, et al. p190RhoGAP mediates protective effects of oxidized phospholipids in the models of ventilator-induced lung injury[J]. Exp Cell Research, 2011, 317: 859–872. DOI:10.1016/j.yexcr.2010.11.011 |
| [22] | Broman MT, Mehta D, Malik AB. Cdc42 regulates the restoration of endothelial adherens junctions and permeability[J]. Trends Cardiovasc Med, 2007, 17: 151–156. DOI:10.1016/j.tcm.2007.03.004 |
| [23] | Pronk MCA, van Bezu JSM, van Nieuw Amerongen GP, et al. RhoA, RhoB and RhoC differentially regulate endothelial barrier function[J]. Small GTPases, 2017. DOI:10.1080/21541248.2017.1339767 |
| [24] | Hippenstiel S, Tannert-Otto S, Vollrath N, et al. Glucosylation of small GTP-binding Rho proteins disrupts endothelial barrier function[J]. Am J Physiol, 1997, 272: L38–L43. |
| [25] | van Nieuw Amerongen GP, van Delft S, Vermeer MA, et al. Activation of RhoA by thrombin in endothelial hyperpermeability:role of Rho kinase and protein tyrosine kinases[J]. Circ Res, 2000, 87: 335–340. DOI:10.1161/01.RES.87.4.335 |
| [26] | Gavard J, Patel V, Gutkind JS. Angiopoietin-1 prevents VEGF-induced endothelial permeability by sequestering Src through mDia[J]. Dev Cell, 2008, 14: 25–36. DOI:10.1016/j.devcel.2007.10.019 |
| [27] | Wildenberg GA, Dohn MR, Carnahan RH, et al. p120-catenin and p190RhoGAP regulate cell-cell adhesion by coordinating antagonism between Rac and Rho[J]. Cell, 2006, 127: 1027–1039. DOI:10.1016/j.cell.2006.09.046 |
| [28] | Garcia JGN, Liu F, Verin AD, et al. Sphingosine 1-phosphate promotes endothelial cell barrier integrity by Edg-dependent cytoskeletal rearrangement[J]. J Clin Invest, 2001, 108: 689–701. DOI:10.1172/JCI12450 |
| [29] | Schlegel N, Waschke J. cAMP with other signaling cues converges on Rac1 to stabilize the endothelial barrier-a signaling pathway compromised in inflammation[J]. Cell Tissue Res, 2014, 355: 587–596. DOI:10.1007/s00441-013-1755-y |
| [30] | Yang N, Higuchi O, Ohashi K, et al. Cofilin phosphorylation by LIM-kinase 1 and its role in Rac-mediated actin reorganization[J]. Nature, 1998, 393: 809–812. DOI:10.1038/31735 |
| [31] | Barabutis N, Dimitropoulou C, Gregory B, et al. Wild-type p53 enhances endothelial barrier function by mediating RAC1 signalling and RhoA inhibition[J]. J Cell Mol Med, 2018, 22: 1792–1804. DOI:10.1111/jcmm.2018.22.issue-3 |
| [32] | Amado-Azevedo J, Reinhard NR, van Bezu J, et al. The minor histocompatibility antigen 1(HMHA1)/ArhGAP45 is a RacGAP and a novel regulator of endothelial integrity[J]. Vasc Pharmacol, 2018, 101: 38–47. DOI:10.1016/j.vph.2017.11.007 |
| [33] | Gavard J, Gutkind JS. VEGF controls endothelial-cell permeability by promoting the beta-arrestin-dependent endocytosis of VE-cadherin[J]. Nat Cell Biol, 2006, 8: 1223–1234. DOI:10.1038/ncb1486 |
| [34] | Ramchandran R, Mehta D, Vogel SM, et al. Critical role of Cdc42 in mediating endothelial barrier protection in vivo[J]. Am J Physiol Lung Cell Mol Physiol, 2008, 295: L363–L369. DOI:10.1152/ajplung.90241.2008 |
| [35] | Amado-Azevedo J, Reinhard NR, van Bezu J, et al. A CDC42-centered signaling unit is a dominant positive regulator of endothelial integrity[J]. Sci Rep, 2017, 7: 10132. DOI:10.1038/s41598-017-10392-0 |
| [36] | Pannekoek WJ, Vliem MJ, Bos JL. Multiple Rap1 effectors control Epac1-mediated tightening of endothelial junctions[J]. Small GTPases, 2018. DOI:10.1080/21541248.2018.1431512 |
| [37] | Reinhard NR, Mastop M, Yin T, et al. The balance between Gαi-Cdc42/Rac and Gα12/13-RhoA pathways determines endothelial barrier regulation by sphingosine-1-phosphate[J]. Mol Biol Cell, 2017, 28: 3371–3382. DOI:10.1091/mbc.e17-03-0136 |
| [38] | Zihni C, Balda MS, Matter K. Signalling at tight junctions during epithelial differentiation and microbial pathogenesis[J]. J Cell Sci, 2014, 127: 3401–3413. DOI:10.1242/jcs.145029 |
| [39] | Kovačević I, Sakaue T, Majolee J, et al. The Cullin-3-Rbx1-KCTD10 complex controls endothelial barrier function via K63 ubiquitination of RhoB[J]. J Cell Biol, 2018, 217: 1015–1032. DOI:10.1083/jcb.201606055 |
| [40] | Marcos-Ramiro B, Garcia-Weber D, Barroso S, et al. RhoB controls endothelial barrier recovery by inhibiting Rac1 trafficking to the cell border[J]. J Cell Biol, 2016, 213: 385–402. DOI:10.1083/jcb.201504038 |
| [41] | Duan WG, Yuan ST, Liao H, et al. Advances in the study of Rho kinase and its inhibitors[J]. Acta Pharm Sin (药学学报), 2007, 42: 1013–1022. |
| [42] | Guan R, Xu X, Chen M, et al. Advances in the studies of roles of Rho/Rho-kinase in diseases and the development of its inhibitors[J]. Eur J Med Chem, 2013, 70: 613–622. DOI:10.1016/j.ejmech.2013.10.048 |
| [43] | Dong M, Yan BP, Liao JK, et al. Rho-kinase inhibition:a novel therapeutic target for the treatment of cardiovascular diseases[J]. Drug Discov Today, 2010, 15: 622–629. DOI:10.1016/j.drudis.2010.06.011 |
| [44] | Sato M, Tani E, Fujikawa H, et al. Involvement of Rho-kinase-mediated phosphorylation of myosin light chain in enhancement of cerebral vasospasm[J]. Circ Res, 2000, 87: 195–200. DOI:10.1161/01.RES.87.3.195 |
| [45] | Masumoto A, Mohri M, Shimokawa H, et al. Suppression of coronary artery spasm by the Rho-kinase inhibitor fasudil in patients with vasospastic angina[J]. Circulation, 2002, 105: 1545–1547. DOI:10.1161/hc1002.105938 |
| [46] | Chiba Y, Ishii Y, Kitamura S, et al. Activation of Rho is involved in the mechanism of hydrogen-peroxide-induced lung edema in isolated perfused rabbit lung[J]. Microvasc Res, 2001, 62: 164–171. DOI:10.1006/mvre.2001.2329 |
| [47] | Wang JJ, Kong H, Xu J, et al. Fasudil alleviates LPS-induced lung injury by restoring aquaporin 5 expression and inhibiting inflammation in lungs[J]. J Biomed Res, 2017. DOI:10.7555/JBR.31.20170024 |
| [48] | Tokushige H, Inatani M, Nemoto S, et al. Effects of topical administration of y-39983, a selective Rho-associated protein kinase inhibitor, on ocular tissues in rabbits and monkeys[J]. Invest Ophthalmol Vis Sci, 2007, 48: 3216–3222. DOI:10.1167/iovs.05-1617 |
| [49] | Wang J, Xu X, Elliott MH, et al. Müller cell-derived VEGF is essential for diabetes-induced retinal inflammation and vascular leakage[J]. Diabetes, 2010, 59: 2297–2305. DOI:10.2337/db09-1420 |
| [50] | Wahl-Jensen VM, Afanasieva TA, Seebach J, et al. Effects of Ebola virus glycoproteins on endothelial cell activation and barrier function[J]. J Virol, 2005, 79: 10442–10450. DOI:10.1128/JVI.79.16.10442-10450.2005 |
| [51] | Eisa-Beygi S, Wen XY. Could pharmacological curtailment of the RhoA/Rho-kinase pathway reverse the endothelial barrier dysfunction associated with Ebola virus infection?[J]. Antiviral Res, 2015, 114: 53–56. DOI:10.1016/j.antiviral.2014.12.005 |
 2019, Vol. 54
2019, Vol. 54


