蛋白多肽类药物以其高效性、特异性和低毒副作用等优点而受到广泛关注, 但主要通过注射给药, 存在患者顺应性低、安全性差等问题[1-3]。口服纳米给药体系可有效避免注射给药导致的相关问题。但口服给药不仅受到胃酸及肠道酶的影响, 也会受到覆盖于小肠上皮细胞表面的黏液层的阻碍作用, 这些因素均影响药物的口服吸收。
黏液的主要成分是黏蛋白, 可通过静电或疏水作用吸附纳米粒, 使其滞留于黏液层, 无法到达上皮细胞而被摄取。在纳米粒表面修饰黏液惰性材料如聚乙二醇(polyethylene glycol, PEG)、N-(2-羟丙基)甲基丙烯酰胺聚合物[N-(2-hydroxypropyl) methacrylamide copolymer, pHPMA]等可有效降低黏蛋白对纳米粒的吸附[4], 从而赋予其良好的穿黏液能力。但PEG或HPMA的包裹也会导致纳米粒的摄取降低[5]。如何保证纳米粒穿黏液能力的同时提高其细胞摄取成为目前研究的难点和重点。
两性离子材料具有等量的阴、阳离子基团, 能够形成水化层, 有效阻止非特异性蛋白、细菌和细胞等的吸附, 因此具有良好的抗黏附能力[6, 7]。本课题组前期构建了表面包裹单层磷脂酰胆碱的两性离子纳米给药体系[1], 该体系不仅具有与聚乙二醇修饰的纳米粒(PEG NPs)相同的穿黏液能力, 还具有更强的细胞摄取。但值得注意的是, 两性离子材料一般为具有一定长度(聚合度)的聚合物[8, 9], 其链长对纳米粒的穿黏液能力和细胞摄取效率的影响尚未见报道。
聚磺酸甜菜碱甲基丙烯酸酯[poly(sulfobetaine methacrylate), pSBMA]具有两性离子材料良好的生物相容性、优良的抗黏附能力等优点, 同时, 其单体合成较为简单、价格较低, 因此被广泛应用于纳米给药体系的研究。本课题合成了不同pSBMA链长的聚己内酯-聚磺酸甜菜碱甲基丙烯酸酯[poly(ε-caprolactone)-block-poly(sulfobetaine methacrylate), PCL-pSBMA]共聚物, 通过纳米沉淀法制备不同链长的pSBMA包裹的纳米粒(pSBMAn NPs), 通过黏蛋白吸附实验、Transwell小室实验和细胞摄取实验来探究两性离子聚合物链长对纳米粒穿黏液能力及细胞摄取能力的影响, 并对不同pSBMAn NPs的细胞毒性和血液相容性进行初步评价, 最后对纳米粒的体内药动学进行研究。
材料与方法试剂与药品 ε己内酯(ε-caprolactone, 百灵威科技有限公司); 三乙二醇(triethylene glycol, TEG)、2, 2'-联吡啶(bipyridine, bpy)、异辛酸亚锡(stannous 2-ethylhexanoate)、磺酸甜菜碱甲基丙烯酸酯(sulfobetaine methacrylate, SBMA)购于上海萨恩化学技术有限公司; 聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic acid), PLGA, 美国Lactel聚合物公司]; 细胞膜红色荧光探针(DiI, 美国Invitrogen公司); 刃天青钠(美国Sigma公司); DMEM高糖培养基(美国Gibco公司); 胎牛血清(美国HyClone公司)。
主要仪器 Zetasizer Nano ZS 90激光粒度分析仪(英国Malvern公司); Varioskan flash多功能化学发光分析仪(美国Thermo Fisher Scientific公司); Transwell小室(膜面积0.33 cm2, 孔径0.45 μm)、IsoporeTM聚碳酸酯膜(孔径0.45 μm), (美国Millipore公司)。
细胞 人源性结肠癌Caco-2细胞株(中国科学院上海细胞生物学研究所); 人源性结肠癌HT29-MTX-E12细胞(E12, 爱尔兰都柏林大学Dr. David Brayde赠送)。细胞实验用25~50代细胞。
动物 Balb/c小鼠, 雄性, 体重18~22 g, 成都达硕生物有限公司, SPF级, 合格证号: 51203500007639, 许可证编号: SCXK (川) 2015-030。饲养环境温度为(25±2) ℃, 相对湿度为(50±10) %。
大分子引发剂的合成 大分子引发剂端溴基聚己内酯(PCL-Br)的合成参照文献[10]:取TEG (0.3 mol)和三乙胺(triethylamine, 30 mmol)溶于二氯甲烷, 将体系置于冰盐浴, 滴加含有α溴异丁酰溴(α-bromoisobutyryl bromide, 30 mmol)的二氯甲烷溶液。室温反应24 h后用饱和氯化钠溶液洗涤, 无水硫酸钠干燥, 并用硅胶柱进行纯化(洗脱剂为乙酸乙酯-石油醚= 4:1), 得无色透明液体(TEG-Br)。
取己内酯(21 mmol)、异辛酸亚锡(0.15 mmol)、TEG-Br (0.15 mmol)和无水甲苯(4 mL), 氩气保护下110 ℃反应5 h, 将产物溶于氯仿, 滴加至大量无水乙醚中沉淀, 真空干燥, 得白色固体(PCL-Br)。
PCL-pSBMA两嵌段聚合物的合成 取适量bpy与不同摩尔比(1:10、1:20、1:40和1:80)的PCL-Br和SBMA, 在氩气保护下加入溴化亚铜(CuBr), 抽真空/充氩气, 重复3次。加入脱氧的三氟乙醇, 用氩气再饱和15 min, 封口后室温反应24 h。将反应体系暴露于空气中结束反应, 并通入过量空气直至反应液呈蓝色。将反应液置于透析袋(Mw 3 500)中, 用乙二胺四乙酸二钠饱和溶液透析2天, 再用纯水透析2天, 冻干得白色固体(PCL-pSBMA)。
聚合物的表征 聚合物PCL-Br的结构与组成采用核磁共振氢谱(proton nuclear magnetic resonance,1H NMR)进行表征。其相对分子质量及质量分布采用凝胶渗透色谱(gel permeation chromatography, GPC)表征(洗脱剂为N, N-二甲基甲酰胺, DMF)。采用红外光谱(infrared spectroscopy, IR)和1H NMR对PCL-pSBMA进行表征。
纳米粒的制备与表征
pSBMAn NPs的制备 将PLGA 2 mg和PCL-pSBMA 2 mg溶于0.2 mL三氟乙醇, 混匀后滴加至2 mL磷酸盐缓冲液(PBS, pH 7.4)中。将制备好的纳米粒超滤除去有机溶剂, 重新分散至PBS中, 用激光粒度分析仪对其粒径和电位进行表征。
DiI标记的纳米粒的制备 将PLGA和PCL-pSBMA混合后加入5 μL DiI或DiR (溶于DMSO, 1 mg·mL-1), 其余与pSBMAn NPs的制备相同。
纳米粒稳定性考察 将制备好的纳米粒重新分散于PBS (1 mg·mL-1, 以PCL-pSBMA计), 按体积比1:9与人工胃液(SGF)、人工肠液(SIF)、PBS或不同浓度的胎牛血清(FBS)溶液混合, 37 ℃振摇(4 h, 100 r·min-1)。通过粒径的变化来考察纳米粒在不同介质中的稳定性。
黏蛋白吸附实验 称取一定量的猪黏蛋白, 用PBS配制成10 mg·mL-1黏蛋白储备液。DiI标记的纳米粒(2 mg·mL-1)按体积比1:9与黏蛋白溶液混匀。样品置于恒温摇床中振摇1 h, 离心除去被黏蛋白吸附的纳米粒, 取上清, 用多功能化学发光仪测定样品中纳米粒的荧光强度(吸收波长549 nm, 发射波长594 nm), 按以下公式计算被黏蛋白吸附的纳米粒:
| $ A\left( \% \right) = \frac{{{F_0} - {F_{\rm{S}}}}}{{{F_0}}} \times 100\% $ |
其中, A代表被吸附的纳米粒百分率, F0代表初始纳米粒的荧光强度, Fs代表上清液中纳米粒的荧光强度。
纳米粒的黏液渗透能力 取猪黏液20 μL均匀铺在Transwell小室中, 表面覆盖一层相同孔径的聚碳酸酯膜。A室中加入DiI标记的NPs (2 mg·mL-1) 200 μL, B室中加入PBS 600 μL, 放入37 ℃摇床孵育。在一定时间点(0.5、1、1.5、2、3和4 h)从B室取样100 μL, 并补加相同体积PBS。用多功能化学发光仪测定样品浓度, 并用以下公式计算纳米粒透过黏液的表观渗透系数(Papp):
| $ {P_{{\rm{app}}}} = \frac{{{\rm{d}}Q}}{{{\rm{d}}t}} \times \frac{1}{{A \times {C_0}}} $ |
其中, dQ/dt表示NPs透过黏液的速率, C0为NPs的初始浓度, A为半透膜的面积(cm2)。
细胞毒性实验 采用阿尔玛蓝法(Alamar blue)考察纳米粒的细胞毒性。将Caco-2或E12细胞按照每毫升4×104个细胞接种于96孔板中, 培养48 h后进行实验。实验前弃去孔板中的培养基, 并用PBS润洗, 加入不同质量浓度(125~500 μg·mL-1)的纳米粒溶液200 μL, 孵育4 h后将纳米粒溶液吸出, 并用PBS洗去残留的纳米粒。随后加入100 μL刃天青(10 μg·mL-1)继续孵育1 h。使用多功能化学发光仪测定各孔荧光值(激发波长530 nm, 发射波长590 nm), 以PBS处理的细胞作为对照组, 按以下公式计算细胞存活率(CV):
| $ {\rm{CV}}\left( \% \right) = \frac{{{F_{{\rm{sam}}}}}}{{{F_{{\rm{con}}}}}} \times 100\% $ |
其中, Fsam表示样品组荧光值, Fcon表示对照组荧光值。
溶血实验 SD大鼠眼球取血, EDTA-2Na抗凝。离心(1 500 r·min-1, 10 min), 弃去上清, 并用PBS洗涤血细胞, 取0.5 mL血细胞分散至24 mL PBS中, 备用。将新制备的纳米粒超滤浓缩后重新分散至PBS, 使其质量浓度分别为4、8和16 mg·mL-1。按体积比1:1与血细胞混合作为样品溶液, 37 ℃孵育2 h, 100 r·min-1离心, 取上清, 于540 nm处检测紫外吸光度。取等体积的纳米粒溶液与PBS混合作为空白对照, 等体积水与血细胞混合作为阳性对照, 而等体积血细胞和PBS混合作为阴性对照。按以下公式计算溶血率(HR):
| $ {\rm{HR}}\left( \% \right) = \frac{{{F_{\rm{a}}} - {F_{\rm{b}}} - {F_{\rm{c}}}}}{{{F_{\rm{d}}} - {F_{\rm{c}}}}} \times 100\% $ |
其中, Fa为样品溶液的吸光度值, Fb为样品空白溶液的吸光度值, Fc为阴性对照吸光度值, Fd为阳性对照吸光度值。
细胞摄取实验 将Caco-2或E12细胞按照每毫升5×104个细胞接种于96孔板中, 培养3天后进行实验。实验前用PBS洗去细胞表面的培养基, 刃天青(10 μg·mL-1)孵育1 h, 测荧光对细胞数目进行校正。用PBS洗去刃天青, 加入荧光标记的纳米粒孵育2 h后, 用预冷的PBS洗去纳米粒, 加入DMSO破坏细胞, 测荧光强度。以pSMBA80 NPs作为对照组, 其荧光值归为1, 计算其他pSBMA修饰的纳米粒的相对荧光强度。
黏液对纳米粒细胞摄取的影响 将消化后的E12细胞按照每毫升5×104个细胞接种到96孔板中, 培养3天。实验前用刃天青对细胞数目进行校正。将细胞分为两组:第1组实验前先用N-乙酰半胱氨酸预处理除去黏液(pre-removal of mucus)[11, 12], 用PBS清洗后加入DiI标记的NPs, 孵育2 h; 第2组直接加入DiI标记的NPs, 孵育2 h后用0.4%福尔马林溶液洗涤, 以除去E12细胞表面的黏液(post-removal of mucus)及被困于黏液中的纳米粒, 然后用PBS清洗除去吸附于细胞膜上的纳米粒。加入DMSO破坏细胞, 用多功能化学发光仪测定各孔荧光强度。以pSBMA80 NPs (post-removal of mucus)作为对照组, 其荧光值归为1, 计算其他pSBMAn NPs的相对荧光强度。
药动学实验 健康Balb/c小鼠随机分成3组。给药前禁食12 h, 自由饮水, 给药前分别给予3%碳酸氢钠中和胃液。分别灌胃给予游离DiR、载DiR的pSBMA10 NPs和pSBMA20 NPs (剂量: DiR 1 mg·kg-1)。给药后0.5、1、2、3、4、6、8、10和24 h经眼球后静脉取血20 μL, 加入80 μL纯水, 用多功能化学发光仪测定血液样品中DiR含量。动物实验根据四川大学关于实验动物的饲养和使用准则进行, 并得到四川大学实验动物伦理委员会批准。
统计学方法 所有数据均使用SPSS软件进行统计学分析, 并用x ± s表示, P < 0.05和P < 0.01分别代表具有显著性差异和非常显著性差异。
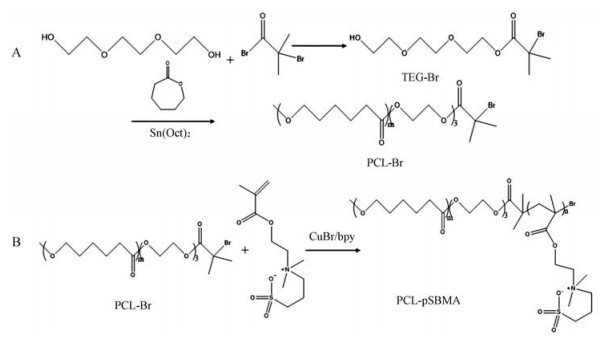
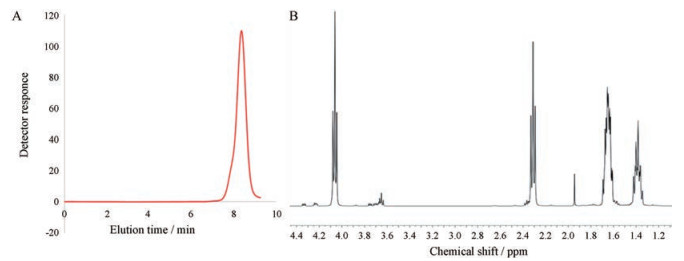
结果与讨论 1 聚合物的合成及表征按照合成路线图 1A, 通过己内酯的开环聚合反应合成大分子引发剂PCL-Br, 采用凝胶渗透色谱(GPC)对其分子量及其分布进行测定, 并通过1H NMR表征其结构与组成。图 1A为PCL-Br的GPC洗脱曲线, 该曲线呈单峰, 分子质量为4 556 Da且PDI为1.145, 表明该聚合物具有较均一的分子量分布。其核磁共振氢谱如图 1B所示, δ 1.94和4.23是TEG-Br (O-CH2-CH2-O)的质子峰, δ 1.42、1.59和2.32是PCL主链上的-CH2-质子峰, 该两处质子峰的同时出现, 表明PCL-Br的成功合成。此外, 通过TEG和PCL质子峰的积分面积比, 可以计算出PCL-Br分子质量为5 883 Da。
|
Scheme 1 The synthesis route of bromoisobutyryl poly(ε-caprolactone) macroinitiator (PCL-Br) (A) and poly(ε-caprolactone)-block-poly(sulfobetaine methacrylate) (PCL-pSBMA) (B) |
|
Figure 1 Characterizations of macroinitiator PCL-Br. A: GPC spectrum; B: 1H NMR spectrum |
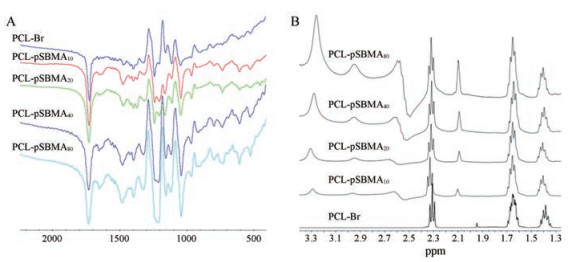
按照合成线路图 1B合成不同pSBMA链长的两嵌段聚合物PCL-pSBMA, 并采用红外(IR)和1H NMR对聚合物进行表征。图 2A为PCL-Br与PCL-pSBMA的红外图谱, 从图中可看出, 与PCL-Br相比, 1 044和1 193 cm-1出现了-S=O的伸展振动吸收, 606 cm-1出现了-C-S伸展振动吸收, 表明SBMA单体成功聚合于PCL-Br骨架。图 2B是PCL-Br和PCL-pSBMA的简易核磁图谱, 从图中可以看出: PCL-pSBMA在δ 1.42、1.59和2.32处仍保留有PCL-Br段的质子峰, 并且在δ 3.30和3.15处还出现了新的质子峰, 分别为pSBMA支链上的(-NH3)2和SO3-CH2-质子峰。该图谱再次证明了PCL-pSBMA的成功合成。此外, 核磁共振氢谱表明(表 1), 随着单体(SBMA)与引发剂(PCL-Br)投料比的增加, 聚合的SBMA单体也越多, 因此链长度越长。
|
Figure 2 Characterization of PCL-pSBMA polymer. A: IR spectrum; B: 1H NMR spectrum |
| Table 1 The molar ratio of PCL-Br to SBMA determined by 1H NMR |
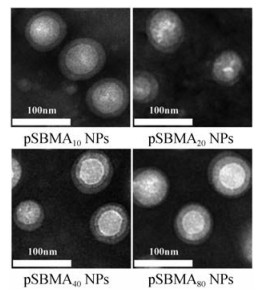
PCL-pSBMA同时具有亲水段pSBMA和疏水段PCL, 因此采用纳米沉淀法制备pSBMA修饰的纳米粒。如表 2所示, 制得的各组纳米粒粒径约为100 nm, 电位约为-7 mV。本实验中制备的纳米粒均呈负电, 这与Zhai等[13]和Guo等[14]实验结果吻合。通过透射电镜(transmission electron microscope, TEM)观察各组纳米粒的形态, 可发现纳米粒的粒径分布与上述结果一致, 且均为类球形(图 3)。
| Table 2 The characterization of pSBMA modified nanoparticles. n = 3, x ± s |
|
Figure 3 Transmission electron microscope (TEM) images of pSBMAn NPs |
纳米粒在不同介质中的胶体稳定性通过观察纳米粒的粒径或PDI变化来考察。实验结果如图 4A所示, 所有pSBMAn NPs在PBS及不同浓度的FBS溶液中孵育4 h后粒径未发生显著性变化(P > 0.05), 表明在PBS和蛋白溶液中有较好的稳定性。这主要是pSBMA链可在疏水内核外形成保护层, 防止颗粒之间聚集, 且pSBMA是较好的抗蛋白黏附材料, 能在一定程度上阻止对蛋白物质的吸附, 因此粒径并未发生显著性变化[15]。但是, 如图 4B所示, 在高浓度蛋白溶液中(15% FBS), 短链pSBMA修饰的纳米粒(即pSBMA10 NPs和pSBMA20 NPs), 其PDI仍较小。而长链pSBMA修饰的纳米粒(pSBMA40 NPs和pSBMA80 NPs)的PDI有所增加, 已经超过0.3, 表明其粒径分布变宽, 稳定性比短链pSBMA修饰的纳米粒差。这可能是因为亲水链长度增加, 纳米粒内核间的疏水作用减弱, 因此影响了纳米粒的稳定性。
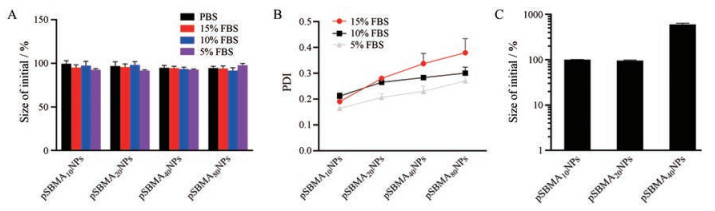
|
Figure 4 The colloidal stability of pSBMAn NPs. The change of particle size (A) and PDI (B) after incubation in phosphate buffer saline (PBS), different concentration of fetal bovine serum (FBS) solutions and simulated intestinal fluid (C) for 4 h. n = 3, x ± s |
纳米粒在人工胃液中粒径迅速变大, 最后析出, 这可能与pSBMA的反聚电解质性质有关, 即在高盐浓度时, 季铵基团和磺酸基团的相互作用被Na+或Cl-离子所屏蔽, pSBMA链呈舒展状态; 而盐浓度降低时, 季铵基团和磺酸基团的相互作用增强, 形成疏水性区域, pSBMA坍塌, 因此稳定性减弱[16]。值得注意的是, pSBMA10 NPs和pSBMA20 NPs在人工肠液孵育4 h后粒径未发生显著性变化(图 4C), 而pSBMA40 NPs粒径由94 nm增加至566 nm, pSBMA80 NPs则直接析出, 表明纳米粒的稳定性随着pSBMA链长的增加而降低, 这与纳米粒在FBS溶液中的稳定性一致。纳米粒在人工肠液中的稳定性比在人工胃液中的稳定性好, 可能是因为人工肠液的主要成分是K2HPO4, 而K+可屏蔽pSBMA中磺酸基团和季铵基团的相互作用。
4 pSBMA链长对纳米粒抗黏蛋白吸附能力的影响黏液的主要成分是带负电的黏蛋白, 可通过疏水作用或静电作用吸附部分纳米粒。因此, 黏蛋白对纳米粒的吸附在一定程度上可以反映纳米粒的穿黏液能力[1]。将DiI标记的纳米粒与10 mg·mL-1黏蛋白共同孵育, 考察对纳米粒的吸附情况。实验结果如图 5A所示, pSBMA10 NPs、pSBMA20 NPs和pSBMA40 NPs被黏蛋白吸附的百分率分别是pSBMA80 NPs的3.96倍(P < 0.01)、3.27倍(P < 0.01)和1.97倍(P < 0.01), 表明随着pSBMA链长增加, 被黏蛋白吸附的纳米粒减少。可能是因为pSBMA中季铵基团和磺酸基团均具有较强的水解能力, 随着pSBMA链长的增加, 水解能力也增强, 因此吸附的水分子增多, 抗黏蛋白吸附的能力增强。
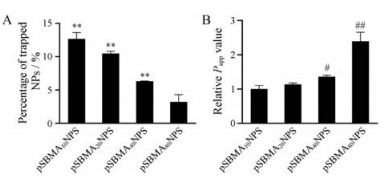
|
Figure 5 The percentage of trapped NPs (A). The relative apparent permeability coefficient (Papp) values of NPs permeation across the mucus (B). **P < 0.01 vs pSBMA80 NPs; #P < 0.05, ##P < 0.01 vs pSBMA10 NPs. n = 3, x ±s |
蛋白黏附实验表明, 纳米粒的抗黏附能力随着pSBMA链长的增加而增强, 因此推测长链pSBMAn NPs的穿黏液能力可能更强。于是采用Transwell小室测定纳米粒穿过黏液的表观渗透系数(Papp)。实验结果如图 5B所示:随着pSBMA链长的增加, 纳米粒的Papp值增大, 表明纳米粒的穿黏液能力增强。
对于PEG NPs而言, 其穿黏液能力随着链长的增加而降低, 因为长链的PEG可能会与黏液缠绕, 导致纳米粒穿黏液能力减弱。而pSBMAn NPs穿黏液能力随着链长的增加而增强, 可能是因为各组纳米粒结构相似, 但长链pSBMAn NPs具有更好的抗蛋白黏附能力, 因此pSBMA80 NPs的穿黏液效果最好。
6 纳米粒的细胞毒性实验采用Alamar blue assay测定各组纳米粒对Caco-2和E12细胞的细胞毒性, 实验结果如图 6A、B所示, pSBMAn NPs的质量浓度在500 μg·mL-1以内(以PCL-pSBMA计), Caco-2和E12细胞的存活率均在85%以上, 表明其具有良好的生物相容性。此外, 部分纳米粒口服后可能会进入血液循环, 因此也考察了pSBMAn NPs的血液相容性, 实验结果如图 6C所示, 各组纳米粒的溶血性呈剂量依赖性。当pSBMAn NPs质量浓度为2 mg·mL-1时, 溶血率几乎为零; 当质量浓度增加到8 mg·mL-1时, 溶血率有所增加, 但仍低于5%。表明pSBMAn NPs具有良好的血液相容性。
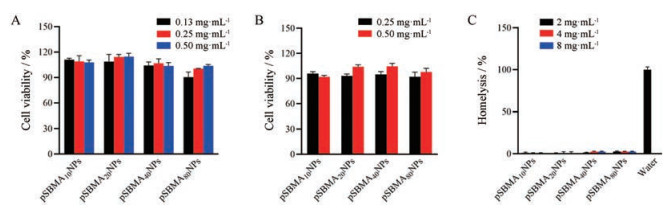
|
Figure 6 The viability of Caco-2 (A) and E12 cells (B) after incubation with pSBMAn NPs for 4 h. C: The hemolysis ratio of erythrocyte after incubation with pSBMAn NPs. n = 3, x ±s |
为探究pSBMA链长对纳米粒摄取效率的影响, 以Caco-2细胞为模型, 考察了不同链长pSBMA修饰的纳米粒的细胞摄取。实验结果如图 7A所示, pSBMA10 NPs和pSBMA20 NPs在细胞内的荧光强度分别是pSBMA80 NPs的2.44倍(P < 0.01)和1.69倍(P < 0.01), 表明纳米粒的细胞摄取随着pSBMA链长的增加而减少。这可能是长链pSBMA修饰的纳米粒具有更好的抗黏附能力, 因此不利于纳米粒与细胞间的接触, 导致摄取降低。
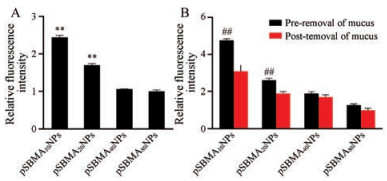
|
Figure 7 The relative cellular uptake of NPs on Caco-2 (A) and E12 (B) cells. **P < 0.01 vs pSBMA80 NPs; ##P < 0.01 vs post-removal of mucus group. n = 3, x ± s |
覆盖于小肠上皮细胞表面的黏液可捕获外来颗粒, 使其无法穿过黏液层而被摄取。因此, 采用可分泌黏液的E12细胞为模型, 考察了黏液对纳米粒摄取的影响。如图 7B所示, 当预先除去黏液时, 纳米粒的摄取情况与Caco-2细胞相同, 其摄取随着pSBMA链长的增加而降低。黏液均可降低pSBMAn NPs的摄取, 但pSBMA链越短, 摄取降低的程度越大, 这与纳米粒的穿黏液结果一致。值得注意的是, 即使有黏液存在, pSBMA10 NPs的摄取仍最高, 这可能是因为其既有一定的穿黏液能力, 又有最高的细胞摄取能力(无黏液存在时)。
据文献[17]报道, 磺基甜菜碱聚合物摄取机制与SBMA链长以及被修饰物相关, 当单个磺基甜菜碱基团修饰小分子荧光染料时, 不仅能增加疏水染料溶解性, 还可通过与细胞膜上的磷脂酰胆碱相互作用而用于细胞膜染色; 当pSBMA聚合物游离存在时, 可通过类似于穿膜肽的方式摄取进入细胞, 避开溶酶体[18], 但修饰于材料或纳米粒表面时, 却表现出良好的抗黏附能力。
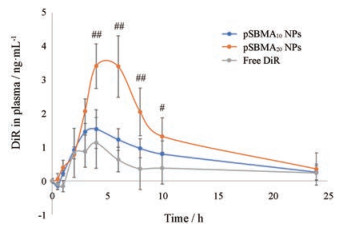
8 药动学研究给药后小鼠血液中DiR浓度变化曲线如图 8, 口服游离DiR和载DiR的pSBMA10 NPs和pSBMA20 NPs后, 血液中的DiR缓慢增加, 6 h后逐渐降低, 24 h后血液中DiR已基本被清除。虽然E12细胞实验结果表明:即使有黏液存在的情况下, pSBMA10 NPs的摄取仍优于pSBMA20 NPs, 但在4~10 h内, 游离DiR组和pSBMA10 NPs组的血药浓度明显低于pSBMA20 NPs组(P < 0.01)。这可能是因为E12细胞表面的黏液厚度要小于小肠表面的黏液层, 而pSBMA20 NPs穿黏液能力强于pSBMA10 NPs, 因此口服吸收较好。
|
Figure 8 The change of DiR in plasma after oral delivery of free DiR, DiR loaded pSBMA10 NPs and pSBMA20 NPs. n = 5, x ±s.#P < 0.05, ##P < 0.01 vs free DiR or pSBMA10 NPs |
本课题结合己内酯的开环聚合反应和原子转移自由基聚合反应成功合成了不同pSBMA链长的两嵌段聚合物PCL-pSBMA, 并通过纳米沉淀法制备了不同链长的pSBMA包裹的纳米粒。采用黏蛋白吸附实验和Transwell小室实验考察了pSBMA链长对纳米粒穿黏液的影响, 结果表明纳米粒的穿黏液能力随着pSBMA链的增长而增强。细胞摄取实验结果表明, pSBMAn NPs的摄取效率随着pSBMA链的增长而降低。在口服纳米给药体系中, 纳米粒不仅需具有良好的抗黏液黏附及穿黏液能力, 还需对小肠上皮细胞有良好的亲和力。本研究发现, 两性离子pSBMA链长对纳米粒穿黏液能力与细胞摄取效率具有相反的影响。动物实验结果表明: pSBMA20 NPs的口服生物利用度高于pSBMA10 NPs。因此筛选出合适链长的pSBMA聚合物, 对于克服黏液层及小肠上皮细胞这两道生理屏障有着重要意义。此外, 细胞毒性实验及血液相容性实验表明pSBMAn NPs具有良好的生物相容性, 为进行体内研究提供了安全保障。
| [1] | Shan W, Zhu X, Tao W, et al. Enhanced oral delivery of protein drugs using zwitterion-functionalized nanoparticles to overcome both the diffusion and absorption barriers[J]. ACS Appl Mater Interfaces, 2016, 8: 25444–25453. DOI:10.1021/acsami.6b08183 |
| [2] | He Z, Santos JL, Tian H, et al. Scalable fabrication of size-controlled chitosan nanoparticles for oral delivery of insulin[J]. Biomaterials, 2017, 130: 28–41. DOI:10.1016/j.biomaterials.2017.03.028 |
| [3] | Shan W, Zhu X, Liu M, et al. Overcoming the diffusion barrier of mucus and absorption barrier of epithelium by self-assembled nanoparticles for oral delivery of insulin[J]. ACS Nano, 2015, 9: 2345–2356. DOI:10.1021/acsnano.5b00028 |
| [4] | Xu Q, Ensign LM, Boylan NJ, et al. Impact of surface polyethylene glycol (peg) density on biodegradable nanoparticle transport in mucus ex vivo and distribution in vivo[J]. ACS Nano, 2015, 9: 9217–9227. DOI:10.1021/acsnano.5b03876 |
| [5] | Mao J, Li JM, Ding JS. The application of poly(2-ethyl-2-oxazoline) in drug delivery system[J]. Acta Pharm Sin (药学学报), 2017, 52: 1235–1240. |
| [6] | Chang Y, Shih YJ, Lai CJ, et al. Blood-inert surfaces via ion-pair anchoring of zwitterionic copolymer brushes in human whole blood[J]. Adv Funct Mater, 2013, 23: 1100–1110. DOI:10.1002/adfm.v23.9 |
| [7] | Cheng G, Zhang Z, Chen SF, et al. Inhibition of bacterial adhesion and biofilm formation on zwitterionic surfaces[J]. Biomaterials, 2007, 28: 4192–4199. DOI:10.1016/j.biomaterials.2007.05.041 |
| [8] | Sin MC, Chen SH, Chang Y. Hemocompatibility of zwitterionic interfaces and membranes[J]. Polym J, 2014, 46: 436–443. DOI:10.1038/pj.2014.46 |
| [9] | Chang Y, Chang WJ, Shih YJ, et al. Zwitterionic sulfobetaine-grafted poly(vinylidene fluoride) membrane with highly effective blood compatibility via atmospheric plasma-induced surface copolymerization[J]. ACS Appl Mater Interfaces, 2011, 3: 1228–1237. DOI:10.1021/am200055k |
| [10] | Wang WL, Wang B, Liu SR, et al. Bioreducible polymer nanocarrier based on multivalent choline phosphate for enhanced cellular uptake and intracellular delivery of doxorubicin[J]. ACS Appl Mater Interfaces, 2017, 9: 15986–15994. DOI:10.1021/acsami.7b03317 |
| [11] | Behrens I, Pena AIV, Alonso MJ, et al. Comparative uptake studies of bioadhesive and non-bioadhesive nanoparticles in human intestinal cell lines and rats:the effect of mucus on particle adsorption and transport[J]. Pharm Res, 2002, 19: 1185–1193. DOI:10.1023/A:1019854327540 |
| [12] | Chater PI, Wilcox MD, Pearson JP. Efficacy and safety concerns over the use of mucus modulating agents for drug delivery using nanoscale systems[J]. Adv Drug Deliv Rev, 2018, 124: 184–192. DOI:10.1016/j.addr.2017.12.006 |
| [13] | Zhai SY, Ma YH, Chen YY, et al. Synthesis of an amphiphilic block copolymer containing zwitterionic sulfobetaine as a novel pH-sensitive drug carrier[J]. Polym Chem, 2014, 5: 1285–1297. DOI:10.1039/C3PY01325A |
| [14] | Guo SS, Janczewski D, Zhu XY, et al. Surface charge control for zwitterionic polymer brushes:tailoring surface properties to antifouling applications[J]. J Colloid Interface Sci, 2015, 452: 43–53. DOI:10.1016/j.jcis.2015.04.013 |
| [15] | Ren PF, Yang HC, Liang HQ, et al. Highly stable, protein-resistant surfaces via the layer-by-layer assembly of poly (sulfobetaine methacrylate) and tannic acid[J]. Langmuir, 2015, 31: 5851–5858. DOI:10.1021/acs.langmuir.5b00920 |
| [16] | Polzer F, Heigl J, Schneider C, et al. Synthesis and analysis of zwitterionic spherical polyelectrolyte brushes in aqueous solution[J]. Macromolecules, 2011, 44: 1654–1660. DOI:10.1021/ma102927c |
| [17] | Ye Y, Zheng Y, Ji C, et al. Self-assembly and disassembly of amphiphilic zwitterionic perylenediimide vesicles for cell membrane imaging[J]. ACS Appl Mater Interfaces, 2017, 9: 4534–4539. DOI:10.1021/acsami.6b15592 |
| [18] | Morimoto N, Wakamura M, Muramatsu K, et al. Membrane translocation and organelle-selective delivery steered by polymeric zwitterionic nanospheres[J]. Biomacromolecules, 2016, 17: 1523–1535. DOI:10.1021/acs.biomac.6b00172 |
 2019, Vol. 54
2019, Vol. 54


