2. 上海中医药大学交叉科学研究院, 上海 201203;
3. 上海和黄药业有限公司, 上海 201401
2. Institute of Interdisciplinary Integrative Medicine Research, Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China;
3. Shanghai Hutchison Pharmaceuticals Co., Ltd., Shanghai 201401, China
菊三七为菊科菊三七属植物菊三七[Gynura japonica (Thunb.) Juel., syn. Gynura segetum (Lour.) Merr.]的干燥根, 为民间常用药, 又名土三七。菊三七在很多省部颁药材标准中有收载, 具有止血、活血化瘀和解毒消肿等功效。因其名称中有“三七”, 且其功效也与药用三七, 即五加科人参属植物三七Panax notoginseng (Burk.) F. H. Chen的干燥根和根茎, 有类同之处, 故在民间常与三七混淆[1]。然而, 近年来发现菊三七含多种吡咯里西啶生物碱(pyrrolizidine alkaloids, PAs)[1, 2], 能导致肝窦阻塞综合征(hepatic sinusoidal obstruction syndrome, HSOS), 引起了人们对其毒性的密切关注。
HSOS的主要临床表现为:肝区疼痛、肿大、出现腹水、黄疸及高胆红素等。其致病机制复杂, 有报道[3]指出其发病机制可能和肝窦内皮细胞内谷胱甘肽的消耗、一氧化氮的耗竭、基质金属蛋白酶(matrix metalloproteinases, MMPs)增加及血管内皮因子表达上调等因素有关。然而, 目前临床上对于肝窦阻塞综合征的治疗手段有限, 虽然欧洲出现了可以治疗由造血干细胞移植导致HSOS的药物——去纤维蛋白多核苷酸, 然而对于由其他因素如服用菊三七等含PAs的草药所导致的HSOS, 现在仍无有效的治疗手段。
胆宁片由大黄、虎杖、青皮、白茅根、陈皮、郁金和山楂7种单味药组成, 是我国国家级中药产品, 具疏肝利胆、清热通下之功效, 收录于中国药典一部[4], 并获得加拿大卫生部天然药品和非处方药局的上市许可证, 成为第一个“功能主治”全部被欧美国家政府认可的复方中药。临床可用于非酒精性脂肪肝、胆结石及胆囊炎的防治; 本课题组前期研究还发现, 胆宁片及其活性成分可有效缓解α-萘基异硫氰酸酯造成的急慢性肝损伤[5-7]。
大量研究证明, HSOS最直接损伤部位为肝窦, 病理特征为肝小静脉内皮部分发生纤维化堆积, 从而导致肝细胞功能受损。随着胶原在肝窦及静脉进一步积累, 肝细胞损伤加重出现坏死变性, 血管出现栓塞现象, 从而加剧肝窦阻塞综合征的病程[3]。纤维化的形成和加剧与HSOS的病程发展紧密相关。亦有报道[8]指出, 野百合碱诱导的HSOS大鼠模型中, 细胞炎症因子肿瘤坏死因子(tumor necrosis factor-α, TNF-α)、白介素(interleukin-1β, IL-1β)在体内的基因表达水平显著升高。此外, 在该疾病的临床样本中, TNF-α在血浆中的水平显著提升。以上动物模型及临床研究发现表明, 炎症参与了HSOS的发病进程。
因此, 本研究探讨胆宁片对菊三七所致HSOS的保护作用, 并从纤维化和炎症反应阐明其作用机制, 为临床治疗该疾病提供实验基础和理论依据。
材料与方法药品与质量控制 胆宁片由上海和黄药业有限公司提供(批次: 100314), 粉碎为细粉; 取胆宁片粉末0.35 g, 按中国药典胆宁片含量测定项下测定大黄素和大黄酚含量[4]。菊三七根采集自江苏省扬州市, 经作者鉴定为菊科菊三七属植物菊三七[Gynura japonica (Thunb.) Juel.]的根, 去除泥沙等异物晾干, 60 ℃烘干过夜后打粉, 参考文献方法[2], 以95%乙醇回流提取得到菊三七醇提物并分析其中PAs的种类及含量。
动物实验 实验方案经上海中医药大学动物实验伦理委员会批准, 所有程序均严格按照动物使用和护理的伦理原则进行。C57BL/6小鼠(雄性, 体重22±2 g)购自上海斯莱克实验动物有限责任公司[合格证号: SCXK (沪) 2012-0002]。小鼠随机分成空白对照组(control)、菊三七模型组(model)和胆宁片保护组(protection), 每组10只。各药物以0.5%羧甲基纤维素钠混悬, 连续给药40天:菊三七模型组每日灌胃菊三七醇提物(1 g·kg-1); 本课题组前期研究[7]表明, 3 g·kg-1胆宁片可显著改善α-萘异硫氰酸酯(ANIT)所致的肝损伤, 故胆宁片保护组每日灌胃胆宁片(3 g·kg-1) 4 h后灌胃菊三七醇提物(1 g·kg-1); 空白组每日灌胃等体积0.5%羧甲基纤维素钠。在实验过程中, 小鼠自由饮水, 进食。末次给药24 h后, 处理动物, 取血和肝组织。
血清生化指标检测 全血室温静置2 h后分离血清, 采用全自动生化分析仪检测血清中肝功能检测指标血清谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)、总胆汁酸(total bile acids, TBA)和总胆红素(total bilirubin, TBIL)。
肝脏病理学检查 取小鼠最大肝叶中央部分肝脏进行固定, 脱水, 石蜡包埋, 进行苏木素-伊红(hematoxylin and eosin, HE)染色和Masson染色。而后将切片置于Nikon显微镜下拍照, 光镜下观察HE及Masson染色切片, 对小鼠肝脏损伤进行评分(每项损伤分成4级, 无损伤记0, 轻度记1, 中度记2, 严重记3);并应用Image pro-plus 6.0软件对Masson染色结果进行阳性率(%)分析。
免疫组织化学法检测表达 取小鼠肝脏石蜡块连续切片, 按照免疫组化试剂盒说明书进行染色, 经抗原修复, 封闭, 抗体孵育, 显色, 而后在光镜下检查MMP9和磷酸化Smad3 (p-Smad3)蛋白表达情况。
酶联免疫吸附测定分析 取小鼠肝脏50 mg, 加入磷酸盐缓冲液500 μL匀浆后, 离心取上清, 按照酶联免疫吸附测定分析试剂盒说明书测定肝脏中羟脯氨酸含量。另取血清50 μL, 按照酶联免疫吸附测定分析试剂盒说明书测定血清中转化生长因子(transforming growth factor-β, TGF-β)含量。
逆转录-聚合酶链式反应分析 取肝脏50 mg, 加入Trizol 1 mL于低温下进行匀浆处理, 根据Trizol法提取RNA, 按照逆转录步骤合成cDNA, 参照聚合酶链式反应试剂盒方法检测肝脏中相关mRNA的表达水平。以目的基因与内参基因β-actin的比值作为基因的相对表达量, 引物序列见表 1。
| Table 1 The primer sequences for reverse transcription-polymerase chain reaction. S: Sense primer; AS: Antisense primer. α-Sma: α-Smooth muscle actin; Mmp: Matrix metalloproteinase; Tnf-α: Tumor necrosis factor-α; Il-1β: Interleukin-1β |
统计学方法 实验结果均以均数±标准差(x±s)表示, 采取Graphpad Primer 5.0统计软件中的one-way ANOVA分析(P < 0.05表示差异具有统计学意义)。
结果 1 胆宁片与菊三七提取物质量控制中国药典[4]规定胆宁片每片(每片重0.36 g)含虎杖和大黄, 以大黄素和大黄酚的总量计, 不得少于3.2 mg。参照中国药典对本研究所用胆宁片进行含量测定, 测得大黄素和大黄酚含量分别为13.5和1.3 mg·g-1, 按每片重0.36 g计, 每片含大黄素和大黄酚总量为5.3 mg, 符合药典标准。
本课题组前期研究表明, 菊三七中主要含6对PAs顺-反异构体, 包括毒性较强的千里光碱(senecionine)、千里光菲林碱(seneciphylline)、菊三七碱甲(seneciphyllinine)及其氮氧化物等[2]。根据前期报道[2]方法, 制备了菊三七醇提取物(提取率为6.0%)并采用液相色谱-质谱联用(liquid chromatography-mass spectrum, LC-MS)对其中主要毒性PAs进行分析(图 1), 所含主要PAs与报道[2]一致, senecionine、seneciphylline及二者氮氧化物含量最高, 分别为4.8、9.5、11.1和16.4 mg·g-1; 12种PAs总含量为50.0 mg·g-1。
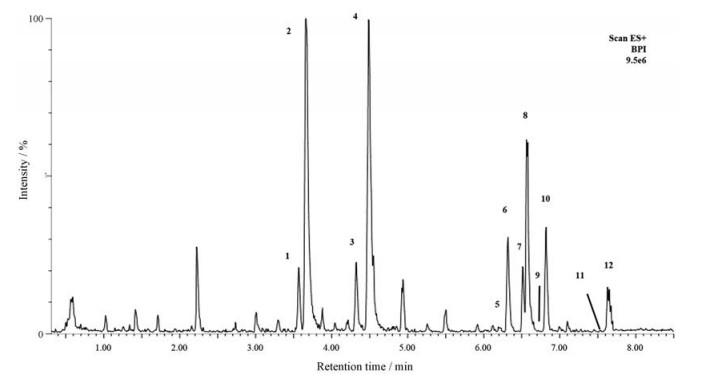
|
Figure 1 The UPLC-MS chemoprofile of the Gynura Rhizoma extracts. 1: Spartioidine N-oxide; 2: Seneciphylline N-oxide; 3: Integerrimine N-oxide; 4: Senecionine N-oxide; 5: Spartioidine; 6: Seneciphylline; 7: (E)-Seneciphyllinine N-oxide; 8: Seneciphyllinine N-oxide; 9: Integerrimine; 10: Senecionine; 11: (E)-Seneciphyllinine; 12: Seneciphyllinine |
由图 2A可知, 菊三七模型组血清肝功能检测指标血清ALT、AST、TBA和TBIL均显著升高, 而胆宁片保护组AST、TBA和TBIL均明显降低, ALT水平亦有恢复趋势。
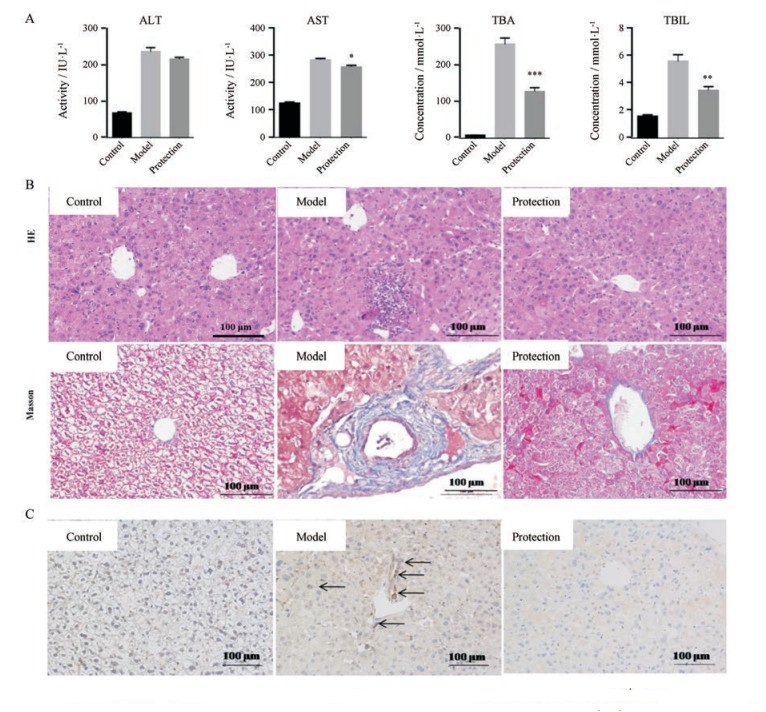
|
Figure 2 The protection effect of Danning tablet against Gynura Rhizoma-induced hepatic sinusoidal obstruction syndrome (HSOS) on mice. The HSOS model was established by intragastrical administration of Gynura Rhizoma extract (1 g·kg-1·d-1) for 40 consencutive days. And mice in the protection group were intragastrical administration of Danning tablet powder (3 g·kg-1·d-1) 4 hours before treatment of Gynura Rhizoma extract. A: Serum biochemical characteristics; B: HE & Masson staining; C: MMP9-immunohistochemical staining (black arrows indicate MMP9-positive cells in the hepatic sinusoid and central vein). n = 10, x±s. *P < 0.05, **P < 0.01, ***P < 0.001 vs model group. ALT: Alanine aminotransferase; AST: Aspartate aminotransferase; TBA: Total bile acids; TBIL: Total bilirubin; MMP9: Matrix metalloproteinase 9 |
由图 2B所示, 与空白组相比, 模型组HE染色显示肝细胞大面积坏死, 出血, 肝窦血液瘀滞, 中央静脉内皮细胞大面积坏死, 脱落; Masson染色观察到肝窦及中央静脉出现大面积纤维化。相比模型组, 胆宁片保护组小鼠HE染色可看出, 无大面积的肝细胞坏死发生, 中央静脉损伤得到一定程度的缓解, 无明显出血发生; Masson染色结果也表明, 胆宁片保护组在肝窦及中央静脉纤维化得到明显缓解。肝内MMP9可降解肝脏中胶原, 是HSOS发展病程中的关键调控点[6]。由图 2C所示, 模型组MMP9的表达明显高于空白组, 而胆宁片保护组MMP9表达显著低于模型组。因此, 胆宁片对MMP9的抑制表达说明其对HSOS有一定的缓解作用。综合HE及Masson染色结果, 对模型组和保护组的HSOS综合评分(表 2), 在胆宁片保护组中, 内皮出血和肝窦出血症状得到明显缓解, 中央静脉损伤和内皮纤维化症状也有一定程度的缓解。
| Table 2 Evaluation of the severity of HSOS. n = 4-10, x±s.*P < 0.05, ***P < 0.001 vs model group |
对Masson染色切片进行胶原阳性率分析, 表明模型组胶原阳性率显著大于空白组(P < 0.001), 而胆宁片保护组中胶原阳性表达细胞明显降低(图 3A)。羟脯氨酸是胶原合成的要素之一, 是评价肝内纤维化的关键指标。由图 3B可知, 模型组肝脏羟脯氨酸含量显著升高, 而给予胆宁片保护后其含量显著下降。此外, 肝脏纤维化与肝星状细胞的激活密切相关, 平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)则是肝星状细胞激活和增殖的重要标志[9]; HSOS模型组中其mRNA表达水平显著升高而胆宁片保护组显著下降, 恢复到空白对照组水平(图 3C)。以上结果表明, 胆宁片能减少HSOS小鼠肝脏胶原合成与堆积, 使得肝纤维化程度明显减轻。
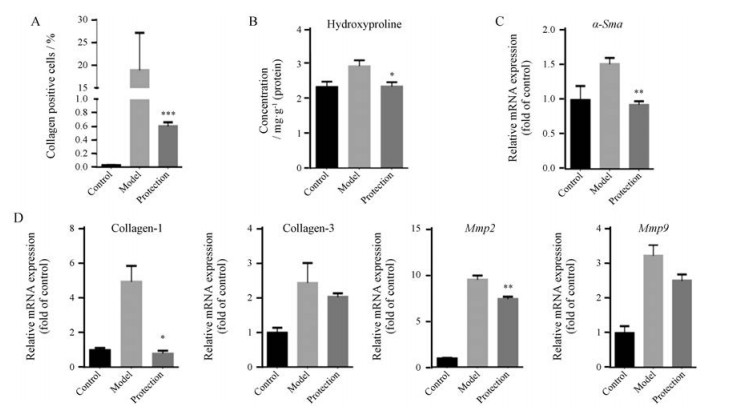
|
Figure 3 Danning tablet alleviated liver fibrosis in HSOS mice. A: Percentage of collagen-positive cells in liver tissue; B: Hepatic hydroxyproline concentration; C: Hepatic mRNA expression of α-Sma; D: Hepatic mRNA expression of fibrosis-related genes. n = 4-10, x±s. *P < 0.05, **P < 0.01, ***P < 0.001 vs model group. α-Sma: α-Smooth muscle actin; Mmp: Matrix metalloproteinase |
与空白组相比, 模型组肝脏纤维化相关基因Collagen 1、Collagen 3、Mmp2、Mmp9的mRNA表达显著上调(图 3D); 而胆宁片保护组的纤维化相关的基因均有不同程度的回调, 从而进一步从基因角度证明给胆宁片保护后, 小鼠肝脏纤维化得到缓解。
3.3 胆宁片抑制TGF-β/p-Smad3通路减缓HSOS小鼠肝脏纤维化p-Smad3免疫组化切片如图 4A所示, HSOS模型组中出现大量p-Smad3阳性细胞, 而胆宁片保护组小鼠肝脏中的p-Smad3阳性表达显著降低, 表明胆宁片可抑制菊三七所引起的Smad3磷酸化。此外, 对小鼠血清中的TGF-β含量进行分析, 与菊三七模型组比较, 胆宁片保护组小鼠血清中TGF-β含量也显著降低(图 4B), 说明胆宁片可降低菊三七所致的TGF-β异常分泌。另外, 胆宁片还可降低菊三七所致TGF-β/p-Smad3通路下游基因Collagen 1 α1 mRNA表达水平的升高(图 4C)。以上结果表明, 胆宁片可抑制TGF-β/p-Smad3通路减缓HSOS小鼠的肝脏纤维化。
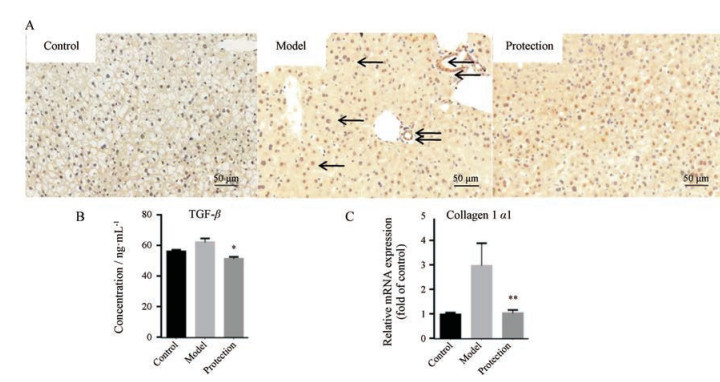
|
Figure 4 Danning tablet inhibited the activation of TGF-β/p-Smad3 signaling pathway on HSOS mice. A: p-Smad3-immunohistochemical staining (black arrows indicate p-Smad3-positive cells); B: Serum excretion of TGF-β; C: Hepatic mRNA expression of Collagen 1 α1. n = 4-10, x±s. *P < 0.05, **P < 0.01 vs model group. TGF-β: Transforming growth factor-β |
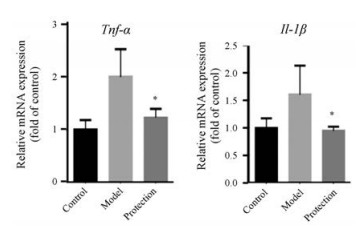
菊三七模型组小鼠肝脏中炎症相关基因TNF-α和IL-1β的mRNA表达水平显著上升; 给予胆宁片保护后, 上述基因均得到一定程度的回调(图 5), 说明胆宁片可以缓解菊三七所致HSOS的炎症反应, 从而缓解HSOS症状。
|
Figure 5 Danning tablet down regulated the over-expression of pro-inflammatory cytokines on HSOS mice. n = 4, x±s. *P < 0.05 vs model group. Tnf-α: Tumor necrosis factor; Il-1β: Interleukin-1β |
近年来, 由于中草药所引起的药物性肝损伤成为国际上最为关注的中药安全性问题之一。菊三七作为我国民间常用中草药, 含有大量肝毒性PAs, 是我国引发HSOS的主要原因[10]。PAs所致HSOS发病机制复杂, 在临床上一般采用抗凝等对症治疗, HSOS晚期患者因中央静脉及肝窦纤维化严重, 则可考虑经颈静脉肝内门体分流术缓解症状[11], 尚无有效药物来进行干预。
研究表明, 胆宁片可通过改善肝氧化应激损伤及中性粒细胞浸润[7]、调节胆汁酸代谢及炎症反应[6]而缓解α-萘基异硫氰酸酯所造成的肝损伤, 且对四氯化碳引起的肝纤维化有明显的保护作用[12]; 其活性成分如姜黄素在治疗肝脏疾病方面亦显示出良好的前景[13], 可有效对抗肝损伤及非酒精性脂肪肝病理进程、抗纤维化、抗癌等。因此, 本研究首先探讨了胆宁片对菊三七所致HSOS的保护作用, 结果表明胆宁片能显著降低HSOS小鼠血清AST、TBA和TBIL水平, 降低HSOS小鼠MMP9水平, 并明显改善肝脏组织病理状况, 缓解内皮出血及肝窦出血、中央静脉损伤及内皮纤维化。MMP9对于降解和重塑细胞外基质动态平衡起着重要的作用, 其增加被认为是HSOS的重要标志和发病机制[3], 作者采用特异性抗体对其进行了免疫组化分析并测定其在肝脏中的基因表达水平, 结果均表明MMP9在HSOS模型组增加而在胆宁片保护组中降低, 确证了胆宁片对HSOS的保护作用。
肝纤维化在HSOS的发病过程中发挥着重要的作用。肝纤维化与肝星状细胞的激活及增殖、胶原蛋白的过度分泌及细胞膜外基质(extracellular matrix, ECM)的过高沉积密切相关。在正常的机体内, ECM的合成与降解保持稳定平衡; 肝脏受损时, 肝星状细胞从原来的稳定状态转化为肌成纤维母细胞, α-SMA、Collagen Ⅰ和Collagen Ⅲ等与肝纤维化相关的因子表达升高, 从而使肝星状细胞分泌大量胶原蛋白, 导致肝脏中ECM的合成增多。同时, 肝损伤会抑制ECM的降解, 打破其原有合成与裂解的平衡, 进一步导致ECM的过度堆积及纤维化的生成。有文献[14]表明姜黄素可参与调节α-SMA、胶原蛋白等基因表达来调控肝星状细胞的增殖与凋亡, 从而抑制肝星状细胞活化, 减少细胞外基质的沉积, 缓解纤维化。在本研究中, 胆宁片显著降低了HSOS小鼠肝脏羟脯氨酸(胶原合成的要素)含量, 并降低了肝脏中α-SMA、Collagen Ⅰ、Collagen Ⅲ及MMPs的mRNA表达水平, 证明了胆宁片可缓解HSOS的肝纤维化。由于胆宁片活性成分通过降低TGF-β、TNF-α等因子而减轻纤维化已有明确的报道[5], 故本文中未对所有纤维化及炎症相关指标同时进行基因和蛋白的检测。进一步研究证明, 胆宁片可降低HSOS小鼠血清中TGF-β分泌并减弱Smad3的磷酸化水平。由此, 推测胆宁片主要通过抑制HSOS小鼠TGF-β/p-Smad3信号通路的活化而减缓肝纤维化。
炎症反应主要由血管与细胞的应答所构成的机体对多种损伤以及刺激所产生的一种自发性防御反应, 其本质是清除与消灭引起损伤的各种致炎因子和促进损伤的修复。炎症发生过程中, 炎症因子如TNF-α、IL-6、IL-1β的分泌及表达水平显著增加, TNF-α与IL-1β又与细胞增殖及凋亡等紧密相关。文献[8]报道, HSOS小鼠体内TGF-β、TNF-α等水平均显著升高。早有研究表明, 姜黄素可抑制炎症因子释放、抗氧化应激等对抗肝损伤及非酒精性脂肪肝病理进程[13]。作者前期研究也表明, 胆宁片有效成分姜黄素可降低ANIT引起肝及肠组织中TNF-α、IL-2、IL-6等炎症相关基因的过度表达[5]。本研究中胆宁片显著降低了HSOS小鼠肝脏中TNF-α和IL-1β的表达水平, 与前述研究结果相似, 进一步说明了胆宁片可降低机体的炎症反应而缓解肝损伤。
综上所述, 胆宁片对菊三七所致HSOS有明显的保护作用, 作用机制可能与其抑制TGF-β/p-Smad3信号通路及炎症信号通路的激活有关。
| [1] | Tang J, Hattori M. Pyrrolizidine alkaloids-containing Chinese medicines in the Chinese Pharmacopoeia and related safety concerns[J]. Acta Pharm Sin (药学学报), 2011, 46: 762–772. |
| [2] | Fang LX, Xiong AZ, Yang X, et al. Mass-spectrometry-directed analysis and purification of pyrrolizidine alkaloid cis/trans isomers in Gynura japonica[J]. J Sep Sci, 2014, 37: 2032–2038. DOI:10.1002/jssc.201400314 |
| [3] | Mohty M, Malard F, Abecassis M, et al. Sinusoidal obstruction syndrome/veno-occlusive disease:current situation and perspectives-a position statement from the European Society for Blood and Marrow Transplantation (EBMT)[J]. Bone Marrow Transplant, 2015, 50: 781–789. DOI:10.1038/bmt.2015.52 |
| [4] | Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (Edition 2015, Vol Ⅰ) (中华人民共和国药典-2015年版: 一部)[S]. Beijing: China Medicinal Science and Technology Press, 2015: 1265-1266. |
| [5] | Yang F, Tang XW, Ding LL, et al. Curcumin protects ANIT-induced cholestasis through signaling pathway of FXR-regulated bile acid and inflammation[J]. Sci Rep, 2016, 6: 33052. DOI:10.1038/srep33052 |
| [6] | Ding LL, Zhang BF, Zhan CS, et al. Danning tablets attenuates α-naphthylisothiocyanate-induced cholestasis by modulating the expression of transporters and metabolic enzymes[J]. BMC Complement Altern Med, 2014, 14: 249. DOI:10.1186/1472-6882-14-249 |
| [7] | Ding LL, Zhang BF, Dou W, et al. Protective effect of Danning tablet on acute livery injury with cholestasis induced by α-naphthylisothiocyanate in rats[J]. J Ethnopharmacol, 2012, 140: 222–229. DOI:10.1016/j.jep.2011.12.047 |
| [8] | Zhu H, Chu Y, Huo J, et al. Effect of prednisone on transforming growth factor-β1, connective tissue growth factor, nuclear factor-κB p65 and tumor necrosis factor-α expression in a murine model of hepatic sinusoidal obstruction syndrome induced by Gynura segetum[J]. Hepatol Res, 2011, 41: 795–803. DOI:10.1111/hep.2011.41.issue-8 |
| [9] | Tsukada S, Parsons CJ, Rippe RA. Mechanisms of liver fibrosis[J]. Clin Chim Acta, 2006, 364: 33–60. DOI:10.1016/j.cca.2005.06.014 |
| [10] | Wang XX, Qi XS, Guo XZ. Tusanqi-related sinusoidal obstruction syndrome in China:a systematic review of the literatures[J]. Medicine, 2015, 94: e942. DOI:10.1097/MD.0000000000000942 |
| [11] | Zhuge YZ, Wang Y, Zhang F, et al. Clinical characteristics and treatment of pyrrolizidine alkaloid-related hepatic vein occlusive disease[J]. Liver Int, 2018, 38: 1867–1874. DOI:10.1111/liv.13684 |
| [12] | Liu RH, Chen ZL, Li TJ, et al. The protective effects of Danning tablet on experimental liver injury in mice and rats[J]. J Pharm Pract (药学实践杂志), 2007, 25: 147–149. |
| [13] | Sun Y, Peng ML. Recent advances in curcumin and its derivatives for treatment of liver diseases[J]. Acta Pharm Sin (药学学报), 2014, 49: 1483–1490. |
| [14] | Lin YL, Lin CY, Chi CW, et al. Study on antifibrotic effects of curcumin in rat hepatic stellate cells[J]. Phytother Res, 2009, 23: 927–932. DOI:10.1002/ptr.v23:7 |
 2019, Vol. 54
2019, Vol. 54


