丙型肝炎病毒(hepatitis C virus, HCV)是丙型肝炎的致病因子, 全球HCV感染者超过1.7亿人[1], 高达80%的感染者由于机体不能有效清除HCV而转为慢性感染, 其中20%慢性感染者会进一步发展为肝硬化、肝细胞癌等严重肝病。由于HCV的RNA-依赖的RNA聚合酶(RNA-dependent RNA polymerase, RdRp) NS5B (non-structural protein 5B)在复制过程中有错配倾向, 导致其基因变异性较大, 不断出现大量新的病毒准种, 因此, 目前丙型肝炎疫苗的研制工作仍在探索之中。临床上现有的抗病毒药物多是以病毒蛋白酶为靶点, 虽然疗效强, 但长期用药后容易产生耐药性, 使得具有全新作用机制和广谱特性的抗病毒药物研发仍有重要前景。近年来与HCV生活周期各个环节有关的宿主细胞因子得到广泛研究, 这也为抗病毒药物的研发提供了新的研究靶点。这类药物的作用机制不是直接作用于病毒本身, 因此就有可能降低耐药的几率, 而且还可能具有广谱的抗病毒优势[2]。随着基因编辑和基于质谱的脂质组学和蛋白质组学技术的发展, 越来越多的证据表明, 宿主脂滴(lipid droplets, LDs)能参与HCV生命周期中的不同环节。它是一种在脂质储存和代谢、蛋白质质量控制以及免疫反应中均很重要的细胞器[3], 普遍存在于由单磷脂层包裹的保守的细胞区室, 在几乎所有的生物体中都可作为能量储存库。由于HCV自身缺乏进行脂质合成的途径, 因此其进化出了利用宿主脂质代谢来完成胞内复制的方式[4]。综合以上现状, 本文将对HCV生活周期与脂滴生物合成及代谢之间的关联做一综述, 并预测这些知识将有利于鉴定宿主因子作为抗病毒干预的合适靶标。
1 脂滴脂滴是细胞内存储中性脂肪的亚细胞器, 与具有双层膜的其他细胞器相比, 它的结构相当独特, 包含疏水性核心和单层两性磷脂。疏水核心主要含有三酰甘油(triacylglycerols, TAGs)和胆固醇酯(cholesterol esters)[5], 而单层磷脂的组成在不同的细胞类型中均有所变化, 但磷脂酰胆碱(phosphatidylcholines)和磷脂酰乙醇胺(phosphatidylethanolamines)是两种主要的磷脂。单层磷脂膜的表面由LDs相关蛋白修饰, 包括诸如激素敏感性脂肪酶(hormone-sensitive lipase, HSL)、脂肪甘油三酯脂肪酶(adipose triglyceride lipase, ATGL)一类的酶[6]。蛋白质组学分析显示, 许多宿主因子与脂滴密切相关。1991年脂滴包被蛋白作为第一个脂滴表面蛋白被发现之后, 脂肪分化相关蛋白(adipose differentiation-related protein, ADRP)、尾连蛋白(tail- interacting protein of 47 kDa, TIP47)和小窝蛋白-1 (caveolin-1)等相继也被发现定位于脂滴表面, 人们统称它们为脂滴相关蛋白。目前, 关于脂滴的起源说法不一, 但比较公认的说法是脂滴起源于内质网, 可能采用类似于出芽的方式形成。支持此学说的主要证据是, 大多数细胞的内质网中含有中性脂质合成所必需的关键酶[7], 多种酶促反应有助于LDs组装和许多生物活性脂质中间体的合成和转化。
真核细胞的细胞类型、饥饿状态以及生理条件等因素决定了宿主利用存储在LDs中的脂质的方式, 主要包括脂解和脂噬这两种途径。在哺乳动物脂肪细胞中, 胞内能量和激素水平的变化激活脂解作用, 这要求HSL、ATGL和单酰甘油脂肪酶(monoacylglycerol lipase, MGL) 3种主要脂肪分解酶的瞬时活化, 从而协调TAG水解产生能量[8]。脂滴包被蛋白定位于LDs表面并保护TAG免受细胞质脂肪酶的降解, 当机体处于饥饿状态时, 脂滴包被蛋白会通过分子伴侣介导的自噬途径降解从而促进脂解作用[9]。另一种脂噬作用泛指细胞内的脂质通过自噬体转运至溶酶体分解的过程。近年来, 自噬在调节脂质代谢中的作用已经被深入研究。自噬是一个非选择性的过程, 但在某些情况下, 也可以选择性地优先降解某一物质, 可以选择性降解脂质的自噬称为脂噬。多种因素, 如营养剥夺、病毒感染和甾醇消耗, 均可引发自噬机制所导致的LDs降解[10]。LDs被吞噬溶酶体降解以释放存储的脂质过程中, 会发生线粒体β-氧化供能, 该过程经常被黄病毒利用以促进它们的复制[11, 12]。
LDs在脂质代谢中起着核心作用, 并与不同的细胞生理活动如脂肪酸运输、细胞信号转导、蛋白质储存、自噬和病毒复制等息息相关[13, 14]。作为具有代谢活性的细胞器, LDs能调节宿主脂质合成与代谢之间的平衡以维持细胞稳态。通过二酰基甘油酰基转移酶-1 (diacylglycerol acyltransferase 1, DGAT-1)和DGAT2催化, 胞内的脂肪酸与二甘油酯(diacylyglycerols, DAGs)会转化成TAGs并储存在LDs中。TAGs可以进一步被水解以产生用于膜磷脂合成的DAGs、磷脂酸(phosphatidic acid)和用于能量生产的游离脂肪酸(free fatty acid, FFA)[15]。此外, 由于LDs具有独特的结构特征并且与内质网相隔较为接近, 其表面也可为通过内质网相关途径(endoplasmic reticulum-associated degradation, ERAD)降解的蛋白质充当临时贮存库[16]。研究发现, 3-羟基-3-甲基戊二酸单酰辅酶A还原酶(3-hydroxy-3-methylglutaryl CoA reductase, HMGCR)可能通过蛋白酶体降解途径在LDs表面降解。HMGCR是哺乳动物细胞中胆固醇合成的一种限速酶, 其泛素化由原始广泛存在蛋白1 (ancient ubiquitous protein 1, AUP1)所介导[17]。AUP1可将泛素缀合酶UBE2G2募集至LDs中并促进其与泛素连接酶gp78和Trc8相结合, 从而启动HMGCR的泛素化降解并最终导致胆固醇合成被抑制[18]。
2 LDs代谢对HCV生活周期的影响HCV历来被用于研究LDs代谢与病毒生命周期之间的相互作用, 随着丙型肝炎病毒体外培养系统的建立以及研究的不断深入, 人们发现HCV复制周期中每一步骤都与宿主的脂质紧密相关。一方面HCV能够调节细胞内脂质代谢并改变宿主细胞的内膜系统, 营造富含脂质的胞内环境以利于病毒复制; 另一方面脂质在病毒复制过程中发挥重要作用, 通过提供细胞内膜表面、脂质、能量和蛋白质等重要组分来参与HCV生活周期的不同阶段。这些相互作用的强度和复杂性强调了针对LDs代谢控制病毒感染的重要性。
2.1 LDs在HCV复制中的作用据报道, HCV RNA复制发生在由NS4B与NS5A诱导形成的囊泡结构上, LDs与其密切相关。当HCV侵入细胞后, 会破坏内质网膜原有的结构, 诱导形成特征性的双层膜囊泡(double-membrane vesicles, DMVs)。DMVs由活性病毒复制酶蛋白和双链RNA (dsRNA)以及几种宿主组分组成, 包括对病毒RNA复制至关重要的囊泡关联膜蛋白关联蛋白A (vesicle-associated membrane protein-associated protein A)和B[19]。这些异常的囊泡结构是病毒RNA基因组进行转录复制的场所, 同时也为病毒RNA以及参与转录复制的病毒非结构蛋白提供保护屏障, 使其免受宿主免疫系统的攻击。大量研究表明, NS5A参与发生在新生膜囊泡上的RNA复制, 并有助于LDs附近的病毒颗粒组装。Viperin是一种干扰素诱导的抗病毒蛋白, 它可以通过干扰HCV非结构蛋白NS5A与细胞内脂筏膜的关联而抑制HCV RNA复制, 表明在HCV复制期间LD与NS5A关联的重要性。而在病毒复制期间, 有两种脂滴相关蛋白与NS5A密切相关。TIP47蛋白是脂滴相关蛋白PAT家族成员之一, 在脂肪细胞中呈一定的时空表达规律, 在基础状态下TIP47主要分布在靠近胞膜的胞浆中, 当生成新生的脂肪滴时, 新生脂肪滴靠近胞膜, TIP47结合到脂肪滴表面并包裹脂肪滴, 主要参与新生脂肪滴的快速装配。TIP47作为HCV感染的新型辅助因子, 通过与NS5A相互作用, 将LD膜整合到膜网结构中, 促进病毒复制[20]。另一种脂滴相关蛋白Rab18是小G蛋白Ras家族的成员之一, 参与细胞内的囊泡运输, 对内质网和高尔基体等细胞器间的膜转运更是至关重要。Rab18促进了NS5A和其他复制酶组分与LDs间的相互作用, 且Rab18与NS5A的结合会将复制位点募集到LDs上[21]。根据宿主细胞需求, LDs会以酯化形式释放游离胆固醇以用于膜形成[22], 因此, 它可以充当细胞内膜表面扩展形成DMVs所需的脂质储库。与此同时, 宿主内与脂质生物合成、降解和转运相关的基因表达会发生显著改变。如控制胆固醇生物合成基因转录的固醇调节元件结合蛋白(sterol-regulatory element binding proteins, SREBPs)被HCV感染所激活[23], 细胞内脂肪酸合酶(fatty acid synthase, FASN)及其他与脂肪酸合成、转运相关的基因会因HCV感染而上调, 而对FASN活性的抑制会阻断HCV RNA的复制以及感染性病毒颗粒的产生[24]。有研究表明, HCV感染后通过下调转录因子——过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptors α)来减少脂肪酸的β-氧化[25], 并且HCV感染还能够促进脂肪酸氧化的单腺苷酸激活蛋白激酶(AMP-activated protein kinase)去磷酸化而失活, 从而减少细胞内脂肪酸氧化并且增加肝细胞内脂质的累积[26]。
2.2 LDs作为HCV组装的平台HCV病毒颗粒组装发生在LDs和内质网膜上, 其颗粒组装的先决条件是信号肽肽酶水解core的C-端跨膜区, 从而使得core定位到LDs表面[27], 随后替代LDs定位的ADRP, 导致ADRP降解并使LDs通过微管依赖的方式向紧靠HCV复制位点的微管组织中心转运[28, 29]。感染性病毒颗粒的产生并非随即发生在LDs附近, 而是需要DGAT-1介导的LDs形成。DGAT1与core相结合并使core定位于DGAT1生成的LDs, 从而使RNA复制复合物募集到病毒组装的合适位点。作为脂滴相关蛋白, 过表达Rab18会减少ADRP的含量, 引起LDs与内质网膜的紧密连接。且Rab18对于将core运输到LDs以及随后的病毒组装是必需的, 它通过将core从病毒复制位点转运到病毒组装位点来参与病毒颗粒成熟。而TIP47通过与LDs相互作用并促进其与LDs的关联, 从而影响病毒颗粒的产生。此外, 在DGAT-1的帮助下, NS5A与core共定位于LDs表面, 可能是通过与core的相互作用触发病毒颗粒组装的早期步骤[30, 31]。Core与NS5A相互作用位点的突变会影响二者在LDs上的共定位, 并显著阻碍病毒颗粒形成[32], 且core的LDs定位与组装效率之间存在相关性, 提示LDs是HCV组装的“基地”[33]。研究发现, HCV感染会增加载脂蛋白J (apolipoprotein J, ApoJ)的表达, 进一步增强core和NS5A与LDs间相互作用的稳定性, 从而促进病毒组装[34, 35]。HCV生活周期与LDs间的关联见图 1。
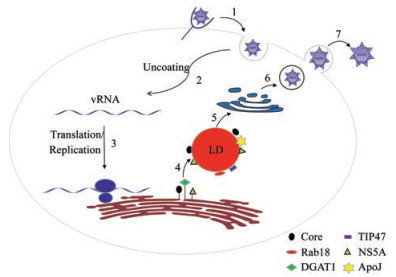
|
Figure 1 The association between the LDs and HCV life cycle. Viral particles are internalized via receptor-mediated endocytosis (1). After the uncoating of viral particles (2), viral RNA is released into cytosol for translation and replication (3). Progeny virions are assembled in close proximity to the ER and LDs. DGAT1 promotes the interaction between NS5A and core at the surface of the ER, and ensures they are targeted to the same LD. Rab18 and TIP47 promote interaction between LDs and replication sites. At the LD surface, interaction of core and NS5A seems to be further enhanced by ApoJ which migrates from the Golgi to LDs upon HCV infection (4). Virions are transported through the host secretory pathway and undergo maturation (5, 6). Mature virions are released from the cell surface (7). LDs: Lipid droplets; HCV: Hepatitis C virus; DGAT1: Diacylglycerol acyltransferase 1; ApoJ: Apolipoprotein J; ER: Endoplasmic reticulum |
HCV病毒颗粒的释放受不同宿主因子调控, 主要与脂代谢和LDs相关。通过质谱分析细胞培养产生的HCV病毒颗粒发现其脂质组成与极低密度脂蛋白(very low density lipoprotein, VLDL)的脂质组成极为相似, 提示HCV病毒颗粒的组装和释放与宿主内脂蛋白及脂质代谢间的关联[36, 37]。新合成的子代RNA会在LDs表面用于翻译生成病毒蛋白或者与宿主和病毒蛋白一起包装形成新的病毒颗粒, 最终新生病毒颗粒以VLDL依赖的方式释放。多项研究证明了载脂蛋白E (apolipoprotein E, ApoE)和VLDL通路在病毒释放中起着重要作用[38, 39], 如ApoE与NS5A直接相互作用并促进病毒颗粒释放。研究发现, Rab9-TIP47复合物也对病毒颗粒的释放至关重要。这是由于TIP47存在一个类似ApoE的结构域, 可与病毒颗粒相互作用, 在Rab9的帮助下, 引导病毒颗粒向胞外释放。而缺乏Rab9结合位点的TIP47突变体会使新合成的病毒颗粒错误地导向至自噬体。
2.4 LDs作为能量储存器的应用病毒基因组的复制是一个耗能过程。在HCV感染的细胞中, 由于能量消耗增高, 胞质中ATP水平会显著降低; 同时, 在感染细胞内的复制隔室中ATP水平升高。这说明机体或者将ATP产生机制引入膜相关的复制位点, 或者通过线粒体和复制隔室之间的膜-膜通讯途径来转运ATP[40]。在病毒感染期间许多细胞信号传导通路的激活也受ATP水平的调节。有人提出: LDs可作为高效的能量储存器。储存在LDs中的能量通过脂解反应释放出来, 脂酶活化来自LDs的TAG库产生大量FFAs, 从而用于β-氧化, 为细胞产生ATP和其他中间体提供能量。与葡萄糖相比, 每克FA水解多释放2.5倍ATP, 这为病毒复制期间的能量供应提供了巨大的储存空间[3]。
2.5 LDs作为脂质储库的应用除了在黄病毒科感染期间提供用于β氧化的FFAs之外, LDs还作为病毒复制所必需的脂质储库起作用。黄病毒科复制的细胞器由FAs及特定的磷脂、鞘脂和胆固醇组成[41, 42]。登革病毒(Dengue virus)通过脂解反应分解LDs来获得FA[11], HCV则通过SREBP信号传导来控制脂质生物合成和相关基因的转录诱导[43]。HCV感染激活了定位于内质网的SREBP前体, 并引发其向高尔基体的运输。此后, 通过位于高尔基体的位点1蛋白酶(site 1 protease, S1P)和位点2蛋白酶(S2P)对SREBP前体进行蛋白水解加工, 释放其N末端片段运输到细胞核中, 会启动与脂肪生成有关的因子如FASN和HMGCoA的转录, 从而调节LDs的生成。HCV复制细胞器使用胆固醇作为结构成分[44]。细胞氧固醇结合蛋白(oxysterol-binding protein)和磷脂酰肌醇4-激酶(phosphatidylinositol 4-kinases)在复制过程中促进胆固醇向HCV重排的膜样结构的运输, 突出了HCV复制对这两种因子的需求[45]。除胆固醇外, 鞘磷脂是HCV复制细胞器的另一种重要膜组分。已有文献报道, 鞘磷脂在HCV RNA复制过程中会增强NS5B与模板RNA的结合, 因此对于HCV的复制是很重要的[46]。编码鞘磷脂合成酶1和2的基因在HCV感染时被上调, 导致鞘磷脂的合成增强[47]。McIntosh等[48]在LDs表面发现具有高亲和力的鞘磷脂结合蛋白ADRP, 说明LDs可能参与HCV复制所必需的鞘磷脂的生物合成。
3 针对LDs代谢而衍生的抗病毒策略由于病毒对宿主LDs具有广泛的依赖性, 病毒、宿主与LDs代谢间的相互作用为潜在的抗病毒干预提供了新的思路。科学家针对病毒经常利用LDs的生物合成、分布、运输和代谢的特定步骤, 已设计出一系列抗病毒策略。研究发现, FASN是催化脂肪酸从头合成的多功能酶, 且在HCV感染时细胞中FASN表达增加, 而使用化学合成的FASN抑制剂C75会阻断FA合成通路, 从而抑制HCV的复制[49]。乙莫克舍是一种不可逆的肉碱棕榈酰转移酶1 (carnitine palmitoyltransferase 1)抑制剂, 通过抑制β-氧化酶的活性, 可以消除细胞内所有的脂肪酸氧化反应, 阻止HCV复制。HCV经低密度脂蛋白受体进入肝细胞, 而HMGCR可上调低密度脂蛋白受体。体内、外研究均表明, HMGCR抑制剂(如洛伐他汀、辛伐他汀、氟伐他汀等)通过抑制胆固醇合成途径中的HMGCR从而抑制HCV复制[50, 51]。此外, Harris等[52]发现DGAT1活性对core蛋白在LDs表面的定位至关重要, 使用DGAT1抑制剂会干扰DGAT1的活性并限制LD与病毒衣壳蛋白的连接, 从而阻断感染性HCV子代病毒体的装配与释放。美国哈佛大学医学部近来发现, 新生病毒颗粒以VLDL依赖的方式释放, 而葡萄柚中所含类黄酮类物质柚皮素有抑制VLDL分泌的作用, 因此能够显著抑制丙型肝炎病毒在被感染细胞内的分泌。
4 结语近年来, 随着对丙型肝炎病毒研究的日益深入, 新药物新疗法不断地出现, 给慢性丙型肝炎的治疗带来了曙光。如HCV NS5A抑制剂由于抗病毒活性更强、清除病毒快速、具有对多种基因型HCV的抑制活性, 已经越来越多的被发现并成为HCV鸡尾酒疗法的重要组成之一[53]。但这些疗法临床应用时间不长, 结构类型多样性差可能导致容易发生交叉耐药, 其长期有效性与安全性尚需进一步评估。因此, 单一的直接抗病毒剂很难治愈HCV感染而不出现耐药, 对于难治性HCV感染更是面临很大挑战。可以大胆推测, 针对LDs代谢而衍生的抗病毒策略, 开发更加有效的治疗方案、多个靶点药物混合制剂以及泛基因型抗病毒药物将会是未来治疗慢性丙型肝炎的趋势。
| [1] | Lavanchy D. Evolving epidemiology of hepatitis C virus[J]. Clin Microbiol Infect, 2011, 17: 107–115. DOI:10.1111/j.1469-0691.2010.03432.x |
| [2] | Jiang Z, Li YP, Li ZR. Research progress of anti-HIV and HCV drugs targeting host cellular factors[J]. Chin J New Drugs (中国新药杂志), 2014, 23: 665–673. |
| [3] | Walther TC, Farese RV Jr. Lipid droplets and cellular lipid metabolism[J]. Annu Rev Biochem, 2012, 81: 687–714. DOI:10.1146/annurev-biochem-061009-102430 |
| [4] | Paul D, Madan V, Bartenschlager R. Hepatitis C virus RNA replication and assembly:living on the fat of the land[J]. Cell Host Microbe, 2014, 16: 569–579. DOI:10.1016/j.chom.2014.10.008 |
| [5] | Thiam AR, Farese RV Jr, Walther TC. The biophysics and cell biology of lipid droplets[J]. Nat Rev Mol Cell Biol, 2013, 14: 775–786. DOI:10.1038/nrm3699 |
| [6] | Tauchi-Sato K, Ozeki S, Houjou T, et al. The surface of lipid droplets is a phospholipid monolayer with a unique fatty acid composition[J]. J Biol Chem, 2002, 277: 44507–44512. DOI:10.1074/jbc.M207712200 |
| [7] | Pol A, Martin S, Fernandez MA, et al. Dynamic and regulated association of caveolin with lipid bodies:modulation of lipid body motility and function by a dominant negative mutant[J]. Mol Biol Cell, 2004, 15: 99–110. DOI:10.1091/mbc.e03-06-0368 |
| [8] | Zimmermann R, Strauss JG, Haemmerle G, et al. Fat mobilization in adipose tissue is promoted by adipose triglyceride lipase[J]. Science, 2004, 306: 1383–1386. DOI:10.1126/science.1100747 |
| [9] | Brasaemle DL. Thematic review series:adipocyte biology. The perilipin family of structural lipid droplet proteins:stabilization of lipid droplets and control of lipolysis[J]. J Lipid Res, 2007, 48: 2547–2559. DOI:10.1194/jlr.R700014-JLR200 |
| [10] | Ouimet M, Marcel YL. Regulation of lipid droplet cholesterol efflux from macrophage foam cells[J]. Arterioscler Thromb Vasc Biol, 2012, 32: 575–581. DOI:10.1161/ATVBAHA.111.240705 |
| [11] | Heaton NS, Randall G. Dengue virus-induced autophagy regulates lipid metabolism[J]. Cell Host Microbe, 2010, 8: 422–432. DOI:10.1016/j.chom.2010.10.006 |
| [12] | Velikkakath AK, Nishimura T, Oita E, et al. Mammalian Atg2 proteins are essential for autophagosome formation and important for regulation of size and distribution of lipid droplets[J]. Mol Biol Cell, 2012, 23: 896–909. DOI:10.1091/mbc.e11-09-0785 |
| [13] | Saka HA, Valdivia R. Emerging roles for lipid droplets in immunity and host-pathogen interactions[J]. Annu Rev Cell Dev Biol, 2012, 28: 411–437. DOI:10.1146/annurev-cellbio-092910-153958 |
| [14] | Welte MA. Expanding roles for lipid droplets[J]. Curr Biol, 2015, 25: R470–R481. DOI:10.1016/j.cub.2015.04.004 |
| [15] | Pol A, Gross SP, Parton RG. Review:biogenesis of the multifunctional lipid droplet:lipids, proteins, and sites[J]. J Cell Biol, 2014, 204: 635–646. DOI:10.1083/jcb.201311051 |
| [16] | Gao Q, Goodman JM. The lipid droplet-a well-connected organelle[J]. Front Cell Dev Biol, 2015, 3: 49. |
| [17] | Spandl J, Lohmann D, Kuerschner L, et al. Ancient ubiquitous protein 1(AUP1) localizes to lipid droplets and binds the E2 ubiquitin conjugase G2(Ube2g2) via its G2 binding region[J]. J Biol Chem, 2011, 286: 5599–5606. DOI:10.1074/jbc.M110.190785 |
| [18] | Jo Y, Hartman IZ, DeBose-Boyd RA. Ancient ubiquitous protein-1 mediates sterol-induced ubiquitination of 3-hydroxy-3-methylglutaryl CoA reductase in lipid droplet-associated endoplasmic reticulum membranes[J]. Mol Biol Cell, 2013, 24: 169–183. DOI:10.1091/mbc.e12-07-0564 |
| [19] | Evans MJ, Rice CM, Goff SP. Phosphorylation of hepatitis C virus nonstructural protein 5A modulates its protein interactions and viral RNA replication[J]. Proc Natl Acad Sci U S A, 2004, 101: 13038–13043. DOI:10.1073/pnas.0405152101 |
| [20] | Daniel F, Zhang J, Matthew A, et al. The lipid droplet-associated protein perilipin 3 facilitates hepatitis C virus-driven hepatic steatosis[J]. J Lipid Res, 2017, 58: 420–432. DOI:10.1194/jlr.M073734 |
| [21] | Ana F, John M. Hepatitis C virus and lipid droplets:finding a niche[J]. Trends Mol Med, 2015, 21: 34–42. DOI:10.1016/j.molmed.2014.11.003 |
| [22] | Maxfield FR, Tabas I. Role of cholesterol and lipid organization in disease[J]. Nature, 2005, 438: 612–621. DOI:10.1038/nature04399 |
| [23] | Moriishi K, Mochizuki R, Moriya K, et al. Critical role of PA28gamma in hepatitis C virus-associated steatogenesis and hepatocarcinogenesis[J]. Proc Natl Acad Sci U S A, 2007, 104: 1661–1666. DOI:10.1073/pnas.0607312104 |
| [24] | Su AI, Pezacki JP, Wodicka L, et al. Genomic analysis of the host response to hepatitis C virus infection[J]. Proc Natl Acad Sci U S A, 2002, 99: 15669–15674. DOI:10.1073/pnas.202608199 |
| [25] | Dharancy S, Malapel M, Perlemuter G, et al. Impaired expression of the peroxisome proliferator-activated receptor alpha during hepatitis C virus infection[J]. Gastroenterology, 2005, 128: 334–342. DOI:10.1053/j.gastro.2004.11.016 |
| [26] | Mankouri J, Tedbury PR, Gretton S, et al. Enhanced hepatitis C virus genome replication and lipid accumulation mediated by inhibition of AMP-activated protein kinase[J]. Proc Natl Acad Sci U S A, 2010, 107: 11549–11554. DOI:10.1073/pnas.0912426107 |
| [27] | McLauchlan J, Lemberg MK, Hope G, et al. Intramembrane proteolysis promotes trafficking of hepatitis C virus core protein to lipid droplets[J]. EMBO J, 2002, 21: 3980–3988. DOI:10.1093/emboj/cdf414 |
| [28] | Boulant S, Douglas MW, Moody L, et al. Hepatitis C virus core protein induces lipid droplet redistribution in a microtubule-and dynein-dependent manner[J]. Traffic, 2008, 9: 1268–1282. DOI:10.1111/tra.2008.9.issue-8 |
| [29] | Nada M, Radwa Y, Shereen A, et al. Epigenetic harnessing of HCV via modulating the lipid droplet-protein, TIP47, in HCV cell models[J]. FEBS Lett, 2015, 589: 2266–2273. DOI:10.1016/j.febslet.2015.06.040 |
| [30] | Lavie M, Dubuisson J. Interplay between hepatitis C virus and lipid metabolism during virus entry and assembly[J]. Biochimie, 2017, 141: 62–69. DOI:10.1016/j.biochi.2017.06.009 |
| [31] | Martins AS, Martins IC, Santos NC. Methods for lipid droplet biophysical characterization in flaviviridae infections[J]. Front Microbiol, 2018, 9: 1951. DOI:10.3389/fmicb.2018.01951 |
| [32] | Targett-Adams P, Hope G, Boulant S, et al. Maturation of hepatitis C virus core protein by signal peptide peptidase is required for virus production[J]. J Biol Chem, 2008, 283: 16850–16859. DOI:10.1074/jbc.M802273200 |
| [33] | Shavinskaya A, Boulant S, Penin F, et al. The lipid droplet binding domain of hepatitis C virus core protein is a major determinant for efficient virus assembly[J]. J Biol Chem, 2007, 282: 37158–37169. DOI:10.1074/jbc.M707329200 |
| [34] | Lin CC, Tsai P, Sun HY, et al. Apolipoprotein J, a glucose-upregulated molecular chaperone, stabilizes core and NS5A to promote infectious hepatitis C virus virion production[J]. J Hepatol, 2014, 61: 984–993. DOI:10.1016/j.jhep.2014.06.026 |
| [35] | Nathan L, Krystal A, Kumar G, et al. Entangled in a membranous web:ER and lipid droplet reorganization during hepatitis C virus infection[J]. Curr Opin Cell Biol, 2016, 41: 117–124. DOI:10.1016/j.ceb.2016.05.003 |
| [36] | Andre P, Komurian-Pradel F, Deforges S, et al. Characterization of low-and very-low-density hepatitis C virus RNA-containing particles[J]. J Virol, 2002, 76: 6919–6928. DOI:10.1128/JVI.76.14.6919-6928.2002 |
| [37] | Nielsen SU, Bassendine MF, Burt AD, et al. Association between hepatitis C virus and very-low-density lipoprotein (VLDL)/LDL analyzed in iodixanol density gradients[J]. J Virol, 2006, 80: 2418–2428. DOI:10.1128/JVI.80.5.2418-2428.2006 |
| [38] | Miyanari Y, Atsuzawa K, Usuda N, et al. The lipid droplet is an important organelle for hepatitis C virus production[J]. Nat Cell Biol, 2007, 9: 1089–1097. DOI:10.1038/ncb1631 |
| [39] | Daniela P, Mohamed LH, Kiyoshi H, et al. TIP47 is associated with the Hepatitis C virus and its interaction with Rab9 is required for release of viral particles[J]. Eur J Cell Biol, 2013, 92: 374–382. DOI:10.1016/j.ejcb.2013.12.003 |
| [40] | Ando T, Imamura H, Suzuki R, et al. Visualization and measurement of ATP levels in living cells replicating hepatitis C virus genome RNA[J]. PLoS Pathog, 2012, 8: e1002561. DOI:10.1371/journal.ppat.1002561 |
| [41] | Heaton NS, Perera R, Berger KL, et al. Dengue virus nonstructural protein 3 redistributes fatty acid synthase to sites of viral replication and increases cellular fatty acid synthesis[J]. Proc Natl Acad Sci U S A, 2010, 107: 17345–17350. DOI:10.1073/pnas.1010811107 |
| [42] | Perera R, Riley C, Isaac G, et al. Dengue virus infection perturbs lipid homeostasis in infected mosquito cells[J]. PLoS Pathog, 2012, 8: e1002584. DOI:10.1371/journal.ppat.1002584 |
| [43] | Olmstead AD, Knecht W, Lazarov I, et al. Human subtilase SKI-1/S1P is a master regulator of the HCV lifecycle and a potential host cell target for developing indirect-acting antiviral agents[J]. PLoS Pathog, 2012, 8: e1002468. DOI:10.1371/journal.ppat.1002468 |
| [44] | Romero-Brey I, Merz A, Chiramel A, et al. Three-dimensional architecture and biogenesis of membrane structures associated with hepatitis C virus replication[J]. PLoS Pathog, 2012, 8: e1003056. DOI:10.1371/journal.ppat.1003056 |
| [45] | Wang H, Perry JW, Lauring AS, et al. Oxysterol-binding protein is a phosphatidylinositol 4-kinase effector required for HCV replication membrane integrity and cholesterol trafficking[J]. Gastroenterology, 2014, 146: 1373–1385. DOI:10.1053/j.gastro.2014.02.002 |
| [46] | Weng L, Hirata Y, Arai M, et al. Sphingomyelin activates hepatitis C virus RNA polymerase in a genotype-specific manner[J]. J Virol, 2010, 84: 11761–11770. DOI:10.1128/JVI.00638-10 |
| [47] | Hirata Y, Ikeda K, Sudoh M, et al. Self-enhancement of hepatitis C virus replication by promotion of specific sphingolipid biosynthesis[J]. PLoS Pathog, 2012, 8: e1002860. DOI:10.1371/journal.ppat.1002860 |
| [48] | McIntosh AL, Storey SM, Atshaves BP. Intracellular lipid droplets contain dynamic pools of sphingomyelin:ADRP binds phospholipids with high affinity[J]. Lipids, 2010, 45: 465–477. DOI:10.1007/s11745-010-3424-1 |
| [49] | Yang W, Hood BL, Chadwick SL, et al. Fatty acid synthase is up-regulated during hepatitis C virus infection and regulates hepatitis C virus entry and production[J]. Hepatology, 2008, 48: 1396–1403. DOI:10.1002/hep.22508 |
| [50] | Sagan SM, Rouleau Y, Leggiadro C, et al. The influence of cholesterol and lipid metabolism on host cell structure and hepatitis C virus replication[J]. Biochem Cell Biol, 2006, 84: 67–79. DOI:10.1139/o05-149 |
| [51] | Delang L, Paeshuyse J, Vliegen I, et al. Statins potentiate the in vitro anti-hepatitis C virus activity of selective hepatitis C virus inhibitors and delay or prevent resistance development[J]. Hepatology, 2009, 50: 6–16. DOI:10.1002/hep.22916 |
| [52] | Harris C, Herker E, Farese RV Jr, et al. Hepatitis C virus core protein decreases lipid droplet turnover:a mechanism for core-induced steatosis[J]. J Biol Chem, 2011, 286: 42615–42625. DOI:10.1074/jbc.M111.285148 |
| [53] | Jiang XB, Li YP, Li ZR. Research progress of HCV NS5A complex inhibitors[J]. Acta Pharm Sin (药学学报), 2016, 51: 1378–1387. |
 2019, Vol. 54
2019, Vol. 54


