2. 岛津企业管理有限公司, 上海 201206;
3. 北京中医药大学, 北京 100029
2. Shimadzu Co., LTD, Shanghai 201206, China;
3. Beijing University of Chinese Medicine, Beijing 100029, China
多糖作为天然化学成分的一个大类, 在自然界分布极广。来源于动物、植物以及微生物的中药材中几乎均含有多糖成分, 多数中药中的多糖成分被认为是活性成分之一。近些年来中药多糖的研究比较活跃, 其功效的发挥与结构有着紧密的联系, 其中多糖的相对分子质量及其分布是影响活性的关键指标之一[1, 2]。Yuan[3]研究表明, 不同相对分子质量分布的枸杞多糖在临床上观察发现, 只有相对分子质量在20 000左右的枸杞多糖对S180肿瘤和Lewi肺癌有较好的疗效。不同的多糖产生生物学活性有其最佳相对分子质量范围, 因此多糖研究中对相对分子质量及其分布的研究是非常重要和必要的[4]。在多糖中药制剂中, 相对分子质量更是体现其生产工艺和质量的重要参数。《中国药典》2015版二部中, 已将Mw及其分布列入多糖药物的质量标准[5], 如右旋糖酐及肝素钠注射液等。Mw大小成为多糖类药物质量控制和质量检测中的关键指标。
测定多糖相对分子质量的方法主要有黏度法、光散射法、渗透压法、高效凝胶色谱法(GPC)以及联用法等, 其中近些年最常用的是GPC法[6, 7]及GPC-MALLS[8-10]联用法。GPC法是根据在凝胶柱上不同相对分子质量的多糖与洗脱保留时间(tR)成一定关系的特性, 先用5或6个已知相对分子质量的标样制成标准曲线, 然后由样品的tR从曲线中求得相对分子质量。MALLS法测定分子量原理[11]是激光照射到样品时, 会在各个方向产生散射光, 在任何方向的光散射强度与相对分子质量和溶液的浓度成正比。MALDI-TOF-MS[12]适合于混合物及蛋白质等生物大分子的测定, 不需要对照品制作标准曲线, 具有灵敏、快速, 对杂质的包容性强, 分析质量范围大的特点。
黄芪多糖是中药多糖中研究最为活跃的产品之一, 并已获得广泛市场应用。其代表性制剂注射用黄芪多糖(国药准字Z20040086)主要用于提高机体免疫力、辅助治疗癌症、糖尿病等疾病, 药效明显, 有着非常广阔的应用前景。本课题组在前期研究中对其单糖组成、糖苷键连接及糖苷键构型等做了初步探索[13]。本实验采用上述3种方法对其相对分子质量进行测定, 并通过比较以明确注射用黄芪多糖的相对分子质量, 为质量标准提供参考, 亦为其他中药多糖制剂标准的制定提供有益借鉴。
材料与方法仪器 LC-20AD高效液相色谱仪-示差检测器(日本岛津公司), 18角度激光光散射仪(美国Wyatt公司), MALDI-TOF-MS 8020 (日本岛津公司), ViscoStar Ⅲ黏度检测器(美国Wyatt公司)。
试剂与供试品 右旋糖酐分子量对照品(S1)购于中国食品药品检定研究院(批号140637~646-201203), 右旋糖苷分子量对照品(S2)购于美国Polymer Standards公司。无水硫酸钠, 分析纯, 购于国药集团。注射用黄芪多糖由天津赛诺有限公司提供, 产品批号: 151201, 250 mg/瓶。
对照品溶液的制备 称取S1系列9个对照品, 重均分子量(MW)分别为: 180、2 700、5 250、9 750、13 050、36 800、64 650、13 5350、300 600, 用流动相溶解制成10 mg·mL–1的对照品溶液; 称取S2系列11个对照品, 重均分子量(MW)分别为180、500、3 000、21 000、44 000、72 000、123 000、325 000、530 000、820 000、3 755 000, 同法制成对照品溶液。
样品溶液的制备 取本品, 精密称定, 加流动相制成每1 mL约含10 mg的溶液, 作为供试品溶液。
凝胶色谱-示差检测器(GPC-RI)测定法 采用GPC-RI对相对分子质量及分布进行测定。色谱条件为:采用Shodex GS-620 HQ凝胶色谱柱(10 μm, 7.5 mm×30 cm), 流动相: 0.7%硫酸钠溶液, 流速: 0.6 mL·min-1, 柱温: 40 ℃, 进样量: 10 μL, 示差检测器温度: 40 ℃。
MALLS测定法 色谱条件同GPC-RI法, 检测器为RI与MALLS联用, MALLS激光波长658 nm, 石英玻璃样品池。MALLS 90°光电二极管检测器用甲苯校正, 其余角度二极管检测器采用MW = 3 000右旋糖酐对照品归一化, dn/dc值为0.138。
MALDI-TOF-MS测定法 采用MALDI-TOF-MS法对样品相对分子质量进行检测。将基质2, 5-二羟基苯甲酸及样品均配成10 mg·mL-1的水溶液, 等体积混合均匀, 采用滴液干燥法, 取混合液0.5 μL滴于靶上, 干燥后送入离子源测定。质谱条件为固体激光器频率200 Hz, 线性正离子模式, 谱图累加激光点400个, 分段扫描, 总分析扫描范围800~300 000。
结果 1 GPC-RI测定结果对S1、S2系列右旋糖酐对照品制备后进行分析。以对照品的LgMw为纵坐标, 以保留时间tR为横坐标, 通过GPC软件拟合三次方程标准曲线。2个系列对照品所得标准曲线方程分别为: S1: y = −9.331×10-3X3 + 0.368 0 X2 − 5.125 X + 30.03 (r2 = 0.999 7); S2: y = −5.469×10-3X3 + 0.195 8 X2 − 2.596 X + 17.86 (r2 = 0.994 8)。所得标准曲线图谱如图 1所示, 2个系列对照品的线性范围均符合实验要求。样品制备后进行分析, 所得注射用黄芪多糖的色谱图如图 1所示。
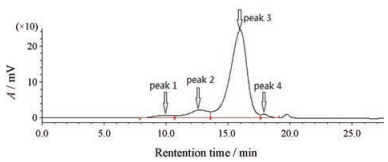
|
Figure 1 GPC-RI chromatogram for astragalas polysaccharides (APs) |
从图 1可看出, 样品依次呈现出4个分离较好的色谱峰, 保留时间范围为7.5~17.5 min。通过标准曲线方程对样品进行测定, 所得结果如表 1所示。在此计算过程未使用普适校正法Mark-Houwink方程。
| Table 1 Mw determination results of APs by GPC-RI-MALLS |
从表 1结果可看出, 注射用黄芪多糖的相对分子质量分布较为宽广, 两种对照品测定结果相对分子质量均为几百到百万范围。2个系列对照品测定结果有较大差异, 尤其是高分子量端峰1, 2种方法测定结果分别为: 3 127 000和1 380 000, 相对分子质量测定有较大差异, 这可能与对照品的线性范围有关。S1的最大相对分子质量为370 000, 本样品峰1相对分子质量已超出其线性范围, 故未对峰1进行计算。在采用MALLS法测定后发现S2结果与MALLS结果更加吻合, 故在讨论部分采用S2计算结果进行讨论。
2 MALLS测定结果经MALLS与RI联用测定所得色谱图如图 2所示, 为便于与RI结果对比, 将MALLS测定结果与RI对应分为4个峰。
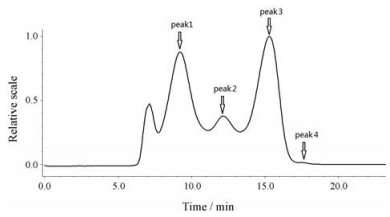
|
Figure 2 GPC-RI-MALLS chromatogram for APs |
由图 2可知, MALLS测定色谱图与示差色谱图分布基本一致, 其中MALLS图中7.5 min前的色谱峰由于示差信号极弱, 无法进行准确计算, 故与示差保持一致, 从7.5 min后色谱峰进行Mw计算。同时MALLS测定中峰4的信号也极弱, 计算误差大, 故只对峰1~3进行计算。最终测定的Mw、均方根旋转半径rz、分布系数等见表 2所示。
| Table 2 GPC-RI-MALLS determination results of APs |
通过表 2可看出, MALLS法共获得3个色谱峰的相对分子质量等信息, 其Mw测定结果与GPC-RI的检测结果趋势一致, 但相对分子质量大小有所差异, 其差异原因将在讨论部分阐述。峰3的均方根旋转半径未测得, 主要是由于MALLS法对于粒径小于10 nm的物质, 无法测得其粒径。
3 MALDI-TOF-MS测定结果MALDI扫描范围为500~300 000, 采用分段扫描模式, 其中在18 940和155 000附近出现较强信号峰, 与示差测定结果较为吻合。而低分子量段即5 000以下碎片较为丰富。200 000以上未检出明显信号峰, 可能是由于相对分子质量越大, 离子化愈加困难有关。除了解相对分子质量信息外, 由碎片离子峰亦可获得多糖结构信息。每个聚合度的黄芪多糖出现两个系列的规律性加合离子峰, 每组系列峰中相邻两峰之间的m/z值均相差162, 表明多糖单体的分子质量约为162 Da, 即糖残基单元为己糖。表 3列出了两组离子峰所对应的m/z值。第1组峰可能为环状己聚糖或己聚糖脱水后的加钠离子峰, 第2组峰为线形己聚糖的加钠离子峰[14]。结果表明注射用黄芪多糖样品中主要存在线形和环状结构的己聚糖, 这与文献[15]报道及本课题组前期研究结果一致。
| Table 3 Assignment of the ion peaks in MS spectrum of APs |
分别采用Shodex GS-620、Shodex KS-804, 以及Shodex SB-804等色谱柱对色谱条件进行优化, 结果见图 3所示。通过MALLS图对比发现: GS-620柱的分离度最佳, 最终确定Shodex GS-620柱作为分离柱。
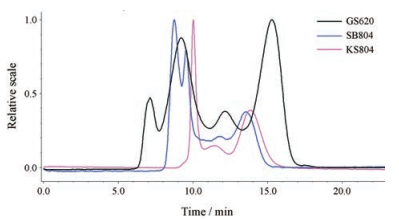
|
Figure 3 Optimization of GPC chromatographic column |
由于样品结构和对照品可能存在一定差异, 故尝试采用普适校正法对其进行校正。普适校正法原理即两种单分散高聚物在溶液中具有相同的流体力体积, 表现为: Mark-Houwink方程[η] = kMa。采用此方法测定必须得知聚合物Mark-Houwink方程中的常数a、k值。该常数可通过查阅手册和文献获得, 亦可在实验条件下对其进行测定。近些年关于中药多糖的相对分子质量研究中多采用GPC标曲法对相对分子质量进行测定, 但较少采用普适校正法, 此法在高分子材料中使用比较广泛[16, 17]。本研究中采用黏度仪对对照品和样品的特性黏度值分别测定, 测得对照品的a值为0.583, k值为0.042 55 mL·g-1, 与文献[18]报道基本一致。样品测定值见表 4所示, 代入GPC软件Mark-Houwink方程计算后所得结果如表 4所示, 并与未经校正的RI和MALLS法测定结果进行比较。
| Table 4 The result comparison of RI and MALLS |
从表 4可看出, 对于高相对分子质量部分, 比如峰1、峰2经过普适校正后其相对分子质量值更贴近于MALLS法测得结果, 说明采用对照品相对分子质量计算过程中, 由于峰1、峰2与采用对照品结构有一定差异, 而导致计算误差大。峰3经普适校正后的RI法测定结果更为准确。经方法相互验证和普适校正后, 注射用黄芪多糖样品4个峰的重均分子量分别为: 1 119 000、184 000、19 000、480。结合上述两部分结果, 表明在日常样品测定中, 同时用几种方法相互验证, 更有利于测定结果的准确性。当测定结果吻合时, 可证明结果的准确性, 可采用其中一种方法建立相应标准; 当测定结果存在较大差异时, 应进一步通过普适校正方式, 验证结果的准确性。
讨论重均分子量作为中药多糖及中药多糖制剂的一个关键参数, 其测定准确性对于质控标准的建立有重要意义。但中药多糖相对分子质量测定往往不同于高分子材料以及生物制品等, 其多表现出相对分子质量范围宽广, 峰分离不完全等特点, 故需通过多种方法验证以获得准确的结果。此研究也体现了中药多糖制剂测定的复杂性, 3种方法测定结果均存在一定差异。其中GPC-RI法是一种相对分子质量相对测定法, 需经普适校正才能得到准确的分子量结果。此法相对分子质量的计算主要依靠标准曲线, 即分子量对保留时间作图所得。样品在色谱柱上的保留时间不仅与其相对分子质量有关, 还与分子的空间结构相关。相对分子质量相同但空间结构不同, 表观尺寸差异很大, 会导致保留体积不同[19]。故测定的准确性与采用的对照品类型、相对分子质量范围都有较大关系。
MALLS是一种相对分子质量测定的绝对方法, 不依赖于标准物质, 无需做校正曲线, 且可获得样品在溶液状态下的部分构象信息。从MALLS法测得的α值可看出对照品与样品结构存在较大的差异。α值是由均方回旋半径对相对分子质量作图, 即Rg-M曲线的斜率值, α可用于推断多糖的结构形态。研究表明, α值在0.2~0.4之间时表明高分子为紧缩的球形构象, 在0.5~0.6之间时表示为无规则线团, 等于1时为刚性棒。通过MALLS测定S2对照品的α值为0.58, 而黄芪多糖各峰的α值均不同, 分别为: 0.67、1.11和0.53。其中峰1、峰2的α值与对照品S2表现出较大差异。故采用未经校正的标准曲线法计算可能会带来较大误差, 这也是导致RI与MALLS测定结果不一致的主要原因。另外, 据报道[20] MALLS法不适用于测定相对分子质量较低的物质, 分子质量越低(Mw < 104 g·mol-1), 用MALLS法测试误差越大, 可能是随着相对分子质量的减小, 影响测定的因素增多所致。
而MALDI-TOF-MS法既可提供相对分子质量结果又可获得部分结构信息, 用于推测其结构。但无法测得高分子量段信息如本样品大于200 000部分, 可能是随着相对分子质量的增大其离子强度降低的原因。故此3种方法结果不一致与其采用仪器原理和特点有关。
本研究通过采用3种相对分子质量常用测定方法GPC-RI、MALLS以及MALDI-TOF-MS法对注射用黄芪多糖相对分子质量进行测定, 并对测定结果进行比较。最终采用经普适校正后的GPC-RI法对注射用黄芪多糖进行测定。GPC-RI法作为一种相对分子质量测定法, 对照品与样品的结构相似性对于结果有很大影响, 有时需经过普适校正来获得准确结果; GPC-MALLS法作为一种相对分子质量的绝对测定法, 在不需要对照品的情况下可获得样品的相对分子质量及构象信息, 可作为一种有效的验证方法; 而MALDI-TOF-MS法无需对照品, 可提供相对分子质量及部分结构信息, 但对于相对分子质量较大的物质无法测定, 更适用于多糖单元结构信息的获取。在对中药多糖制剂进行相对分子质量研究或建立相应标准时, 可采用以上3种方法相互验证的方式, 对其结果进行确认, 以保证结果的准确性。本研究为多糖类制剂Mw测定方法的选择提供了参考, 也为注射用黄芪多糖质量标准的制定提供依据。
| [1] | Gao XR, Liu PX. Research on the structure-activity relationship of polysaccharides[J]. Chin Tradit Herb Drugs (中草药), 2004, 35: 229–231. |
| [2] | Tian LM, Qiu XM, Pan ZJ, et al. Development of a new HPLC technique for analyzing monosaccharide composition and its application in the quality control of Silybum marianum poly-saccharide[J]. Acta Pharm Sin (药学学报), 2010, 45: 498–504. |
| [3] | Yuan ZL. Lycium barbarum polysaccharides's production technique and determination of polysaccharides content along with molecular weight distribution[J]. Guangdong Chem Ind (广东化工), 2003, 30: 43–47. |
| [4] | Li JP. Discussion on relative molecular mass and distribution study of polysaccharide in active fraction of traditional Chinese medicines[J]. Chin J Pharm Anal (药物分析杂志), 2009, 29: 1768–1771. |
| [5] | Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. 2015 Ed. Vol Ⅱ. Beijing: China Medical Science Press, 2015: 169. |
| [6] | Yan J, Liu W, Wu XY, et al. Molecular weight determination and monosaccharide composition analysis of Bupleurum Chinense DC polysaccharide[J]. J Anhui Agric Sci (安徽农业科学), 2010, 38: 4550–4553. |
| [7] | Ye SD. Determination of molecular weight of Ganoderma lucidum polysaccharides and its monosaccharides components analysis[J]. J Instrum Anal (分析测试学报), 2015, 46: 51–54. |
| [8] | Chen TQ, Adilbekov J, Wang J, et al. Study on molecular characteristics of four components contained in Hedysari Radix polysaccharide by gel permeation chromatography multi angle laser light scatting technology[J]. China J Chin Mater Med (中国中药杂志), 2012, 37: 1798–1804. |
| [9] | Wu YL, Wang YL, Yang L. Application of SEC-RI-MALLS technique on the study of lentinan molecular weight and distribution[J]. Chin J Pharm Anal (药物分析杂志), 2011, 31: 2256–2259. |
| [10] | Ren LL, Qi X, Mo HB. Accurate measurement of molecular mass and molecular mass distribution of chitosan and its products by GPC laser light scatter method[J]. J Instrum Anal (分析测试学报), 2010, 29: 35–39. |
| [11] | Qin JQ, Huang SY. Determination methods of molecular weight of polysaccharides in traditional Chinese medicine[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2015, 21: 226–228. |
| [12] | Cheng AY, Zhu ZJ, Xv D. Determination of relative molecular weight of polysaccharides in Bletilla striata by MALDI-TOF-MS[J]. Chin Tradit Herb Drugs (中草药), 2008, 39: 817–820. |
| [13] | Wang Y, Wang Z, An JH, et al. Study on standardization method of Astragalus polysaccharide reference substance[J]. Chin Tradit Herb Drugs (中草药), 2017, 48: 4897–4901. |
| [14] | Hu P, Qiao WF, Wang F, et al. Research on the methods for relative molecular weight determination of polysaccharides from Ophiopogon japonicus[J]. Chin Tradit Pat Med (中成药), 2013, 35: 2684–2689. |
| [15] | Tang YW, Zhang Y, Wang YL, et al. Isolation and structure feature analysis of Astragalus polysaccharides[J]. Lishizhen Med Mater Med Res (时珍国医国药), 2014, 225: 1097–1100. |
| [16] | Cheng GW, Fan XD, Zhou ZY, et al. Determination of molecular weight of polyether glycol by size exclusion chroma-tography multi angle laser light scattering[J]. Polym Mater Sci Eng (高分子材料科学与工程), 2008, 24: 127–130. |
| [17] | Liu W, Li W, Li BG, et al. Determination and application of make-houwink constants of syndiotactic polystyrene[J]. Polym Mater Sci Eng (高分子材料科学与工程), 2003, 19: 187–189. |
| [18] | Brandrup J, Immergut EH, Grulke EA. Polymer Handbook[M]. 4th Ed. New York: John Wiley & Sons, 2001: 46. |
| [19] | Yang H. Isolation, Characterization of Polysaccharides from Ganoderma lucidum Fruiting Bodies and Correlation Analysis Chromatographic Fingerprint-immunocompetence (灵芝子实体多糖的分离分析及其免疫活性与色谱指纹图谱的相关性研究)[D]. Wuxi: Jiangnan University, 2015: 19-21. |
| [20] | Liu HT, Zhang CY, Yang R, et al. Research progress of determination methods for molecular mass and molecular mass distribution of polysaccharides excipients[J]. Chin J Pharm Anal (药物分析杂志), 2018, 38: 376–384. |
 2019, Vol. 54
2019, Vol. 54


