2. 中药制药过程新技术国家重点实验室, 江苏 连云港 222001
2. State Key Laboratory of New-tech for Chinese Medicine Pharmaceutical Process, Lianyungang 222001, China
独活为伞形科植物重齿毛当归(Angelica pubescens Maxim. F. biserrata Shan et Yuan)的干燥根[1], 其主要含有香豆素类、挥发油类, 以及少量甾醇和糖类等化学成分[2]。独活中的挥发油类成分主要为单萜和倍半萜及其衍生物[3], 香豆素类成分主要包括甲氧基欧芹素、香柑内酯、花椒毒素、伞形花内酯、佛手酚、欧芹烯酚、欧芹酚甲醚、二氢欧山芹醇、二氢欧山芹素、二氢欧山芹醇乙酸酯、异欧前胡素、补骨脂素等[4]。研究显示, 独活具有抗炎镇痛[5-7]、抗老年痴呆[8]、抗胃溃疡、抑菌、抗肿瘤和抗氧化等作用[2]。
为进一步明确中药材独活的物质基础, 为制定科学合理的质量控制方法提供依据, 并为其作用机制研究奠定良好基础, 本论文对独活醇提组分的化学成分进行了研究。采用Diaion HP-20大孔吸附树脂、Sephadex LH-20凝胶柱色谱、硅胶柱色谱和制备液相色谱等方法对独活醇提组分的化学成分进行分离纯化, 结果分离得到两个新倍半萜类化合物angesesquid A (1)和angesesquid B (2)。进一步研究发现, 化合物1和2都能明显抑制原代大鼠椎间盘软骨细胞中NO的释放, 但对PGE2的抑制作用不明显, 这说明它们一定程度上都能抑制炎症反应的发生。
结果与讨论 1 结构鉴定Angesesquid A (1, 图 1)为白色无定形粉末, HR-ESI-MS: m/z为305.136 8 [M+Na]+ (理论计算值为305.136 5), 说明其相对分子质量为282, 化合物分子式为C15H22O5, 不饱和度为5。其1H NMR谱显示4个甲基质子信号, 包括两个偕甲基δH 1.17 (3H, s, H-11)和δH 1.26 (3H, s, H-12), 1个与烯碳相连的甲基δH 1.96 (3H, s, H-14), 1个甲基单峰δH 1.35 (3H, s, H-13);同时, 还有两个连氧的次甲基质子信号δH 3.85 (1H, dd, J = 7.1 Hz, 6.1 Hz, H-9)和δH 4.62 (1H, m, H-7), 一个烯质子信号δH 5.90 (1H, s, H-5)。13C NMR谱和DEPT谱显示15个碳信号, 包括1个羰基碳δC 198.4 (C-4), 一对双键碳δC 126.2 (C-5)和δC 161.5 (C-6), 1个季碳δC 115.2 (C-2), 两个偕氧的季碳δC 84.4 (C-8)和δC 81.6 (C-3), 两个连氧的次甲基碳δC 76.5 (C-9)和δC 73.2 (C-7a), 1个次甲基碳δC 53.4 (C-3a), 2个亚甲基碳δC 37.0 (C-10)和δC 36.2 (C-7), 4个甲基碳δC 26.2 (C-11)、δC 23.2 (C-14)、δC 21.4 (C-12)和δC 20.0 (C-13)。综合上述质谱、1H和13C NMR谱, 可推测化合物1为一个倍半萜化合物, 其结构中存在3个环。
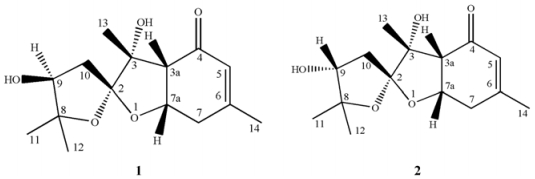
|
Figure 1 Structures of compounds 1 and 2 |
化合物1的1H-1H COSY谱中(图 2), 可观察到烯烃质子δH 5.90 (1H, s, H-5)与δH 1.96 (3H, s, H-14)、δH 2.65 (2H, t, J = 7.6 Hz, H-7)的相关, δH 2.65 (2H, t, J = 7.6 Hz, H-7)与δH 4.62 (1H, m, H-7a)的相关, δH 4.62 (1H, m, H-7a)与δH 2.81 (1H, d, J = 9.2 Hz, H-3a)的相关, δH 3.85 (1H, dd, J = 7.1, 6.1 Hz, H-9)与δH 2.57 (1H, dd, J = 14.4, 7.3 Hz, H-10)、δH 2.03 (1H, dd, J = 14.4, 6.0 Hz, H-10)的相关。化合物1的HMBC谱中(图 2), 烯质子δH 5.90 (1H, s, H-5)与δC 53.4 (C-3a)、δC 23.2 (C-14)、δC 36.2 (C-7)相关, δH 2.82 (1H, d, J = 9.2 Hz, H-3a)与δC 198.4 (C-4)、δC 73.2 (C-7a)、δC 36.2 (C-7)的碳相关, 表明结构中存在1个取代的环己烯酮片段。δH 1.96 (3H, s, H-14)与δC 161.5 (C-6)、δC 126.2 (C-5)和δC 36.2 (C-7)的HMBC相关也证明C-6位被甲基取代。此外, δH 1.35 (3H, s, H-13)与δC 53.4 (C-3a)、δC 81.6 (C-3)、δC 115.2 (C-2)相关, δH 2.03 (1H, dd, J = 14.3, 5.9 Hz, H-10a)与δC 115.2 (C-2)、δC 84.4 (C-8)、δC 76.5 (C-9)相关, δH 3.85 (1H, dd, J = 7.1, 6.1 Hz, H-9)与δC 115.2 (C-2)、δC 26.2 (C-11)相关, 证明了侧链的存在, 且环己烯酮的δC 53.4 (C-3a)与侧链的δC 81.6 (C-3)相连。综合以上信息, δC 84.4 (C-8)的季碳只有与δC 115.2 (C-2)的季碳通过氧相连并成环才合理, 同样的, δC 73.2 (C-7a)的次甲基碳只有与δC 115.2 (C-2)的季碳通过氧相连并成环才合理, 该化合物的平面结构确定。化合物1的NOESY谱(图 3), H-3a/H-7a、H-3a/H-13的Noe相关证明H-3a、H-7a和H-13在同侧, H-9/H-13相关证明H-9和H-13在同侧。由此化合物1的相对构型被确定(图 1)。该化合物的结构未见文献报道, 其碳和氢信号归属列于表 1。
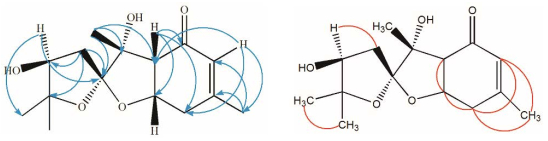
|
Figure 2 Key HMBC (  |
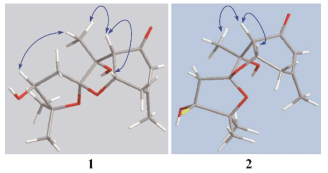
|
Figure 3 Key NOESY ( |
| Table 1 1H NMR (400 MHz) and 13C NMR (100 MHz) data of compounds 1 and 2 (CD3OD, δ in ppm, J in Hz) |
Angesesquid B (2, 图 1)为白色无定形粉末, HR-ESI-MS: m/z为305.136 8 [M+Na]+ (理论计算值为305.136 5), 说明其相对分子质量为282, 化合物分子式为C15H22O5, 不饱和度为5。化合物2的13C NMR (100 MHz, CD3OD)和DEPT与化合物1相似, 具有15个碳信号, 其中1个羰基碳信号δC 198.3 (C-4), 一对双键碳δC 126.2 (C-5)、δC 161.4 (C-6), 1个季碳δC 114.7 (C-2), 两个偕氧的季碳信号δC 84.1 (C-8)、δC 81.8 (C-3), 两个连氧的次甲基碳信号δC 76.2 (C-9)、δC 73.0 (C-7a), 1个次甲基碳δC 53.7 (C-3a), 2个亚甲基碳δC 38.1 (C-10)、δC 36.2 (C-7), 4个甲基碳δC 27.3 (C-11)、δC 23.2 (C-14)、δC 21.4 (C-12)、δC-13 20.0 (C-13)。化合物2的1H NMR (400 MHz, CD3OD)与化合物1相似, 具有4个甲基质子信号:两个偕甲基δH 1.11 (3H, s, H-11)、δH 1.28 (3H, s, H-12), 1个连在烯碳上的甲基δH 1.96 (3H, s, H-14), 1个单峰甲基δH 1.40 (3H, s, H-13); 1个烯质子信号δH 5.90 (1H, s, H-5); 1个连氧的次甲基质子信号δH 4.62 (1H, m, H-7a); 化合物2的1个连氧的次甲基质子信号δH 4.17 (1H, dd, J = 7.8, 7.0 Hz, H-9)与化合物1的一个连氧的次甲基质子信号δH 3.85 (1H, dd, J = 7.1, 6.1 Hz, H-9)不同, 可能是相对构型不同。1H-1H COSY和HMBC谱(图 4)表明其平面结构和化合物1相同, 其全部的碳和氢信号归属见表 1。NOESY谱中(图 3), 化合物1能明显看到H-9/H-13的相关, 而化合物2无此相关, 证明化合物2的9-OH构型与化合物1相反。化合物2的相对构型被确定(图 1)。其结构也未见文献报道, 碳和氢信号归属列于表 1。
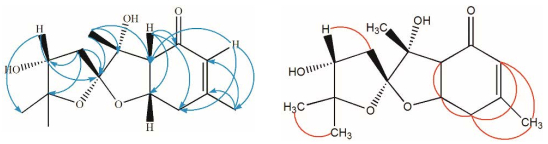
|
Figure 4 Key HMBC (  |
采用原代大鼠椎间盘软骨细胞体外炎症模型对化合物进行抗炎活性评价。结果显示, 化合物1和2对该体外炎症模型细胞的增殖均无明显影响(表 2), 它们都能明显抑制NO的释放(表 3), 但对PGE2的释放无明显抑制作用。上述结果说明化合物1和2能一定程度上抑制炎症反应的发生。
| Table 2 Effects of compounds on the growth of primary rat intervertebral disc chondrocytes |
| Table 3 Effects of compounds on production of NO and PGE2 in 1L-1β-stimulated cells. ***P < 0.001 vs model; ###P < 0.001 vs control |
Waters Snapt G2质谱仪; Bruker AV-300/400超导核磁共振波谱仪; Agilent 1260分析型高效液相色谱仪和Agilent 1260制备型高效液相色谱仪; Agilent RRHD SB-C18 (2.1 mm×100 mm, 1.8 μm)色谱柱和Ultimate XB-C18 (250 mm×21.2 mm, 5 μm), 上海月旭科技股份有限公司; 超净工作台(SW-CJ-2F, 苏州安泰空气技术有限公司, 中国); 二氧化碳培养箱(Thermo scientific 3100, Thermo Fisher Scientific, 美国); 倒置显微镜(CKX41SF, OLYPÌS, 日本); 酶标仪(Spectra Max 340 PC, Molecular Devices, 美国); 立式压力蒸气灭菌锅(BXM-30R, 上海博讯实业有限公司医疗设备厂, 中国); 离心机(LD4-2A, 北京众益中和生物技术有限公司, 中国); 细胞自动计数仪(Cl028, Invitrogen, 美国); 移液枪(Eppendorf, 德国); 96孔细胞培养板、细胞培养瓶购自于美国Costar公司; Diaion HP-20大孔吸附树脂购自日本三菱; 柱色谱硅胶(200~300目)购自于青岛海洋化工公司; 薄层色谱硅胶预制板购自青岛海洋化工公司; Sephadex LH-20柱色谱填料购自瑞典Pharmacia公司; 色谱纯乙腈、甲醇购自于瑞典Oceanpak公司; 食用级95%乙醇购自连云港长和酒业有限公司; 氘代试剂购自美国CIL公司; DMEM (Dulbecco's modified Eagle medium)培养基、胎牛血清(fetal bovine serum, FBS)、青霉素及链霉素均购自于美国Gibco公司; 二甲基亚砜(DMSO)购自于美国Sigma公司; CCK-8试剂盒购自于上海贝博生物公司; NO、PGE2检测试剂盒购自于碧云天生物技术研究所; SD大鼠, 雄性, SPF级, 体重260~300 g, 由上海西普尔-必凯实验动物有限公司提供, 许可证号: SCXK (沪) 2008-0016, 动物饲养于屏障环境中, 12/12 h明暗交替, 温度22~25 ℃, 相对湿度50%~60%, 动物自由进食饮水, 适应7天后开始实验。
中药材购自安徽亳州药材市场(产地甘肃, 批号20170911), 由连云港康济大药房连锁有限公司吴舟执业药师鉴定为独活(Radix Angelicae Pubescentis)。药材留样(编号:独活20170911)现保存江苏康缘药业股份有限公司现代中药研究院中药组分库。
1 提取与分离独活药材10 kg经300 L、75%乙醇提取2次, 合并2次提取液, 70 ℃减压浓缩得350 g醇提浸膏。醇提浸膏经硅胶柱色谱分离、梯度洗脱[二氯甲烷-甲醇(100:0; 100:1; 100:2; 100:4; 100:10; 100:50; 100:100; 0:100, v/v)]得到8个组分(Fr.1~Fr.8)。其中组分Fr.5经Saphadex LH-20柱色谱, 甲醇洗脱得到18个组分(Fr.5-1~Fr.5-18), 其中Fr.5-(6~7), 经制备液相色谱等度洗脱[乙腈-水(35:65, v/v)]得到的4个组分[Fr.5-(6~7)-1~Fr.5-(6~7)-4], 其中Fr.5-(6~7)-3再经制备液相色谱等度洗脱[乙腈-水(30:70, v/v)]得到化合物1 (15 mg, tR = 35 min), 其中Fr.5-(6~7)-4再经制备液相色谱等度洗脱[乙腈-水(30:70, v/v)]得到化合物2 (18 mg, tR = 40 min)。
2 CCK-8法检测细胞增殖[9]取对数生长期的原代大鼠椎间盘软骨细胞, 用0.25%胰酶-0.02% EDTA消化约2 min后, 弃胰酶, 加入含10% FBS的DMEM培养基中和胰酶作用, 轻轻吹打使成单细胞悬液, 离心弃上清, 用完全培养基重悬细胞并计数, 调整细胞悬液至每毫升1×105个细胞, 按每孔200 μL接种至96孔培养板, 37 ℃、5% CO2条件下培养24 h, 吸弃上清, 每孔加入100 μL无血清DMEM培养基饥饿24 h使其同步化, 吸弃上清, 按实验需要分为对照组、化合物组, 并给予相应药物, 继续培养24 h, 提前4 h每孔加入10 μL CCK-8, 4 h后于酶标仪450 nm波长处检测吸光度值(A450)。实验重复3次, 每组设3个复孔。
3 Griess法测定细胞上清中NO[10]取对数生长期细胞以每毫升1×105个细胞的浓度接种于96孔培养板, 每孔200 μL, 于37 ℃、5% CO2细胞培养箱中培养24 h。吸弃上清, 每孔加入100 μL无血清DMEM培养基饥饿24 h使其同步化, 吸弃上清后, 对照组给予无血清培养基100 μL, 模型组给予用无血清培养基配制的IL-1β 100 μL (终质量浓度为10 µg·L-1), 化合物组给予含10 µg·L-1 IL-1β (终质量浓度)无血清培养基配制的药液100 μL (终浓度为50 µmol·L-1), 37 ℃、5% CO2细胞培养箱中继续培养24 h。取上清50 μL, 检测炎症因子NO。对炎症因子NO有明显抑制作用的化合物将进一步检测炎症因子PGE2。实验重复3次, 每组实验设3个复孔。
4 统计分析方法采用SPSS 19.0统计软件进行分析, 实验结果以x ± SD表示, 组间比较采用单因素方差分析, 组内两两比较采用LSD检验。P < 0.05为差异有显著性, P < 0.01为差异有非常显著性, P < 0.001为差异有极显著性。
| [1] | Chinese Pharmacopoeia Committee. Pharmacopoeia of the People's Republic of China (中华人民共和国药典·一部)[M]. Part 1. Beijing: China Medical Science Press, 2015: 263-264. |
| [2] | Li ZY, Zhang HP. Aldose reductase and inflammatory diseases[J]. China Mod Med (中国当代医药), 2012, 5: 17–18. |
| [3] | Lin L, Qian XP, Liu BR, et al. Research progress on the chemical constituents and the anti-tumor activity of Angelica pubescens[J]. J Mod Oncol (现代肿瘤医学), 2011, 19: 373–376. |
| [4] | Ding XF, Feng X, Dong YF, et al. Studies on chemical constituents of the roots of Angelica pubescens[J]. J Chin Med Mater (中药材), 2008, 31: 516–518. |
| [5] | Qiu JB, Xu Q, Jiang XH. Effects of ethanol extract of Angelicae Pubescentis Radix on cyclooxygenase[J]. China Med Her (中国医药导报), 2011, 32: 42–43. |
| [6] | Fan L, Li L, He HF, et al. Pharmacological studies on anti-inflammatory and analgesic effects of Radix Angelicae Pubea-scentis's volatile oil[J]. Anhui Med Pharm J (安徽医药), 2009, 13: 133–134. |
| [7] | Wang AW, Liu Y, Luo Q, et al. Study on pharmacodynamics of analgesia and anti-inflammation of Duhuo-Jisheng Tang[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2018, 24: 61–64. |
| [8] | Du JG, Gao SS, Wang C, et al. Duhuo's effect on the positioning navigation ethology of the AD model rat[J]. Liaoning J Tradit Chin Med (辽宁中医杂志), 2009, 36: 144–145. |
| [9] | Liu YQ, Zhong KH, Wang YL, et al. Comparison of experi-mental conditions of CCK-8 and MTS for human amniotic epithelial cells proliferation assay[J]. Chin J Rehabil Theory Pract (中国康复理论与实践), 2012, 18: 827–830. |
| [10] | Pan SY, Pan XW, Wang SP. The relationship between the protection of ginsenoside for spinal cell and nitric oxide[J]. China J Chin Mater Med (中国中药杂志), 2003, 28: 851–853. |
 2019, Vol. 54
2019, Vol. 54


