2. 中国医学科学院、北京协和医学院药物研究所, 神经科学中心, 天然药物活性物质与功能国家重点实验室, 北京 100050
2. State Key Laboratory of Bioactive Substances and Functions of Natural Medicines, Neuroscience Center, Institute of Materia Medica, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
肝纤维化是一种严重影响人们生活质量的疾病, 是肝硬化和肝癌早期的重要病理特征[1]。肝纤维化因其发病率高、治愈率低和致死率高日益受到重视[1-3]。肝纤维化主要由肝病毒感染、酗酒、胆汁淤积和代谢紊乱等因素引发的慢性病[1, 4]。细胞外基质(extracellular matrix, ECM)合成与降解失衡, 导致ECM过度沉积是引发肝纤维化主要的原因。肝星形细胞(hepatic stellate cells, HSCs)的激活在肝纤维化中发挥了关键性作用[5]。目前, 无有效可逆转肝纤维化的药物。
人参皂苷Rg1是一种四环三萜类皂苷, 许多中草药含有Rg1。药理学研究表明, Rg1具有抗氧化、抗凋亡、抗炎、抗肿瘤和抗疲劳等作用[6, 7]。人参皂苷Rg1在多种肝脏疾病中具有广泛的药理作用[8]。先前的研究表明, Rg1对脂肪肝、酒精肝炎和药物性肝损伤具有强效作用[8-12]。Rg1可介导核因子红系2相关因子2 (nuclear factor erythroid 2 related factor 2, Nrf2)信号通路抵抗酒精等因素引发的氧化应激。另外, Rg1通过其他多种途径抵抗四氯化碳(CCl4)等因素诱发的肝炎和肝纤维化[13-17]。但是, Rg1对胆汁淤积诱导的肝纤维化的作用尚未见报道。
本研究采用胆总管结扎(BDL)的方法制备胆汁淤积性肝纤维化模型[18], 在此基础上, 通过灌胃给予人参皂苷Rg1的方法评价其对BDL诱导的肝纤维化的治疗作用, 同时观察Rg1在此模型中对VCAM-1的表达影响, 进一步探究VCAM-1在此模型肝纤维化过程中表达变化规律, 并探讨Rg1对肝纤维化治疗相关的作用机制, 为将Rg1开发成有效的肝纤维化治疗药物提供理论依据。
材料与方法动物 雄性C57 BL/6J小鼠(8周, 体重22~24 g), 购自北京斯贝福生物技术有限公司[清洁级, 合格证号: SCXK (京) 2016-0002], 饲养于中国医学科学院药物研究所动物房。所有动物实验都获得单位伦理学委员会批准。实验动物在明暗交替(12 h:12 h)的清洁级动物房中饲养, 自由进食饮水, 预适应环境7天。
药品与试剂 人参皂苷Rg1购自云南极粹生物科技有限公司, 纯度 > 98%;异氟烷(瑞沃德实验技术有限公司); DAPI、AlexaFluor 546标记驴抗兔抗体(Life Technology公司); NF-κB p65抗体、增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)抗体(美国Santa Cruz公司); 白细胞介素-1β (interleukin 1β, IL-1β)抗体、肿瘤坏死因子α (tumor necrosis factor-alpha, TNF-α)抗体、VCAM-1抗体、髓过氧化物酶(myeloperoxidase, MPO)抗体和α平滑肌动蛋白(alpha smooth muscle actin, α-SMA)抗体(Abcam公司); 谷丙转氨酶(alanine transaminase, ALT)试剂盒、谷草转氨酶(aspartate transaminase, AST)试剂盒、总胆汁酸(total bile acid, TBA)试剂盒和总胆红素(total bilirubin, T.Bili)试剂盒(中生北控生物科技有限公司); P1200核蛋白和胞浆蛋白提取试剂盒、RIPA裂解液、ECL超敏发光液(北京普利莱基因技术有限公司); 其他相关试剂购自北京化工厂。
胆总管结扎模型的建立 将小鼠分成两批进行实验:第1批进行胆总管双结扎, 随机分为假手术组、BDL-1d组、BDL-3d组、BDL-7d组和BDL-14d组(分别在胆总管双结扎后的第1、3、7和14天进行取材), 经过禁食不禁水12 h。采用异氟烷吸入性麻醉后, 将小鼠仰卧于手术台上, 头部放置通有异氟烷的小鼠面罩, 以便手术中持续麻醉小鼠, 医用胶条固定其四肢, 75%酒精消毒。在剑突处下方正中切口, 长约1.5 cm左右, 打开腹腔后找到胆总管, 过程中注意避免伤及肝脏和胰腺等, 游离出胆总管后, 用手术缝合线在近十二指肠端和靠近肝脏端双重结扎, 然后依层复位, 缝合手术切口, 碘酊消毒后常规饲养。假手术组不进行结扎, 其余操作同胆总管双结扎的模型组。手术后先将小鼠放置于温控毛毯上, 待小鼠苏醒。第2批小鼠也随机分为假手术组、BDL-14d组和Rg1 (40 mg·kg-1)治疗组。小鼠经过胆总管结扎后, 1天1次进行灌胃给药。假手术组和BDL-14d组以同样的方式给予生理盐水, 治疗组每天通过灌胃给药方式给予Rg1 (40 mg·kg−1), 每天观察小鼠状态, 连续给药14天, 禁食不禁水12 h后进行取材。
血清生化指标检测 将血浆室温静置2 h后进行离心, 常规分离血清, 利用全自动生化分析仪测定小鼠血清中ALT、AST、TBA和T.Bili含量。
肝脏病理切片 小鼠麻醉后固定, 用常规浓度磷酸缓冲盐溶液(phosphate buffer saline, PBS)经心脏灌流, 至肝脏白色, 换4%多聚甲醛灌流5 min, 取小鼠肝脏固定于4%多聚甲醛24 h以上, 石蜡切片脱蜡水化, 进行苏木素-伊红染色(苏木素染细胞核, 伊红染细胞质), 脱水封片, 显微镜镜检, 图像采集分析。
Sirius red染色 石蜡切片脱蜡至水。天狼猩红染色液染色:切片入饱和苦味酸天狼猩红染色液内染色8 min。漂洗:切片入无水酒精漂洗数分钟, 显微镜下观察满意为止。封片:切片于60 ℃烤箱烤干后于二甲苯透明5 min, 中性树胶封片。显微镜镜检, 图像采集分析。
Masson染色 石蜡切片脱蜡至水, 苏木素染细胞核, 丽春红染色, 磷钼酸处理, 苯胺蓝染色, 分化, 脱水中性树胶封片, 显微镜镜检, 图像采集分析。
免疫组化 检测肝脏中VCAM-1表达情况。主要的操作步骤:石蜡切片经二甲苯和酒精梯度脱蜡, 抗原修复, 透化打孔(0.5% Triton X-100室温孵育10 min), 灭活10 min (3% H2O2), 5% BSA室温封闭45 min, 将VCAM-1抗体溶液1:200 (3% BSA+PBS)加于切片上, 4 ℃孵育过夜, PBS漂洗5 min×3次, 二抗羊抗兔1:200, 室温孵育120 min, PBS漂洗5 min×3次, DAB试剂盒显色, 适当时终止显色, 脱水封片, 显微镜下观察, 采集图像。
免疫荧光 检测肝脏内中性粒细胞(MPO阳性细胞)数目的变化情况。具体操作步骤:石蜡切片脱蜡, 抗原修复, 透化打孔(0.5% Triton X-100室温孵育10 min), 5% BSA室温封闭45 min, 将MPO抗体溶液1:200 (3% BSA+PBS)滴加于切片上, 4 ℃孵育过夜, PBS漂洗10 min×3次, 免疫荧光二抗(AlexaFluor 546标记驴抗兔抗体1:500, Hochest 33342 1:1 000)室温避光孵育1 h, PBS漂洗10 min×3次, 90%甘油封片, 荧光显微镜下观察, 采集图像。
Western blot 小鼠安乐处死, 分离并取出肝脏, 总蛋白提取, 液氮速冻后加入含有蛋白酶抑制剂的RIPA裂解液超声破碎, 离心取上清液, BCA法蛋白定量, 加入上样缓冲液, 沸水中15 min, -20 ℃保存。根据胞浆胞核蛋白提取试剂盒说明书提取核内蛋白。蛋白上样量为40 μg, 具体步骤:配制聚丙烯酰胺凝胶, 电泳, 将蛋白转印至PVDF膜, 用封闭液3% BSA封闭2 h, 一抗(VCAM-1、IL-1β、TNF-α、NF-κB p65、PCNA、α-SMA、β-actin) 4 ℃孵育过夜, PBST漂洗10 min× 3次, 二抗室温孵育2 h, PBST漂洗10 min×3次, 加入ECL超敏发光液显影。用Quantity one分析软件对蛋白条带进行灰度分析。
Real-time PCR分析 小鼠安乐处死, 分离并取出肝脏, 液氮速冻后加入Trizol试剂提取肝脏组织中总RNA、总RNA的纯度分析及含量计算, 经逆转录得到cDNA, 获得的cDNA保存于-20 ℃。实时荧光定量PCR检测, 检测指标VCAM-1。
统计学分析 实验数据采用x± s表示, 实验结果用Graphpad Prism 6软件进行统计分析。数据多组间比较采用方差分析(one-way ANOVA)进行统计分析; 两两比较采用t检验, 当P < 0.05, 则有显著性差异。
结果 1 BDL诱导小鼠肝纤维化过程中肝损伤和肝功能随胆总管结扎时间延长而加重如图 1a所示, 分别对每组小鼠的肝组织进行了苏木精-伊红染色(hematoxylin-eosin staining, H & E)。正常小鼠肝小叶结构清晰, 肝细胞形态完整。BDL诱导的模型组小鼠肝组织可见大量炎性细胞浸润、显著的空泡样病变、肝细胞坏死及明显的胆汁淤积现象, 并随BDL时间的延长而加重。另外, BDL对小鼠肝功能产生严重影响, 随着BDL造模时间的延长, 模型组小鼠的肝功能明显受到损伤, 小鼠血清中AST和ALT测定结果见图 1b, c。BDL造成胆汁淤积现象, 随着造模时间延长而加重, 如图 1d, e所示, 总胆汁酸(TBA)和总胆红素(T.Bili)随造模时间延长而升高。此外, 本研究分别对每组小鼠的肝组织进行了Sirius red染色和Masson染色, 结果见图 1f, 假手术组小鼠肝几乎没有胶原纤维, BDL诱导的模型组小鼠肝组织中胶原纤维随胆总管结扎时间延长而增加, 胶原纤维结缔组织大量增生沉积, 形成宽大致密的汇管区-中央静脉纤维间隔和假小叶。与假手术组相比, BDL-7d组胶原基质沉积有明显差异, 而BDL-14d组肝组织Sirius red染色和Masson染色的阳性面积显著增加。这些指标表明BDL诱导的胆汁淤积性肝损伤模型是成功的。

|
Figure 1 Aggravation of liver function and collagen fibers with prolonged time during bile duct ligation (BDL)-induced fibrosis. a: Representative HE staining results of BDL mice. b-e: Representative serum biochemical parameters of BDL mice. b: Aspartate transaminase (AST); c: Alanine transaminase (ALT); d: Total bile acid (TBA); e: Total bilirubin (T.Bili). Liver tissue sections are semi-quantitatively analyzed for the positive areas of collagen fiber staining. f: Sirius red staining and Masson staining. n = 6, x± s. *P < 0.05, **P < 0.01, ***P < 0.001 vs sham group. Original magnification, 100× |
如图 2a所示, H & E染色发现人参皂苷Rg1 (40 mg·kg-1)对胆汁淤积性肝损伤具有保护作用, 可保护肝细胞组织结构。BDL导致小鼠肝组织肿胀、点状坏死和融合性坏死、大量炎性细胞浸润及胆汁淤积现象。Rg1治疗后可缓解这些病理改变。通过14天造模和给药后, 取血清检测AST、TBA、T.Bili和ALT水平的改变(图 2b~e)。由图可见, BDL导致这些血清生化指标显著升高(P < 0.001), Rg1可降低这些指标, 但未能降低至正常水平。与模型组相比, Rg1 (40 mg·kg-1)组可显著降低AST、ALT和T.Bili水平, 而TBA水平有所下降, 但无显著性差异。综上, 人参皂苷Rg1能够减轻BDL诱导的胆汁淤积性肝损伤, 并改善肝功能。

|
Figure 2 Protective effect of Rg1 on histopathological changes and serum parameters. a: Representative liver histology of mice by H & E staining. The abnormal elevations of AST, ALT, TBA and T.Bili were reversed by the treatment of Rg1 (40 mg·kg-1). b: AST; c: TBA; d: T.Bili; e: ALT. n=4-6, x± s, ***P < 0.001 vs sham group; #P < 0.05, ##P < 0.01 vs BDL-14d group. Original magnification, 40× |
本研究结果显示, 人参皂苷Rg1能明显缓解BDL诱导的胆汁淤积性肝纤维化。分别对假手术组、BDL-14d组和给药组Rg1 (40 mg·kg-1)的肝组织切片进行了Masson染色和Sirius red染色, 结果见图 3。在图 3a, c中, 假手术组小鼠肝组织中几乎没有胶原纤维沉积, BDL诱导的模型组小鼠肝中胶原纤维结缔大量增生沉积, 主要分布在汇管区和坏死区域, 40 mg·kg-1 Rg1组可减轻肝纤维化程度, 减少Masson染色和Sirius red染色阳性面积。如图 3b, d所示, 分别是Masson染色和Sirius red染色的阳性面积量化结果。活化的HSC细胞是ECM主要的来源[19], 而α-SMA是HSC细胞活化的标记物。如图 3e, f所示, 与BDL-14d组相比, 40 mg·kg-1 Rg1组可降低肝脏中α-SMA蛋白的表达水平, 抑制HSC细胞的活化。

|
Figure 3 Rg1 effectively ameliorated BDL-induced liver fibrosis. Liver tissue sections are semi-quantitatively analyzed for the positive areas of collagen fiber staining; Positive areas of Masson staining and Sirius red staining in BDL-14d group was significantly increased compared with sham group, while the Rg1 (40 mg·kg-1) group was significantly reduced comparing with the BDL-14d group. Rg1 inhibited expression level of α-SMA in BDL-induced mice. a: Masson staining; b: Quantitative results corresponding to Masson staining; c: Sirius red staining; d: Quantitative results corresponding to Sirius red staining; e, f: Western blot analysis of α-SMA in liver tissue. n=4-6, x± s. *P < 0.05, ***P < 0.001 vs sham group; #P < 0.05, ##P < 0.01 vs BDL-14d. Original magnification, 40× |
黏附分子在肝炎和肝纤维化中扮演了重要角色, 慢性肝炎患者的肝脏中黏附分子被上调[20]。本研究分析Rg1对BDL诱发肝纤维化中VCAM-1的影响。首先发现, VCAM-1在BDL诱导的肝纤维化过程中呈现一种动态变化(图 4a, b)。免疫组织化学(图 4a)显示, VCAM-1主要表达在肝组织坏死区的肝细胞、血管内皮细胞和胆管上皮细胞, 诱导白细胞跨过上皮和内皮向炎症部位聚集, 加剧炎症反应。与假手术组相比, BDL造模后第1天VCAM-1表达上调, 到第7天VCAM-1的表达达到高峰, 第14天表达略有下调。采用qPCR方法, 对各组肝组织中VCAM-1 mRMA水平进行检测, 结果(图 4b)显示, BDL诱导的肝纤维化过程中VCAM-1 mRNA表达水平与蛋白水平一致。另外, 给予Rg1后降低VCAM-1的表达。如图 4c, d所示, 与假手术组相比, VCAM-1在BDL-14d组肝组织中表达升高, 40 mg·kg-1 Rg1可显著降低VCAM-1的蛋白水平。免疫组织化学显示, 40 mg·kg-1 Rg1也减轻肝损伤, 并缓解炎性细胞的聚集(图 4c)。为进一步研究人参皂苷Rg1对VCAM-1的调控机制, 本研究检测了VCAM-1的上游NF-κB的活化情况。对3组实验小鼠的肝组织细胞核中NF-κB的含量进行检测发现, 与假手术组相比, BDL-14d组肝组织细胞中NF-κB入核显著增加, 而Rg1 40 mg·kg-1组可明显降低细胞核内NF-κB的含量(图 4e, f)。这提示Rg1可抑制NF-κB信号通路的活化, 下调VCAM-1的表达, 抑制炎症反应, 从而减轻肝纤维化。

|
Figure 4 Dynamic changes of VCAM-1 during BDL-induced liver fibrosis and activation of the NF-κB signaling pathway inhibited by Rg1. Rg1 (40 mg·kg-1) inhibits the activation of NF-κB signaling pathway, down-regulates the expression of VCAM-1, andinhibits the inflammatory response, thereby reducing liver fibrosis. a: Immunohistochemistry results of VCAM-1 staining; b: Quantitative analysis of VCAM-1 by qPCR; c and d: Inhibitory effect of Rg1 on VCAM-1 level determined by immunohistochemistry and Western blot in BDL-induced mice. e and f: Inhibitory effect of Rg1 on nucleus NF-κB level determined by Western blot in BDL-induced mice. n=4-6, x± s. *P < 0.05, **P < 0.01, ***P < 0.01 vs sham group; #P < 0.05 vs BDL-14d group. Original magnification, 100× |
VCAM-1可介导白细胞向炎症部位聚集, 而上述结果表明Rg1可降低VCAM-1表达。本文检测了肝脏中性粒细胞浸润情况。结果显示, Rg1可显著减少受损后肝脏组织中性粒细胞浸润。如图 5a所示, 与假手术组相比, BDL-14d组肝组织中MPO阳性细胞显著增多, 40 mg·kg-1 Rg1组可明显降低MPO阳性细胞数, 这可能与其降低VCAM-1的表达相关。然后, 采用Western blot方法, 对肝纤维化组织中IL-1β和TNF-α的蛋白水平进行检测, 如图 5b, c所示, 与假手术组相比, BDL-14d组的肝组织中两者含量显著上升, 40 mg·kg-1 Rg1组可有效地降低损伤肝组织内IL-1β和TNF-α的含量。说明Rg1抑制炎性细胞浸润, 降低炎性因子的含量, 减轻炎症反应。
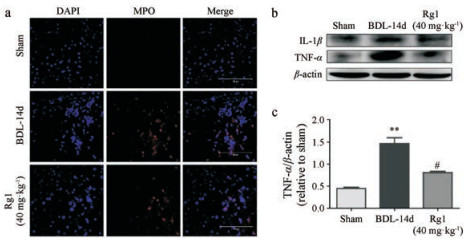
|
Figure 5 Attenuation of hepatitis and liver fibrosis induced by Rg1 in BDL-induced liver fibrosis mice. a: Representative MPO staining results of BDL-induced mice treated with Rg1; b, c: Inhibitory effect of Rg1 on pro-inflammation cytokines levels, including IL-1β and TNF-α by Western blot. n=4-6, x± s. **P < 0.01 vs sham group; #P < 0.05 vs BDL-14d group. Scale bar=100 μm |
肝纤维化的高发病率和高致死率给社会带来沉重的负担, 因而引发全世界广泛关注。然而, 目前临床上无有效的可治愈肝纤维化的药物, 开发有效治疗肝纤维化药物迫在眉睫。肝纤维化是肝硬化和肝癌早期的病理特征, 是由慢性肝损伤所引发[19]。人参皂苷Rg1是一种具有广泛药理活性天然产物, 在体内外和临床研究中发现, Rg1对酒精性肝损伤[9, 10]、药物性肝损伤[11]、CCl4诱导的肝损伤[14]和肝衰竭都有护肝作用[8]。但是Rg1在胆汁淤积性肝纤维化中的研究却很少见。在本文中, 通过BDL建立胆汁淤积性肝纤维化模型, 研究发现Rg1降低BDL诱导的慢性肝损伤中AST、ALT、TBA和T.Bili水平, 改善肝功能和缓解胆汁淤积现象, 可见Rg1预防BDL诱导的慢性肝损伤具有良好的效果。Rg1明显降低MPO阳性细胞数, 减少中性粒细胞浸润肝脏, 降低IL-1β和TNF-α的蛋白水平, 缓解炎症反应。同时, Rg1减少此模型小鼠肝脏中α-SMA的表达, 抑制HSC的活化, 从而缓解肝纤维化。深入研究发现, Rg1显著抑制BDL诱导的肝纤维化肝脏中VCAM-1的表达, 并抑制细胞核中NF-κB蛋白水平的升高, 因而Rg1可能通过抑制NF-κB/VCAM-1信号通路, 进而减少炎性细胞浸润肝脏, 缓解BDL诱导的肝纤维化。由于前期报道发现Rg1治疗肝损伤的有效剂量为10~160 mg·kg-1 [8, 9, 14], Rg1治疗缺血性脑损伤的有效剂量也在此范围[21]。因而, 本文选用了40 mg·kg-1剂量对胆汁淤积性肝纤维化进行实验。
前期研究表明, Rg1可改善化学性等外源性物质诱发的肝损伤和血清生化指标。其最主要是由于Rg1的抗氧化活性, 通过调控Keap1-Nrf2-ARE信号通路[8-11, 14]。但是Rg1对BDL导致的胆汁淤积性肝纤维化的影响尚未见报道。BDL诱发的肝病可良好地模仿胆汁淤积性肝病。BDL引发胆汁排泄受阻, 严重造成肝内胆管血管损伤, 如胆管扩张、血管内溶血, 管壁通透性升高, 甚至导致肝纤维化和肝硬化[22]。本文研究了Rg1对BDL诱导的肝纤维化的影响, 发现长期给予Rg1可以有效改善AST和ALT, 能有效地抵抗胆汁淤积诱发的肝损伤。
慢性炎症驱动肝纤维化的进程[23]。因而抗炎治疗可有效地削弱这种驱动力, 并可预防或逆转肝炎和肝纤维化。Rg1可有效地增强机体免疫力和抗氧化能力。Rg1通过抑制NF-κB信号通路的激活及其下游TNF-α和IL-1β等炎性因子的表达, 发挥抗炎护肝作用[9]。另外, Rg1能抵抗四氯化碳诱发的急慢性肝炎[7, 14]。本研究显示, BDL诱导的肝纤维化中炎性因子水平升高, 而给予Rg1治疗后可下调损伤肝内TNF-α和IL-1β等炎性因子的表达, 这表明Rg1可减弱BDL诱导的胆汁淤积性肝损伤中炎症反应。VCAM-1是一种在免疫系统中具有重要作用的免疫球蛋白分子[24]。其主要表达于内皮细胞在内的多种细胞上, 能够介导白细胞跨越内皮向炎症部位聚集[25]。可溶性血管细胞黏附分子-1 (soluble vascular cell adhesion molecule-1, sVCAM-1)作为肝硬化的不同阶段检测的潜在标志物[26]。VCAM-1可通过与α4β1结合促进淋巴细胞存活, 加剧慢性肝炎症状[27]。另外, 特发性肺纤维化患者外周血中VCAM-1显著升高, 并且其参与了成纤维细胞增殖, 促进肺纤维化的进程[28]。本文研究发现, Rg1可显著降低肝纤维化组织中VCAM-1的蛋白水平。BDL诱导的肝纤维化中中性粒细胞数目增加, 而给予40 mg·kg-1 Rg1治疗后可有效地减少VCAM-1分泌, 降低中性粒细胞的浸润数目。另有报道显示, Rg1可显著减少受损脑区中性粒细胞数量[29], 与本文结果一致。
本文利用胆汁淤积模型, 探讨了VCAM-1在肝纤维化过程中的表达变化规律及Rg1对其调控机制。BDL对小鼠肝功能的影响随着给予BDL时间的延长而加重, 在BDL-14d出现明显的纤维化。VCAM-1主要表达在肝组织坏死区的肝细胞、血管内皮细胞和胆管上皮细胞, VCAM-1在BDL-1d表达上调, 至BDL-7d达到高峰, BDL-14d表达有所下降, 与对照组相比仍有高表达。Marx等[21, 30]研究表明抑制NF-κB易位可降低VCAM-1启动子活性, 减少白细胞黏附和抑制随后的跨内皮细胞迁移。为研究Rg1对VCAM-1的调控机制, 本研究检测了VCAM-1的上游NF-κB在细胞核内的含量变化情况。结果表明, Rg1治疗可明显降低核NF-κB蛋白水平。如图 6所示, Rg1可抑制NF-κB异位, 减弱VCAM-1启动活性, 抑制炎症反应, 从而减轻胆汁淤积性肝纤维化。然而Rg1如何调节NF-κB表达或异位活性, 以及其对肝纤维化的治疗效果及作用机制仍有待进一步研究。
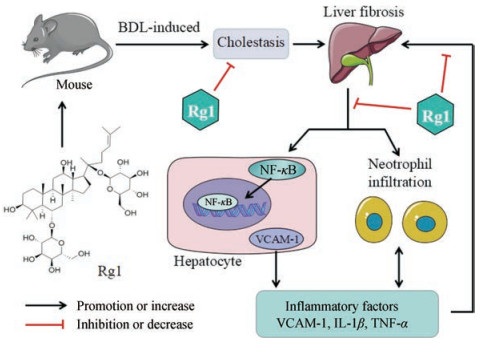
|
Figure 6 Schematic of Rg1 mechanism of preventing BDL-induced liver fibrosis through NF-κB signal pathway |
| [1] | Lim YS, Kim WR. The global impact of hepatic fibrosis and end-stage liver disease[J]. Clin Liver Dis, 2008, 12: 733–746. DOI:10.1016/j.cld.2008.07.007 |
| [2] | Davis GL, Alter MJ, El-Serag H, et al. Aging of hepatitis C virus (HCV)-infected persons in the United States:a multiple cohort model of HCV prevalence and disease progression[J]. Gastroenterology, 2010, 138: 513–521. DOI:10.1053/j.gastro.2009.09.067 |
| [3] | Mitchell AE, Colvin HM, Beasley RP. Institute of medicine recommendations for the prevention and control of hepatitis B and C[J]. Hepatology, 2010, 51: 729–733. DOI:10.1002/hep.v51:3 |
| [4] | Fujii H, Kawada N. Fibrogenesis in alcoholic liver disease[J]. World J Gastroenterol, 2014, 20: 8048–8054. DOI:10.3748/wjg.v20.i25.8048 |
| [5] | Hernandez-Gea V, Friedman SL. Pathogenesis of liver fibrosis[J]. Annu Rev Pathol, 2011, 6: 425–456. DOI:10.1146/annurev-pathol-011110-130246 |
| [6] | Budiarto BR, Chan WH. Oxidative stresses-mediatedapoptotic effects of ginsenoside Rb1 on pre-and post-implantation mouse embryos in vitro and in vivo[J]. Environ Toxicol, 2017, 32: 1990–2003. DOI:10.1002/tox.v32.8 |
| [7] | Tian W, Chen L, Zhang L, et al. Effects of ginsenoside Rg1 on glucose metabolism and liver injury in streptozotocin-induced type 2 diabetic rats[J]. Genet Mol Res, 2017. DOI:10.4238/gmr16019463 |
| [8] | Luo P, Chu SF, Gao Y, et al. Advances in study of pharmacological effects of ginsenoside Rg1 in hepatic diseases[J]. Acta Pharm Sin (药学学报), 2018, 53: 21–27. |
| [9] | Gao Y, Chu SF, Li JW, et al. Anti-inflammatory function of ginsenoside Rg1 on alcoholic hepatitis through glucocorticoid receptor related nuclear factor-kappa B pathway[J]. J Ethnopharmacol, 2015, 173: 231–240. DOI:10.1016/j.jep.2015.07.020 |
| [10] | Gao Y, Chu SF, Xia CY, et al. Rg1 attenuates alcoholic hepatic damage through regulating AMPK and Nrf2 signal pathways[J]. J Asian Nat Prod Res, 2016, 18: 765–778. DOI:10.1080/10286020.2016.1162787 |
| [11] | Gao Y, Chu SF, Shao QH, et al. Antioxidant activities of ginsenoside Rg1 against cisplatin-induced hepatic injury through Nrf2 signaling pathway in mice[J]. Free Radic Res, 2017, 51: 1–13. DOI:10.1080/10715762.2016.1234710 |
| [12] | Gao Y, Chu S, Zhang Z, et al. Hepataprotective effects of ginsenoside Rg1-a review[J]. J Ethnopharmacol, 2017, 206: 178–183. DOI:10.1016/j.jep.2017.04.012 |
| [13] | Zhao J, Shi Z, Liu S, et al. Ginsenosides Rg1 from Panaxginseng:a potential therapy for acute liver failure patients?[J]. Evid Based Complement Alternat Med, 2014, 2014: 538059. |
| [14] | Li JP, Gao Y, Chu SF, et al. Nrf2 pathway activationcontributes to anti-fibrosis effects of ginsenoside Rg1 in arat model of alcohol-and CCl4-induced hepatic fibrosis[J]. Acta Pharmacol Sin, 2014, 35: 1031–1044. DOI:10.1038/aps.2014.41 |
| [15] | Yao X, Jiang W, Ma CH, et al. Protective effects of ginsenoside Rg1 against carbon tetrachloride-induced liver injury in mice through suppression of inflammation[J]. Phytomedicine, 2016, 23: 583–588. DOI:10.1016/j.phymed.2016.02.026 |
| [16] | Dong XQ, Duan LP, Miao YL, et al. A stereological analysis of ginsenoside Rg1 in inhibiting hepatic fibrosis[J]. Chongqing Med (重庆医学), 2014, 43: 3599–3601, 3616. |
| [17] | Geng J, Peng W, Huang Y, et al. Ginsenoside-Rg1 from Panaxnotoginseng prevents hepatic fibrosis induced by thioacetamidein rats[J]. Eur J Pharmacol, 2010, 634: 162–169. DOI:10.1016/j.ejphar.2010.02.022 |
| [18] | Kirkland JG, Godfrey CB, Garrett R, et al. Reversible surgical model of biliary inflammation and obstructive jaundice in mice[J]. J Surg Res, 2010, 164: 221–227. DOI:10.1016/j.jss.2009.08.010 |
| [19] | Friedman SL. Mechanisms of hepatic fibrogenesis[J]. Gastroenterology, 2008, 134: 1655–1669. DOI:10.1053/j.gastro.2008.03.003 |
| [20] | Volpes R, van den Oord JJ, Desmet VJ. Immunohistochemical study of adhesion molecules in liver inflammation[J]. Hepatology, 1990, 12: 59–65. DOI:10.1002/(ISSN)1527-3350 |
| [21] | Xie CL, Wang WW, Xue XD, et al. A systematic review and meta-analysis of ginsenoside-Rg1(G-Rg1) in experimental ischemic stroke[J]. Sci Rep, 2015, 5: 7790. DOI:10.1038/srep07790 |
| [22] | Ghonem NS, Assis DN, Boyer JL. Fibrates and cholestasis[J]. Hepatology, 2015, 62: 635–643. DOI:10.1002/hep.v62.2 |
| [23] | Lee UE, Friedman SL. Mechanisms of hepatic fibrogenesis[J]. Best Pract Res Clin Gastroenterol, 2011, 25: 195–206. DOI:10.1016/j.bpg.2011.02.005 |
| [24] | Zhang D, Yuan D, Shen J, et al. Up-regulation of VCAM1 relates to neuronal apoptosis after intracerebral hemorrhage in adult rats[J]. Neurochem Res, 2015, 40: 1042–1052. DOI:10.1007/s11064-015-1561-x |
| [25] | Yamada Y, Arao T, Matsumoto K, et al. Plasma concentrations of VCAM-1 and PAI-1:a predictive biomarker for post-operative recurrence in colorectal cancer[J]. Cancer Sci, 2010, 101: 1886–1890. DOI:10.1111/cas.2010.101.issue-8 |
| [26] | Lo Iacono O, Rincón D, Hernando A, et al. Serum levels of soluble vascular cell adhesion molecule are related to hyperdynamic circulation in patients with liver cirrhosis[J]. Liver Int, 2008, 28: 1129–1135. DOI:10.1111/j.1478-3231.2008.01763.x |
| [27] | Afford SC, Humphreys EH, Reid DT, et al. Vascular cell adhesion molecule 1 expression bybiliaryepithelium promotes persistence of inflammation by inhibiting effector T-cell apoptosis[J]. Hepatology, 2014, 59: 1932–1943. |
| [28] | Agassandian M, Tedrow JR, Sembrat J, et al. VCAM-1 is a TGF-β1 inducible gene upregulated in idiopathic pulmonary fibrosis[J]. Cell Signal, 2015, 27: 2467–2473. DOI:10.1016/j.cellsig.2015.09.003 |
| [29] | Chu SF, Zhou X, Zhang Z, et al. HMGB1 is involved into the anti-ischemic stroke effect of ginsenoside Rg1 in diabetic rats[J]. Acta Pharm Sin (药学学报), 2018, 53: 958–965. |
| [30] | Marx N, Sukhova GK, Collins T, et al. PPARα activators inhibit cytokine-induced vascular cell adhesion molecule-1 expression in human endothelial cells[J]. Circulation, 1999, 99: 3125–3131. DOI:10.1161/01.CIR.99.24.3125 |
 2019, Vol. 54
2019, Vol. 54


