姜黄素(curcumin, Cur)是从姜科姜黄属(Curcuma longa L)姜黄、郁金和莪术等根茎中提取而得到的一类天然化合物[1], 具有抗氧化、抗癌、抗肿瘤和抗炎等多种药理活性而备受关注[2-4]。但由于其水中溶解度低(11 ng·mL-1)[5], 碱性溶液中(pH 13)极易降解[6]等缺点, 其临床应用受到了极大的限制。Chen等[7]采用微球技术增加姜黄素的溶解度及稳定性, 但是聚乳酸-羟基乙酸共聚物(PLGA)价格较高, 而且载药量仅为15%, 成本较高。因此, 增加姜黄素在水中的溶解度、提高其碱性溶液中的稳定性是研究的关键所在。
表面活性剂具有增溶作用, 通常情况下, 非离子型表面活性剂的临界胶束浓度(CMC)比离子型表面活性剂低1~2个数量级, 常用于难溶性药物的增溶, 但前者对药物的增溶量往往低于后者。因此, 利用现有的表面活性剂进行复配来降低CMC, 改善对药物的增溶效果。CMC越小, 增溶能力越强, 此外, 非离子表面活性剂具有毒性低、溶血作用小, 不易受电解质、pH值影响等优点, 能与大多数药物配伍用于外用、内服和注射等[8]。大量研究表明, 由于静电作用的存在, 阳离子表面活性剂对酸性难溶性药物的保护、增溶能力往往优于非离子表面活性剂和阴离子表面活性剂[9-11]。因此, 本文以非离子型表面活性剂Tween 80和阳离子表面活性剂十二烷基三甲基溴化铵(DTAB)复配, 考察Tween 80与DTAB复配体系对水溶液中姜黄素的增溶能力及碱性溶液中对姜黄素的保护作用。表面活性剂及药物的结构见图 1。
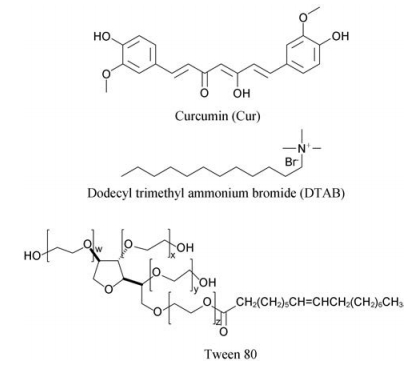
|
Figure 1 The chemical structure of curcumin and surfactants |
材料与仪器 Tween 80 (天津博迪化工股份有限公司, 批号: 20150605); DTAB (99%, 山东西亚化学工业有限公司, 批号: X0949); Cur (≥99.0%, 陕西浩洋生物科技有限公司, 批号: 20151109);氢氧化钠(天津博迪化工股份有限公司); 二次蒸馏水(SZ-93自动双重纯水蒸馏器, 上海亚荣生化仪器厂)。UV-9100紫外分光光度计(北京瑞利公司); UV-1750紫外可见分光光度计(日本岛津公司); BZY系列自动表面张力仪(上海方瑞仪器有限公司)。
临界胶束浓度的测定 根据Clint’s方程[12]Eq.1制备一系列浓度的DTAB和Tween 80的复配溶液, 其中DTAB的摩尔分数分别为0、0.2、0.4、0.6、0.8和1, 采用铂金板法测定25 ℃下溶液的表面张力, 以溶液的表面张力对浓度的对数作图, 曲线突变点即为CMC。
| $\frac{1}{{{\rm{CM}}{{\rm{C}}_{{\rm{id}}}}}} = \frac{{{\alpha _1}}}{{{\rm{CM}}{{\rm{C}}_1}}} + \frac{{{\alpha _2}}}{{{\rm{CM}}{{\rm{C}}_2}}}$ | (Eq.1) |
其中α1、α2分别是表面活性剂1和表面活性剂2的摩尔分数; CMC1、CMC2分别是表面活性剂1和表面活性剂2的临界胶束浓度; CMCid为二元表面活性剂复配体系的理论CMC。
姜黄素含量测定方法 准确称取姜黄素13.19 mg于25 mL量瓶中, 无水乙醇定容, 摇匀, 作为母液。用移液管分别移取0.32、0.4、0.5、0.6、1.0和1.1 mL于10 mL量瓶中, 无水乙醇定容, 摇匀, 在422 nm下分别测定其吸光度, 绘制姜黄素的标准曲线, 实验操作均在室温25~30 ℃下进行。回归方程为A = 0.015 6 + 0.129 6 C, 相关系数R = 0.998 9。
表面活性剂复配对姜黄素的增溶作用 配制一系列高于CMC的表面活性剂复配溶液, 分别取4 mL于10 mL样品管中, 加入过量的姜黄素, 于37 ℃的摇床中振摇72 h后, 10 000 r·min-1离心10 min, 取上清液过0.45 μm滤膜并用无水乙醇适当稀释, 于422 nm下测定吸光度, 重复测定3次, 用Eq.2计算摩尔增溶比(MSR)[13]。MSR越大, 表面活性剂的增溶能力越强。
| ${\rm{MSR}} = \frac{{{S_t} - {S_{{\rm{CMC}}}}}}{{{C_t} - {C_{{\rm{CMC}}}}}}$ | (Eq.2) |
其中Ct为表面活性剂溶液大于CMC时浓度; St和SCMC分别为表面活性剂溶液浓度为Ct和CMC时药物的溶解度。以姜黄素的浓度(mmol·L-1)对表面活性剂的浓度(mmol·L-1)作图, 直线的斜率即为MSR。
表面活性剂复配对姜黄素的保护作用 用NaOH配制pH 13的碱性溶液, 在该溶液及用该溶液配制的浓度远高于CMC的表面活性剂复配溶液中分别加入姜黄素母液200 μL, 立即用紫外分光光度计在300~600 nm内进行定时扫谱。然后以相应的最大吸收波长处的吸光度计算姜黄素的浓度(C), 以log C对时间作图, 求出降解速率常数(k), 实验操作均在室温25~30 ℃下进行。以碱性溶液下姜黄素的k值为参照, 对比不同表面活性剂复配体系下姜黄素的k值, k值越小, 说明该表面活性剂复配体系对姜黄素的保护作用越好。
结果与讨论 1 临界胶束浓度表面活性剂溶液的表面张力(γ)随表面活性剂溶液浓度对数(log C)的变化曲线见图 2。α表示DTAB在溶液中的摩尔分数。实验测得的CMC (用CMCex表示)和理想状态下的CMCid见表 1[14, 15]。DTAB的CMC值近似等于Tween 80 CMC值的550倍, 可见非离子型表面活性剂更易于形成胶束, 这是由于非离子型表面活性剂本身不发生电离, 链之间几乎没有电斥力。当两者复配后, 随着Tween 80摩尔分数的增加, CMCex值降低, 且CMCex比相应的CMCid要低, 说明两种表面活性剂间存在协同作用, 使胶束更易形成[16]。DTAB为阳离子型表面活性剂, 形成的胶束亲水基之间存在较强的静电斥力, 当加入Tween 80后, Tween 80穿插在DTAB分子间, 减弱了这种静电斥力; 而且Tween 80亲水基中含有的聚氧乙烯基与DTAB中铵根离子的偶极-离子作用同样使胶束结构更紧凑, 胶束更易形成, 从而降低CMCex。
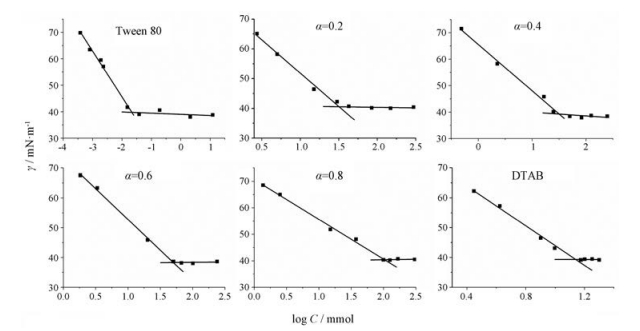
|
Figure 2 Variation of surface tension with total surfactant concentration at different mole fractions of DTAB in solution (α). All experiments were performed at room temperature (25 ℃) |
| Table 1 Summary about experimentally obtained critical micelle concentrations (CMCex), critical micelle concentrations obtained from Clint's equation (CMCid), molar solubilization ratio (MSR) and degradation rate constant (k) of the mixed micelles at different mole fractions of DTAB in solution (α). bCMC values provided by the literatures[14, 15] |
在不同摩尔配比下, 表面活性剂复配溶液对姜黄素的增溶结果见图 3。不同表面活性剂的复配体系均实现了对姜黄素的增溶, 且姜黄素的溶解度随表面活性剂溶液浓度的增加呈线性增加, 相关系数R2均大于0.9。胶束对药物的增溶取决于多种因素, 如溶剂的性质、表面活性剂的种类、胶束的聚集情况以及溶质与胶束之间的相互作用等。在表面活性剂复配体系的水溶液中, 姜黄素以分子形式(Cur0)存在, 脂溶性强, 容易被非极性环境所吸引, 即被胶束内核包裹或储存于胶束的栅栏层中。胶束聚集数随表面活性剂浓度的增加逐渐增多, 表观上姜黄素的溶解度逐渐增加。MSR用于表征表面活性剂对药物的增溶能力, 其值越大, 增溶效果越好。由表 1数据可知, Tween 80的CMC最小, 较低浓度下便可实现对姜黄素的增溶。非离子型表面活性剂分子质量大, 疏水端与Cur0之间的作用力较强, 增溶效果最好。将Tween 80与DTAB复配后, 随着DTAB摩尔分数的增加, MSR值降低, 增溶能力变差, 这与表面活性剂复配体系的CMC密切相关。
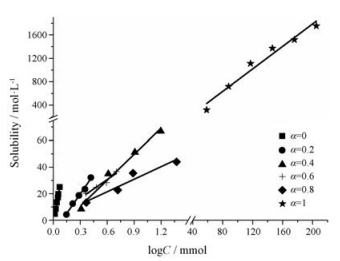
|
Figure 3 Variation of the solubility of Cur in the mixed surfactant micelles at different mole fractions of DTAB in solution (α, 37 ℃, n = 3) |
为了更直观地表达CMC与MSR之间的关系, 将两者分别为横坐标和纵坐标进行线性拟合, 结果见图 4。表面活性剂复配体系中Tween 80的摩尔分数越大, CMC越低, 两者的协同作用越强, 形成的胶束聚集数越多, 非极性环境空间越大, MSR值越大, 对姜黄素的增溶能力越强。
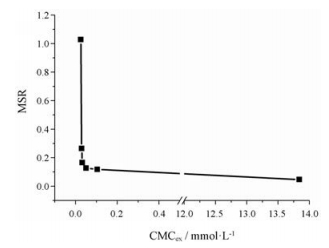
|
Figure 4 The relationship between CMCex and MSR. All experiments were performed at room temperature (25-30 ℃) |
姜黄素在碱性水溶液(pH 13)和表面活性剂复配碱性溶液中的降解谱图及相应的药物降解情况见图 5。在pH 13溶液中, 姜黄素以离子形式(Cur3-)存在[17]。Cur3-在pH 13溶液中最大吸收峰位置在469 nm, 与姜黄素水溶液中最大吸收峰(422 nm)相比, 发生了红移, 说明离子间的静电作用会影响姜黄素的紫外吸收。静电作用越强, 最大吸收峰位置红移越明显。非离子表面活性剂Tween 80不产生电荷, 对静电作用几乎没有贡献, 不会影响Cur3-在碱性溶液中最大吸收峰位置; 然而DTAB的铵根离子会增强离子间的静电作用, Cur3-在碱性溶液中最大吸收波长红移至473 nm。两者复配后, Cur3-在碱性溶液中最大吸收波长处于469~471 nm之间。因此, 根据相应谱图下最大吸收波长处的吸光度计算不同表面活性剂复配溶液中姜黄素的含量。
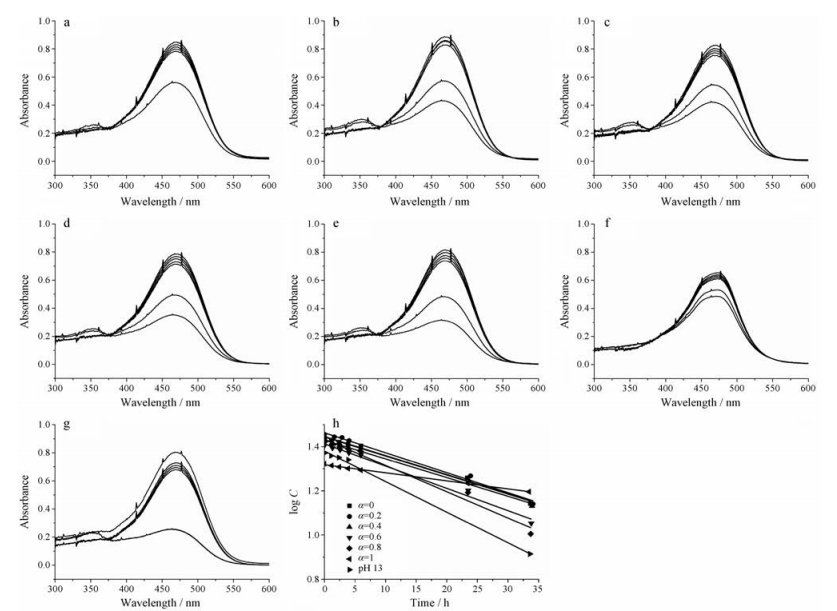
|
Figure 5 Changes in the absorption spectra of Cur3- (17 μmol·L-1) in surfactant mixtures of DTAB and Tween 80 with the mole fractions of DTAB at 0 (a), 0.2 (b), 0.4 (c), 0.6 (d), 0.8 (e), 1 (f) and pH 13 solution (g) with increasing time. The surfactant concentrations of micelles were above the CMC. The extent of degradation of Cur3- in terms of the decrease in absorbance maxima with increasing time interval (h). The rate of degradation is determined from the initial slope of the best-fit linear curve. All experiments were performed at pH 13 and at room temperature (25-30 ℃) |
结果显示, 姜黄素降解的浓度对数log C与时间呈良好的线性关系, 说明姜黄素降解为典型的一级动力学过程。由表 1数据可知, Cur3-在碱性溶液中的降解速率k为0.037。加入表面活性剂后, 除了Tween 80, k值均有所减小, 说明表面活性剂对姜黄素的增溶延缓了药物的降解。如图 6所示, 在Tween 80碱性溶液中, 尽管Tween 80对姜黄素的增溶能力最强, 但是其与Cur3-之间的静电作用较弱, 胶束与Cur3-之间的作用较差, 导致Cur3-的降解速率与pH 13溶液中的降解速率相当。然而, 在DTAB胶束溶液中, Cur3-的降解速率降低了50%, 结合谱图可知, 静电作用的存在可以增强Cur3-在碱性溶液中的稳定性[18], 而这种静电作用是由Cur3-和DTAB的铵根离子引起的。Cur3-增溶在胶束的内核或栅栏层中(图 6), 阻断了Cur3-与溶液中离子的接触, 由此可见, 胶束将姜黄素保护起来, 降解迟缓。

|
Figure 6 Schematic of the solubilization behavior |
有文献[12]报道, Cur3-在纯十四烷基三甲基溴化铵(TTAC)和十六烷基三甲基溴化铵(CTAB)胶束的强静电吸引使得Cur3-位于栅栏层水界面附近, 不利于Cur3-稳定, 而Gemini-C12/TTAC、Gemini-C12/CTAB、Gemini-C14/TTAC和Gemini-C14/CTAB复配胶束的栅栏层比纯TTAC和CTAB胶束的栅栏层具有较好的刚性和疏水性, Cur3-周围环境的水可及性比纯TTAC/CTAB小, 因此复配胶束可以更有效地抑制Cur3-降解, 其与表面活性剂复配后的CMC亦相关。对于本文中的Tween 80和DTAB复配体系, 姜黄素的降解速率k与CMCex的关系如图 7所示。在碱性溶液中, Tween 80的存在增强了胶束的刚性和疏水性, 加上Cur3-与DTAB较强的静电作用使大部分姜黄素储存在胶束栅栏层, 保护姜黄素从而延缓其降解。随着DTAB摩尔分数的增加, 静电作用的逐渐增强并没有持续降低姜黄素的降解速率, 而是出现了最小值, 即当DTAB的摩尔分数为0.4时, 姜黄素的降解速率最低, 为0.020, 说明表面活性剂复配后, 胶束对姜黄素的保护作用有最佳的胶束结构选择, 其机制仍需进一步探讨。综上可知, Tween 80的存在可以降低CMC, 增加对姜黄素的增溶能力, 但是对姜黄素的降解无明显影响; DTAB的存在恰好能够弥补这种缺憾, 与Tween 80形成的复配胶束保护姜黄素, 延缓药物降解。此外, Tween 80的加入可以减少阳离子型表面活性剂的使用, 降低毒性, 达到协同作用的效果。因此, 对于姜黄素碱性溶液中的稳定性来说, 复配胶束是更好的选择。
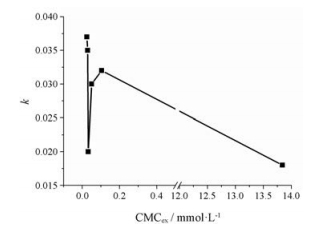
|
Figure 7 The relationship between CMCex and k. All experiments were performed at room temperature (25-30 ℃) |
非离子型表面活性剂Tween 80和阳离子表面活性剂DTAB复配后, 随着Tween 80摩尔分数的增加, CMC降低, 在胶束化过程中表现出适度的协同作用, 对姜黄素的增溶能力增强。在pH 13溶液中, DTAB和Cur3-的静电作用力最强, 药物的降解速率最小, 但是考虑到阳离子表面活性剂的生物毒性, 姜黄素在碱性溶液中可以通过复配胶束来进行保护, 降解得以缓解, 且DTAB的摩尔分数为0.4时效果最好。综合考虑表面活性剂复配体系对姜黄素的增溶结果, 最终选择DTAB摩尔分数为0.4的复配体系来实现对姜黄素的增溶和保护作用。
| [1] | Kumar A, Kaur G, Kansal SK, et al. Enhanced solubilization of curcumin in mixed surfactant vesicles[J]. Food Chem, 2016, 199: 660–666. DOI:10.1016/j.foodchem.2015.12.077 |
| [2] | Lantz RC, Chen GJ, Solyom AM, et al. The effect of turmeric extracts on inflammatory mediator production[J]. Phytomedicine, 2005, 12: 445–452. DOI:10.1016/j.phymed.2003.12.011 |
| [3] | Shi M, Cai Q, Yao L, et al. Antiproliferation and apoptosis induced by curcumin in human ovarian cancer cells[J]. Cell Biol Int, 2006, 30: 221–226. DOI:10.1016/j.cellbi.2005.10.024 |
| [4] | Zhao S, Ma L, Cao C, et al. Curcumin-loaded redox response of self-assembled micelles for enhanced antitumor and anti-inflammation efficacy[J]. Int J Nanomed, 2017, 12: 2489–2504. DOI:10.2147/IJN |
| [5] | Liu J, Chen F, Tian W, et al. Optimization and characterization of curcumin loaded in octenylsuccinate oat β-glucan micelles with an emphasis on degree of substitution and molecular weight[J]. J Agric Food Chem, 2014, 62: 7532–7540. DOI:10.1021/jf5014692 |
| [6] | Boruah B, Saikia PM, Dutta RK. Binding and stabilization of curcumin by mixed chitosan-surfactant systems:a spectroscopic study[J]. J Photoch Photobiol A, 2012, 245: 18–27. DOI:10.1016/j.jphotochem.2012.07.004 |
| [7] | Chen D, Liu Y, Fan K, et al. Relation between drug release and the drug status within curcumin-loaded microsphere[J]. Acta Pharm Sin (药学学报), 2016, 51: 140–146. |
| [8] | Simões SI, Tapadas JM, Marques CM, et al. Permeabilisation and solubilisation of soybean phosphatidylcholine bilayer vesicles, as membrane models, by polysorbate, Tween 80[J]. Eur J Pharm Sci, 2005, 26: 307–317. DOI:10.1016/j.ejps.2005.07.002 |
| [9] | Vinarov Z, Dobreva P, Tcholakova S. Effect of surfactant molecular structure on progesterone solubilization[J]. J Drug Deliv Sci Tech, 2018, 43: 44–49. DOI:10.1016/j.jddst.2017.09.014 |
| [10] | Jabbari M, Teymoori F. An insight into effect of micelle-forming surfactants on aqueous solubilization and octanol/water partition coefficient of the drugs gemfibrozil and ibuprofen[J]. J Mol Liq, 2018, 262: 1–7. DOI:10.1016/j.molliq.2018.04.054 |
| [11] | Rangel-Yagui CO, Hsu HWL, Pessoa-Jr A, et al. Micellar solubilization of ibuprofen influence of surfactant head groups on the extent of solubilization[J]. Rev Bras Cienc Farm, 2005, 41: 237–246. |
| [12] | Clint JH. Micellization of mixed nonionic surface active agents[J]. J Chem Soc Faraday Trans, 1975, 71: 1327–1334. DOI:10.1039/f19757101327 |
| [13] | Yadav SK, Parikh K, Kumar S. Mixed micelle formation of cationic gemini surfactant with anionic bile salt:a PAH solubilization study[J]. Colloids Surf A, 2017, 522: 105–112. DOI:10.1016/j.colsurfa.2017.02.048 |
| [14] | Stoyanova K, Vinarov Z, Tcholakova S. Improving ibuprofen solubility by surfactant-facilitated self-assembly into mixed micelles[J]. J Drug Deliv Sci Tech, 2016, 36: 208–215. DOI:10.1016/j.jddst.2016.10.011 |
| [15] | Yadav SK. Interaction parameters and micellisation constant of SDS and DTAB in aqueous and mixed solvents[J]. Arch Appl Sci Res, 2013, 5: 105–109. |
| [16] | Ćirin DM, Poša MM, Krstonošić VS. Interactions between sodium cholate or sodium deoxycholate and nonionic surfactant (Tween 20 or Tween 60) in aqueous solution[J]. Ind Eng Chem Res, 2012, 51: 3670–3676. DOI:10.1021/ie202373z |
| [17] | Wan Z, Ke D, Hong J, et al. Comparative study on the interactions of cationic gemini and single-chain surfactant micelles with curcumin[J]. Colloids Surf A, 2012, 414: 267–273. DOI:10.1016/j.colsurfa.2012.08.046 |
| [18] | Leung MH, Colangelo H, Kee TW. Encapsulation of curcumin in cationic micelles suppresses alkaline hydrolysis[J]. Langmuir, 2008, 24: 5672–5675. DOI:10.1021/la800780w |
 2019, Vol. 54
2019, Vol. 54


