2. 军事医学科学院毒物药物研究所, 北京 100850
2. Institute of Pharmacology and Toxicology, Academy of Military Medical Science, Beijing 100850, China
炎症是具有血管系统的生物机体对损伤因子所发生的复杂的防御反应[1]。当致炎因子作用于机体时, 机体通过炎症反应消除致炎因子, 这是一个损伤和抗损伤的过程。凡能消除炎症反应的药物统称为抗炎类药物, 抗炎药物是临床上仅次于抗感染药物的第二大类药物, 主要包括甾体类抗炎药物和非甾体抗炎药物。甾体类抗炎药物出现于20世纪40年代, 对关节炎等疾病的治疗虽然具有较好的近期疗效, 但长时间使用会引起依赖性和肾上腺皮质功能衰退, 因此非甾体抗炎药物逐渐成为抗炎药物研究开发的主要方向。目前临床使用的非甾体抗炎药物皆为花生四烯酸环氧酶抑制剂, 通过抑制花生四烯酸环氧酶进而抑制炎症部位前列腺素的合成, 从而达到抗炎作用[2]。但抑制炎症部位前列腺素合成的同时也抑制了胃、肾等部位前列腺素的合成, 因此会导致胃出血等一系列不良反应, 因此寻找抗炎活性好、不良反应低的非甾体抗炎药物一直是药物化学领域一个重要的研究课题。
姜黄素(图 1)是一种从姜科姜黄属植物中提取得到的多酚类化合物, 姜黄素具有抗氧化、抗病毒、抗肿瘤等多种生物活性[3-5], 其抗炎活性尤其引人注目[6-8]。1982年Mukhopadhyay等[9]通过采用角叉菜胶局部注射致大、小鼠急性足趾水肿的实验, 首先发现姜黄素具有抗炎活性。后来临床试验也证明姜黄素具有良好的抗炎活性[10-12]。与目前临床使用的非甾体抗炎药物相比, 姜黄素具有非常强的抗炎活性, 同时不良反应也很低。早期的毒性实验中, 给大鼠每日口服姜黄素1.8 g·kg-1, 连续服用90天未见明显毒性[13]; 在Ⅰ期临床试验中, 25个受试者每天给药8 g姜黄素未见不良反应的报道[14]。进一步研究发现姜黄素对胃肠道没有明显刺激, 对心血管、中枢神经系统和肾上腺皮质也没有影响, 因此具有良好的应用开发前景[10, 12, 15]。但姜黄素水溶性差, 由此导致生物利用度很低, 限制了它在临床的使用[16, 17]。
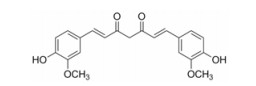
|
Figure 1 Chemical structure of curcumin |
前药是一种本身无活性或活性很低, 但在体内经代谢转化而产生生物活性的化合物。引入琥珀酸酯作为一种重要的药物设计策略, 在前药设计中应用十分广泛。通过引入丁二酰基桥, 可以将化合物原有的活性基团(如羟基、胺基等)转变为羧基; 从羧基结构出发, 既可以使其成盐以提高水溶性, 又可以酯化以提高酯溶性, 为前药设计提供了多种可能。为了改善姜黄素的水溶性, 根据其结构, 本文设计合成了姜黄素单琥珀酸酯及姜黄素双琥珀酸酯的钠盐(图 2), 并对其溶解度、稳定性、大鼠体内的代谢以及抗炎活性进行了研究。
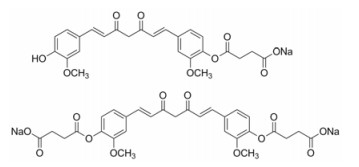
|
Figure 2 Chemical structures of curcumin succinate prodrugs |
首先按照合成路线1对目标化合物进行了合成。即:在三乙胺存在条件下, 姜黄素与琥珀酸酐直接进行酯化反应生成一、二取代的姜黄素琥珀酸酯。分离提纯后, 再将其分别与氢化钠反应制成一、二取代的姜黄素琥珀酸酯钠盐, 这是一条文献报道的琥珀酸酯类前体药物合成的经典方法。但在实际操作过程中发现生成的一、二取代的姜黄素琥珀酸酯极性很大, 分离十分困难。柱层析过程中拖尾现象非常严重, 难以分离, 因此对合成路线进行优化, 采用合成路线2完成了目标化合物的合成。
合成路线2首先在三乙胺、N-羟基琥珀酰亚胺、4-二甲氨基吡啶存在的条件下, 琥珀酸酐与叔丁醇进行酯化反应制备了丁二酸单叔丁酯; 然后将丁二酸单叔丁酯与姜黄素反应合成一、二取代的姜黄素琥珀酸叔丁酯。由于生成的一、二取代姜黄素琥珀酸叔丁酯化合物极性明显降低, 易于进行柱层析分离。分离提纯后得到的一、二取代姜黄素琥珀酸叔丁酯在氯化氢作用下分别进行脱保护, 得到一、二取代姜黄素琥珀酸酯, 再将其与氢化钠反应即得到最终产物一、二取代姜黄素琥珀酸酯钠盐。用这种方法合成的姜黄素琥珀酸酯钠盐纯度好, 稳定性高, 经长时间放置未见游离姜黄素析出。
2 前药的理化性质、代谢及抗炎活性 2.1 前药的溶解度及稳定性药物的溶解度是药物的一个重要参数, 也是药物能否被吸收的关键因素之一。姜黄素本身难溶于水, 在水中的溶解度仅为13.76 μg·mL-1, 一直没有找到与之合适的剂型[18]。本文合成了一取代和二取代姜黄素琥珀酸酯钠盐并用紫外分光光度法测定了它们在水中的溶解度, 结果表明一取代姜黄素琥珀酸酯钠盐在水中的溶解度为5.0 mg·mL-1, 二取代姜黄素琥珀酸酯钠盐在水中的溶解度为7.5 mg·mL-1, 比姜黄素具有明显改善, 达到了注射剂的要求。
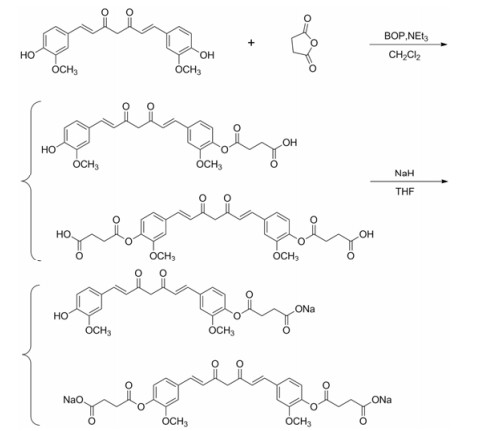
|
Scheme 1 Synthesis of curcumin succinate prodrugs |
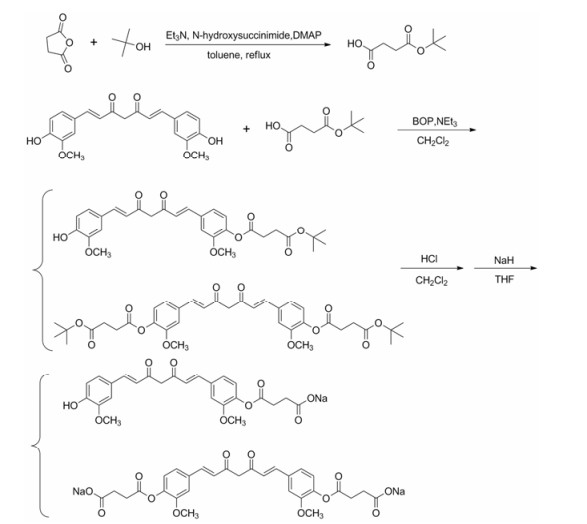
|
Scheme 2 Synthesis of curcumin succinate prodrugs |
Wang等[19]通过实验证实, 姜黄素在中性pH值中稳定性较差, 分解产生阿魏酰甲烷(4-羟基-3-甲氧基肉桂酸甲烷)和阿魏酸(4-羟基-3-甲氧基肉桂酸)。在pH = 7.4的磷酸盐缓冲溶液中, 25 mmol·L-1的姜黄素溶液5 min后含量约为50%, 10 min后含量约剩10%。结果显示分解呈pH依赖性, 中性-碱性条件下易分解。Wan等[20]也证实, 在溶液中, 当pH≤5时姜黄素稳定。随着溶液的pH值升高, 姜黄素的降解速率明显加快。为了考察姜黄素琥珀酸酯钠盐的稳定性, 本文采用紫外分光光度法测定一取代和二取代姜黄素琥珀酸酯钠盐在水中含量与时间变化曲线, 结果见图 3和图 4。
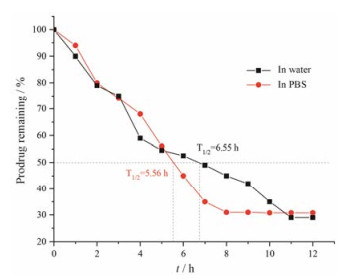
|
Figure 3 Plot of percent prodrug remaining as a function of time for curcumin succinate monoester in water and in phosphate buffer solution (pH 7.4) |
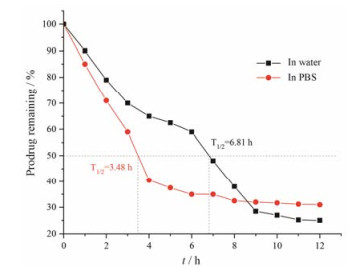
|
Figure 4 Plot of percent prodrug remaining as a function of time for curcumin 4, 4'-bissuccinate ester in water and in phos'phate buffer solution (pH 7.4) |
姜黄素单取代琥珀酸酯钠盐在水中和PBS缓冲溶液中的稳定性相近, 在水中比PBS缓冲溶液中略稳定(T1/2水 = 6.55 h, T1/2PBS = 5.56 h); 姜黄素双取代琥珀酸酯钠盐在水中和PBS缓冲溶液中的稳定性相差很大, 在水中比PBS缓冲溶液中稳定得多(T1/2水 = 6.81 h, T1/2PBS = 3.48 h)。姜黄素单取代琥珀酸酯钠盐和姜黄素双取代琥珀酸酯钠盐在水中的稳定性较好, 半衰期基本相同(T1/2一取代 ≈ 6.55 h, T1/2二取代 ≈ 6.81 h); 在PBS缓冲溶液中, 姜黄素单取代琥珀酸酯钠盐的稳定性强于姜黄素双取代琥珀酸酯钠盐(T1/2二取代 ≈ 3.48 h, T1/2一取代 ≈ 5.56 h)。与姜黄素相比, 姜黄素琥珀酸酯前体药物在水中和PBS缓冲溶液中的稳定性已经具有明显改善。
2.2 大鼠体内代谢实验由于姜黄素具有抗炎、抗氧化、抗病毒、抗肿瘤等多种生物活性, 逐渐引起了国内外学者的关注, 人们对其进行了广泛深入地研究。Wahlstrom等[21]最先对姜黄素的生物利用度进行了研究。他们给大鼠口服姜黄素1 g·kg-1, 但在血浆中几乎检测不到姜黄素的浓度, 后来又开展了一系列研究, 取得的实验结果大致相似。出现这种现象的主要原因是姜黄素的水溶性差, 因而导致其生物利用度很低。但姜黄素转化成琥珀酸酯前体药物后, 其水溶性得到了极大地改善。经尾静脉注射姜黄素琥珀酸酯前体药物后, 大鼠血浆中只能检测到姜黄素而检测不到姜黄素琥珀酸酯, 说明前药已经迅速完全转变成姜黄素。图 5和图 6是经尾静脉注射姜黄素琥珀酸酯前体药物(12.5 mg·kg-1)后得到的姜黄素血药浓度曲线。由血药浓度曲线可以看出, 姜黄素在大鼠体内代谢速度较快, 半衰期T1/2为10 min, 约180 min代谢完全。
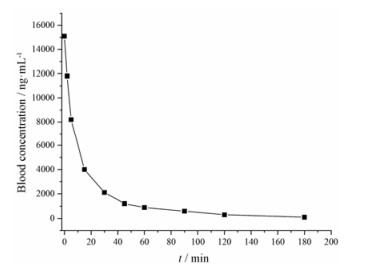
|
Figure 5 Plot of the plasma curcumin concentrations versus time obtained after intravenous administration of curcumin succinate monoester (12.5 mg·kg-1) |
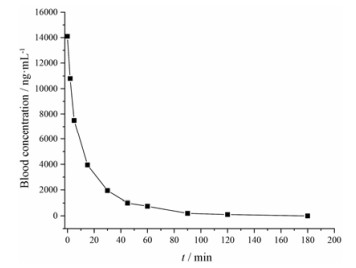
|
Figure 6 Plot of the plasma curcumin concentrations versus time obtained after intravenous administration of curcumin 4, 4'- bissuccinate ester (12.5 mg·kg-1) |
本文以地塞米松为阳性对照, 生理盐水为阴性对照, 采用鸡蛋清诱导的大鼠足跖肿胀模型对姜黄素琥珀酸酯前体药物的抗炎活性进行了评价, 实验结果见表 1。
| Table 1 Anti-inflammatory activity of curcumin succinate prodrugs |
结果显示, 生理盐水组的大鼠在致炎后, 右后足跖逐渐发生肿胀, 并且在1 h后达到肿胀顶点, 2 h后略有缓解, 但仍明显处于肿胀状态; 地塞米松组的大鼠在致炎后, 右后足跖同样发生肿胀, 但在30 min后逐渐开始消肿, 2 h后恢复正常; 另外两个姜黄素前药组的大鼠致炎后, 右后足跖发生肿胀, 30 min后开始消肿, 2 h同样恢复正常。由此可以得出结论, 二取代姜黄素琥珀酸酯钠盐和一取代姜黄素琥珀酸酯钠盐在进入大鼠体内后, 在30 min开始产生明显消肿的作用, 2 h后完全消肿, 同等剂量下其抗炎效果与地塞米松相当。姜黄素琥珀酸酯前体药物进入大鼠体内代谢产生姜黄素, 姜黄素通过抑制大鼠体内花生四烯酸环氧酶抗炎活性[22, 23]。与以往的实验不同, 本实验首次采用注射给药, 因此比较准确提供了姜黄素血药浓度与药物作用强度的关系, 为后期研究打下了基础。
3 小结姜黄素是一种从姜科姜黄属植物中提取得到的多酚类化合物, 具有良好的抗炎活性。针对姜黄素水溶性差的特点, 本文设计并合成了单取代和双取代姜黄素琥珀酸酯前体药物。与姜黄素相比, 所得前体药物的水溶性明显改善, 同时在水中和磷酸盐缓冲溶液(pH 7.4)中具有良好的稳定性。体内代谢实验表明, 姜黄素琥珀酸单酯和双酯进入大鼠体内后可迅速完全释放出姜黄素。抗炎实验显示, 姜黄素琥珀酸单酯和双酯经尾静脉注射给药后, 对鸡蛋清诱导的大鼠足肿胀模型产生明显的抗炎作用, 与同等剂量下地塞米松的药效相似。以上实验为姜黄素琥珀酸酯前体药物的深入研究打下了基础。
实验部分熔点用SGWX-4型显微熔点仪测定, 温度未校正; 核磁共振谱用Bruker Avance Ⅲ 500核磁共振仪测定, TMS为内标; 质谱用Varian MS 500质谱仪测定; 紫外吸收采用双光束紫外可见分光光度计(上海光谱仪器有限公司)测定; 柱色谱硅胶(200~300目)为青岛海洋化工厂生产, 薄层色谱采用Merck GF254薄层色谱硅胶板; 其余试剂均为市售分析纯产品, 除特别说明外, 未经处理直接使用。
1 前体药物的合成 1.1 琥珀酸单叔丁酯的合成将丁二酸酐5 g (50 mmol)、N-羟基琥珀酰亚胺1.726 g (15 mmol)、4-二甲氨基吡啶0.611 g (5 mmol)混合溶于30 mL甲苯中, 再加入叔丁醇4.818 g (65 mmol)和三乙胺1.518 g (15 mmol), 升温至110 ℃, 搅拌回流反应24 h。停止反应, 将反应液冷却至室温, 加入乙酸乙酯30 mL稀释, 并用10%柠檬酸水溶液洗涤3次, 饱和氯化钠水溶液洗涤3次, 收集有机相, 加入无水硫酸钠干燥过夜。过滤, 滤液减压蒸馏, 得到棕色油状液体, 用石油醚-乙醚重结晶, 得到白色针状晶体3.031 g, 产率44.1%, 熔点50~55 ℃, 1H NMR (500 MHz, CDCl3) δ 12.19 (s, 1H), 2.89 (d, J = 6.5 Hz, 2H), 2.70 (d, J = 6.5 Hz, 2H), 1.50 (s, 9H); LC-MS m/z: 173.1 [M-H]-。
1.2 一、二取代姜黄素琥珀酸叔丁酯的合成将琥珀酸单叔丁酯2.088 g (12 mmol)、三乙胺3.642 g (36 mmol)、BOP 5.304 g (12 mmol)混合溶于20 mL CH2Cl2中。冰浴条件下, 将其缓慢滴加至姜黄素2.210 g (6 mmol)的CH2Cl2溶液中, 30 min后缓慢升至室温, 继续反应4 h。反应结束后, 先后用水和饱和氯化钠洗涤反应液, 收集有机相, 无水硫酸钠干燥过夜。过滤, 滤液减压蒸馏得到深红色黏稠液体, 硅胶柱层析(流动相:石油醚-丙酮=3:1)得产物。
一取代姜黄素琥珀酸叔丁酯橙色油状液体0.56 g, 转化率18%。1H NMR (500 MHz, CDCl3) δ 7.62~7.59 (m, 2H), 7.28~6.92 (m, 6H), 6.56~6.48 (m, 2H), 5.84 (s, 1H), 3.94 (s, 3H), 3.87 (s, 3H), 2.89 (t, J= 6.8 Hz, 2H), 2.68 (t, J = 6.8 Hz 2H), 1.48 (s, 9H); LC-MS m/z: 523.1 [M-H]-。
二取代姜黄素琥珀酸叔丁酯黄色油状液体3.045 g, 转化率75%。1H NMR (500 MHz, CDCl3) δ 7.63 (d, J = 15.8 Hz, 2H), 7.28 (s, 2H), 7.18~7.06 (m, 4H), 6.58 (d, J = 15.8 Hz, 2H), 5.87 (s, 1H), 3.89 (s, 6H), 2.89 (t, J = 5.9 Hz, 4H), 2.68 (t, J = 5.9Hz, 4H), 1.48 (s, 18H); LC-MS m/z: 702.8 [M+Na]+。
1.3 一、二取代姜黄素琥珀酸酯的合成冰浴且避光条件下, 分别将一取代姜黄素琥珀酸叔丁酯1.082 g (2 mmol)和二取代姜黄素琥珀酸叔丁酯3 g (4.4 mmol)溶于30 mL二氯甲烷中, 缓慢通入过量的氯化氢气体。TLC监测原料消失后, 停止通氯化氢, 将反应液减压浓缩得产物。
一取代姜黄素琥珀酸酯深绿色固体粉末0.892 g, 产率92.3%, 熔点136~138 ℃。1H NMR (500 MHz, DMSO-d6) δ 9.70 (s, 1H), 8.32 (s, 1H), 7.70~7.61 (m, 2H), 7.30~6.94 (m, 6H), 6.56~6.49 (m, 2H), 6.14 (s, 1H), 3.81 (s, 6H), 2.97 (t, J = 7.1 Hz, 2H), 2.70 (t, J = 7.1 Hz, 2H); LC-MS m/z: 491.0 [M+Na]+。
二取代姜黄素琥珀酸酯深黄色固体粉末2.2 g, 产率79.8%, 熔点130~132 ℃。1H NMR (500 MHz, DMSO-d6) δ 12.30 (s, 2H), 7.66 (d, J = 15.9 Hz, 2H), 7.52 (s, 2H), 7.34 (d, J = 10.8 Hz, 2H), 7.13 (d, J = 10.8 Hz, 2H), 6.99 (d, J = 15.9 Hz, 2H), 6.21 (s, 1H), 3.83 (s, 6H), 2.81 (t, J = 6.3 Hz, 4H), 2.59 (t, J = 6.3 Hz, 4H); LC-MS m/z: 569.1 [M+H]+。
1.4 一、二取代姜黄素琥珀酸酯钠盐的合成冰浴且避光条件下, 分别将一取代姜黄素琥珀酸酯0.562 g (1.196 mmol)和二取代姜黄素琥珀酸酯1.253 g (2.2 mmol)溶于30 mL四氢呋喃中。精确称取处理后的氢化钠固体0.287 g (1.196 mmol)和0.106 g (4.4 mmol), 分别加入一取代和二取代姜黄素琥珀酸酯的四氢呋喃溶液中。TLC监测原料消失后, 停止反应。将反应液减压蒸馏, 经冻干得产物。
一取代姜黄素琥珀酸酯钠盐深红色固体粉末0.423 g, 产率72.1%, 熔点105~108 ℃。
二取代姜黄素琥珀酸酯钠盐深黄色固体粉末1.039 g, 产率77.1%, 熔点107~111 ℃。
2 溶解度测试实验精密称取姜黄素琥珀酸酯钠盐2 mg加入到离心管中, 加入超纯水1 mL使其溶解。待全部溶解后, 再次精密称取钠盐2 mg, 加入其中, 重复上述步骤, 直到观察到固体不再溶解, 记录加入固体的总质量, 即得到姜黄素琥珀酸酯钠盐在水中的溶解度。
3 稳定性实验 3.1 水中稳定性实验本实验采用紫外分光光度法测试姜黄素衍生物在水及缓冲溶液中的稳定性, 具体方法为:精密称取姜黄素琥珀酸酯钠盐25.00 mg于250 mL的量瓶中, 加入超纯水并定容至250 mL, 得到100 μg·mL-1的姜黄素衍生物溶液, 室温下避光保存。从起点开始, 每隔1 h取样, 过滤, 加入到石英比色皿中, 设置检测波长为500~350 nm, 进行扫描, 测定其最大吸收波长下对应的吸光度, 并与起始吸光度比较, 计算其含量百分率, 做含量百分率-时间曲线, 即得到姜黄素琥珀酸酯钠盐在水中的稳定性数据。
3.2 磷酸盐缓冲溶液中稳定性实验精密称取姜黄素琥珀酸酯钠盐25.00 mg于250 mL的量瓶中, 加入磷酸盐缓冲溶液(pH = 7.4 ± 0.2)并定容至250 mL, 得到100 μg·mL-1的姜黄素琥珀酸钠溶液, 室温下避光保存。从起点开始, 每隔1 h取样, 过滤, 加入到石英比色皿中, 设置检测波长为500~350 nm, 进行扫描, 测定其最大吸收波长下对应的吸光度, 并与起始吸光度比较, 计算其含量百分率, 作含量百分率-时间曲线, 即得到姜黄素琥珀酸酯钠盐在磷酸盐缓冲溶液中的稳定性数据。
4 体内代谢实验姜黄素琥珀酸酯前体药物体内代谢实验采用Xevo TQ MS-acquity UPLC System (美国Waters公司)测定, 色谱柱为ACQUITY UPLC BEH Shield RP18 (2.1 mm × 50 mm, 1.7 µm, 美国Waters公司), 流动相乙腈-0.2%甲酸水溶液, 流速0.4 mL·min-1, 华法令为内标, 单个样品分析时间3.5 min, 梯度洗脱(0 min: 40%乙腈, 3 min: 100%乙腈), 柱温35 ℃; 进样量5 µL。
实验动物为成年SD大鼠, 体重190~200 g, 由军事医学科学院北京实验动物中心提供, 经伦理委员会批准且实验均按照相关指导原则和规定进行, 实验前禁食12 h, 自由饮用无菌水。
大鼠适应3天后, 尾静脉注射给药, 剂量为12.5 mg·mL-1, 每个时间点5只动物。分别于给药后2 min、5 min、15 min、30 min、45 min、1 h、1.5 h、2 h、2.5 h从眼底静脉丛取血0.5 mL, 置于肝素化的1.5 mL Eppendorf中, 于4 ℃、3 000 r·min-1条件下离心10 min, 转移血浆于1.5 mL Eppendorf中, -80 ℃冰箱中保存备用。
将血浆供试品在室温下融化后混匀以备用。用移液器吸取血浆100 μL于2 mL Eppendorf管中, 依次加入内标20 μL, 乙腈(含0.2%的甲酸) 300 μL, 涡旋振荡5 min, 12 000 r·min-1、4 ℃条件下离心15 min, 取上清液400 μL, 置于1.5 mL Eppendorf管中, 30 ℃水浴中氮气流下吹干, 残留物用含50%水的乙腈溶液100 μL复溶, 涡旋振荡1 min, 12 000 r·min-1、4 ℃条件下离心15 min, 取上清液5 μL进样。采用WatersXevo系列三重四级杆质谱仪测定, 氮气为载气, 电喷雾离子源(ESI)正负离子模式同时检测记录实验结果。
5 抗炎活性实验本实验以采用鸡蛋清作为致炎剂, 以雄性大鼠(成年SD大鼠, 体重190~200 g, 购于军事医学科学院北京实验动物中心, 实验前禁食12 h, 自由饮用无菌水)为模型, 设置两组对照组和两组实验组。阳性对照组静脉注射地塞米松, 阴性对照组静脉注射生理盐水, 两组实验组分别静脉注射二取代和一取代姜黄素琥珀酸酯钠盐的生理盐水溶液。踝关节方向皮下注射鸡蛋清作为致炎方式, 并测定大鼠踝关节肿胀程度, 以观察姜黄素衍生物的抗炎消肿作用, 具体实验步骤为:将20只雄性大鼠随机分为4组, 每组5只, 称重, 并分别编号为1、2、3、4、5。其中第一组是生理盐水组, 第二组是二取代姜黄素琥珀酸酯钠盐组, 第三组是地塞米松组, 第四组是一取代姜黄素琥珀酸酯钠盐组; 取第一组大鼠由尾静脉注射生理盐水1 mL·kg -1, 第二组大鼠由尾静脉注射0.5%的二取代姜黄素琥珀酸酯钠盐生理盐水溶液1 mL·kg-1, 第三组大鼠由尾静脉注射0.5%地塞米松注射液1 mL·kg-1, 第四组大鼠由尾静脉注射0.5%的一取代姜黄素琥珀酸酯钠盐生理盐水溶液1 mL·kg-1; 剪去每只鼠右后肢踝关节的毛并在足跖某处用记号笔画点作为测量点, 并用软尺测量右后足的原始周长; 在4组大鼠注射药物30 min后, 从右后足掌心向踝关节方向用4号针头皮下注射10%鸡蛋清0.1 mL; 在注射致炎物后的5、15、30、60和120 min分别测量右后足跖的周长, 将致炎后的足跖厚度减去致炎前的足跖厚度即为足跖肿胀度。
| [1] | Ferrero-Miliani L, Nielsen OP, Andersen PS, et al. Chronic inflammation-importance of NOD2 and NALP3 in interleukin-1β generation[J]. Clin Exp Immunol, 2007, 147: 227–235. |
| [2] | Vane JR. Inhibition of prostaglandin synthesis as a mechanism of action for aspirin-like drugs[J]. Nat New Biol, 1971, 231: 232–235. DOI:10.1038/newbio231232a0 |
| [3] | Roth G, Chandra A, Nair M. Novel bioactivities of Curcuma longa constituents[J]. Nat Prod, 1998, 61: 542–545. DOI:10.1021/np970459f |
| [4] | Aggarwal BB, Kumar AP, Bharti AC. Anticancer potential of curcumin preclinical and clinical studies[J]. Anticancer Res, 2003, 23: 363–398. |
| [5] | Jordan WC, Drew CR. Curcumin-a natural herb with anti-HIV activity[J]. J Natl Med Assoc, 1996, 88: 333. |
| [6] | Chan MM, Ho CT, Huang HI. Effects of three dietary phytochemicals from tea rosemary and turmeric on inflammation-induced nitrite production[J]. Cancer Lett, 1995, 96: 23–29. DOI:10.1016/0304-3835(95)03913-H |
| [7] | Chan MM, Huang HI, Fenton MR, et al. In vivo inhibition of nitric oxide synthase gene expression by curcumin a cancer preventive natural product with anti-inflammatory properties[J]. Biochem Pharmacol, 1998, 55: 1955–1962. DOI:10.1016/S0006-2952(98)00114-2 |
| [8] | Lukita Atmadja W, Ito Y, Baker GL, et al. Effect of curcuminoids as anti-inflammatory agents on the hepatic microvascular response to endotoxin[J]. Shock, 2002, 17: 399–403. DOI:10.1097/00024382-200205000-00010 |
| [9] | Mukhopadhyay A, Basu N, Ghatak N, et al. Anti-inflammatory and irritant activities of curcumin analogues in rats[J]. Agents Actions, 1982, 12: 508–515. DOI:10.1007/BF01965935 |
| [10] | Satoskar RR, Shah SJ, Shenoy SG. Evaluation of antiinflammatory property of curcumin (diferuloyl methane) in patients with postoperative inflammation[J]. Int J Clin Pharmcol Ther Toxicol, 1986, 24: 651–654. |
| [11] | Lal B, Kapoor AK, Asthana OP, et al. Efficacy of curcumin in the management of chronic anterior uveitis[J]. Phytother Res, 1999, 13: 318–322. DOI:10.1002/(ISSN)1099-1573 |
| [12] | Lal B, Kapoor AK, Agrawal PK, et al. Role of curcumin in idiopathic inflammatory orbital pseudotumours[J]. Phytother Res, 2000, 14: 443–447. DOI:10.1002/(ISSN)1099-1573 |
| [13] | Majeed M, Badmaev V, Shivakumar U, et al. Curcuminoids Antioxidant Phytonutrients[M]. Piscataway, NJ: Nutriscience Publishers Inc, 1995. |
| [14] | Cheng AL, Hsu C, Lin J, et al. Phase Ⅰ clinical trial of curcumin a chemopreventive agent in patients with high-risk or pre-malignant lesions[J]. Anticancer Res, 2001, 21: 2895–2900. |
| [15] | Deodhar SD, Sethi R, Srimal RC. Preliminary studies on antirheumatic activity of curcumin[J]. Indian J Med Res, 1980, 71: 632–634. |
| [16] | Wahlstrom B, Blennow G. A study on the fate of curcumin in the rat[J]. Basic Clin Pharmacol, 1978, 43: 86–92. |
| [17] | Pan MH, Huang TM, Lin JK. Biotransformation of curcumin through reduction and glucuronidation in mice[J]. Drug Metab Dispos, 1999, 27: 486–94. |
| [18] | Modasiya M, Patel V. Studies on solubility of curcumin[J]. Int J Pharm Life Sci, 2012, 3: 1490–1497. |
| [19] | Wang YJ, Pan MH, Cheng AL, et al. Stability of curcumin in buffer solutions and characterization of its degradation products[J]. J Pharm Biomed, 1997, 15: 1867–1876. DOI:10.1016/S0731-7085(96)02024-9 |
| [20] | Wan H, Zhao Y, Han G, et al. Study on stability of curcumin in different condition[J]. Med Innov China (中国医学创新), 2009, 6: 17–18. |
| [21] | Wahlstrom B, Blennow G. A study on the fate of curcumin in the rat[J]. Basic Clin Pharmacol, 1978, 43: 86–92. |
| [22] | Ammon HP, Safayhi H, Mack T, et al. Mechanism of antiinflammatory actions of curcumin and boswellic acids[J]. J Ethnopharmacol, 1993, 38: 113–119. DOI:10.1016/0378-8741(93)90006-Q |
| [23] | Jian YT, Wang JD, Mai GF, et al. Curcumin regulates cyclooxygenase-2 activity in trinitrobenzene sulfonic acid-induced colitis[J]. J Fourth Mil Med Univ (第四军医大学学报), 2005, 26: 521–524. |
 2018, Vol. 53
2018, Vol. 53


