2. 河南大学基础医学院, 河南 开封 475004
2. School of Basic Medical Science, Henan University, Kaifeng 475004, China
氧化应激(oxidative stress, OS)指在遭受各种有害刺激时, 机体内的活性氧(reactive oxygen species, ROS)、活性氮(reactive nitrogen species, RNS)等自由基产生过多, 超过机体的清除能力, 机体内氧化与抗氧化系统动态失衡, 导致组织损伤。为减轻这种损害, 生物在进化过程中不断完善自身复杂的防御功能, 其中核因子E2相关因子2 (nuclear factor erythroid-2 related factor 2, Nrf2)介导的信号通路是细胞内抗氧化应激和维持氧化还原平衡的重要通路之一[1]。Nrf2是调控机体抗氧化应激反应的核转录因子, 能够诱导抗氧化、抗炎症及生物转化酶等保护细胞的相关基因表达[2]。在非应激条件下, Nrf2连接到Keap1- Cul3-E3复合体上, 受Cul-3-E3泛素连接酶的作用迅速泛素化, 经由泛素-蛋白酶体通路降解。当细胞内发生氧化应激或亲电信号增强时, Keap1 (Kelch-like ECH-associated protein 1)蛋白的半胱氨酸残基被氧化, 构象发生改变与Nrf2解偶联, 释放出游离的Nrf2, 进入细胞核, 诱导一系列靶基因的表达[3]。
p62作为信号转导途径中一种支架和适配子蛋白, 分子结构中的多个功能结构域与相应蛋白相互作用, 介导多种细胞功能, 尤其在细胞的选择性自噬过程中发挥重要作用[4]。2010年, Komatsu等[5]研究发现, 在自噬缺陷的小鼠肝脏, p62的大量积聚可以激活Nrf2通路, 这种作用是通过p62与Keap1蛋白的结合完成的。由此推测, p62表现出的抗氧化作用与Nrf2/Keap1信号通路有关。氧化应激和过量ROS的产生与多种神经退行性疾病、慢性肝脏疾病、动脉粥样硬化、类风湿关节炎以及恶性肿瘤的发病密切相关, 也是机体衰老发生的重要原因。某些神经退行性疾病和慢性肝脏疾病中细胞自噬活性降低, 细胞内形成的异常蛋白质聚集体和包涵体中常发现p62蛋白存在[6]。因此, p62参与调节Nrf2信号途径的作用机制及与细胞抗氧化保护和疾病的关系引起广泛关注, 深入研究p62与Nrf2/Keap1信号通路的关系也将为寻找治疗这些疾病的新方法提供依据。
1 p62的结构特征及表达调控p62也称SQSTM1, 由SQSTM1基因编码, 分子质量为62 kDa。最早是作为淋巴细胞特异性蛋白酪氨酸激酶(lymphocyte-specific protein tyrosine kinase, Lck)结合配体被发现[7], 后发现也可作为非典型蛋白激酶C (atypical protein kinase C, aPKC)的结合伴侣[8]。p62蛋白含有440个氨基酸残基, 这些氨基酸序列包含至少9个带有结构性模体的结构域, 包括: ① PB1结构域, 位于N末端的Phox和Bem1结构域, 介导p62蛋白低聚物形成及其与aPKC、ERK、NBR1、MEK5等的结合; ② ZZ型锌指结构域(ZNF), 可与RIP (receptor interacting protein)结合, 与肿瘤坏死因子信号转导和NF-κB的激活途径有关; ③ p38结合结构域, 与一种促有丝分裂蛋白激酶(MAPK) p38结合, 参与细胞因子受体信号转导通路; ④ TBS结构域, 参与结合肿瘤坏死因子受体相关因子6 (tumor necrosis factor receptor associated factor 6, TRAF6)。TRAF6属于泛素蛋白连接酶E3的RING (really interesting new gene)结构域家族成员, 催化泛素连接成多聚泛素链, 也通过本身的多聚泛素化被激活, 在NF-κB信号转导中发挥作用; ⑤核定位信号(nuclear localization signal, NLS)和核输出信号(nuclear export signal, NES)结构域, 介导p62在细胞质与细胞核之间持续快速穿梭移动; ⑥ LIR (LC3-interaction region), 由22个氨基酸构成的线状区域, 介导p62与微管相关蛋白1轻链3 (microtubule-associated protein 1 light chain 3, LC3)的相互作用, 在自噬体形成和自噬降解中起关键作用; ⑦ PEST序列, 一段富含脯氨酸、谷氨酸、丝氨酸和苏氨酸的26个氨基酸序列, 可能参与蛋白质的快速降解与更新; ⑧ KIR (Keap1 interacting region), 与Keap1结合的作用区域, Keap1将Cul-3泛素连接酶募集到底物上, 促进其泛素化, 将标记多聚泛素链的Nrf2转运到蛋白酶体降解; ⑨ UBA结构域(ubquitin-associated domains), 位于p62的C末端, 以非共价键的形式结合泛素, 选择性募集损伤的蛋白和细胞器, 传递至自噬泡经自噬途径降解。p62还通过UBA结构域与caspase-8作用, 促进细胞凋亡[9] (图 1)。
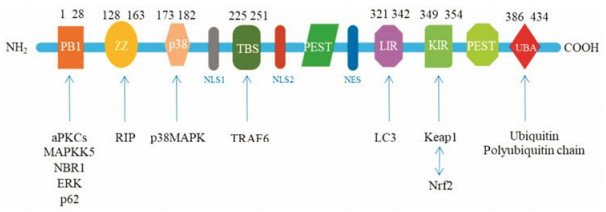
|
Figure 1 The functional domains of p62 |
细胞内p62蛋白含量主要受转录水平的调控, 翻译后的自噬性降解也对p62蛋白水平产生较大影响, 经氧化应激活化的Nrf2途径是诱导编码p62的SQSTM1在转录水平表达的重要因素。内质网应激也诱导SQSTM1的mRNA表达, 该过程受到Ras-ERK和JNK/c-Jun信号的调控。细胞内蛋白酶体途径受到抑制和处于应激(如饥饿、缺氧)状态也能诱导p62的合成[10]。p62蛋白通过自噬途径被迅速降解。若SQSTM1的mRNA表达没有大幅度改变时, p62蛋白水平增高是自噬损伤的标志。
2 Nrf2的结构及调控Nrf2属于CNC-bZIP家族成员, 是抗氧化防御系统的重要转录因子。鼠的Nrf2蛋白由597氨基酸组成, 人Nrf2蛋白则由605个氨基酸构成。Nrf2是一种功能模块化的蛋白质, 由Itoh等[11]首次克隆并命名为erythroid cell-derived protein with CNC homology (ECH), 由不同的保守结构域构成, 称为Neh (Nrf2- ECH homology)结构域。目前有7个结构域被报道, 即Neh1~Neh7, 每一结构域都具有不同的功能。Neh1是包含碱性亮氨酸拉链(bZIP)的结构域, 与其他蛋白质和DNA结合形成异源二聚体。Neh2位于Nrf2的N末端, 介导Nrf2与Keap1的结合, 在Keap1抑制Nrf2活性过程中起关键作用。Neh3位于Nrf2的C端, 参与Nrf2对靶基因的反式激活。若去除Nrf2蛋白C端的16个氨基酸, Nrf2的bZIP结构域则丧失功能[12]。Neh4和Neh5位于Neh1与Neh2之间, 也是Nrf2发挥反式激活作用的结构域。分别与具有转录激活作用的CBP (cAMP-response-element-binding protein-binding protein)和BRG1结合, 协同诱导组蛋白乙酰化和染色质解聚, 使RNA聚合酶复合物易于与DNA的启动子区域相互作用, 启动靶基因mRNA的转录[13]。Neh6和Neh7参与对Nrf2的翻译后调节, 尽管对Nrf2活性也起着抑制作用, 但与Neh2与Keap1结合作用的机制不同。Neh6和Neh7对Nrf2活性调节作用也与氧化还原状态无关。Neh6还包含DSGIS和DSAPGS两个保守的模体, 参与β-TrCP (β-transducin repeat-containing protein)对Nrf2识别和结合。Neh7还可以直接作用于维甲酸X受体α (retinoid X receptor α, RXRα)的DNA结合的结构域, 减少Neh4和Neh5与相应辅助激活因子的结合, 抑制Nrf2的活性[14]。Nrf2活性的调节主要通过改变Nrf2蛋白的降解速度完成。在基础条件下, Nrf2受Cul-3-E3泛素连接酶催化迅速泛素化, 经26S蛋白酶体降解。鼠类肝癌Hepa细胞Nrf2的半寿期仅有13 min, 人肝癌HepG2细胞的半寿期也仅15 min[15]。
Keap1是Cul3-E3泛素连接酶底物适配子蛋白, 与Cul3-E3泛素连接酶结合形成Keap1-Cul3-E3复合体, 并在细胞质与Nrf2结合, 促进Nrf2蛋白泛素化和蛋白酶体降解, 维持Nrf2在低水平状态[16]。Keap1含有627个氨基酸残基, 人类Keap1包含27个半胱氨酸残基, 其中的部分半胱氨酸残基对ROS和亲电子试剂非常敏感。Keap1半胱氨酸残基的修饰可改变Keap1的构象, 使其与Nrf2解耦联。因此, Keap1被视为氧化应激的传感器[17]。Keap1包含5个结构域, 包括N端结构域、BTB (broad complex, Tramtrack, and Bric-a-Brac)结构域、IVR (intervening region)结构域、Kelch重复结构域又称DGR (double glycine repeat)区和C端结构域。其中, BTB结构域是与其他蛋白质相互作用的结构域, 参与同源或异源二聚体的形成, 也参与Keap1与Cul3-E3泛素连接酶结合过程。IVR结构域含有较多半胱氨酸残基, 其中Cys257、Cys273、Cys288和Cys297已确定与Keap1作用有关, 还可以与Cul3-E3泛素连接酶作用, 诱导Nrf2的泛素化[18]。Kelch重复结构域介导Keap1与Nrf2的Neh2结合。Nrf2与Keap1的作用机制一般用“铰链与门闩模型” (hinge-and-latch model)解释。Neh2包括2个高度保守的肽段序列与Keap1结合, 即低亲和力的DLG模体(门闩)和高亲和力的ETGE模体(铰链)[19]。在非氧化应激状态下, 细胞质内同源二聚体的Keap1中的2个Kelch结构域分别与ETGE和DLG模体结合, 这种“两点结合”的模式保证Nrf2的构象易受Cul3-E3泛素连接酶催化作用, 迅速泛素化并于26S蛋白酶体快速降解。Nrf2的泛素化位点位于DLG与ETGE模体之间的一段α-螺旋, 包含7个赖氨酸残基。Keap1与ETGE模体具有较高的亲和力, 而与DLG模体结合特点是“快速连接和快速断开”。在氧化应激条件下, ROS通过对IVR结构域的半胱氨酸残基的修饰, 改变Keap1的构象, 致使低亲和力的DLG模体与Keap1解开(打开门闩), 使Cul3-E3泛素连接酶不能有效作用于Nrf2的泛素化位点, Nrf2的泛素化和蛋白酶体降解被阻断。但高亲和力的ETGE模体并未与Keap1解开, 类似于门的铰链连接。在此状态下, 由于细胞质中Nrf2通过ETGE模体与Keap1结合, 占据Keap1的结合位点但不能被降解, 两者的结合处于饱和状态, 新合成的Nrf2易于转移至细胞核内, 与sMaf形成异二聚体后识别并结合ARE基因序列, 诱导多个与细胞保护相关基因的表达[20] (图 2)。
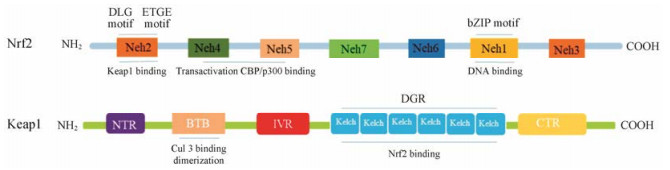
|
Figure 2 Domain stucture of Nrf2 and Keap1 protein |
2010年, 5个课题组先后独立证明p62与Keap1相互作用, 进而阐明Nrf2-Keap1-ARE通路与自噬作用的相互联系[21, 22]。其中3个课题组证明了p62的KIR结构域(349-DPSTGE-354)直接参与结合Keap1。自噬缺陷导致p62蛋白积聚时, Keap1被限制在p62蛋白的聚合物中, p62通过LIR结构域与自噬相关蛋白LC3结合形成LC3-p62-Keap1复合体, 将Keap1转运至自噬体降解, 减少Keap1-Cul3-E3复合体的形成, 降低Nrf2泛素化以及通过泛素-蛋白酶体通路的降解, 活化Nrf2信号通路[23]。因此, p62在调节Keap1自噬性降解和控制Keap1作用方面发挥关键作用。p62过度表达会降低Keap1的半衰期, 而敲除p62或Atg7基因延长其半衰期, 造成Keap1积聚[24]。X射线晶体结构分析表明, p62的KIR结构域结合Kelch重复结构域的方式与Nrf2 ETGE模体结合Keap1的方式十分类似, 提示p62过表达或在细胞内大量积聚可竞争性抑制Keap1与Nrf2的结合[5]。但是, 由于Keap1与p62的结合解离常数显著低于Keap1与Nrf2 ETGE模体的结合解离常数, p62似乎对Keap1与Nrf2的结合不会产生太大影响。根据蛋白质氨基酸序列分析结果, p62-KIR的氨基酸序列中与Nrf2-ETGE的谷氨酸残基相对应的氨基酸残基是351位的丝氨酸残基(S351), 且S351保守性强, 由此Komatsu课题组[25]推测, 如果p62的S351磷酸化, 其与Keap1的亲和力将会大大增加, 达到与Nrf2-ETGE竞争的程度。实际检测的结果是, KIR结构域中S351的磷酸化使p62与Keap1亲和力提高了大约30倍, 显著增强了p62与Keap1结合能力。但p62磷酸化的确切信号途径尚不清楚, 目前认为至少mTOR (mammalian target of rapamycin)、ULK1 (UNC-51-like kinase 1)和TBK1 (TANK-binding kinase 1) 3种不同激酶参与这一过程。p62的S351被mTORC1诱导产生磷酸化后, 更易与Keap1的结合, 促进Keap1的自噬性降解[26]。
p62的表达也受Nrf2调控, Nrf2直接与p62启动子区的抗氧化反应元件ARE结合, 在转录水平诱导p62的表达[27]。同时, p62表达量增加能够通过结合Keap1增加Keap1的降解, 减少Nrf2泛素化, 使Nrf2的作用增强, 形成了一条正反馈回路。p62与Nrf2的正反馈调节机制受多种因素影响, 在细胞抗氧化作用机制以及许多疾病发病和治疗策略制定中具有重要意义。应用自噬缺陷小鼠模型发现, 敲除小鼠肝细胞自噬信号通路中关键的Atg5或Atg7基因, 均能观察到p62-Keap1在细胞质积聚和Nrf2持续活化及其所致组织损伤和肿瘤产生[28]。此类非经典Nrf2活化现象也在Atg7敲除的小鼠肺、表皮角化细胞和黑色素细胞中观察到。早期对低剂量砷剂致癌作用机制的研究中, 发现低剂量亚砷酸钠通过降低Nrf2的泛素化水平, 活化Nrf2, 但并没有Keap1的半胱氨酸修饰[29]。以后的研究发现, 砷剂激活Nrf2的作用, 是通过p62途径(非经典途径)完成的[30]。
4 p62/Nrf2通路的细胞保护作用氧化应激过程产生的ROS造成生物大分子损伤, 是导致多种疾病和衰老的重要因素。Keap1-Nrf2- ARE信号通路作为机体抗氧化应激和维持氧化还原平衡的重要信号通道之一, 能够诱导与ROS清除、生物转化、DNA修复和线粒体功能相关的基因表达, 如超氧化物歧化酶(superoxide dismutase, SOD)和过氧化氢酶(catalase, CAT)等, 降低细胞内ROS含量, 减少氧化应激所造成的损伤。在认识p62与Nrf2- Keap1-ARE通路相互作用的机制前, 已有研究发现, NF-κB介导的细胞保护作用需要p62的参与。p62缺陷的小鼠细胞内ROS水平显著提高, 细胞死亡率和恶性转化均增加[31]。羟基酪醇(hydroxytyrosol)能够诱导视网膜色素上皮细胞中Nrf2表达, 增加细胞的GSH水平, 保护细胞免受t-BHP导致的凋亡, 此过程伴随p62表达的显著变化。羟基酪醇处理细胞6 h后, p62的mRNA表达量以羟基酪醇剂量依赖方式提高。特别是经羟基酪醇处理24 h后, p62的蛋白质水平显著增加[32]。能量物质供应不足和营养过剩都可造成细胞内ROS水平增高。禁食后提供高糖无脂饮食的小鼠, mTORC1活性增加, 抑制自噬作用, 使肝细胞p62水平增加, 促进Keap1的降解和Nrf2的活化, 减少过量ROS对细胞的损伤作用[33]。高水平的p62也能够增加mTORC1活性, 减少细胞的自噬作用, 进一步增加p62蛋白水平, 对于保护细胞和维持细胞在机体能量代谢异常情况下的生存有重要意义。支气管上皮细胞慢性镉暴露所致恶性转化的研究中, 细胞内ROS的变化引起了广泛的关注。在细胞发生恶性转化前, 在镉诱导下细胞内ROS水平明显增加。但在恶性转化之后, 细胞自噬作用障碍, p62含量增加, Nrf2被激活, 抗氧化相关的酶如CAT、SOD1和抗凋亡蛋白如Bcl-2、Bcl-xL表达量增加, 细胞内ROS水平下降, 致使细胞凋亡率下降, 细胞的生存、增殖和恶变率增加[34]。利用光敏剂对肿瘤细胞进行光动力学治疗时, 细胞内产生了高浓度ROS和含p62和NBR1 (neighbor of BRCA1 gene 1)的聚集物, 且该聚集物需通过p38MAPK途径调节的自噬作用清除。用遗传学方法或药物阻断p38MAPK途径可减少p62和NBR1聚集物的形成, 降低Nrf2活性, 增加光敏剂诱导的氧化应激作用和细胞死亡率。p62缺陷时细胞内聚集物减少, ROS水平降低, caspase活性降低, 细胞生存率增加[35]。Kaposi肉瘤相关疱疹病毒(Kaposi’s sarcoma-associated herpesvirus, KSHV)能够诱导被感染内皮细胞的Nrf2活化, 活化的方式与由ROS介导的“经典途径”无关, 是通过磷酸化p62的S351和S403, 增加其与Keap1亲和力, 诱导Keap1的63位赖氨酸的多泛素化及降解增加所致[36]。
许多与衰老相关疾病中, 氧化应激作用是造成蛋白质损伤的重要因素, 受损蛋白质在细胞质聚集并泛素化, 经自噬过程清除。p62能够加速自噬作用, 减少受损蛋白对细胞的毒害作用。因此, 有人将p62作为衰老相关疾病的潜在治疗靶点, 并展开多项研究。在视网膜黄斑变性发病机制的研究中, 已确认p62通过加强自噬清理作用和活化Nrf2抗氧化信号通路保护视网膜色素上皮细胞。特别是在氧化应激条件下, p62与Nrf2相互促进, 形成正反馈调节机制, 为视网膜黄斑变性的预防和治疗手段提供新的思路[37]。正常皮肤黑色素细胞暴露在H2O2时, 自噬作用显著增强, 保护细胞避免氧化损伤。但白癜风患者黑色素细胞的自噬功能受损, 对H2O2造成的氧化损伤高度敏感。Li课题组等[38]证明, 白癜风患者黑色素细胞的自噬异常与Nrf2-p62通路的损伤有关。上调Nrf2-p62通路或p62水平可减轻H2O2对白癜风黑色素细胞的氧化损伤作用。因此, 上调p62相关的信号通路可用于治疗白癜风。同一课题组应用辛伐他汀保护白癜风黑色素细胞避免H2O2的氧化损伤作用。结果显示, 经辛伐他汀处理后的黑色素细胞内ERK/JNK和p62均被激活, 并与活化的Nrf2形成正反馈调节环路, 有效提高黑色素细胞的抗氧化能力, 为此类药物的临床应用提供了实验依据[39]。
5 p62/Nrf2通路与神经系统疾病Nrf2在脑组织中广泛存在, 是调节自噬、氧化应激和炎症的重要信号分子[40]。已发现Nrf2在调节小胶质细胞功能, 保护神经元及星形胶质细胞避免氧化损伤方面发挥关键作用[41]。在小鼠中枢神经系统, Nrf2具有细胞保护作用, Nrf2缺陷小鼠对缺血性脑损伤的敏感性增加。星形胶质细胞表达的Nrf2也能保护细胞及临近神经元, 减少有害物质对细胞的损伤。但在Keap1敲除小鼠, 持续激活Nrf2则表现出对细胞的损伤作用[42]。Nrf2活性随年龄增长而下降, 是影响神经退行性疾病发病的重要因素。
氧化应激通过激活Nrf2, 刺激一系列自噬基因的表达, 特别是p62的表达。脑组织中的p62也受mTOR复合物作用而磷酸化, 进一步激活Nrf2[43]。人脑组织病理分析结果显示, 各种神经退行性疾病如阿尔茨海默病(Alzheimer's disease, AD)、路易体痴呆(dementia with Lewy bodies, DLB)、帕金森病(Parkinson's disease, PD)和肌萎缩侧索硬化症(amyotrophic lateral sclerosis, ALS)等脑组织细胞质包涵体中均有Keap1与p62共定位[44]。AD患者脑组织总p62水平显著高于非AD患者, 特别是AD患者脑组织p62蛋白的349位丝氨酸残基(S349)磷酸化程度显著升高, 并与脑组织的持续氧化应激状态有关[45]。二硫化碳(carbon disulfide, CS2)是一种在化工工业广泛应用的有机溶剂, 可造成多种神经系统疾病。CS2处理的大鼠脊髓神经元的mTORC1信号系统被激活, 增加p62水平和其磷酸化状态, 降低Keap1的水平。Nrf2从细胞质转位的细胞核, 诱导Nrf2-ARE信号系统的活化, 抗氧化酶的表达量显著增加。说明CS2导致神经系统氧化应激的同时, 通过激活p62-Nrf2-Keap1途径, 减少氧化应激损伤, 具有相应的保护作用[46]。近年来, 在寻找治疗神经退行性疾病新靶点时, 人们对Nrf2控制的抗氧化途径寄予希望。在体外实验中发现, 一种神经细胞分化诱导剂鼠尾草酸在诱导PC12细胞分化过程中, 通过Nrf2诱导p62表达, 促进TrkA信号, 增强Nrf2的作用。如将p62基因敲除, 鼠尾草酸诱导神经分化作用被抑制[47]。
脑组织氧化应激对细胞的损伤可降低自噬功能, 细胞内有害蛋白质和损伤的细胞器不能及时清除, 最终导致神经元死亡。自噬功能障碍导致错误折叠细胞毒性蛋白以包涵体形式过量积聚, 是多种神经退行性疾病的病理学标志。在各种神经退行性疾病的脑神经元细胞质的包涵体中都发现p62蛋白的存在和细胞核Nrf2水平降低[48]。p62缺陷小鼠脑组织Nrf2的核转位也下降, 并表现出类似AD样的症状[49]。二甲基延胡索酸(dimethyl fumarate, DMF)通过激活Nrf2, 可减轻帕金森病毒素6-羟多巴胺在鼠黑质纹状体产生氧化应激, 具有神经保护作用[50]。营养学研究结果显示, 食用含多酚类物质如花青素、芪类、褪黑激素、山柰酚、槲皮素、白藜芦醇和完整水果, 可激活自噬, 保护神经元避免氧化应激损伤。多种多酚类物质能够激活神经元的Nrf2, 启动ARE介导生物转化酶类和抗氧化应激蛋白的转录和表达, 如谷胱甘肽过氧化物酶(glutathione peroxidase)、谷胱甘肽转移酶(glutathione transferase, GST)和SOD, 减少氧化应激[51]。在一项对一种巴西特有浆果açaí营养机制研究中, 发现摄入大量açaí食物大鼠的海马和额皮质的ROS和炎症标识物减少, Nrf2表达显著增加, 内源性抗氧化酶激活, 但额皮质的p62积聚显著低于对照组。免疫组化染色结果也显示, 补充açaí可使动物额皮质“斑点状”包涵体减少。更深入的机制研究发现, 摄入açaí食物通过抑制mTOR的磷酸化, 激活beclin1, 减少p62积聚和LC3的转变, 诱导海马和额皮质的自噬[52]。
对于散发的神经退行性疾病, 衰老是重要的风险因素。随着年龄增加, 细胞的蛋白降解系统的效率越来越低。已有报道, NRF2缺陷可加重早期PD患者神经元的蛋白质积聚、炎症和死亡。一般认为, 泛素-蛋白酶体降解系统和自噬系统的变化相互影响, 均与神经退行性疾病的发病机制有关[53]。近期一项研究结果显示, 大脑皮质神经元的26S蛋白酶体功能障碍可提高线粒体的p62和OPTN的磷酸化程度, p62的UBA和LIR结构域分别将泛素化物质与自噬体连接, 表现为早期阶段选择性自噬[54]。由于神经元基础自噬效率较高, 短期26S蛋白酶体功能障碍诱导自噬发生可能对细胞具有保护作用, 但持续26S蛋白酶体功能障碍可能启动过度自噬, 甚至导致自噬性细胞死亡[55]。
6 p62/Nrf2通路与心血管疾病心肌细胞对有氧代谢的需求很高, 需要大量线粒体的支持。在机体所有细胞类型中, 心肌细胞的线粒体含量最高, 占据细胞体积的40%。心肌细胞的这种特征能产生更多的ROS。但与之矛盾的是, 心肌组织的SOD、CAT、谷胱甘肽过氧化物酶和谷胱甘肽还原酶的含量并没有相应提高, 远低于肝脏, 使心脏更易于受到氧化应激的损伤。心血管系统过多的ROS产物造成血管损伤, 通过血管内皮细胞与血管平滑肌细胞相互作用, 最终导致异常血管重构, 是高血压、动脉粥样硬化和心衰的重要病理基础[56]。Nrf2在调控机体抗氧化应激反应中具有重要作用。Nrf2启动子多态性的调查数据显示, Nrf2的表达量下降可增加心血管疾病的发病概率[57]。动物实验结果显示, 小鼠心肌组织Nrf2基因敲除加重缺血性心力衰竭, 并提高主动脉缩窄的死亡率。在持续应用血管紧张素II之后, Nrf2基因敲除小鼠表现出比野生型小鼠更严重心脏氧化应激和心肌肥厚[58]。心血管损伤作用常表现为Nrf2激活, 同时细胞内p62也发生相应的变化。DPP-4抑制剂吉格利汀通过激活Nrf2, 直接降低血管平滑肌细胞的异常增殖和迁移。吉格利汀激活Nrf2不仅在mRNA水平, 也经p62的作用, 增加Keap1的蛋白酶体降解, 诱导Nrf2的靶基因HO-1和NQO1的表达, 这类药物对预防动脉粥样硬化和心肌梗死作用显著[59]。体内实验证明, 血管损伤后, p62在降低血管新生内膜增生和颈动脉重塑方面发挥基础作用。p62基因敲除小鼠的大动脉血管平滑肌细胞在体外培养和胎牛血清作用下较野生型的增殖更快, 细胞密度更高, 说明p62对血管平滑肌细胞增殖具有抑制作用。另外, p62缺陷的血管平滑肌细胞较野生型迁移更快, 说明p62对血管平滑肌细胞迁移具有抑制作用[60]。
大多数心肌损伤或心肌细胞死亡都是由于缺血增加ROS启动的。心肌损伤引发的急性炎症反应, 使嗜中性粒细胞和巨噬细胞渗透到心肌组织, 也成为ROS的另一来源, 心肌缺血再灌注进一步增加心脏的ROS负荷, 加大对心肌的损害作用。已观察到心肌梗死患者服用大剂量他汀类药物能显著改善疗效, 尽管他汀类药物介导心脏保护作用的机制不清楚, 有证据显示他汀类除抑制炎症反应外, 也激活Nrf2通路。阿伐他汀用于冠状动脉左前降支闭锁的大鼠, 诱导Nrf2和HO-1的表达, 使梗死面积减少20%[61]。心肌细胞培养模型也显示, Nrf2通过降低ROS并诱导抗氧化酶和生物转化酶的表达对心肌细胞的保护作用[62]。应用鼠类心肌梗死模型, 发现多种Nrf2诱导剂能够减少梗死面积、保护左心室功能和减少心律失常的发生。一种三萜系化合物甲基巴多索隆, 来源于天然产物齐墩果酸, 作为Nrf2的强力诱导剂已进行了临床试验, 可在多个器官激活Nrf2, 对心脏具有保护作用[63]。白藜芦醇也已被证明有希望用于临床治疗肿瘤和心血管疾病。用白藜芦醇处理后, 小鼠睾丸的Nrf2以及其下游基因如NQO-1、HO-1、SOD、CAT和金属硫蛋白的表达量均显著增加。研究发现, 白藜芦醇诱导的Nrf2活化主要依赖p62的作用, p62促进Keap1降解, 完成Nrf2活化过程[64]。
动脉粥样硬化源自血管局部区域胆固醇酯的沉积、炎症和氧化应激的相互作用, 导致内皮细胞损伤和平滑肌细胞增殖。应用小鼠模型或人内皮细胞检测的结果显示, 活化Nrf2能够减缓动脉粥样硬化的发生[65]。用氧化低密度脂蛋白(LDL)处理骨髓来源的巨噬细胞, 细胞内Nrf2升高, 减轻氧化损伤, 对细胞有保护作用。如巨噬细胞中缺乏Nrf2, 可加速泡沫细胞的形成, 促进动脉粥样硬化的发生[66]。高活性Nrf2抑制动脉粥样硬化的形成和发展与其抗炎作用有关, 而Nrf2对平滑肌细胞增殖的控制则影响动脉粥样硬化斑块形成[57]。Sergin等[67]报道, 动脉粥样硬化的泛素化包涵体含有大量p62蛋白, p62被隔离在泛素化包涵体中对机体是一种保护作用, 因为敲除p62基因可导致泛素化和错误折叠蛋白质的弥散性分布, 实验动物的预后更差。动脉粥样硬化血管的局部区域过量产生的ROS, 在促进泛素化包涵体形成的同时, 也活化Nrf2, 诱导p62的表达[68]。p62作为适配子蛋白将各种蛋白质转移到这种细胞质的小体中, 其中Keap1被募集并隔离是Nrf2活化的快速机制。应用DHA可以诱导p62阳性细胞质小体形成, 大部分Keap1被隔离, 同时活化Nrf2, 可显著增强血管内皮细胞对炎症信号的耐受作用。如敲除p62或Keap1基因, 将显著降低DHA介导的抗炎作用[69]。
7 p62/Nrf2通路与恶性肿瘤自噬在维持正常组织的稳态和肿瘤的生长中发挥关键作用。处于营养缺乏的恶劣微环境中, 肿瘤细胞需要依赖自噬作用与之适应, 降解蛋白质可有效提供氨基酸, 为细胞生存和增殖所需蛋白质提供合成原料。肿瘤细胞中自噬持续激活是由于PI3K/Akt/ mTOR信号通路的失调造成的。自噬对于肿瘤细胞是一把“双刃剑”。在肿瘤微环境中, 自噬作用可以促进肿瘤细胞的存活和增殖, 但有些情况下对肿瘤细胞有抑制作用。有人提出, 抑制自噬保护肿瘤细胞的机制可能与以下几种作用有关: ①自噬的底物之一p62在细胞内积聚, 激活NF-κB; ② p62积聚增加Nrf2的稳定性, 使肿瘤细胞对氧化应激具有更强的抵抗力; ③细胞保留包括线粒体在内的部分受损细胞器, 维持了细胞的基本代谢和功能[70]。Denk和Zatloukal课题组[71]首先在人肝细胞癌的细胞质透明小体中发现p62的积聚。人类的多种肿瘤细胞中都能够检测到p62的过度积聚。因此, 编码p62 DNA质粒的疫苗有可能用于癌症的免疫治疗[72]。
不断有证据显示, Nrf2蛋白水平在许多类型的癌细胞和癌症患者的肿瘤标本中是增加的, Nrf2的持续激活与多种实体瘤对化疗药物耐药有关[73]。Nrf2活性在某些癌细胞内的异常增高与Keap1-Nrf2系统的调节相关, 并引起关注。开始人们对这些发现感到困惑, 因为研究者一直认为, Keap1-Nrf2系统主要在预防化学致癌方面起作用。然而, Nrf2活性增高使癌细胞获得更强的抗氧化和药物代谢活性, 对细胞有保护作用, 利于癌细胞的恶性转化[74]。许多证据还表明, Nrf2蛋白表达水平与恶性肿瘤的侵袭性及不良预后正相关[75], 据此有人提出Nrf2表达量可作为恶性肿瘤不良预后的预测指标[76], 通过各种途径降低Nrf2的表达或靶向促进Nrf2的降解成为提高肿瘤疗效和改善肿瘤患者预后的新的治疗策略[77]。也有研究发现, Nrf2基因多态性是某些肿瘤治疗的预后标志物之一[78]。一般认为, 至少有4条途径与癌细胞内Nrf2激活有关: ① Nrf2、Keap1或CUL3突变造成Nrf2在癌细胞中的活性异常增高; ② Keap1表观遗传学变化导致Keap1表达下降, Nrf2增加; ③ p62、p21等与Keap1结合的蛋白在细胞内积聚, 阻断Nrf2与Keap1的结合, 导致Nrf2在细胞内大量积聚, 并发挥作用; ④受肿瘤代谢物如延胡索酸的作用, Keap1的半胱氨酸修饰影响其活性, 导致Nrf2的积聚。以上所有分子水平的变化的结果均是阻断Keap1与Nrf2的结合, 使Nrf2在肿瘤细胞内积聚, 增加具有细胞保护作用靶基因的表达, 使肿瘤细胞获得对化疗和放疗耐受的能力[79]。一项对175例胃癌患者的研究结果表明, Nrf2阳性组患者的总生存率显著低于Nrf2阴性组, Nrf2表达阳性与对以5-氟尿嘧啶为基础的联合化疗的耐药呈正相关关系[80]。
值得注意的是, Nrf2与p62形成的正反馈回路, 可能是某些致癌因素作用的关键途径。在对砷诱导皮肤癌机制的研究中, 发现砷剂作用于人皮肤角化HaCaT细胞可通过激活Nrf2诱导p62的表达, 小鼠皮肤的砷的慢性暴露也增加表皮细胞p62表达水平, 并与增殖有关, 但此作用机制却与自噬无关。提示砷诱导p62表达并形成p62/Nrf2正反馈回路在砷诱导皮肤癌机制中的重要作用, 靶向抑制p62可用于预防砷对皮肤癌的诱导作用[81]。有研究显示, 在p62诱导的肝细胞癌发生过程中, Nrf2具有重要的中介作用。用p62 KIR结构域点突变方式减少p62与Keap1的结合, 可降低Nrf2活性, 使p62失去致癌作用[82]。但是, 因突变所致的Nrf2活化在人肝细胞癌病例中仅占14%左右[83]。一项关于肝细胞癌模型的研究结果显示, 小鼠肝细胞癌和人肝细胞癌中HepG2细胞Nrf2活化主要是由于p62的作用而不是因Nrf2基因突变所致[84]。
乳腺癌细胞的Nrf2和p62表达量均较癌旁组织及良性乳腺上皮细胞高, 对多柔比星抵抗的乳腺癌细胞的Nrf2和p62表达量也显著高于多柔比星敏感细胞群, 将多柔比星抵抗的乳腺癌细胞的Nrf2和p62基因沉默后, 对多柔比星的敏感性显著提高[85]。应用Nrf2抑制剂能够降低HCV阳性的肝癌患者对抗癌药物的耐药作用[86]。顺铂抵抗的人卵巢癌细胞p62的表达水平远高于顺铂敏感者, 且这种顺铂耐药作用是通过调节Keap1-Nrf2-ARE信号途径实现的。在顺铂耐药的人卵巢癌细胞内敲除p62可恢复其对顺铂的敏感性[87]。
8 展望Nrf2-Keap1和自噬通路均是通过上调一系列抗氧化和细胞保护基因的表达, 减少氧化应激和细胞内外有害物质的破坏作用。正常情况下, Nrf2的间断活化对细胞具有保护作用, 能够维持细胞结构完整和功能的正常进行。但如果调控Nrf2的基因突变使Nrf2持续活化, 则促进肿瘤发生并增强肿瘤细胞对化疗药物的抵抗作用。自噬也是一种细胞应激反应, 在维护细胞内蛋白质稳态和细胞器健康方面发挥关键作用。p62作为自噬信号通路中的支架和适配子蛋白, 是自噬信号与Nrf2信号通路的相互连接和相互作用的枢纽。自噬作用障碍可导致细胞内的p62积聚, 将Keap1转运至自噬体降解, 减少Nrf2的降解, 活化Nrf2信号通路。尽管p62/Nrf2信号途径的诸多细节尚不清楚, 但目前研究已显示其在多种疾病尤其肿瘤的发生、发展以及治疗效果方面有重要作用。进一步研究和探讨p62/Nrf2信号途径复杂严密的调控机制, 不但帮助人们深入认识相关疾病的生理和病理机制, 也将为预防和延缓疾病的发展提供理论依据, 为寻找相关疾病的治疗和新药的作用靶点提供新思路。
| [1] | Stępkowski TM, Kruszewski MK. Molecular cross-talk between the NRF2/KEAP1 signaling pathway, autophagy, and apoptosis[J]. Free Radic Biol Med, 2011, 50: 1186–1195. DOI:10.1016/j.freeradbiomed.2011.01.033 |
| [2] | Zhao CY, Wang XL, Peng YK. Role of Nrf2 in neurodegenerative diseases and recent progress of its activators[J]. Acta Pharm Sin (药学学报), 2015, 50: 375–384. |
| [3] | Kobayashi M, Li L, Iwamoto N, et al. The antioxidant defense system Keap1-Nrf2 comprises a multiple sensing mechanism for responding to a wide range of chemical compounds[J]. Mol Cell Biol, 2009, 29: 493–502. DOI:10.1128/MCB.01080-08 |
| [4] | Liu SM, Dong YJ, Liu B. Progress of study on p62 and protein degradation pathways[J]. Acta Physiologica Sin (生理学报), 2015, 67: 48–58. |
| [5] | Komatsu M, Kurokawa H, Waguri S, et al. The selective autophagy substrate p62 activates the stress responsive transcription factor Nrf2 through inactivation of Keap1[J]. Nat Cell Biol, 2010, 12: 213–223. DOI:10.1038/ncb2021 |
| [6] | Deshmukh P, Unni S, Krishnappa G, et al. The Keap1-Nrf2 pathway:promising therapeutic target to counteract ROS-mediated damage in cancers and neurodegenerative diseases[J]. Biophys Rev, 2017, 9: 41–56. DOI:10.1007/s12551-016-0244-4 |
| [7] | Park I, Chung J, Walsh CT, et al. Phosphotyrosine-independent binding of a 62-kDa protein to the Src homology 2(SH2) domain of p56lck and its regulation by phosphorylation of Ser-59 in the lck unique N-terminal region[J]. Proc Natl Acad Sci U S A, 1995, 92: 12338–12342. DOI:10.1073/pnas.92.26.12338 |
| [8] | Sanchez P, De Carcer G, Sandoval IV, et al. Localization of atypical protein kinase C isoforms into lysosome-targeted endosomes through interaction with p62[J]. Mol Cell Biol, 1998, 18: 3069–3080. DOI:10.1128/MCB.18.5.3069 |
| [9] | Jin Z, Li Y, Pitti R, et al. Cullin3-based polyubiquitination and p62-dependent aggregation of caspase-8 mediate extrinsic apoptosis signaling[J]. Cell, 2009, 137: 721–735. DOI:10.1016/j.cell.2009.03.015 |
| [10] | Liu WJ, Ye L, Huang WF, et al. p62 links the autophagy pathway and the ubiqutin-proteasome system upon ubiquitynated protein degradation[J]. Cell Mol Biol Lett, 2016, 21: 29. DOI:10.1186/s11658-016-0031-z |
| [11] | Itoh K, Igarashi K, Hayashi N, et al. Cloning and characterization of a novel erythroid cell-derived CNC family transcription factor heterodimerizing with the small Maf family proteins[J]. Mol Cell Biol, 1995, 15: 4184–4193. DOI:10.1128/MCB.15.8.4184 |
| [12] | Nioi P, Nguyen T, Sherratt PJ, et al. The carboxy-terminal Neh3 domain of Nrf2 is required for transcriptional activation[J]. Mol Cell Biol, 2005, 25: 10895–10906. DOI:10.1128/MCB.25.24.10895-10906.2005 |
| [13] | Katoh Y, Itoh K, Yoshida E, et al. Two domains of Nrf2 cooperatively bind CBP, a CREB binding protein, and synergistically activate transcription[J]. Genes Cells, 2001, 6: 857–868. DOI:10.1046/j.1365-2443.2001.00469.x |
| [14] | Zenkov NK, Kozhin PM, Chechushkov AV, et al. Mazes of Nrf2 regulation[J]. Biochemistry (Mosc), 2017, 82: 556–564. DOI:10.1134/S0006297917050030 |
| [15] | Zenkov NK, Menshchikova EB, Tkachev VO. Keap1/Nrf2/ARE redox-sensitive signaling system as a pharmacological target[J]. Biochemistry (Mosc), 2013, 78: 19–36. DOI:10.1134/S0006297913010033 |
| [16] | Baird L, Llères D, Swift S, et al. Regulatory flexibility in the Nrf2-mediated stress response is conferred by conformational cycling of the Keap1-Nrf2 protein complex[J]. Proc Natl Acad Sci U S A, 2013, 110: 15259–15264. DOI:10.1073/pnas.1305687110 |
| [17] | Sihvola V, Levonen AL. Keap1 as the redox sensor of the antioxidant response[J]. Arch Biochem Biophys, 2017, 617: 94–100. DOI:10.1016/j.abb.2016.10.010 |
| [18] | Canning P, Cooper CD, Krojer T, et al. Structural basis for Cul3 protein assembly with the BTB-Kelch family of E3 ubiquitin ligases[J]. Biol Chem, 2013, 288: 7803–7814. DOI:10.1074/jbc.M112.437996 |
| [19] | Katoh Y, Iida K, Kang MI, et al. Evolutionary conserved N-terminal domain of Nrf2 is essential for the Keap1-mediated degradation of the protein by proteasome[J]. Arch Biochem Biophys, 2005, 433: 342–350. DOI:10.1016/j.abb.2004.10.012 |
| [20] | Dinkova-Kostova AT, Kostov RV, Canning P. Keap1, the cysteine-based mammalian intracellular sensor for electrophiles and oxidants[J]. Arch Biochem Biophys, 2017, 617: 84–93. DOI:10.1016/j.abb.2016.08.005 |
| [21] | Lau A, Wang XJ, Zhao F, et al. A noncanonical mechanism of Nrf2 activation by autophagy deficiency:direct interaction between Keap1 and p62[J]. Mol Cell Biol, 2010, 30: 3275–3285. DOI:10.1128/MCB.00248-10 |
| [22] | Copple IM, Lister A, Obeng AD, et al. Physical and functional interaction of sequestosome 1 with Keap1 regulates the Keap1-Nrf2 cell defense pathway[J]. J Biol Chem, 2010, 285: 16782–16788. DOI:10.1074/jbc.M109.096545 |
| [23] | Jiang T, Harder B, Rojo de la Vega M, et al. p62 links autophagy and Nrf2 signaling[J]. Free Radic Biol Med, 2015, 88: 199–204. DOI:10.1016/j.freeradbiomed.2015.06.014 |
| [24] | Guo W, Kan JT, Cheng ZY, et al. Hydrogen sulfide as an endogenous modulator in mitochondria and mitochondria dysfunction[J]. Oxid Med Cell Longev, 2012, 2012: 878052. |
| [25] | Ichimura Y, Waguri S, Sou YS, et al. Phosphorylation of p62 activates the Keap1-Nrf2 pathway during selective autophagy[J]. Mol Cell, 2013, 51: 618–631. DOI:10.1016/j.molcel.2013.08.003 |
| [26] | Moscat J, Diaz-Meco MT. Feedback on fat:p62-mTORC1-autophagy connections[J]. Cell, 2011, 147: 724–727. DOI:10.1016/j.cell.2011.10.021 |
| [27] | Liu Y, Kern JT, Walker JR, et al. A genomic screen for activators of the antioxidant response element[J]. Proc Natl Acad Sci U S A, 2007, 104: 5205–5210. DOI:10.1073/pnas.0700898104 |
| [28] | Ni HM, Boggess N, McGill MR, et al. Liver-specific loss of Atg5 causes persistent activation of Nrf2 and protects against acetaminophen-induced liver injury[J]. Toxicol Sci, 2012, 127: 438–450. DOI:10.1093/toxsci/kfs133 |
| [29] | Wang XJ, Sun Z, Chen W, et al. Activation of Nrf2 by arsenite and monomethylarsonous acid is independent of Keap1-C151:enhanced Keap1-Cul3 interaction[J]. Toxicol Appl Pharmacol, 2008, 230: 383–389. DOI:10.1016/j.taap.2008.03.003 |
| [30] | Lau A, Zheng Y, Tao S, et al. Arsenic inhibits autophagic flux, activating the Nrf2-Keap1 pathway in a p62-dependent manner[J]. Mol Cell Biol, 2013, 33: 2436–2446. DOI:10.1128/MCB.01748-12 |
| [31] | Duran A, Linares JF, Galvez AS, et al. The signaling adaptor p62 is an important NF-kappaB mediator in tumorigenesis[J]. Cancer Cell, 2008, 13: 343–354. DOI:10.1016/j.ccr.2008.02.001 |
| [32] | Zou X, Feng Z, Li Y, et al. Stimulation of GSH synthesis to prevent oxidative stress-induced apoptosis by hydroxytyrosol in human retinal pigment epithelial cells:activation of Nrf2 and JNK-p62/SQSTM1 pathways[J]. J Nutr Biochem, 2012, 23: 994–1006. DOI:10.1016/j.jnutbio.2011.05.006 |
| [33] | Rhee SG, Bae SH. The antioxidant function of sestrins is mediated by promotion of autophagic degradation of Keap1 and Nrf2 activation and by inhibition of mTORC1[J]. Free Radic Biol Med, 2015, 88: 205–211. DOI:10.1016/j.freeradbiomed.2015.06.007 |
| [34] | Son YO, Pratheeshkumar P, Roy RV, et al. Nrf2/p62 signaling in apoptosis resistance and its role in cadmium-induced carcinogenesis[J]. J Biol Chem, 2014, 289: 28660–28675. DOI:10.1074/jbc.M114.595496 |
| [35] | Rubio N, Verrax J, Dewaele M, et al. p38(MAPK)-regulated induction of p62 and NBR1 after photodynamic therapy promotes autophagic clearance of ubiquitin aggregates and reduces reactive oxygen species levels by supporting Nrf2-antioxidant signaling[J]. Free Radic Biol Med, 2014, 67: 292–303. DOI:10.1016/j.freeradbiomed.2013.11.010 |
| [36] | Gjyshi O, Flaherty S, Veettil MV, et al. Kaposi's sarcoma-associated herpesvirus induces Nrf2 activation in latently infected endothelial cells through SQSTM1 phosphorylation and interaction with polyubiquitinated Keap1[J]. J Virol, 2015, 89: 2268–2286. DOI:10.1128/JVI.02742-14 |
| [37] | Wang L, Ebrahimi K, Chyn M, et al. Biology of p62/sequestosome-1 in age-related macular degeneration (AMD)[M]//Bowes Rickman C, LaVail M, Anderson R, et al. Retinal Degenerative Diseases. Advances in Experimental Medicine and Biology. Cham Heidelberg: Springer, 854: 17-22. |
| [38] | He Y, Li S, Zhang W, et al. Dysregulated autophagy increased melanocyte sensitivity to H2O2-induced oxidative stress in vitiligo[J]. Sci Rep, 2017, 7: 42394. DOI:10.1038/srep42394 |
| [39] | Chang Y, Li S, Guo W, et al. Simvastatin protects human melanocytes from H2O2-induced oxidative stress by activating Nrf2[J]. J Invest Dermatol, 2017, 137: 1286–1296. DOI:10.1016/j.jid.2017.01.020 |
| [40] | Shah ZA, Li RC, Thimmulappa RK, et al. Role of reactive oxygen species in modulation of Nrf2 following ischemic reperfusion injury[J]. Neuroscience, 2007, 147: 53–59. DOI:10.1016/j.neuroscience.2007.02.066 |
| [41] | Rojo AI, Innamorato NG, Martín-Moreno AM, et al. Nrf2 regulates microglial dynamics and neuroinflammation in experimental Parkinson's disease[J]. Glia, 2010, 58: 588–598. DOI:10.1002/glia.20947 |
| [42] | Calkins MJ, Vargas MR, Johnson DA, et al. Astrocyte-specific overexpression of Nrf2 protects striatal neurons from mitochondrial complex Ⅱ inhibition[J]. Toxicol Sci, 2010, 115: 557–568. DOI:10.1093/toxsci/kfq072 |
| [43] | Hensley K, Harris-White ME. Redox regulation of autophagy in healthy brain and neurodegeneration[J]. Neurobiol Dis, 2015, 84: 50–59. DOI:10.1016/j.nbd.2015.03.002 |
| [44] | Tanji K, Maruyama A, Odagiri S, et al. Keap1 is localized in neuronal and glial cytoplasmic inclusions in various neurodegenerative diseases[J]. J Neuropathol Exp Neurol, 2013, 72: 18–28. DOI:10.1097/NEN.0b013e31827b5713 |
| [45] | Tanji K, Miki Y, Ozaki T, et al. Phosphorylation of serine 349 of p62 in Alzheimer's disease brain[J]. Acta Neuropathol Commun, 2014, 2: 50. DOI:10.1186/2051-5960-2-50 |
| [46] | Wang S, Chen Y, Kou R, et al. Carbon disulfide activates p62-Nrf2-keap1 pathway in rat nerve tissues[J]. Toxicology, 2016, 368-369: 19–27. DOI:10.1016/j.tox.2016.08.013 |
| [47] | Kosaka K, Mimura J, Itoh K, et al. Role of Nrf2 and p62/ZIP in the neurite outgrowth by carnosic acid in PC12h cells[J]. J Biochem, 2010, 147: 73–81. DOI:10.1093/jb/mvp149 |
| [48] | Ramsey CP, Glass CA, Montgomery MB, et al. Expression of Nrf2 in neurodegenerative diseases[J]. Neuropathol Exp Neurol, 2007, 66: 75–85. DOI:10.1097/nen.0b013e31802d6da9 |
| [49] | Ramesh Babu J, Lamar Seibenhener M, Peng J, et al. Genetic inactivation of p62 leads to accumulation of hyperphosphorylated tau and neurodegeneration[J]. J Neurochem, 2008, 106: 107–120. DOI:10.1111/j.1471-4159.2008.05340.x |
| [50] | Jing X, Shi H, Zhang C, et al. Dimethyl fumarate attenuates 6-OHDA-induced neurotoxicity in SH-SY5Y cells and in animal model of Parkinson's disease by enhancing Nrf2 activity[J]. Neuroscience, 2015, 286: 131–140. DOI:10.1016/j.neuroscience.2014.11.047 |
| [51] | Poulose SM, Bielinski DF, Shukitt-Hale B. Walnut diet reduces accumulation of polyubiquitinated proteins and inflammation in the brain of aged rats[J]. J Nutr Biochem, 2013, 24: 912–919. DOI:10.1016/j.jnutbio.2012.06.009 |
| [52] | Poulose SM, Bielinski DF, Carey A, et al. Modulation of oxidative stress, inflammation, autophagy and expression of Nrf2 in hippocampus and frontal cortex of rats fed with açaí-enriched diets[J]. Nutr Neurosci, 2017, 20: 305–315. DOI:10.1080/1028415X.2015.1125654 |
| [53] | Lastres-Becker I, García-Yagüe AJ, Scannevin RH, et al. Repurposing the NRF2 activator dimethyl fumarate as therapy against synucleinopathy in Parkinson's disease[J]. Antioxid Redox Signal, 2016, 25: 61–77. DOI:10.1089/ars.2015.6549 |
| [54] | Klionsky DJ, Abdelmohsen K, Abe A, et al. Guidelines for the use and interpretation of assays for monitoring autophagy (3rd edition)[J]. Autophagy, 2016, 12: 1–222. DOI:10.1080/15548627.2015.1100356 |
| [55] | Nikoletopoulou V, Papandreou ME, Tavernarakis N. Autophagy in the physiology and pathology of the central nervous system[J]. Cell Death Differ, 2015, 22: 398–407. DOI:10.1038/cdd.2014.204 |
| [56] | Satoh K, Satoh T, Kikuchi N, et al. Basigin mediates pulmonary hypertension by promoting inflammation and vascular smooth muscle cell proliferation[J]. Circ Res, 2014, 115: 738–750. DOI:10.1161/CIRCRESAHA.115.304563 |
| [57] | Chen QM, Maltagliati AJ. Nrf2 at the heart of oxidative stress and cardiac protection[J]. Physiol Genomics, 2018, 50: 77–97. DOI:10.1152/physiolgenomics.00041.2017 |
| [58] | Strom J, Xu B, Tian X, et al. Nrf2 protects mitochondrial decay by oxidative stress[J]. FASEB J, 2016, 30: 66–80. DOI:10.1096/fj.14-268904 |
| [59] | Choi SH, Park S, Oh CJ, et al. Dipeptidyl peptidase-4 inhibition by gemigliptin prevents abnormal vascular remodeling via NF-E2-related factor 2 activation[J]. Vascul Pharmacol, 2015, 73: 11–19. DOI:10.1016/j.vph.2015.07.005 |
| [60] | Sugimoto R, Warabi E, Katayanagi S, et al. Enhanced neointimal hyperplasia and carotid artery remodelling in sequestosome 1 deficient mice[J]. J Cell Mol Med, 2010, 14: 1546–1554. |
| [61] | Sun G, Li Y, Ji Z. Atorvastatin attenuates inflammation and oxidative stress induced by ischemia/reperfusion in rat heart via the Nrf2 transcription factor[J]. Int J Clin Exp Med, 2015, 8: 14837–14845. |
| [62] | He X, Kan H, Cai L, et al. Nrf2 is critical in defense against high glucose-induced oxidative damage in cardiomyocytes[J]. J Mol Cell Cardiol, 2009, 46: 47–58. DOI:10.1016/j.yjmcc.2008.10.007 |
| [63] | Yates MS, Tauchi M, Katsuoka F, et al. Pharmacodynamic characterization of chemopreventive triterpenoids as exceptionally potent inducers of Nrf2-regulated genes[J]. Mol Cancer Ther, 2007, 6: 154–162. DOI:10.1158/1535-7163.MCT-06-0516 |
| [64] | Zhao Y, Song W, Wang Z, et al. Resveratrol attenuates testicular apoptosis in type 1 diabetic mice:role of Akt-mediated Nrf2 activation and p62-dependent Keap1 degradation[J]. Redox Biol, 2018, 14: 609–617. DOI:10.1016/j.redox.2017.11.007 |
| [65] | Zakkar M, Van der Heiden K, Luong le A, et al. Activation of Nrf2 in endothelial cells protects arteries from exhibiting a proinflammatory state[J]. Arterioscler Thromb Vasc Biol, 2009, 29: 1851–1857. DOI:10.1161/ATVBAHA.109.193375 |
| [66] | Ruotsalainen AK, Inkala M, Partanen ME, et al. The absence of macrophage Nrf2 promotes early atherogenesis[J]. Cardiovasc Res, 2013, 98: 107–115. DOI:10.1093/cvr/cvt008 |
| [67] | Sergin I, Bhattacharya S, Emanuel R, et al. Inclusion bodies enriched for p62 and polyubiquitinated proteins in macrophages protect against atherosclerosis[J]. Sci Signal, 2016, 9: :ra2. DOI:10.1126/scisignal.aad5614 |
| [68] | Johansson I, Monsen VT, Pettersen K, et al. The marine n-3 PUFA DHA evokes cytoprotection against oxidative stress and protein misfolding by inducing autophagy and NFE2L2 in human retinal pigment epithelial cells[J]. Autophagy, 2015, 11: 1636–1651. DOI:10.1080/15548627.2015.1061170 |
| [69] | Mildenberger J, Johansson I, Sergin I, et al. N-3 PUFAs induce inflammatory tolerance by formation of KEAP1-containing SQSTM1/p62-bodies and activation of NFE2L2[J]. Autophagy, 2017, 13: 1664–1678. DOI:10.1080/15548627.2017.1345411 |
| [70] | Yoshida GJ. Therapeutic strategies of drug repositioning targeting autophagy to induce cancer cell death:from pathophysiology to treatment[J]. J Hematol Oncol, 2017, 10: 67. DOI:10.1186/s13045-017-0436-9 |
| [71] | Stumptner C, Heid H, Fuchsbichler A, et al. Analysis of intracytoplasmic hyaline bodies in a hepatocellular carcinoma. Demonstration of p62 as major constituent[J]. Am J Pathol, 1999, 154: 1701–1710. DOI:10.1016/S0002-9440(10)65426-0 |
| [72] | Sabbieti MG, Agas D, Capitani M, et al. Plasmid DNA-coding p62 as a bone effective anti-inflammatory/anabolic agent[J]. Oncotarget, 2015, 6: 3590–3599. |
| [73] | Bao LJ, Jaramillo MC, Zhang ZB, et al. Nrf2 induces cisplatin resistance through activation of autophagy in ovarian carcinoma[J]. Int J Clin Exp Pathol, 2014, 7: 1502–1513. |
| [74] | Padmanabhan B, Tong KI, Ohta T, et al. Structural basis for defects of Keap1 activity provoked by its point mutations in lung cancer[J]. Mol Cell, 2006, 21: 689–700. DOI:10.1016/j.molcel.2006.01.013 |
| [75] | Cho HY, Kim K, Kim YB, et al. Expression patterns of Nrf2 and Keap1 in ovarian cancer cells and their prognostic role in disease recurrence and patient survival[J]. Int J Gynecol Cancer, 2017, 27: 412–419. DOI:10.1097/IGC.0000000000000908 |
| [76] | Tong YH, Zhang B, Yan YY, et al. Dual-negative expression of Nrf2 and NQO1 predicts superior outcomes in patients with non-small cell lung cancer[J]. Oncotarget, 2017, 8: 45750–45758. |
| [77] | Mostafavi-Pour Z, Ramezani F, Keshavarzi F, et al. The role of quercetin and vitamin C in Nrf2-dependent oxidative stress production in breast cancer cells[J]. Oncol Lett, 2017, 13: 1965–1973. DOI:10.3892/ol.2017.5619 |
| [78] | Ishikawa T. Genetic polymorphism in the NRF2 gene as a prognosis marker for cancer chemotherapy[J]. Front Genet, 2014, 5: 383. |
| [79] | Taguchi K, Yamamoto M. The KEAP1-NRF2 system in cancer[J]. Front Oncol, 2017, 7: 85. DOI:10.3389/fonc.2017.00085 |
| [80] | Kawasaki Y, Ishigami S, Arigami T, et al. Clinicopathological significance of nuclear factor (erythroid-2)-related factor 2(Nrf2) expression in gastric cancer[J]. BMC Cancer, 2015, 15: 5. DOI:10.1186/s12885-015-1008-4 |
| [81] | Al-Hajj M, Wicha MS, Benito-Hernandez A, et al. Prospective identification of tumorigenic breast cancer cells[J]. Proc Natl Acad Sci U S A, 2003, 100: 3983–3988. DOI:10.1073/pnas.0530291100 |
| [82] | Suzuki T, Motohashi H, Yamamoto M. Toward clinical application of the Keap1-Nrf2 pathway[J]. Trends Pharmacol Sci, 2013, 34: 340–346. DOI:10.1016/j.tips.2013.04.005 |
| [83] | Schulze K, Imbeaud S, Letouzé E, et al. Exome sequencing of hepatocellular carcinomas identifies new mutational signatures and potential therapeutic targets[J]. Nat Genet, 2015, 47: 505–511. DOI:10.1038/ng.3252 |
| [84] | Umemura A, He F, Taniguchi K, et al. p62, upregulated during preneoplasia, induces hepatocellular carcinogenesis by maintaining survival of stressed HCC-initiating cells[J]. Cancer Cell, 2016, 29: 935–948. DOI:10.1016/j.ccell.2016.04.006 |
| [85] | Wei Y, Liu D, Jin X, et al. PA-MSHA inhibits the growth of doxorubicin-resistant MCF-7/ADR human breast cancer cells by downregulating Nrf2/p62[J]. Cancer Med, 2016, 5: 3520–3531. DOI:10.1002/cam4.938 |
| [86] | Saito T, Ichimura Y, Taguchi K, et al. p62/Sqstm1 promotes malignancy of HCV-positive hepatocellular carcinoma through Nrf2-dependent metabolic reprogramming[J]. Nat Commun, 2016, 7: 12030. DOI:10.1038/ncomms12030 |
| [87] | Xia M, Yu H, Gu S, et al. p62/SQSTM1 is involved in cisplatin resistance in human ovarian cancer cells via the Keap1-Nrf2-ARE system[J]. Int J Oncol, 2014, 45: 2341–2348. DOI:10.3892/ijo.2014.2669 |
 2018, Vol. 53
2018, Vol. 53


