中药及其复方具有多成分、多靶点的特点, 因此, 以中医药理论为指导, 依托于多元化的制剂技术与层次化的释药方式, 制备中药/复方多元释药系统, 体现中药整体观, 从而充分发挥中药预防、治疗疾病的优势, 是中药制剂现代化发展的一种合理选择[1]。中药组分多元释药系统是由多组分、多单元构成的体系, 将提取富集得到的不同药效组分, 根据各组分的性质特点, 设计不同释药单元并进行组合, 以达到提高生物利用度、增强药效的目的。微丸是实现中药组分多元释放的良好载体, 它是一种粒径小于2.5 mm的球状或类球状口服固体剂型, 具有比表面积大、生物利用度高、便于分剂量及适于组合的特点。释药的重复性与一致性较好, 且通过包衣制成不同释药性能的微丸, 可以满足多元释药系统的需求[2]。
当归为伞形科(Umbrelliferae)植物当归Angelica sinensis (Oliv.) Diels的干燥根, 具有补血活血、调经止痛、润燥滑肠等功效。当归的主要活性成分包括挥发油、有机酸和多糖等。现代研究表明, 当归及其有效成分具有抗炎、抗氧化、抗肿瘤和调节免疫等多种药理作用[3]。
超临界流体萃取技术是提取包括挥发油在内的脂溶性成分的一种有效手段, 具有提取温度低、提取得率高等优点, 并且有效地避免了水蒸汽蒸馏中油水相容、转移过程易损失等实际操作难题。当归超临界提取物中含有苯酞类、有机酸类等多种成分, 其中藁本内酯的含量最高[4]。酚酸类化合物是一类具有苯环的有机酸类化合物。当归总酚酸中含有阿魏酸、绿原酸和琥珀酸等成分, 其中阿魏酸是主要成分, 含量可达(16.14 ± 0.21)%[5]。当归多糖为水溶性活性成分的代表, 亦是发挥免疫作用的主要活性成分; 此外, 当归多糖显示出抗肿瘤、调节血液系统和抗氧化等作用[6]。
本课题组前期针对当归不同有效部位进行了制备与富集。研究发现, 当归不同组分具有抗炎和抗氧化作用, 在炎症相关的AOM/DSS小鼠结直肠癌模型上显示出一定的化学预防效果, 能够降低炎症相关结直肠癌发病率, 减少高级上皮内瘤变发生率, 延缓肿瘤发展速度, 并且组分间的配伍应用可以起到增效的目的[7, 8]。当归总酚酸与超临界提取物、当归多糖与超临界提取物联用, 均可以显著抑制AOM/DSS小鼠结直肠癌的发病率。此外, 当归总酚酸与超临界提取物以2:1的比例灌肠给药, 对大鼠溃疡性结肠炎的发生发展起到延缓与改善作用[9]。
然而, 超临界提取物的主要成分藁本内酯性质不稳定、易分解, 口服超临界提取物或藁本内酯单体后, 藁本内酯被迅速吸收并达最大血药浓度且难以维持较高水平的血药浓度稳态, 在消化道与肝脏代谢较多, 首过效应明显, 生物利用度偏低[10], 具有低溶解性、高渗透性的特征, 属于生物药剂学第Ⅱ类药物[11]; 另有文献[12]报道, 阿魏酸在动物胃内吸收迅速, 然后迅速进入肝脏发生生物转化, 在体内作用时间较短。阿魏酸在药物溶解/吸收模拟系统中累积溶出量达77.57%, 累积渗透量仅0.13%, 属于生物药剂学第Ⅲ类药物[13]。以藁本内酯为代表的挥发油类成分和以阿魏酸为代表的酚酸类成分存在口服生物利用度低的问题, 这在一定程度上会影响药效的发挥。目前对多糖的药代动力学研究还较为薄弱[14], 当归多糖的生物药剂学性质尚未见相关报道, 有文献表明, 通过血清指纹图谱, 以欧式距离研究多糖的药代动力学, 当归多糖灌胃新西兰大白兔后, 45 min时欧氏距离开始增加, 60 min达到最大值, 90 min后趋于平缓, 提示45~90 min时作用较强[15]。基于各组分性质, 通过制剂学手段, 制备当归有效组分多元释药系统, 对于更好地发挥当归的结肠炎及结直肠癌化学预防功效, 具有重要意义。一方面, 将当归超临界提取物和酚酸提取物制成结肠靶向微丸, 使药物口服后在结肠部位大部分或全部释放, 直达病灶, 发挥局部和全身的作用, 有利于解决生物利用度低的问题; 另一方面, 将当归多糖制备为胃部释放微丸, 以发挥调节全身免疫的作用, 起到“扶正”的功效。
本研究以前期对当归用于结肠炎及结直肠癌化学预防的研究确定的有效组分为基础, 参考优化的结肠定位微丸处方与制备工艺[9], 制备结肠靶向释放单元; 以挤出-滚圆法制备当归多糖微丸作为胃部释放单元, 并采用Box-Behnken试验设计和正交试验设计, 以18~24目收率和平面临界角为指标, 分别优化微丸处方与工艺参数。将结肠靶向微丸与胃部释放微丸组成当归有效组分多元释药系统, 进行体外释放研究, 并结合小动物活体成像系统进行体内动态追踪, 评价多元释药系统的一致性与结肠靶向性, 为中药多元释药系统的研究与开发提供参考。
材料与方法主要仪器 Thermo Ultimate 3000高效液相色谱仪、Ultimate可变波长检测器(美国赛默飞科技有限公司); UH5300双光束分光光度计(日本Hitachi公司); Caleva Multi Lab湿法制粒挤出滚圆一体机(英国Caleva Process Solutions公司); BY300A型小型包衣机及恒温控制器、CJY-300C型脆碎度测定仪(上海黄海药检仪器有限公司); RC806D溶出试验仪(天津天大天发科技有限公司); TDL-5-A型离心机(上海安亭科学仪器有限公司); PB-10型pH计(北京赛多利斯科学仪器有限公司); 小动物活体成像系统(美国Carestream Fx Pro公司); SUPRA55场发射扫描电子显微镜(德国ZEISS公司)。
试剂 当归超临界提取物[藁本内酯含量为(42.89 ± 0.47) %]、当归酚酸提取物[阿魏酸含量为(16.14 ± 0.21) %]和当归多糖提取物[总糖含量为(51.07 ± 2.17) %]均为本实验室自制; 藁本内酯对照品(上海源叶生物科技有限公司, 纯度≥98%, 批号: S13M9D55861);阿魏酸(含量以99.9%计, 批号: 110773-201614)、D-无水葡萄糖(含量以99.9%计, 批号: 110833-201506) (中国食品药品检定研究院); 单硬脂酸甘油酯(成都华夏化学试剂有限公司); Tween-80 (天津市光复精细化工研究所); 柠檬酸三乙酯(上海麦克林生化科技有限公司); 尤特奇FS 30D [赢创德固赛特种化学(上海)有限公司馈赠]; 微晶纤维素PH101 (湖州市菱湖新望化学有限公司); 二氧化硅(安徽山河药用辅料股份有限公司); 荧光染料Cy5 (北京泛博生物化学有限公司); 流动相所用甲醇、乙腈均为色谱级(Sigma Aldrich公司), 其余试剂为分析纯。
实验动物 昆明小鼠, SPF级, 雄性, 体重(30 ± 1) g, 由斯贝福(北京)生物技术有限公司提供, 许可证号: SCXK (京) 2016-0002。
指标性成分含量测定方法学的建立 ①藁本内酯: HPLC色谱条件为色谱柱Inertsil ODS-3C18 (250 mm × 4.6 mm, 5 μm); 流动相为甲醇-水(70:30), 等度洗脱, 体积流量1 mL·min-1; 紫外检测波长326 nm; 柱温30 ℃, 进样量10 μL; 理论塔板数按照藁本内酯计算不低于3 500。精密称定藁本内酯对照品10.00 mg, 加甲醇制成质量浓度为400 μg·mL-1对照品溶液。②阿魏酸: HPLC色谱条件为色谱柱Inertsil ODS-3C18 (250 mm × 4.6 mm, 5 μm); 流动相为乙腈-0.085%磷酸水溶液(17:83), 等度洗脱, 体积流量1 mL·min-1, 紫外检测波长316 nm, 柱温30 ℃, 进样量10 μL; 理论塔板数按照阿魏酸计算不少于5 000。精密称定阿魏酸对照品9.95 mg, 加70%甲醇制成质量浓度为398 μg·mL-1对照品溶液。③苯酚硫酸法测定多糖含量:精密称取D-无水葡萄糖20.65 mg, 加蒸馏水制成质量浓度为206.5 μg·mL-1储备液, 再稀释得质量浓度为103.25 μg·mL-1对照品溶液。供试品溶液制备:精密称取适量结肠靶向微丸丸芯或多糖微丸, 充分研碎, 分别加入甲醇、70%甲醇和蒸馏水, 称定重量。超声30 min, 再称定重量, 用溶剂补足减失的重量, 4 000 r·min-1离心10 min, 取上清液, 过0.45 μm滤膜, 作为测定藁本内酯、阿魏酸和多糖含量的供试品溶液。取不载药丸芯, 按上述方法制备空白制剂溶液。精密量取对照品溶液, 以蒸馏水补足体积至1.0 mL, 再依次加入5%苯酚水溶液1.0 mL和浓硫酸5.0 mL, 摇匀, 沸水浴加热15 min, 冰水浴放置10 min, 室温放置15 min, 486 nm处测定吸光度。对含量测定方法的专属性、线性关系、精密度、稳定性、重复性和加样回收率进行考察。
当归多糖微丸的制备工艺与评价指标 当归多糖粉末与各辅料均过80目筛, 备用。取主药与固体辅料共10 g, 加入适宜的润湿剂, 制成软材, 以合适的挤出速率、滚圆速率和滚圆时间为工艺参数(根据预实验, 暂定挤出速率100 r·min-1, 滚圆速率2 000 r·min-1, 滚圆时间2 min)制备微丸, 于40 ℃干燥4 h, 筛选18~24目微丸, 即得。计算微丸18~24目收率(w), w = m1/m2 × 100%, m1为18~24目微丸重量, m2为制得微丸重量。测量平面临界角(j), 评价微丸圆整度, 将一定量微丸平铺于玻璃平板上, 平板一侧抬起, 测定在微丸开始滚动前, 倾斜平面与水平面所形成的角, 角度越小表明微丸的圆整度越好。
单因素试验筛选处方 以微丸18~24目收率和平面临界角为指标, 固定其他因素不变, 分别考察润湿剂浓度、载药量、抗黏剂用量和润湿剂用量对实验结果的影响, 确定处方优化时的因素与水平。主药与固体辅料总量共10 g, 润湿剂浓度包括30%、40%、50%、60%和70%乙醇, 载药量为2、3、4、5和6 g, 抗黏剂用量为0.1、0.2、0.3和0.4 g, 润湿剂用量为5、6、7、8和9 mL。
Box-Behnken试验设计优化处方 根据单因素考察结果, 选择对微丸18~24目收率和平面临界角影响较大的3个因素, 采用Box-Behnken试验设计, 以微丸18~24目收率和平面临界角为指标, 优化当归多糖微丸处方, 并进行3批验证。
正交试验设计优选制备工艺参数 结合预实验和文献可知, 影响微丸成形的工艺因素主要有挤出速率、滚圆速率和滚圆时间。因此, 选取以上3个因素为考察因素, 每个因素设计3个梯度水平, 见表 1。以18~24目收率和平面临界角为考察指标, 以优化后处方, 按L9 (34)正交试验表进行试验。18~24目收率和平面临界角采用Min-Max法进行标准化[16], 并按照18~24目收率0.4、平面临界角0.6的权重计算总分, 作为综合评价的指标。多指标综合评分时, 采用最小-最大标准化(Min-Max标准化)法对数据进行标准化处理, 可以解决数据同趋化和量纲问题。对于18~24目收率, 值越大越好, 故X' = (X - Xmin) / (Xmax - Xmin); 对于平面临界角, 值越小越好, X' = (Xmax - X) / (Xmax - Xmin), X'为标准化数据, X为原数据, Xmax为极大值, Xmin为极小值。根据直观分析及方差分析结果确定最佳制备工艺参数, 进行3批验证试验并测定总糖量, 评价制剂工艺稳定性。
| Table 1 Factors and levels of process parameters for the preparation of polysaccharides gastric releasing pellets |
当归结肠靶向微丸的制备工艺 参考实验室已有处方制备丸芯, 并进行包衣[9], 丸芯处方为微晶纤维素20 g, 酚酸类提取物6 g, 超临界提取物3 g, 水12 g, 0.8%羧甲基纤维素钠7.4 g; 包衣液以尤特奇FS 30D为包衣材料, 添加1.5%柠檬酸三乙酯和Tween-80, 1.2%单硬脂酸甘油酯。按挤出速率80 r·min-1, 滚圆速率1 600 r·min-1, 滚圆时间2 min的工艺参数, 制备丸芯; 采用包衣锅法进行包衣, 包衣锅转速50 r·min-1, 控制热风温度50 ℃, 喷枪压力0.6~0.8 MPa, 包衣增重16%。制备3批丸芯, 分别测定藁本内酯与阿魏酸含量, 评价制剂工艺稳定性。
当归有效组分多元释药系统的质量评价 按2015年版《中国药典》四部, 采用手动筛分法, 测定微丸的粒度。使用脆碎度检查仪, 取一定量微丸(约6.5 g, m1), 参照片剂脆碎度检查法测定脆碎度, 操作结束后, 用24目筛筛分, 称量留在筛网上的微丸重量(m2), 按下式计算脆碎度(F): F = (m1 - m2) / m1 × 100%。按2015年版《中国药典》四部水分测定法测定水分。通过肉眼和扫描电子显微镜观察微丸外观性状。
当归多糖微丸的体外释放评价 按2015年版《中国药典》四部配制pH 1.2的溶出介质, 备用。对3批微丸, 按2015年版《中国药典》四部0931溶出度与释放度测定法——转篮法进行释放度测定, 释放介质为pH 1.2 HCl 900 mL, 转速100 r·min-1, 温度(37 ± 0.5) ℃, 分别于5、10、15、20、30、40、50和60 min取样2 mL, 并补充同温度同体积的溶出介质, 过0.45 μm滤膜, 进行含量测定, 计算累计释放率。采用f2相似因子法对释药过程的一致性进行评价, 并进行模型拟合。f2相似因子计算公式如下:
f2 = 50×log{[1+(1/n)t=1n (Rt-Tt)2]-0.5×100}
其中, n为取样时间点个数, Rt为参比样品(或变更前样品)在t时刻的溶出度值, Tt为试验批次(或变更后样品)在t时刻的溶出度值。
当归结肠靶向微丸的体外释放评价 按2015年版《中国药典》四部配制分别pH 1.2、6.8和7.8的溶出介质, 备用。考虑到藁本内酯极性较小, 在各溶出介质中加入2% Tween-80。按2015年版《中国药典》四部0931溶出度与释放度测定法——转篮法进行释放度测定。释放介质分别为含2% Tween-80的pH 1.2 HCl 500 mL、pH 6.8磷酸盐缓冲液500 mL、pH 7.8磷酸盐缓冲液500 mL, 转速100 r·min-1, 温度(37 ± 0.5) ℃, 微丸分别在pH 1.2 HCl溶液中释放2 h, 立刻转入pH 6.8磷酸盐缓冲液中释放4 h, 再转入pH 7.8磷酸盐缓冲液中释放6 h, 换液过程在3 min内完成。分别于1、2、4、6、8、10和12 h定时取样2 mL, 并补充同温度同体积的溶出介质, 过0.45 μm滤膜, 进行含量测定, 计算累计释放率, 使用f2相似因子法评价其释放过程中的一致性, 并进行模型拟合。
当归有效组分多元释药系统的体内动态追踪 将Cy5荧光染料分别溶于润湿剂60%乙醇和水中, 制备含荧光的多糖微丸和结肠靶向微丸。取健康昆明小鼠, 禁食、不禁水24 h, 采用自制灌胃装置分别给予含Cy5荧光染料的多糖微丸和结肠靶向微丸, 在不同时间点注射5%水合氯醛麻醉, 放入成像暗箱平台, 设置仪器参数进行荧光拍照(激发波长630 nm, 发射波长700 nm); 然后调整参数进行X-射线显影。当微丸在体内不崩解时, 几乎不显示或显示微弱荧光; 当微丸崩解后, 体内可显现出较强荧光。将荧光信号和X-射线信号叠加, 根据含荧光强度标尺的成像图片, 大致判断微丸在动物体内的位置, 以及微丸的释放与分布。
统计学方法 Box-Behnken试验设计采用Design Expert 8.0.6软件, 正交试验设计采用SAS 8.2统计软件进行统计学数据分析, 方差分析比较显著性差异, 以P < 0.05有统计学意义。
结果 1 指标性成分含量测定方法学的建立藁本内酯和阿魏酸的HPLC测定方法专属性良好, 藁本内酯在质量浓度为0.4~400 μg·mL-1内线性关系良好, 回归方程为Y = 0.295 9 X + 0.240 7, R2 = 0.999 6;阿魏酸在质量浓度为0.398 8~398.8 μg·mL-1内线性关系良好, 回归方程为Y = 0.834 4 X - 0.122 9, R2 = 1;精密度、稳定性和重复性均良好, 加样回收率的RSD均小于3%。
D-无水葡萄糖在质量浓度为1.032 5~103.25 μg·mL-1内线性关系良好, 回归方程为Y = 0.009 8 X + 0.021 6, R2 = 0.997 2。精密度、稳定性和重复性均良好, 加样回收率的RSD为2.53%。上述方法的建立为评价制剂工艺稳定性和体外释放性能奠定了基础。
2 当归多糖微丸的制备工艺研究 2.1 单因素筛选处方 2.1.1 润湿剂浓度润湿剂不仅具有诱发物料黏性的作用, 而且在挤出滚圆过程中还具有润滑和保持软材塑性的作用[17]。不同浓度的乙醇是目前最常用的润湿剂, 当乙醇浓度为30%时, 制得的软材黏性大, 微丸收率低且极易在滚圆过程中成团; 70%乙醇制得的软材偏干, 滚圆后得到的微丸圆整度差, 且粉性强。因此, 选择40%、50%和60%乙醇作为处方优化时润湿剂的浓度。
2.1.2 载药量随着载药量的增大, 软材的黏性越来越强, 制得微丸18~24目收率降低, 且当载药量≥5 g时, 滚圆后不能得到粒径满足要求的微丸。因此, 选择载药量为2、3和4 g作为处方优化的因素范围。
2.1.3 抗黏剂用量二氧化硅在固体制剂中是良好的抗黏剂, 可以改善软材的成型性。不添加二氧化硅时, 微丸的收率较低, 且圆整度较差; 当二氧化硅用量为0.2 g (处方的2%)时, 微丸的圆整度和收率都较好。因此, 选择处方中加入0.2 g二氧化硅作为抗黏剂。
2.1.4 润湿剂用量润湿剂用量为5及6 mL时, 制得的软材偏干, 挤出物在滚圆过程中不易被切断, 得到的多为哑铃状短棒, 难以成丸; 当润湿剂用量达到10 mL时, 软材黏性明显变大, 挤出物为长条状, 且在滚圆过程中微丸互相黏连, 越滚越大, 不能得到合适粒径的微丸。润湿剂用量为7~9 mL时, 所得微丸的收率和平面临界角均较好, 故选择润湿剂用量为7、8和9 mL作为处方优化的水平范围。
2.2 试验设计及优化综合单因素试验结果, 选择对微丸收率和圆整度影响较大的3个因素:载药量(A)、润湿剂浓度(B)和润湿剂用量(C)进行Box-Behnken试验设计, 以18~24目收率和平面临界角为指标, 对微丸处方进行优化。试验设计结果见表 2。
| Table 2 Design and results of Box-Behnken tests. A: Drug loading capacity; B: Concentration of wetting agent; C: Volume of wetting agent |
根据Box-Behnken试验设计的统计学要求, 实验模型通过最小二乘法拟合为二次多项式方程, 采用Design Expert 8.0.6软件对指标18~24目收率和平面临界角与影响因素之间的关系进行多元回归分析, 建立数学模型。18~24目收率的二次方模型(1)为: w = 85.67 - 23.89A + 4.23B - 5.82C + 23.60AB - 11.01AC + 5.24BC - 37.03A2 - 0.91B2 - 1.06C2, 失拟度为0.061 6, R2 = 0.987 6;平面临界角的二次方模型(2)为: j = 9.13 + 0.054A + 0.047B + 1.27C - 2.25AB + 0.98AC - 0.29BC + 3.55A2 + 0.04B2 - 0.059C2, 失拟度为0.306 6, R2 = 0.937 7。方程拟合度良好, 说明该模型可以较好地预测实验结果。
由回归系数的显著性可知, 模型(1)中, A、B、C、AB、AC、A2的差异在统计学水平上有意义(P < 0.05), 其他各项在统计学上没有意义。模型(2)中, C、AB、A2的差异在统计学水平上有意义(P < 0.05), 其他各项在统计学上没有意义。载药量、润湿剂浓度和润湿剂用量对18~24目收率与平面临界角的影响见图 1。
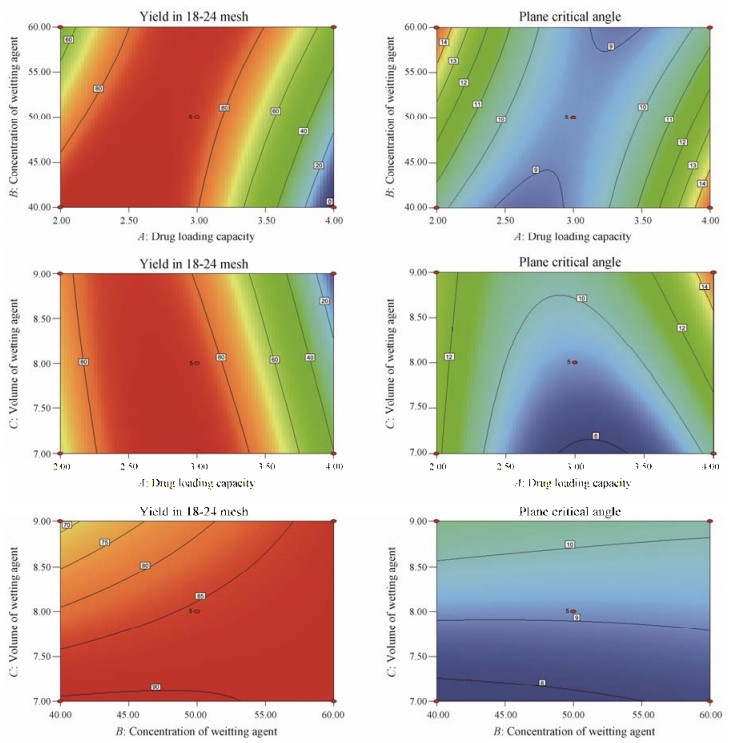
|
Figure 1 Response surface plot with yield in 18-24 mesh and plane critical angle of drug loading capacity, concentration of wetting agent and volume of wetting agent |
根据预测模型, 优选了收率较高且平面临界角较小的处方:载药量3.3 g, 润湿剂为60%乙醇, 润湿剂用量7 mL。3批验证结果见表 3, 优化后制得微丸的18~24目收率和平面临界角与预测结果相差较小, 该模型总体上可以较好地预测实验结果。
| Table 3 The measured and predicted value of indexes of the optimized prescription. n = 3, x± s |
由方差分析可知, 各因素均没有显著性差异; 结合直观分析结果, 发现挤出速率对实验结果的影响最大, 其次是滚圆时间, 滚圆速率对微丸成形影响最小, 确定最佳制备工艺参数为挤出速率75 r·min-1, 滚圆速率1 800 r·min-1, 滚圆时间3 min。
3批验证试验结果显示, 优化工艺制得的微丸, 收率为(87.57 ± 1.12)%, 平面临界角为(7.50 ± 0.24)°均与正交试验考察得到的最佳挤出滚圆工艺结果相当, 说明优化工艺参数稳定、合理、可行。3批微丸的含糖量为(167.73 ± 4.72) mg·g-1, RSD为2.81%, 说明微丸工艺稳定性良好。
3 多元释药系统的质量评价 3.1 形态与圆整度在优化工艺制备的多元释药系统中, 肉眼观察, 多糖微丸呈棕黄色, 载超临界提取物与酚酸提取物的微丸与包衣后微丸均为淡黄色。大多数为球形, 极少数为椭球形, 表面光滑圆整。多糖微丸的平面临界角为(7.50 ± 0.24)°, 载超临界提取物与酚酸提取物微丸的平面临界角为(7.28 ± 0.24)°。通过扫描电子显微镜观察微丸的形态(图 2), 在50倍放大倍数下观察, 发现微丸大小较均一, 多糖微丸和载超临界提取物与酚酸提取物的微丸表面较圆整, 包衣后微丸表面较光滑, 包衣膜完整, 表明微丸制备工艺合理稳定。

|
Figure 2 Scanning electron microscope photographs of polysaccharide pellet (A), no coating pellet loading supercritical extracts and phenolic acid extracts (B) and colon specific pellet (C) (×50) |
微丸粒度均以18~24目分布最多, 多糖微丸占(87.57 ± 1.12) %, 载超临界提取物与酚酸提取物的微丸占(81.68 ± 0.86) %。粒度分布范围较窄, 表明微丸粒度较均匀。
3.3 脆碎度对3批微丸进行评价, 多糖微丸失重百分率为(0.97 ± 0.03) %, 超临界提取物与酚酸提取物微丸失重百分率为(6.23 ± 0.02) %, 包衣后失重百分率为(2.37 ± 0.11) %。
3.4 水分取微丸2 g, 采用烘干法进行水分测定, 多糖微丸的含水量为(6.85 ± 0.04) %, 超临界提取物与酚酸提取物微丸的含水量为(5.28 ± 0.02) %。
4 多元释药系统的体外释放评价 4.1 当归多糖微丸对3批多糖微丸进行体外释放评价, 总糖的体外累计释放曲线如图 3所示。微丸在人工胃液中5 min即可释放70%左右, 在30 min时累计释放率达到90%;达到了在胃部快速释放的要求。释放曲线之间无差异, f2值分别为85.78、90.78和87.84, 说明制备的微丸批次间差异较小, 重复性较好, 制备工艺稳定。用常见释放动力学模型进行方程拟合, 结果见表 4。模型拟合结果表明制得的胃部释放微丸的体外释放曲线更接近于Weibull方程。
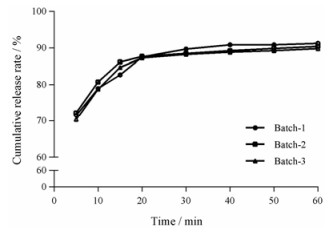
|
Figure 3 In vitro release of polysaccharide gastric releasing pellets |
| Table 4 Release equations' fitting of polysaccharides |
丸芯制备工艺稳定, 藁本内酯与阿魏酸的含量测定RSD均小于3%。3批结肠靶向微丸的指标性成分藁本内酯和阿魏酸的体外累计释放曲线如图 4所示。通过包衣, 制剂基本实现了结肠靶向释放的目的, 且释放较为完全。藁本内酯在人工结肠液中6 h的累计释放率可以达到91.82%, 阿魏酸在人工结肠液中6 h的累计释放率达到95.14%。经f2检验, 释放曲线之间无差异(藁本内酯3批释放结果的f2值分别为73.60、80.10和84.53;阿魏酸3批释放结果的f2值分别为80.00、77.48和88.43, 均大于50), 说明制备的3批结肠靶向微丸的差异较小, 重复性较好, 制备工艺较稳定。
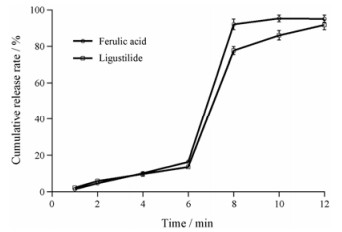
|
Figure 4 In vitro release of colon specific pellets (n = 3, x± s) |
对释放曲线用不同模型方程进行拟合, 结果见表 5, 藁本内酯和阿魏酸的释药曲线均接近于Ritger- Peppas方程, 系数n > 0.89, 提示药物释放机制为骨架溶蚀。
| Table 5 Release equations' fitting of ligustilide and ferulic acid |
载荧光染料多糖微丸的含糖量为(165.22 ± 3.64) mg·g-1, 载荧光染料结肠靶向微丸藁本内酯含量为(28.50 ± 0.37) mg·g-1、阿魏酸含量为(16.58 ± 0.27) mg·g-1, 体外释放行为与未包载荧光染料的微丸基本一致, 表明荧光染料的加入对本多元释药系统没有影响。取健康昆明小鼠分别灌胃含荧光染料的不同制剂, 于灌胃后不同时间点麻醉动物, 用小动物成像系统动态检测微丸在体内的位置与释放, 结果见图 5。
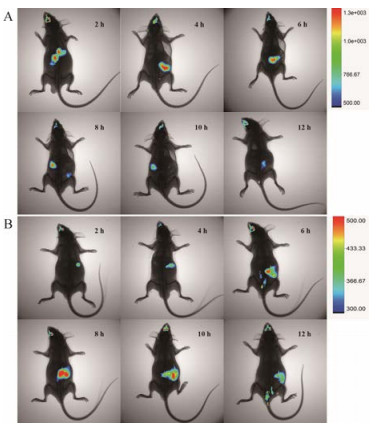
|
Figure 5 Fluorescence and X-ray imaging results of gastric releasing pellets (A) and colon specific pellets (B) in mice |
多糖微丸在灌胃2 h后在胃部溶出释放, 表现出强烈荧光。且随着时间的推移, 微丸在胃肠道内运动, 荧光强度逐渐减弱, 表明微丸在体内逐渐代谢。
结肠靶向微丸在小鼠体内显示出良好的靶向释放性能。2~4 h时体内不显示强烈荧光, 随着微丸在小鼠胃肠道内移动, 6 h时微丸在体内分解释放, 大致判断微丸在小鼠小肠下端附近; 8 h时荧光强度最强, 结合X-射线成像, 判断微丸大部分释放并分布于结肠部位; 10~12 h时, 荧光强度逐渐减弱, 表明微丸在小鼠体内逐渐代谢并开始排出。
讨论本研究基于疾病筛选得到的有效组分, 依照各组分的性质, 设计多元释药系统。针对结肠炎与炎症相关的结直肠癌, 当归超临界提取物、总酚酸及多糖具有不同程度的治疗及延缓疾病发展的作用, 但是超临界提取物主要成分藁本内酯与酚酸提取物主要成分阿魏酸代谢快, 生物利用度低, 不利于发挥药效。同时, 文献[15]报道当归多糖灌胃在兔体内45~90 min作用较强。因此, 将当归超临界提取物与酚酸提取物配伍制成结肠靶向微丸, 解决口服生物利用度低的问题; 将当归多糖制成普通微丸, 使其在胃部释放, 发挥全身免疫调节作用, 整体上以期达到提高药效的目的。本研究采用挤出-滚圆法制备当归多糖胃部释放微丸和载有超临界提取物及酚酸提取物的结肠靶向微丸, 并以18~24目收率和平面临界角为指标, 采用Box-Behnken试验设计对多糖微丸的处方进行了优化, 采用正交试验设计优选了制备工艺参数, 得到了稳定、合理、可行的制备工艺。以实验室前期优化工艺制得的当归结肠靶向微丸结合多糖微丸组成的当归有效组分多元释药系统, 体外释放性能良好; 采用小动物活体成像法, 评价了微丸在小鼠体内的动态变化, 多糖微丸可以实现胃部释放, 结肠靶向微丸体内靶向性良好, 基本达到了制剂的设计目的, 为后续结肠炎及结直肠癌化学预防相关研究奠定了基础。采用小动物活体成像系统可以直观地评价制剂的体内过程及靶向性, 为多元释药系统的评价提供了一种可视化的方法。中药微丸目前的研究多集中在小分子化合物或活性部位上, 对于多糖等大分子组分的微丸制备与评价较少, 本文为多糖类组分微丸的研究提供一定的参考。但本研究仅对多元释药系统的释放性质进行了初步研究, 对于该系统的体内释放行为以及药效评价还有待进一步深入探讨。
| [1] | Sun E, Jia XB, Huang Y, et al. Thought and application of traditional Chinese medicine multiple drug delivery system based on material basis component[J]. Chin J Chin Master Med (中国中药杂志), 2012, 37: 2181–2185. |
| [2] | Wang YJ, Han W, Li H, et al. Application of traditional Chinese medicine pellets in sustained-release and controlled-release preparation[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2011, 17: 256–259. |
| [3] | Li X, Zhang LH, Wang XX, et al. Research progress on chemical constituents and pharmacological action of Angelica sinensis[J]. Chin Med Mat (中药材), 2013, 36: 1023–1028. |
| [4] | Li XN, Yang YH, Zhao BC, et al. Optimization of supercritical CO2 fluid extraction process for volatile oil from Angelica sinensis[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2013, 19: 27–29. |
| [5] | Zhao BC, Kang Q, Peng Y, et al. Effect of Angelica sinensis root extract on cancer prevention in different stages of an AOM/DSS mouse model[J]. Int J Mol Sci, 2017, 18: 1750. DOI:10.3390/ijms18081750 |
| [6] | Wen Y, Fu ZY, Lai Y, et al. Research progress of pharmacological action of angelica polysaccharides[J]. Chin Med Herald (中国医药导报), 2012, 9: 27–29. |
| [7] | Peng Y, Zhao BC, Kang Q, et al. Colorectal cancer preventive effect of combined administration of phenolic acids and supercritical extracts from Angelica sinensis[J]. Chin J Chin Master Med (中国中药杂志), 2018, 43: 1235–1240. |
| [8] | An J. Study on Synergistic Anti-inflammatory and Antioxidant Effects of Different Groups of Angelica Extract (当归提取物中不同组分配伍的协同抗炎、抗氧化作用研究)[D]. Beijing: Beijing University of Chinese Medicine, 2014. |
| [9] | Ru QG. Preparation and In Vitro and In Vivo Evaluation of Effective Colon Specific Pellets of Angelica Sinensis (当归有效组分结肠定位微丸的制备及体内外评价)[D]. Beijing: Beijing University of Chinese Medicine, 2017. |
| [10] | Zhao BC. Evaluation of the Chemoprevention Effect and Mechanism Study Using Effective Combination of Angelica Sinensis on Colorectal Cancer (当归有效组分配伍应用的结直肠癌化学预防效果评价及机理研究)[D]. Beijing: Be ijing University of Chinese Medicine, 2015. |
| [11] | Xi JZ, Qian DW, Duan JA, et al. Effect of β-cyclodextrin inclusion complex on transport of major components of Xiangfu Siwu decoction essential oil in Caco-2 cell monolayer model[J]. Chin J Chin Master Med (中国中药杂志), 2015, 40: 2970–2974. |
| [12] | Zou QF, Ma K, Lu R. Research progress in pharmacokinetic study on ferulic acid[J]. Drug Eval Res (药物评价研究), 2013, 36: 297–301. |
| [13] | Hou JP, He X, Xu XF, et al. Application of an in vitro DDASS to evaluate oral absorption of two chemicals simultaneously:establishment of a level A in vitro-in vivo correlation[J]. Drug Dev Ind Pharm, 2012, 38: 1305–1312. DOI:10.3109/03639045.2011.650642 |
| [14] | Yi Y, Wang HX, He JR. Research progresses of pharmacokinetics of polysaccharides[J]. Acta Pharm Sin (药学学报), 2014, 49: 443–449. |
| [15] | Qiu LP, Lv QT, Zhang FK, et al. Extraction and separation of Angelica sinensis polysaccharide and serum fingerprint study[J]. Chin Med Mat (中药材), 2008, 31: 65–67. |
| [16] | Liu Y. Study on the Preparation Process and Quality Standard of Wenluotong External Granules (温络通外用颗粒的制备工艺及质量标准研究)[D]. Beijing: Beijing University of Chinese Medicine, 2017. |
| [17] | Huang Y, Jiao XB, Chen B. Effect and influence of water/ethanol on pellet preparation by extrusion-spheronization[J]. Chin Tradit Herbal Drugs (中草药), 2010, 41: 845–848. |
 2018, Vol. 53
2018, Vol. 53


