2. 沈阳市第二中学, 辽宁 沈阳 110016
2. Shenyang No.2 High School, Shenyang 110016, China
柴胡为伞形科植物柴胡(Bupleurum chinense DC.)或狭叶柴胡(Bupleurum scorzonerifolium Wild.)的干燥根, 二者分别习称为“北柴胡”和“南柴胡”[1]。柴胡味苦, 微寒, 入肝、胆经, 具有和解退热、疏肝解郁、升举阳气之功效[2]。柴胡中含有多种活性成分, 包括皂苷、挥发油、黄酮、多糖等几大类[3−6], 其中, 皂苷类成分是柴胡的主要活性成分, 具有解热、抗炎、抗肿瘤、保肝、免疫调节等药理作用[7]。
中药炮制的目的有多方面, 主要表现为以下几点:提高净度, 确保质量, 增效、减毒, 改变作用趋向, 缓和性能, 便于调剂和制剂, 便于保存, 便于服用等[8]。柴胡传统的炮制品沿用至今的有生品、醋制品、酒制品和蜜制品, 现代还增加了鳖血制品、麸炒品、酒润麸炒品等, 临床上常用生品和醋制品。目前, 在柴胡炮制方法的研究中, 围绕生品和醋制品的较多, 对其他炮制品的研究则较少, 并且对不同炮制品中化学成分的研究较集中于柴胡皂苷a、d, 指标成分较少, 不足以科学的评价柴胡的炮制方法[9−11]。
随着中药材种植规模的增加, 现今关于北柴胡采收期方面的研究日益增多, 但大部分研究都是针对某一个地区的北柴胡, 对多个主产地的北柴胡采收期并未系统的研究[12−15]。鉴于此, 本文采用HPLC法对北柴胡不同产地、不同采收期和不同炮制品中的柴胡皂苷a、b2、c、d、e、f进行测定, 观察不同产地的北柴胡不同采收期柴胡皂苷的动态积累规律, 并考察不同的炮制方法对北柴胡中柴胡皂苷含量的影响, 为规范北柴胡的最佳采收期和炮制方法提供理论依据, 对有效的利用北柴胡资源及扩大其临床应用范围有着重要意义。
材料与方法仪器 Shimadzu LC-20A Prominence UFLC XR高效液相色谱仪、Shimadzu AUY120电子天平(日本岛津公司); METTLER TOLEDO电子天平(瑞士梅特勒−托利多公司); TDZ4-WS低速台式离心机(湖南湘仪实验室仪器开发有限公司); KQ-300E型超声波清洗器(昆山市超声仪器有限公司); 电磁炉(广东美的生活电器制造有限公司); 电热鼓风干燥箱(上海一恒科学仪器有限公司); 多功能粉碎机(浙江德清拜杰电器有限公司)。
试剂与样品 柴胡皂苷a (纯度98.4%, 批号: MUST-17050105)、柴胡皂苷b2 (纯度99.5%, 批号: MUST-17032104)、柴胡皂苷c (纯度98.5%, 批号: MUST-17031402)、柴胡皂苷d (纯度98.6%, 批号: MUST-17050106)和柴胡皂苷f (纯度98.6%, 批号: MUST-17031806) (成都曼斯特生物科技有限公司); 柴胡皂苷e (纯度≥98.0%, 批号: CHB170818) (成都克洛玛生物科技有限公司); 乙腈(色谱纯, 美国Sigma公司); 甲醇(色谱纯, 山东禹王和天下新材料有限公司); 氨水(分析纯, 天津市科密欧化学试剂有限公司); 纯净水(杭州娃哈哈集团有限公司)。米醋(山西水塔醋业股份有限公司), 黄酒(浙江塔牌绍兴酒有限公司), 蜂蜜(上海冠生园蜂制品有限公司), 鳖血(中华鳖的新鲜血液), 麦麸(市售)。北柴胡共32批, 在种植后第二年开始采收, 于2017年5月至12月(每月中旬)分别采自四个产地的同一种植基地(辽宁省朝阳市、陕西省宝鸡市、甘肃省陇南市和山西省运城市), 药材在采挖后洗净并烘干。经沈阳药科大学功能食品与葡萄酒学院贾英教授鉴定, 为伞形科植物柴胡(Bupleurum chinense DC.)的干燥根, 其来源见表 1。炮制用药材为辽宁朝阳市二年生成熟北柴胡。
| Table 1 The source of all the samples |
HPLC色谱条件 色谱柱: Agela Venusil MP C18 (4.6 mm × 250 mm, 5 μm); 流动相: A (水) − B (乙腈), 梯度洗脱, 程序为: 0~10 min, 34% B; 10~42 min, 34%~50% B, 流速: 1.0 mL·min−1, 柱温: 30 ℃, 检测波长: 210 nm和254 nm, 进样量: 10 μL。
北柴胡不同炮制品的制备
生柴胡[16, 17] 取北柴胡原药材, 除去杂质与残茎, 洗净泥沙, 加水润透后切段(1 cm左右), 烘干, 即得。
炒柴胡[16, 18] 取生柴胡置炒锅内, 用文火炒制8 min, 出锅后放凉, 置烘箱40 ℃烘6 h, 即得。
醋柴胡[16, 17] 醋拌品, 100:20 (药材:辅料, 即每100 g生柴胡加入20 g炮制辅料)加入米醋, 拌匀, 室温闷透(闷润4 h), 置烘箱40 ℃烘6 h, 即得。醋炙品, 100:20加入米醋, 拌匀, 室温闷透(闷润4 h), 置锅内文火炒制8 min, 出锅后放凉, 置烘箱40 ℃烘6 h, 即得。
酒柴胡[16, 17] 酒拌品、酒炙品的炮制方法同醋拌品与醋炙品的制备方法(100:20加入黄酒)。
蜜柴胡[16, 19] 蜜拌品、蜜炙品的炮制方法同醋拌品与醋炙品的制备方法(100:20加入炼蜜, 炼蜜用1/2的沸水稀释)。
麸炒柴胡[16, 20] 麸炒品, 取麦麸(100:20加入麦麸)置预热的锅中, 翻炒麦麸, 起烟后, 加入生柴胡, 文火炒制8 min, 出锅后筛去麦麸, 放凉, 置烘箱40 ℃烘6 h, 即得。酒润麸炒品[16, 21], 先加入黄酒(100:20)室温闷透, 炮制方法同麸炒品的制备方法。
鳖血柴胡[16, 17]鳖血炙品(100:20加入1:1冷开水稀释的鳖血)与鳖血黄酒炙品(100:20加入1:1黄酒稀释的鳖血)的炮制方法同醋炙品的制备方法。
对照品储备液的制备 分别取柴胡皂苷a、b2、c、d、e和f对照品适量, 精密称定, 加入甲醇溶解制成质量浓度分别为1.760、0.024 90、0.499 0、1.990、0.250 5和0.498 0 mg·mL−l的混合对照品储备液。
供试品溶液的制备 取北柴胡经粉碎(过4号筛)所得的粉末约0.5 g, 精密称定, 置具塞锥形瓶中, 加入含5%氨水的甲醇溶液25 mL, 30 ℃水温超声处理30 min, 滤过, 分别用甲醇10 mL洗涤容器与药渣2次, 合并洗液与滤液后回收溶剂。残渣加甲醇溶解, 转移至10 mL量瓶中, 加甲醇定容, 摇匀后过0.22 μm微孔有机滤膜, 取续滤液, 即得。
系统适用性 分别取混合对照品溶液和供试品溶液, 按“高效液相色谱条件”进样分析, 各色谱峰的拖尾因子均在0.95~1.05之间, 与相邻色谱峰的分离度大于1.5, 柴胡皂苷a、b2、c、d、e和f的理论塔板数均不小于5 000;取混合对照品溶液, 按“高效液相色谱条件”连续进样5次, 各色谱峰峰面积的相对标准偏差不大于2.0%;取对照品溶液适量, 加入甲醇溶液逐步稀释, 以信噪比3:1时对应待测物浓度为检测限, 以信噪比10:1时对应待测物浓度为定量限, 进行测定。配制一系列不同浓度的灵敏度对照溶液, 测定各待测物质的信噪比, 均大于10, 结果表明色谱系统的检测能力良好。
结果 1 HPLC定量方法学考察 1.1 专属性通过比较空白溶液、对照品溶液和供试品溶液的色谱图考察专属性。结果表明, 供试品溶液中其他成分对待测成分无干扰, 分析方法专属性良好, 色谱图见图 1。
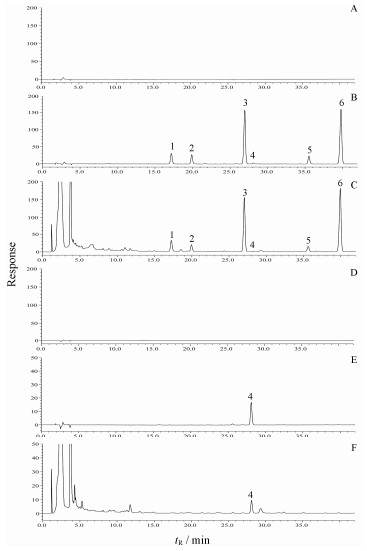
|
Figure 1 HPLC chromatograms of A (210 nm), D (254 nm): Blank solvent; B (210 nm), E (254 nm): Mixed standards; C (210 nm), F (254 nm): sample of Bupleurum chinense DC.; 1: Saikosaponin c; 2: Saikosaponin f; 3: Saikosaponin a; 4: Saikosaponin b2; 5: Saikosaponin e; 6: Saikosaponin d |
取各对照品溶液适量, 加入甲醇溶液逐步稀释, 以信噪比3:1时对应待测物浓度为检测限(LOD), 以信噪比10:1时对应待测物浓度为定量限(LOQ)进行测定, 结果见表 2。
| Table 2 Linearity, LOD and LOQ of six saikosaponins |
分别精密量取混合对照品储备液0.1、1.0、2.0、3.0和4.0 mL置5 mL量瓶中, 用甲醇稀释至刻度, 摇匀, 与混合对照品储备液同时配置成系列标准溶液。按“高效液相色谱条件”进样测定, 记录色谱峰的峰面积, 以各对照品浓度x (μg·mL−l)为横坐标, 峰面积y为纵坐标, 绘制标准曲线, 进行回归计算, 结果见表 2。
1.4 精密度重复性 取同一批北柴胡粉末(No.4)各约0.25 g、0.5 g、1.0 g, 精密称定, 按“供试品溶液的制备”项下操作, 制备低、中、高浓度供试品溶液各3份, 按“高效液相色谱条件”进样测定。柴胡皂苷a、b2、c、d、e和f含量的RSD分别为1.58%、1.38%、1.38%、1.61%、1.67%和1.47%, 结果表明方法重复性良好。
中间精密度 连续3天取同一批北柴胡粉末(No.4), 按“供试品溶液的制备”项下操作, 制备供试品溶液各3份, 按“高效液相色谱条件”进样测定。柴胡皂苷a、b2、c、d、e和f含量的RSD分别为1.61%、1.59%、1.61%、1.61%、1.80%和1.18%, 结果表明方法日间精密度良好。取同一批北柴胡粉末(No.4), 由3个不同的分析人员独立按“供试品溶液的制备”项下操作, 平行制备供试品溶液3份, 按“高效液相色谱条件”进样测定。柴胡皂苷a、b2、c、d、e和f含量的RSD分别为1.62%、1.93%、1.32%、1.53%、1.53%和1.52%, 结果表明方法中间精密度良好。
1.5 准确度取已知含量的北柴胡粉末(No.4) 9份, 各约0.25 g, 精密称定, 分别按已知含量的50%、100%和150% 3个水平加入对照品, 按“供试品溶液的制备”项下操作, 制备供试品溶液, 按“高效液相色谱条件”进样测定, 记录柴胡皂苷a、b2、c、d、e和f的峰面积, 并计算各成分的回收率及RSD, 结果如表 3所示。
| Table 3 The results of recovery test |
按“供试品溶液的制备”项下制备供试品溶液, 室温放置, 分别于0、2、4、6、8、12和24 h按“高效液相色谱条件”进样测定, 记录峰面积, 柴胡皂苷a、b2、c、d、e和f峰面积的RSD分别为1.03%、1.21%、1.44%、1.41%、1.09%和1.32%, 表明供试品溶液在24 h内稳定。
2 样品含量测定取不同批次的北柴胡粉末约0.5 g, 精密称定, 按“供试品溶液的制备”项下操作, 制备供试品溶液, 按“高效液相色谱条件”进样10 μL, 测定峰面积, 采用外标法对柴胡皂苷类成分的含量进行测定, 不同产地、不同采收期的北柴胡中柴胡皂苷含量的结果见表 4, 不同炮制品(n = 3)的柴胡皂苷含量的结果见表 5。
| Table 4 The content of saikosaponins at different harvest time from different producing areas |
| Table 5 The content of saikosaponins in different processed products (n = 3) |
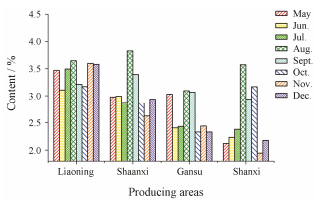
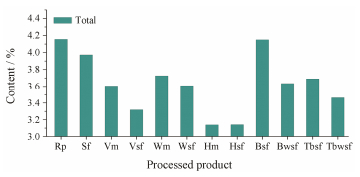
根据上述不同产地、不同采收期和不同炮制方法的北柴胡中6种柴胡皂苷的含量测定结果, 分别以采收地、炮制品为横坐标, 6种柴胡皂苷含量之和为纵坐标绘制柱形图, 结果见图 2、图 3。
|
Figure 2 The content of sum of six saikosaponins in different harvest time from different producing areas |
|
Figure 3 The content of sum of six saikosaponins in different processed product. Rp: Raw product; Sf: Stir-fried; Vm: Vinegar-moistened; Vsf: Vinegar-stir-fried; Wm: Wine-moistened; Wsf: Wine-stir-fried; Hm: Honey-moistened; Hsf: Honey-stir-fried; Bsf: Bran-stir-fried; Bwsf: Bran-wine-stir-fried; Tbsf: Turtle blood-stir-fried; Tbwsf: Turtle blood-wine-stir-fried |
北柴胡生长分为营养生长期和生殖生长期, 大致分为6个阶段:抽茎拔节期(5月)、孕蕾期(6月)、开花期(7月~8月)、做果期(8月)、果熟期(9月)、枯萎期(10~12月)[22]。5月, 北柴胡处于营养生长期, 在过去一年积累的皂苷类成分在根部蓄积, 此时柴胡皂苷的含量较高; 6月北柴胡进入开花前的准备期、7月进入盛花期, 此间需消耗大量的水和养分, 柴胡皂苷的含量较低; 8月北柴胡进入做果期, 植株生长缓慢, 皂苷类物质大量积累, 达到峰值, 9月之后北柴胡的生长发育基本停止, 10月开始进入枯萎期, 这时柴胡皂苷的含量又产生一个低值, 11月之后随着气温的降低, 北柴胡进入越冬期, 植株整体进入休眠状态, 柴胡皂苷的含量达到一个稳定的状态。
四个产地中, 不同采收期的北柴胡中柴胡皂苷的含量变化趋势不尽相同, 辽宁、陕西和甘肃的北柴胡在5月和8月柴胡皂苷的含量均较高, 而山西的北柴胡中柴胡皂苷的含量只在8月达到最大值, 这可能与各地区气候条件、土壤类型不同有关, 因此, 采收期的选择应因地制宜。但只以柴胡皂苷的含量决定北柴胡的最佳采收期并不合适, 研究[23]表明一年生柴胡成熟根的柴胡皂苷含量要高于两年生柴胡, 但一年生成熟根的产量远远不及二年生柴胡, 从实际出发, 应结合根的产量、柴胡皂苷含量等来确定北柴胡的最佳采收期; 北柴胡在生长后期根干重持续增加, 10月中旬达到最大值, 并且此时北柴胡的地上部分开始枯萎, 便于采挖根部[22]。结合实际, 辽宁、陕西和甘肃三个产地建议在春、秋季采收北柴胡, 山西则建议在秋季采收。
11种炮制品中柴胡皂苷含量依次为:生品 > 麸炒品 > 炒制品 > 酒拌品 > 鳖血炙品 > 酒润麸炒品 > 酒炙品 > 醋拌品 > 鳖血黄酒炙品 > 醋炙品 > 蜜炙品 > 蜜拌品; 除蜜拌品之外, 其他炮制品中柴胡皂苷b2的含量均比生品高, 并且柴胡皂苷a、b2、d三者的含量差异显著, 可能是因为在炮制过程中加入了米醋等辅料, 并且加热, 导致柴胡皂苷a、d结构中C13、C28间的氧醚环开环降解, 分别生成次生柴胡皂苷b1和b2所致[24]; 但柴胡皂苷b2的增加量与柴胡皂苷d的减少量并不成比例, 可能是因为酸性、加热等条件下, 柴胡皂苷a、d的糖苷键易水解[25], 使得柴胡皂苷d降解为其他产物并不完全转化为b2, 或是柴胡皂苷b2的来源并不一定局限于柴胡皂苷d[26], 有可能是由柴胡皂苷a或是其他途径转化而来。北柴胡以不同的方法炮制后, 柴胡皂苷的含量差异显著, 仅依据柴胡皂苷的含量, 建议北柴胡使用生品, 这与北柴胡临床常用生品相符。药材炮制后可起到“增效、减毒”的作用, 研究[27]表明柴胡经炮制后药效会产生明显的变化, 因此, 在用药过程中, 应根据病症不同采用不同的炮制品, 以达到合理用药的目的。
| [1] | Chinese Pharmacopoeia Commission. The Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. 2015 ed. Part Ⅰ. Beijing: China Medical Science Press, 2015: 280. |
| [2] | Chinese Herbs Editorial Committee. State Administration of Traditional Chinese Medicine. Herba Sinica (中华本草) (Vol. 5)[M]. Shanghai: Shanghai Science and Technology Press, 1999: 909-919. |
| [3] | Liang Z, Zhang J, Yang G, et al. Chemical profiling and histochemical analysis of Bupleurum marginatum, roots from different growing areas of Hubei province[J]. Acta Pharm Sin B, 2013, 3: 53–64. |
| [4] | Zhang T, Zhou J, Wang Q. Flavonoids from aerial part of Bupleurum chinense DC.[J]. Biochem Syst Ecol, 2007, 35: 801–804. DOI:10.1016/j.bse.2007.03.023 |
| [5] | Bertoli A, Pistelli L, Morelli I, et al. Volatile constituents of micropropagated plants of Bupleurum fruticosum L.[J]. Plant Sci, 2004, 167: 807–810. DOI:10.1016/j.plantsci.2004.05.017 |
| [6] | Li CN, Liu Y, Liu YY, et al. Advances in research of chemical constituents and active constituents of Dictamnus dasycarpus DC.[J]. Chin Arch Tradit Chin Med (中华中医药学刊), 2014, 32: 2674–2677. |
| [7] | Chen YS, Sun SW. Advances in studies on chemical constituents and pharmacological effects of Bupleurum chinense[J]. Heilongjiang Med (黑龙江医药), 2014, 27: 630–633. |
| [8] | Tang TY, Cai CF. Processing Technology of Modern Chi-nese Medicine (现代中药炮制技术)[M]. Beijing: Chemical Industry Press, 2004: 11-14. |
| [9] | Yang Q, Yu H, Gong QF. Study on processing for Bupleurum in medical history and modern research[J]. J Jiangxi Univ Tradit Chin Med (江西中医药大学学报), 2017, 29: 121–124. |
| [10] | Zhang Y, Qiu Y. Development of modern research on processing of Bupleurum chinense[J]. Hunan J Tradit Chin Med (湖南中医杂志), 2015, 31: 197–200. |
| [11] | Bai ZL, Wang Y, Jia TZ. Optimization of processing technology for vinegar selection of Bupleurum chinense by orthogonal test[J]. J Liaoning Univ Tradit Chin Med (辽宁中医药大学学报), 2008, 10: 148–149. |
| [12] | Wang RJ, Wang H, Jin XJ. Study on the suitable harvest time of Bupleurum in central Gansu[J]. Gansu Agric Sci Technol (甘肃农业科技), 2018(01): 54–58. |
| [13] | Hou FJ, Li Y, Song JN, et al. Study on the quality of radix Bupleurum in different harvesting periods in Shexian County, Hebei Province[J]. Jiangxi J Tradit Chin Med (江西中医药), 2015, 46: 70–71. |
| [14] | Cai H, Du SM, Ye F, et al. Study on dynamic accumulation of saikosaponin a, d from Bupleurum marginatum in various collecting periods in northwest of Hubei[J]. Res Pract Chin Med (现代中药研究与实践), 2014, 28: 17–19. |
| [15] | Wei B, Li XK, Yang Y, et al. Content determination of saikosaponins in Bupluerum chinense from different origins and different harvest time[J]. Liaoning J Tradit Chin Med (辽宁中医杂志), 2012, 39: 2464–2466. |
| [16] | Chinese Pharmacopoeia Commission. The Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. 2015 ed. Part Ⅳ. Beijing: China Medical Science Press, 2015: 31. |
| [17] | Administration of Drug Administration of the People's Republic of China. National Standard for the Processing of Traditional Chinese Medicine (全国中药炮制规范)[S]. Beijing: People's Medical Publishing House, 1988: 85. |
| [18] | Zhejiang Food and Drug Administration. Standard for Processing of Traditional Chinese Medicine in Zhejiang Province (浙江省中药炮制规范)[S]. Hangzhou: Zhejiang Science and Technology Press, 2006: 127. |
| [19] | Fujian Food and Drug Administration. Standard for Processing of Chinese Herbal Medicine Slices in Fujian Province (福建省中药饮片炮制规范)[S]. Fuzhou: Fujian Science and Technology Press, 2013: 41. |
| [20] | Hunan Provincial Health Department. Standard for Processing of Traditional Chinese Medicinal Materials in Hunan Province (湖南省中药材炮制规范)[S]. Changsha: Hunan Science and Technology Press, 1983: 73. |
| [21] | Gong QF. Traditional Chinese Medicine Processing Method for Camphor Tree (樟树中药传统炮制法)[M]. Nanchang: Jiangxi People's Publishing House, 1983: 111-112. |
| [22] | Yu Y, Wang XQ, Bao YX, et al. Studies on laws of growth and development of Bupleurum chinense[J]. Jilin Agric Univ (吉林农业大学学报), 2003, 25: 523–527. |
| [23] | Tan LL. Studie on Relationship between Structures, Development and Medicinal Components Accumulation of Bupleurum chinense DC. and Bupleurum scorzonerifolium Wild. (药用柴胡的结构发育与主要药用成分积累关系的研究)[D]. Xi'an: Northwest University, 2008: 68-69. |
| [24] | Zhang Q. Study on the Saikosaponins Structure Transformation and the Toxicity of Saikosaponin b2(柴胡皂苷结构转化及柴胡皂苷b2毒性初步研究)[D]. Luoyang: Henan University of Science and Technology, 2014: 7. |
| [25] | Guo Z, Peng B, Li ZY, et al. Study on transformation rule of saikosaponin a and saikosaponin d under different extraction conditions by UPLC-QTof-MS[J]. Nat Prod Res Dev (天然产物研究与开发), 2014, 26: 716–720. |
| [26] | Cong MY, Gong YR, Liang SB, et al. Effect of extraction and processing on chemical constituents in Bupleuri Radix by HPLC-ELSD fingerprint[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2018, 24: 13–17. |
| [27] | Cai WJ. Effect of different processing methods on efficacy of Bupleurum chinense and its Clinical Application[J]. J North Pharm (北方药学), 2015, 12: 89–89. |
 2018, Vol. 53
2018, Vol. 53


