2. 贵阳中医学院第一附属医院, 贵州 贵阳 550001;
3. 黑龙江中医药大学药物安全性评价中心, 黑龙江 哈尔滨 150040
2. First Affiliated Hospital of Guiyang College of Traditional Chinese Medicine, Guiyang 550001, China;
3. Drug Safety Evaluation Center, Heilongjiang University of Chinese Medicine, Harbin 150040, China
中医学认为甲亢分为阴虚火旺型及非阴虚火旺型, 其中火旺而阴虚是甲亢的主要病机特点。甲亢之火并非外来实火, 而是内生虚火, 所以不宜用苦寒清热法, 否则火不能去, 反而更盛。正如《素问·至真要大论》所云: “诸寒之而热者取之阴。”王冰言“壮水之主, 以制阳光”。《静香楼医案》云: “阴不足者, 阳必上亢而内燔。欲阳之降, 必滋其阴, 徒恃清凉无益也。”宜给予滋阴降火, 则阴能生, 阳火能降, 阴阳回复平衡。玄参味甘苦咸, 性寒质润, 偏入阴分, 以滋阴降火、解毒散结作用为主, 对于热毒实火、阴虚内热等证均可应用。
课题组前期对纳入的47个专利中治疗甲亢的中药复方进行了统计分析, 共涉及到了168味中药, 玄参用药频率位居第9 (31.91%)[1]。以玄参为臣药的芪玄抑甲宁可能通过调节脑垂体轴来控制甲状腺激素的分泌以及调控Th17细胞的相关因子, 治疗阴虚火旺甲亢大鼠[2-6]。且课题组前期采用优甲乐对正常大鼠造成甲亢模型, 分别从体征指标、基础代谢率及体内相关指标进行考察此甲亢模型具有一定的科学性[7]。然而, 单味中药玄参对阴虚火旺甲亢的作用机制尚不明确。
故本研究以优甲乐(euthyrox, 左甲状腺素钠片)所致的阴虚火旺甲亢模型为实验对象, 从尿液代谢组学层面探讨了玄参提取物对阴虚火旺甲亢干预作用所涉及的相关代谢通路。期望能够明确玄参提取物治疗阴虚火旺甲亢的相关靶点及生物学基础, 从而为玄参开发成作用靶标明确、安全有效治疗阴虚火旺甲亢的中药新药奠定基础。
材料与方法仪器 超高液相色谱-飞行时间串联质谱仪(美国Waters公司); KDC-160HR高速冷冻离心机(科大创新有限公司); Milli-Q超纯水系统(Milli-Q公司)。
药品和试剂 玄参饮片购自黑龙江省药材公司(批号: 20120623012), 经黑龙江中医药大学中药资源与开发教研室王振月教授鉴定为玄参科植物玄参(Scrophularia ningpoensis Hemsl.)。玄参提取物为课题组前期实验所得[8], 保存于黑龙江中医药大学中药药性理论实验室; 优甲乐®euthyrox® 50 μg (左甲状腺素钠片, 批准文号: H20140052;厂家: Merck KGaA); 亮氨酸脑啡肽(L9133) (Sigma-Aldrich公司); 色谱级甲醇(Dikma科技公司); 色谱级乙腈(Dikma科技公司)。
实验动物 雄性清洁级SD大鼠30只, 体重180~220 g, 由辽宁长生生物技术有限公司提供, 合格证号SCXK (辽) 2015-0001。动物饲养于黑龙江中医药大学动物实验中心的代谢笼中, 室内温度20~25 ℃, 相对湿度40%~60%, 12 h避光, 12 h光照, 自由饮食。经黑龙江中医药大学实验动物管理和使用委员会审核, 符合科技部《关于善待实验动物的指导性意见》和《实验动物使管理和使用委员会章程》的相关规定, 实验动物伦理审查批准编号DWLL20151108001。
动物分组、造模与给药方法 大鼠随机分为空白组、优甲乐诱导的阴虚火旺甲亢模型[7, 9]、玄参提取物治疗组, 每组10只。分别饲养于代谢笼中。空白组每天正常饲喂, 早上分别i.g.生理盐水, 两次, 间隔时间为90 min; 模型组每天上午i.g. 120 mg·kg-1优甲乐混悬液(给药质量浓度为12 mg·mL-1, 给药体积为10 mL·kg-1), 90 min后i.g.生理盐水, 每天一次, 连续15天; 玄参提取物组每天i.g.玄参提取物1 350 mg·kg-1 (临床给药剂量折算而来, 给药质量浓度为135 mg·mL-1, 给药体积为10 mL·kg-1)[8], 其余处理与模型组相同。
样品采集与处理 分别于给药过程中的第0、1、3、5、7、9、11、13和15天各组分别收集24 h尿液。尿液样本于12 000 r·min-1、4 ℃, 离心10 min去除固体残渣, 将尿液上清液转移至-80 ℃储存。检测前, 将冻融的尿液于13 000 r·min-1、4 ℃, 离心10 min, 上清液转移至1.5 mL离心管, 然后用0.22 μm的微孔滤膜进行过滤, 上清液进行UPLC-TOF-MS检测。
代谢组学色谱与质谱条件
色谱条件: Waters Acquity SDS LCT Premier色谱柱; 进样量2.00 μL。柱温40 ℃, 样品温度4.0 ℃。流速为0.4 mL·min-1。流动相为0.05%甲酸-乙腈(A) - 0.05%甲酸-水(B), 梯度洗脱, 0~8.00 min, 2.0%~40.0% A; 8.00~10.00 min, 40.0%~98.0% A; 10.00~13.00 min, 98.0%~100.0% A; 13.00~14.00 min, 100.0%~2.0% A。
质谱条件:正负离子模式, 毛细管电压正离子模式1 300.0 V, 负离子模式1 500.0 V; 样品锥孔电压正离子模式60.0 V, 负离子模式70.0 V; 脱溶剂气温度350.0 ℃; 源温度110.0 ℃; 锥孔气流量20.0 L·h-1; 脱溶剂气流量750.0 L·h-1; 离子能量正离子模式35.0 V, 负离子模式34.0 V; 质量扫描范围m/z 100 to 1 500 Da。
代谢组学数据处理与分析 在Progenesis QI[10]软件上加载LC-MS运行, 在每个分析步骤中可视化原始数据。离子强度图显示保留时间、m/z和特征强度以及质谱和色谱图的二维图, 为运行时自动校准、峰匹配和化合物去卷积提供质量保证。将ANOVA P < 0.05和变量重要性投影(VIP)值> 1作为选择显著化合物的筛选条件, 过滤数据, 然后导入到EZinfo进行分析。通过无监督的主成分分析(PCA)来检查异常值和分类趋势, 并将数据可视化。再使用正交偏最小二乘(OPLS-DA)评估两组差异。S-plot图中, 每个点代表准确的质量保留时间, X轴代表变量, 离原点越远的数据点的相对贡献度越大, S-plot图两端的点代表组间可信度最高的离子。将这些差异化合物重新导入到Progenesis QI软件中进行相关分析。
潜在代谢标志物鉴定及代谢通路分析 通过HMDB、KEGG等数据库进行化合物的分类鉴定, 最终用cytoscape 3.4.0软件将获得的化合物和通路的网络图进行可视化。
结果 1 尿液代谢谱分析空白组、模型组、玄参提取物治疗组的尿液具有代表性的基峰强度(BPI)色谱图, 见图 1。由于UPLC色谱柱中的小颗粒填料, 小分子代谢物在短短的13 min内就能得到很好的分离。本研究发现, 健康大鼠与模型组大鼠的尿液代谢谱图存在明显差异, 表明模型组大鼠具有独特的尿液代谢物特征, 提示玄参的生物标志物不是单一物质的改变, 而是多种代谢物差异构成了尿液的生物标志物群。
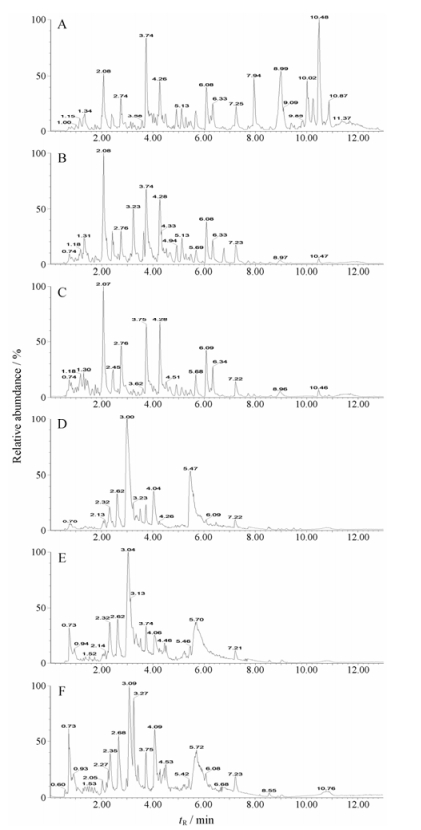
|
Figure 1 Based peak intensity chromatograms obtained from the positive ion and negative ion of rat urine. A, D: Control group; B, E: Model group; C, F: Radix Scrophulariae group |
使用PCA法研究优甲乐诱导的阴虚火旺甲亢大鼠尿液代谢表型的经时轨迹变化, 模型组第15天的尿液代谢表型与第0天的最远, 说明优甲乐诱导的阴虚火旺甲亢的病理状态达到最高, 见图 2。使用3D- PCA法研究第15天优甲乐对正常大鼠的影响, 见图 3A和B, 模型组样本点在PC3维与对照组可以完全区分开, 说明优甲乐模型组大鼠机体生理及物质代谢状况已经发生了明显的改变。而玄参提取物干预后, 玄参组样本点远离于模型组而向空白组接近, 表明玄参提取物干预后, 由优甲乐诱导产生的偏离得到了明显的改善(图 3C和D)。
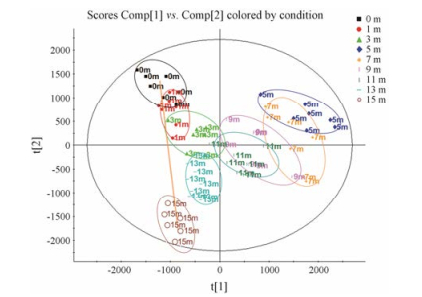
|
Figure 2 Trajectory change diagram of the urine metabolic phenotypes of rats at different time points following the administration of euthyrox. 0 m represents before administration; 1 m represents the first day after administration; 3 m represents the third day after administration; 5 m represents the fifth day after administration; 7 m represents the seventh day after administration; 9 m represents the ninth day after administration; 11 m represents the eleventh day after administration; 13 m represents the thirteenth day after administration; 15 m represents the fifteenth day after administration. The X axis is the score on the first principal component; The Y axis is the score on the second principal component |
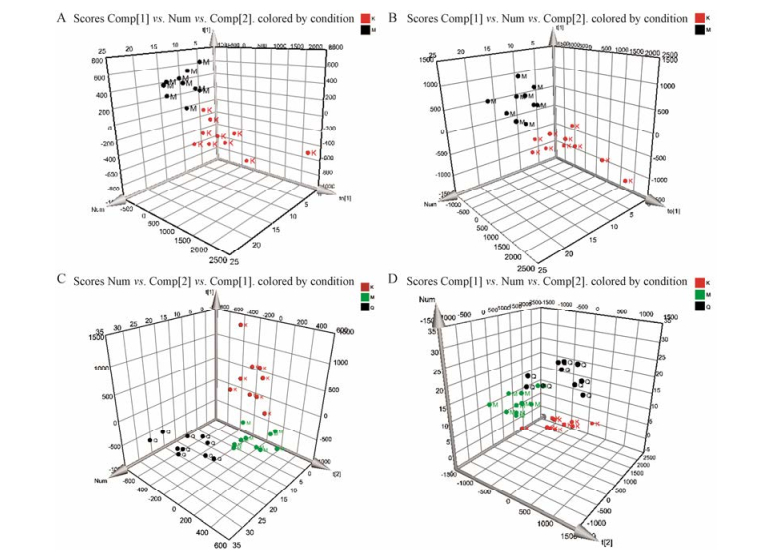
|
Figure 3 3D-PCA score plot among control group, model group and Radix Scrophulariae group. K represents control group, M represents model group; Q or g represents Radix Scrophulariae group. The X axis is the score on the first principal component; The Y axis is the score on the second principal component. A, C: Positive ion detection mode; B, D: Negative ion detection mode |
本文使用OPLS-DA模型中VIP参数评价潜在的生物标志物, 结合S-plot及VIP-plot的结果, 见图 4, 选取VIP > 1的差异变量, 再用t检验对筛选到的差异变量在对照组和给药组间进行验证, 只有P < 0.05的差异变量才被认为是潜在的生物标志物。

|
Figure 4 S (A, B) and VIP score plots (C, D) of euthyrox on normal rat urine samples in positive and negative ion mode |
在尿液中筛选得到45个具有显著差异的化合物, 通过比对这些潜在生物标志物的峰面积, 其中优甲乐对正常大鼠的尿液中潜在干预靶点中, 26个上调, 19个下调, 见表 1和图 5。
| Table 1 Potential biomarkers in urine samples from hyperthyroidism rat model of yin deficiency induced by euthyrox. U represents urine. *P < 0.05, **P < 0.01 vs control group. ↑: Upregulation; ↓: Downregulation; HMDB ID represents HMDB number; Formula represents the molecular formula of markers; Metabolites represents the name of markers; KEGG represents the corresponding pathway number in KEGG |

|
Figure 5 Heatmaps visualization for urine samples. Rows: Samples; columns: Metabolites. Color key indicates metabolite expression value, blue: Lowest; red: Highest. K represents control group; R represents model group; U represents urine. |
将45个潜在生物标志物作为优甲乐对正常大鼠尿液中潜在生物标志物, 并进行MetaPA识别显著富集通路分析, 结果显示45个优甲乐扰动的尿液代谢物参与18个代谢通路, 见图 6, 分别是泛醌和其他萜醌类生物合成、戊糖和葡萄糖醛酸相互作用、酪氨酸代谢、甘油磷脂代谢、尼古丁和烟酰胺代谢、色氨酸代谢、半胱氨酸和蛋氨酸代谢、嘧啶代谢、赖氨酸降解、类固醇激素生物合成、淀粉与蔗糖代谢、甘氨酸, 丝氨酸和苏氨酸代谢、精氨酸和脯氨酸代谢、嘌呤代谢、苯丙氨酸、酪氨酸和色氨酸生物合成、亚油酸代谢、α-亚麻酸代谢和花生四烯酸代谢。
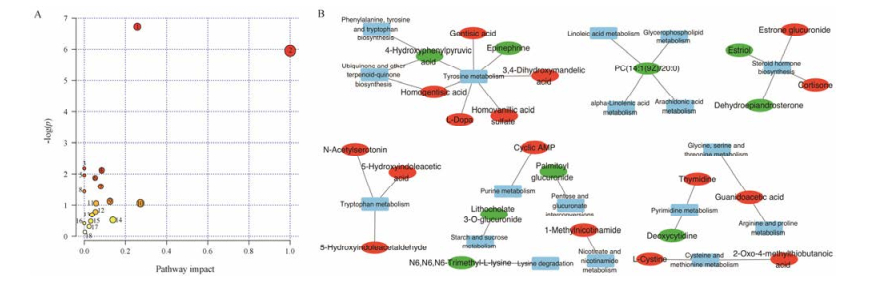
|
Figure 6 Topological graph of potential biomarkers in model group based on METPA (A) and pathway analysis of potential targets of euthyrox on normal rat (B). 1: Tyrosine metabolism; 2: Ubiquinone and other terpenoid-quinone biosynthesis; 3: Phenylalanine, tyrosine and tryptophan biosynthesis; 4: Tryptophan metabolism; 5: Linoleic acid metabolism; 6: Steroid hormone biosynthesis; 7: Cysteine and methionine metabolism; 8: alpha-Linolenic acid metabolism; 9: Nicotinate and nicotinamide metabolism; 10: Pentose and glucuronate interconversions; 11: Pyrimidine metabolism; 12: Lysine degradation; 13: Starch and sucrose metabolism; 14: Glycerophospholipid metabolism; 15: Glycine, serine and threonine metabolism; 16: Arachidonic acid metabolism; 17: Arginine and proline metabolism; 18: Purine metabolism. Blue rectangles represent pathway; red Ellipses represents metabolites (red: Upregulation; green: Downregulation) |
与阴虚火旺甲亢模型组相比, 玄参可显著回调的代谢物有6个(P < 0.05), 其中上调的有1个、下调的有5个, 通过玄参对尿液中代谢物的调节作用, 干预阴虚火旺甲亢的发生, 见表 2和图 7。基于METPA分析发现玄参可以显著回调的尿液中代谢标记物所涉及的代谢通路有5个, 分别是色氨酸代谢、嘧啶代谢、酪氨酸代谢、嘌呤代谢和甾体激素类生物合成。
| 表 2 Biomarkers in the urine sample of hyperthyroidism rat model of yin deficiency induced by euthyrox |

|
Figure 7 Ion intensity of potential biomarkers obtained from urine samples (n = 10, x±s). *P < 0.05, **P < 0.01 vs model group |
5-羟吲哚乙酸(5-HIAA)参与了色氨酸代谢[11]。五羟色胺(5-HT)的合成是色氨酸在色氨酸羟化酶作用下生成5-羟色氨酸(5-HTP), 又在5-羟色胺酸脱羧酶催化下脱去羧基生成5-HT。在单胺氧化酶作用下, 5-HT降解为5-HIAA。5-HIAA是5-HT的主要代谢产物, 在尿液样本中, 5-HIAA用于确定机体内5-HT水平, 不具有生物活性。在本研究中, 模型组中5-HIAA水平显著上调(P < 0.01), 推测优甲乐促进了5-HT向5-HIAA的转化, 导致5-HIAA在尿液中含量的增加, 报道指出肾功能异常和甲状腺功能亢进的患者有5-HIAA水平的改变[12]。而玄参的干预显著下调5-HIAA的表达(P < 0.01)。因此玄参可能间接抑制单胺氧化酶的活性, 抑制5-HT向5-HIAA的转化进而调节色氨酸代谢发挥滋阴降火作用。
胸苷(脱氧胸苷, 脱氧胸腺嘧啶核苷)是一种嘧啶脱氧核苷, 参与了嘧啶代谢。本研究中, 模型组尿液中胸苷水平显著上调(P < 0.01), 据报道胸苷含量过高导致机体发热及神经系统症状[13], 推测阴虚火旺性甲亢患者所出现的五心烦热、头痛目眩等症状可能是由于机体内胸苷高表达引起的, 而玄参显著下调尿液中胸苷水平(P < 0.05), 因此玄参的治疗作用可能是通过调节嘧啶代谢中胸苷的水平来实现的。
左旋多巴(L-dopa)是儿茶酚胺类神经递质酶促合成过程的中间代谢产物, 也是多巴胺(DA)递质的前体物质, 由酪氨酸羟化酶催化左旋酪氨酸生成。DA不能透过血脑屏障, 而左旋多巴是多巴胺的代谢前体, 能透过血脑屏障, 代谢为DA[14]。左旋多巴在体内代谢后, 大部分转变为DA, 其主要代谢物为3-甲氧基-4-羟苯乙酸(高香草酸, HVA)和二羟苯乙酸(DOPAC), 迅速经尿排泄[15]。据报道左旋多巴在脑中转化成DA而发挥作用, 用于治疗原发性震颤麻痹及非药原性震颤麻痹综合征, 也用于治疗肝昏迷[14], 而甲亢患者机体亦有震颤的表现[16]。本研究模型组尿液中左旋多巴显著高表达(P < 0.01), 而甲亢患者机体推测优甲乐抑制左旋多巴向DA的转化, 导致DA的机体内含量的减少而使得机体出现震颤。而玄参促进此转化的进行, 进而改善模型组的酪氨酸代谢。
环磷酸腺苷(CAMP)的功能是起第二信使的作用, 并具有广泛的生物学效应, 可影响许多酶的活性和细胞内的生理生化过程。例如蛋白质激酸、磷酸化酶、脂肪分解、胰岛素释放等, 均可被CAMP促进和加强, 而糖原合成酶、血小板凝集等又可被CAMP抑制[17]。它不仅在神经系统中有重要的作用, 而且对行为和情绪有影响。例如, 将二丁基环-磷酸腺苷(为CAMP的衍生物), 埋藏于大鼠丘脑下部, 可引起发热、运动增多、激怒等现象[18]。同一药品注入侧脑室也引起运动增多。有研究者[19]观察到:躁狂症患者尿中CAMP排出量较多, 抑郁症患者排出量较少, 躁狂-抑郁症患者由抑郁相转向躁狂相的当天, 尿中CAMP含量剧增。实验表明[20]:含氮激素的作用都是通过CAMP而完成的, 当此类激素到达某个可作用的细胞(称为靶细胞)时, 首先和该细胞膜上相应的受体结合, 结合一旦成功, 便激活细胞膜上的腺苷酸环化酶, 使得三磷酸腺苷转变为CAMP; 细胞内CAMP浓度一改变, 便引起一系列化学反应。这些化学反应不仅执行了传递激素信息的功能, 而且还有一系列功能放大的作用。最后就使细胞产生明显的生理效应。本研究模型组尿液中CAMP高表达(P < 0.01), 玄参显著下调模型组中CAMP水平(P < 0.01), 推测, 玄参可能通过抑制CAMP的含量调节嘌呤代谢进而改善阴虚火旺甲亢大鼠烦躁易怒的状态。
雌酮为雌二醇的氧化产物, 雌酮的生物活性比雌二醇弱, 在患肝脏疾病、睾丸肿瘤、心肌梗塞等疾病时, 雌酮水平增高[21, 22]。本研究模型组尿液中雌酮高表达(P < 0.05), 且临床上报道甲状腺机能亢进患者的雌激素水平高于正常健康者激素水平, 雌激素水平与甲亢有相关性, 雌激素对甲状腺机能的发生、发展有促进作用[23]。故推测优甲乐导致机体发生器质性病变, 而玄参治疗后显著下调雌酮水平(P < 0.01), 因此, 玄参可能通过调节类固醇激素的合成途径中雌酮的水平间接调节雌激素水平来发挥治疗作用。
本研究发现了6个潜在生物标志物, 分别为脯氨酸二甲内盐、雌酮、胸苷、5-羟吲哚乙酸、环磷酸腺苷和左旋多巴, 相关性最强的通路有色氨酸代谢、嘧啶代谢、酪氨酸代谢、嘌呤代谢和甾体激素类生物合成。值得注意的是玄参提取物对脯氨酸二甲内盐的下调和雌酮、胸苷、5-羟吲哚乙酸、环磷酸腺苷和左旋多巴的上调均具有显著的逆转趋势, 能够使得它们的表达恢复平衡。这些结果可能表明了玄参提取物对优甲乐诱导的阴虚火旺甲亢的防治作用, 可以通过尿液中多个代谢物靶点的干预来实现。鉴别出尿液中6个潜在生物标志物参与了阴虚火旺甲亢相关的代谢通路, 而玄参提取物对尿液中相关靶点具有干预作用, 从而找到玄参防治阴虚火旺甲亢的生物学基础。
| [1] | Liu C, Liu H, Miao J, et al. Discussion on the law of traditional Chinese medicine for treating hyperthyroidism in the national patents[J]. Inf Tradit Chin Med (中医药信息), 2013, 52: 61–64. |
| [2] | Liu S, Cui X, Chen P, et al. A comparative study of two hyperthyroidism models induced by Yersiniaenterocolitica and Euthyrox[J]. Chin J Comp Med (中国比较医学杂志), 2014, 24: 19–24, 3. |
| [3] | Liu S, Zhen Z, Wang K, et al. Pharmacodynamic research of QixuanYijianing in the treatment of hyperthyroidism[J]. Acta Chin Med Pharmacol (中医药学报), 2017, 45: 48–51. |
| [4] | Liu S, Zhen Z, Zhang N, et al. Research progress of animal models of graves disease[J]. J Liaoning Univ TCM (辽宁中医药大学学报), 2016, 18: 8–11. |
| [5] | Liu S, Zhen Z, Li J, et al. Regulatory effect of Qixuanyijianing on Th17 cells of rats with hyperthyroidism[J]. Pharmacol Clin Chin Mater Med (中药药理与临床), 2017, 33: 144–148. |
| [6] | Liu S, Cui X, Feng G, et al. Supplementing Qi and nourishing Yin prescription in treatment of hyperthyroidism[J]. J Liaoning Univ TCM (辽宁中医药大学学报), 2014, 16: 5–7. |
| [7] | Xiao H, Tan C, Dou D. Effects of 3 Chinese drugs with cold property on hyperthyrosis rats induced by euthyrox[J]. Chin Arch Tradit Chin Med (中华中医药学刊), 2016, 34: 2122–2125. |
| [8] | Zhang N, Li Z, Liu G, et al. Antidiabetic activity of Radix Scrophulariae and its split fraction[J]. Pharmacol Clin Chin Mater Med (中药药理与临床), 2016, 32: 55–60. |
| [9] | Zhao H, Zhang N, Pang M, et al. The effect of Radix Scrophulariae and split components on material and energy metabolism in pyretic syndrome rats[J]. Pharmacol Clin Chin Mater Med (中药药理与临床), 2017, 33: 93–96. |
| [10] | Lin L, Lin H, Zhang M, et al. A novel method to analyze hepatotoxic components in Polygonum multiflorum using ultra-performance liquid chromatography-quadrupole time-of- flight mass spectrometry[J]. J Hazard Mater, 2015, 299: 249–259. DOI:10.1016/j.jhazmat.2015.06.014 |
| [11] | Myint AM, Bondy B, Baghai TC, et al. Tryptophan metabolism and immunogenetics in major depression: a role for interferon- gamma gene[J]. Brain Behav Immun, 2013, 31: 128–33. DOI:10.1016/j.bbi.2013.04.003 |
| [12] | Li Y, Mu S, Tang A. Progress in the study of 5-hydroxyindolyl acetic acid[J]. Pract Prev Med (实用预防医学), 2010, 17: 2131–2134. |
| [13] | Karbownik M, Modrzejewska H, Gesing A, et al. Thymidine kinase activity in homogenates of rat thyroid lobes from euthyroid, hypothyroid and/or hyperthyroid rats incubated with EGF: studies ex vivo in vitro[J]. Endocr Regul, 1999, 33: 17–23. |
| [14] | Porras G, De Deurwaerdere P, Li Q, et al. L-Dopa-induced dyskinesia: beyond an excessive dopamine tone in the striatum[J]. Sci Rep, 2014, 4: 3730. |
| [15] | Huang L, Deng M, Zhang S, et al. Coadministration of beta-asarone and levodopa increases dopamine in rat brain by accelerating transformation of levodopa: a different mechanism from Madopar[J]. Clin Exp Pharmacol Physiol, 2014, 41: 685–690. |
| [16] | Mazzucchi S, Frosini D, Calabrese R, et al. Symptomatic orthostatic tremor associated with Graves' disease[J]. Neurol Sci, 2014, 35: 929–931. DOI:10.1007/s10072-014-1672-1 |
| [17] | Wu J, Sun L, Chen X, et al. Cyclic GMP-AMP is an endogenous second messenger in innate immune signaling by cytosolic DNA[J]. Science, 2013, 339: 826–830. DOI:10.1126/science.1229963 |
| [18] | Macdonald LJ, Graham JG, Kurten RC, et al. Coxiella burnetii exploits host cAMP-dependent protein kinase signalling to promote macrophage survival[J]. Cell Microbiol, 2014, 16: 146–159. DOI:10.1111/cmi.2014.16.issue-1 |
| [19] | Kim MH, Leem YH. Chronic exercise improves repeated restraint stress-induced anxiety and depression through 5HT1A receptor and cAMP signaling in hippocampus[J]. J Exerc Nutr Biochem, 2014, 18: 97–104. DOI:10.5717/jenb.2014.18.1.97 |
| [20] | Paramonov VM, Mamaeva V, Sahlgren C, et al. Genetically- encoded tools for cAMP probing and modulation in living systems[J]. Frontiers Pharmacol, 2015, 6: 196. |
| [21] | Lauro FV, Francisco DC, Elodia GC, et al. Evaluation of activity of an estrogen-derivative as cardioprotector drug using an ischemia-reperfusion injury model[J]. Int J Clin Exp Med, 2015, 8: 12041–12055. |
| [22] | Sinclair M, Gow PJ, Angus PW, et al. High circulating oestrone and low testosterone correlate with adverse clinical outcomes in men with advanced liver disease[J]. Liver Int, 2016, 36: 1619–1627. DOI:10.1111/liv.2016.36.issue-11 |
| [23] | Olivo J, Gordon GG, Rafii F, et al. Estrogen metabolism in hyperthyroidism and in cirrhosis of the liver[J]. Steroids, 1975, 26: 47–56. DOI:10.1016/0039-128X(75)90005-7 |
 2018, Vol. 53
2018, Vol. 53


