2. 泰州市第二人民医院, 江苏 泰州 225500
2. Taizhou Second People's Hospital, Taizhou 225500, China
神经胶质瘤是最常见的中枢神经系统原发性的脑部肿瘤。胶质母细胞瘤恶性度最高, 预后最差, 约占颅内肿瘤40%~50%。目前临床常用的化疗药物均具有骨髓抑制、肺毒性和血液毒性等不良反应, 且易产生耐药性。迫切需要一种高效、低毒的化疗药物来改善胶质瘤的治疗现状。本文研究的蓝萼甲素(GLA)是从蓝萼香茶菜中提取出的二萜类化合物, 近年来的药理研究显示其通过激活人凋亡相关因子配体和C-Jun氨基末端激酶(C-Jun N-terminal kinase, JNK)信号通路诱导人类乳腺癌细胞凋亡[1]。GLA能够诱导HL-60细胞凋亡[2]; 对人宫颈鳞癌SiHa细胞株生长具有抑制作用[3]; 可诱导白血病细胞K562的细胞毒性及细胞周期阻滞[4]; GLA可抑制HepG2细胞增殖并诱导其凋亡[5]。关于胶质瘤方面, Xiao等[6]研究报道GLA作为蛋白激酶B (protein kinase B, Akt)的负性调节剂诱导了胶质瘤细胞U87MG凋亡, 但其具体的作用靶蛋白还不清楚。本研究就蓝萼甲素对胶质瘤细胞的凋亡作用及机制进行深入的探讨, 以期为临床开发新的抗胶质瘤药物提供一定的依据。
材料与方法主要仪器 蛋白电泳仪和实时荧光定量PCR仪(美国Bio-Rad公司); 离心机(上海安亭仪器厂); 二氧化碳培养箱和酶标仪、核酸浓度测定仪(美国Thermo公司); 流式细胞仪(美国R & D公司); 倒置光学显微镜(日本Oylmpus公司)。
药品与试剂 GLA由苏州大学张健副教授研究组分离制备, 纯度 > 99%, 结构见图 1, 1H NMR (Me2CO-d6, 400 MHz) δ: 6.00 (1H, brs, H-17), 5.36 (1H, brs, H-17), 4.80 (1H, brs, H-14α), 4.19 (1H, m, H-7β), 3.01 (1H, brs, H-13α), 1.04 (3H, s), 1.09 (6H, s)。13C NMR (100 MHz, Me2CO-d6) δ: 38.6 (C-1), 34.1 (C-2), 216.7 (C-3), 47.1 (C-4), 51.6 (C-5), 31.4 (C-6), 73.8 (C-7), 61.4 (C-8), 53.7 (C-9), 39.3 (C-10), 18.6 (C-11), 30.6 (C-12), 46.8 (C-13), 75.3 (C-14), 206.2 (C-15), 149.5 (C-16), 116.6 (C-17), 27.6 (C-18), 21.1 (C-19), 18.4 (C-20)[7]。培养基、胎牛血清(fetal bovine serum, FBS) (美国Hyclone公司); 胰蛋白酶、双抗(美国Gibco公司); 二甲亚砜(dimethyl sulfoxide, DMSO)、α-tubulin、GAPDH抗体(美国Sigma公司); 细胞色素C (cytochrome C)抗体(美国Epitomic公司); cleaved caspase-3、cleaved PAR、phospho-p38、p38 MAPK、phospho-SAPK/JNK、SAPK/JNK、phospho- p42/44 MAPK、p42/44 MAPK抗体(美国Cell Signaling公司)。

|
Figure 1 Chemical structure of glaucocalyxin A (GLA) |
细胞培养 C6、U251、GL261、U87MG和T98G细胞培养于含10% FBS及1%双抗的完全培养基中, 置于37 ℃恒温、恒湿和5% CO2培养箱中培养。细胞密度达到75%~80%可进行实验。
MTT检测 细胞种于96孔板, 加入不同浓度的GLA及终浓度为500 μmol·L-1卡莫司汀[1, 3-bis (2-chloroethyl)-1-nitrosourea, BCNU]阳性对照药。处理24 h后加入质量浓度为0.5 mg·mL-1 MTT, 每孔30 μL, 37 ℃孵育2 h后, 每孔加DMSO 100 μL, 用酶标仪在490 nm波长处测定吸收度。
Hoechst 33258染色 将盖玻片置于24孔板内, 种入细胞使其生长密度约为80%。GLA处理24 h后, 磷酸缓冲盐溶液(phosphate buffer saline, PBS)洗3次, 加入冰甲醇0.5 mL, 固定细胞15 min。用PBS洗3次后, 加入Hoechst 33258染色液(1:10 000) 0.5 mL, 37 ℃染色15 min, 在荧光显微镜下观察。
平板克隆 将细胞种于6孔板中, 每个孔500个, 24 h后用不同浓度的GLA处理细胞。置细胞培养箱中培养14天。加冰甲醇2 mL, 固定细胞15 min。然后弃固定液, PBS洗3次, 加入0.1%结晶紫染色液500 μL, 30 min后用水清洗4次, 空气干燥。在显微镜下统计细胞数, 大于50个细胞的记为1个克隆。计算克隆形成率。克隆形成率= (克隆数/接种细胞数) × 100%。
细胞周期检测 细胞种于6孔板中, 每孔接种4×105个细胞, 加药处理后, 用胰酶消化, 1 100 rmin-1离心3 min。用PBS洗3次, 加入PBS 300 μL重悬细胞, 逐滴加入无水乙醇700 μL, 4 ℃固定12 h。取出后室温放置30 min, 1 100 rmin-1离心3 min, 弃固定液, PBS清洗3次, 用试剂盒中提供的缓冲液500 μL重悬细胞, 加入RNA酶, 使其终质量浓度为50 μg·mL-1, 37 ℃孵育30 min, PI染色15 min, 采用流式细胞仪检测。
Annexin V/propidium iodide (PI)双染检测凋亡 细胞种于6孔板, 每孔接种4×105个细胞, 加药处理后, 用胰酶消化, PBS清洗细胞2次, 收集1×105个细胞。用试剂盒中的缓冲液500 μL重悬细胞, 加入Annexin V和PI各5 μL, 避光反应5 min, 采用流式细胞仪检测。
线粒体膜电位检测 细胞种于6孔板中, 每孔接种4×105个细胞, 加药处理后, 收集细胞, 用培养液500 μL重悬细胞, 加入染色工作液500 μL, 细胞培养箱中孵育20 min。孵育结束后, 1 000 ×g, 4 ℃离心5 min, 用染色缓冲液洗2次。再加入适量染色缓冲液重悬细胞, 用流式细胞仪进行分析。
Western blot 细胞以合适的密度接种于6孔板, 经处理后, 收集细胞。每个样品中加入适量的裂解液, 置于冰上裂解后15 min, 震荡数秒, 再裂解5 min, 4 ℃, 12 500 rmin-1离心15 min, 收集上清液, 测定蛋白浓度。制备分离胶和浓缩胶后, 蛋白上样进行凝胶电泳。采用250 mA恒流将蛋白从凝胶转移至聚偏二氟乙烯膜, 待转膜结束后, 采用7%牛血清白蛋白室温封闭1 h, 加入一抗4 ℃孵育过夜, 洗膜后加入二抗室温孵育1 h, 洗膜5次, 加入显影液, 室温孵育1 min显影。
稳定同位素标记(stable isotope labeling with amino acids in cell culture, SILAC)定量蛋白组学 两组细胞同时培养, A组培养基含有12C, B组含有13C。待12C、13C完全掺入到蛋白中后, 加药处理24 h, 提取蛋白。然后上样, 跑胶, 结束后凝胶进行银染、漂洗和脱色处理。将最后的样品放入冷冻干燥机干燥后用适量0.1%三氟乙酸溶解, 采用质谱仪检测。得到的数据用Sequest及Gene Ontology软件进行分析[8]。
统计学方法 采用SPSS 17.0软件对实验结果进行统计分析, 制作图表。所有数据以均数±标准差表示, 组间比较用one-way ANOVA检验, post hoc analysis后期分析采用LSD-t检验, P < 0.05具有统计学意义。
结果 1 GLA对胶质瘤细胞活力的影响为了研究蓝萼香茶菜中提取的二萜类化合物GLA的抗胶质瘤作用, 检测了不同浓度GLA对5株不同来源的胶质瘤细胞活力的影响。5株胶质瘤细胞分别为大鼠胶质瘤细胞C6、小鼠胶质瘤细胞GL261、人胶质瘤细胞U251、U87MG和T98G细胞。除T98G细胞外, 其余4株细胞分别用5、10、20 μmol·L-1 GLA处理。T98G细胞最高浓度为50 μmol·L-1 (图 2)。结果表明, GLA显著抑制5株胶质瘤细胞的细胞活力且呈剂量依赖性, 对C6细胞、GL261细胞、U251细胞、U87MG细胞和T98G细胞的IC50值分别为15.03±1.44、14.14±1.35、12.42±0.68、18.49±1.36和44.32±1.92 μmol·L-1。

|
Figure 2 GLA inhibits glioma cell viability. C6 (A), GL261 (B), U87MG (C), U251 (D) and T98G cells (E) were treated with the indicated concentrations of GLA for 24 h, cell viability was determined by MTT assay. BCNU: 1, 3-bis (2-Chloroethyl)-1-nitrosourea. n = 3, x±s. *P < 0.05, **P < 0.01 vs control |
细胞死亡包括凋亡、坏死及自噬, 为了探究GLA引起的细胞死亡是否通过凋亡途径, 首先从细胞形态进行观察。图 3A的结果显示, 用10 μmol·L-1 GLA处理C6细胞24 h后, 显微镜下可明显观察到细胞变圆, 从培养皿上脱落。Hoechst染色呈典型的凋亡现象, 细胞核呈致密浓染或半月形凝聚(图 3B)。平板克隆实验结果显示, 在较低浓度0.625 μmol·L-1时, GLA能有效地抑制C6细胞集落的形成; 1.25 μmol·L-1 GLA能够使C6细胞形成的集落数寥寥无几(图 3C)。GLA诱导C6细胞凋亡呈剂量依赖性(图 3D)。细胞周期的结果显示, GLA主要阻滞了细胞周期的G2/M期(图 3E)。

|
Figure 3 GLA induced apoptosis in C6 cells. Cells were incubated with or without the indicated concentrations of GLA for 24 h. A: Cell morphology was observed using an invert microscope; B: Chromatin condensation (white arrow) was measured by Hoechest 33258 stain and observed under a fluorescent microscope; C: Colony formation assay was measured by crystal violet stain and observed under an invert microscope; D: Cell apoptosis was measured by Annexin V and propidium iodide (PI) stain and then detected by flow cytometry; E: Cell cycle was measured by propidium iodide stain and monitored by flow cytometry. n = 3, x±s. *P < 0.05, **P < 0.01 vs control |
线粒体途径是细胞发生凋亡的内源性途径, 为了进一步确定GLA引起的C6细胞死亡是通过凋亡, 需要检测GLA对C6细胞线粒体途径的影响, 图 4A的结果表明, GLA剂量依赖性地降低了C6细胞的线粒体膜电位。线粒体膜电位降低后会引起线粒体膜通透性的改变, 使得线粒体中cytochrome C释放到细胞浆中。GLA处理细胞后, 分离细胞浆蛋白, 检测cytochrome C的表达量, 发现释放入胞浆的cytochrome C明显增多(图 4B)。

|
Figure 4 GLA induced glioma cell apoptosis through mitochondrial pathway. A: Cell were collected after the drug treatment for 24 h, stained with JC-1 and then detected by flow cytometry; B: Cytoplasmic protein lysates were obtained 24 h after the drug treatments were subjected to Western blot to assess the levels of cytochrome C. Detection of glyceraldehyde-3-phosphate dehydrogenase (GAPDH) was done to confirm the equal loading of the samples. The values were expressed as a percentage of control band intensity, which was set to 100%. n = 3, x±s. *P < 0.05, **P < 0.01 vs control |
采用蛋白质组学的方法检测GLA作用后发生改变的细胞凋亡相关蛋白。其中GEF-H1上调十分明显, 上调倍数高达73倍, 见图 5A。PCR的结果显示, GLA能够剂量依赖性地增加C6细胞中GEF-H1的mRNA水平(图 5B)。当使用GEF-H1的siRNA将细胞中的GEF-H1沉默58.68%后(图 5C), 能够明显减少GLA引起的C6细胞存活率下降(图 5D)。

|
Figure 5 Proteomic analysis of C6 glioma cells after GLA treatment. The protein abundances were obtained by stable isotope labeling with amino acids in cell culture (SILAC). GO classification of the proteins whose abundances changed. The analysis includes all the proteins that were significantly affected by GLA. A: GO enrichment of up-regulated proteins (blank bar) and down-regulated proteins (black bar) involved in cell apoptosis; B: Effect of GLA on GEF-H1 mRNA of C6 cell; C: Effect of siGEF-H1 on GEF-H1 mRNA of C6 cell; D: Effect of siGEF-H1 on cell viability induced by GLA. *P < 0.05 vs negative |
GEF-H1能够正性调控MAPK家族蛋白的表达而诱导细胞凋亡, 检测GLA对MAPK家族蛋白的影响, 见图 6A。首先检测了15、30 min和1、2、4 h时间点, 发现在加入GLA (10 μmol·L-1) 15 min时就能够明显激活MAPK家族蛋白的表达, p-ERK、p-JNK和p-p38的表达明显增加, 且在2 h时达到峰值, 所以后续实验选择2 h对C6细胞进行剂量依赖性的检测。结果显示, GLA引起MAPK家族3个蛋白的磷酸化水平存在剂量依赖性, 图 6B结果表明GLA诱导C6细胞凋亡可能是通过MAPK途径来实现的。
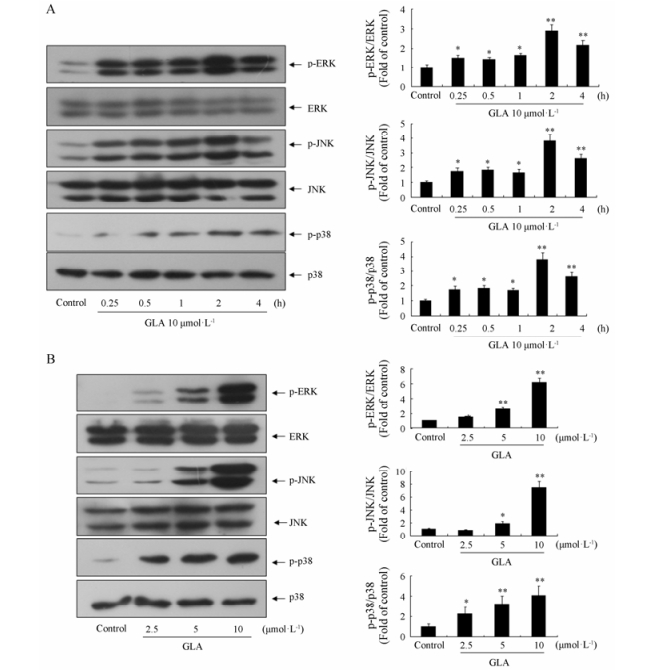
|
Figure 6 Effects of GLA on MAPK pathway. A: Western blot analysis result of C6 cell processed with 10 μmol·L-1 GLA after indicated time. B: Western blot analysis result of C6 cell processed with GLA in various dose. Quantification of these protein levels was performed by densitometric analysis. Detection of ERK, JNK, p38 was done to confirm the equal loading of the samples. n = 3, x±s. *P < 0.05, **P < 0.01 vs control |
为了进一步研究MAPK在GLA诱导C6细胞凋亡中的作用, 采用了p38的抑制剂SB203580 (10 μmol·L-1)、ERK的抑制剂U0126 (10 μmol·L-1)及JNK的抑制剂SP600125 (10 μmol·L-1)对细胞进行预处理30 min, 再加入GLA处理2 h后, 检测两个凋亡相关蛋白的表达。结果显示, ERK的抑制剂U0126能显著抑制GLA引起的caspase 3的活化及PARP的剪切(图 7A)。图 7B的结果进一步证明ERK的抑制剂U0126能够缓解GLA诱导的C6细胞的凋亡。这些结果表明ERK激活在GLA诱导细胞凋亡中起到重要作用。

|
Figure 7 GLA induced C6 cell apoptosis was mediated through ERK activation. A: Protein extracts were prepared and subjected to Western blot assay using antibody against cleaved caspase-3, cleaved PARP. Protein levels of α-tubulin were also measured as controls; B: The apoptotic status was determined by Annexin V-FITC binding assay; C: Protein extracts were prepared and subjected to Western blot assay using antibody against p-ERK, p-JNK, p-p38. Protein levels of ERK, JNK, p38 were also measured as controls. SB: SB203580; U: U0126; SP: SP600125. n = 3, x±s. *P < 0.05, **P < 0.01, ***P < 0.001 vs control |
蓝萼香茶菜中的总二萜有抗菌、抗肿瘤等作用, GLA为对映贝壳杉烯类二萜, 其中α, β-不饱和酮是抗胶质瘤作用的活性基团。U87MG细胞为PTEN基因发生突变的细胞株, T98G细胞为p53基因发生突变的细胞株, U251为PTEN基因和p53基因双突变的细胞株。GLA对C6、GL261、U251、U87MG和T98G细胞的细胞活力都产生影响并呈剂量依赖性, 说明GLA对胶质瘤细胞的杀伤作用不依赖于PTEN基因和p53基因。采用C6细胞进行平板克隆实验发现, 0.625 μmol·L-1 GLA能抑制细胞克隆的形成, 说明在低浓度时GLA就能抑制细胞的生长。
Gao等[2]发现GLA可以诱导HL-60细胞凋亡, 凋亡细胞百分率从7.80% (0 μg·mL-1)上升到40.60% (10 μg·mL-1)。本实验通过Hoechst染色进行初步的判断, 观察到染色质的浓缩。Annexin-V与PI双染检测发现, 随着GLA剂量的增加, 无论是早期凋亡还是晚期凋亡数目都有增加, 基本确定了GLA能够诱导C6凋亡。细胞周期实验发现, 经过10 μmol·L-1 GLA处理的C6细胞与正常细胞相比, G2/M期的数量由31.62%增加至71.32%, 这与文献[2]报道结果一致。
细胞凋亡必然经过线粒体途径, 会出现线粒体膜电位的降低, 进而导致线粒体膜通透性的改变, 细胞色素C从线粒体释放到细胞浆中, caspase-3的激活进而切割下游底物如PARP, 最后执行凋亡。所以, 本实验中检测了线粒体膜电位的改变、细胞色素C的释放及caspase-3的激活, 其结果证明了GLA使得线粒体膜电位降低, 细胞色素C释放到胞浆, caspase-3活化并剪切PARP。Xiao等[6]研究中, GLA作用U87MG细胞6 h时, 就能够检测到活化的caspase-3, 本实验用GLA作用C6细胞24 h, 发现caspase-3活化十分明显。Gao等[2]研究中发现GLA处理HL-60细胞24 h, 线粒体膜电位降低, 与本实验相符。
Xiao等[6]研究显示GLA是通过抑制Akt的磷酸化来诱导U87MG细胞实现凋亡的, 而本实验用SILAC蛋白组学方法得出的结果显示GEF-H1蛋白上调最为明显, 也证明了GLA能够引起C6细胞中GEF-H1的mRNA水平的升高。当使用GEF-H1的siRNA将细胞中的GEF-H1沉默后, 能够明显减少GLA引起的C6细胞的存活率下降, 说明GEF-H1可能是其中关键蛋白。
GEF-H1与Rho家族蛋白中RhoA、RhoB、RhoC和Rac都有结合活性, 但是对RhoA的结合活性最好[9]。GEF-H1作为RhoA特定的活化剂, 在细胞的凋亡中起到了关键作用[10, 11]。Gawlak等[12]发现在人肺上皮细胞发生病理环状拉伸时涉及到GEF-H1的活性增强, 使Rho的活化及ERK的磷酸化。Li等[13]研究也显示RhoA/ROCK1信号通路在亚硒酸钠诱导的白血病细胞凋亡的命运中起到重要作用, 并且调节了ERK1/2与MEK-ERK之间的相互作用。Cullis等[14]发现GEF-H1对RAS/MAPK通路起到正反馈作用, GEF-H1作为MAPK信号的放大器对胰腺肿瘤异种移植瘤的生长和存活十分重要。这些研究都显示了GEF-H1与MAPK通路有关, 作者推测MAPK家族是否就是GEF-H1激活Rho后下游的效应器, 所以检测了GLA对MAPK家族3个蛋白的影响。结果显示, ERK、JNK和p38在GLA处理15 min时就发生了磷酸化, 且随着GLA剂量的增加, 磷酸化程度也增加。
Kim等[15]研究显示, ERK的激活参与了kaempferol诱导MCF-7凋亡, 用ERK的抑制剂PD9805及siRNA沉默ERK后能够减轻kaempferol引起的MCF-7凋亡。而Jeong等[16]研究显示, kaempferol引起人胶质瘤A172细胞凋亡是通过降低ERK和Akt的表达, 增加ROS实现的。ERK的抑制剂U0126和Akt的抑制剂LY984002或过表达ERK、Akt都能够增加kaempferol诱导的细胞凋亡。同一种化合物在不同的细胞中ERK发挥了相反的作用。关于ERK在细胞信号通路中的作用, 有研究认为ERK与细胞增殖相关, 而越来越多的证据显示ERK也涉及了细胞凋亡途径。如:淫羊藿素通过ERK信号通路诱导人前列腺平滑肌细胞生长抑制以及诱导其凋亡, 此作用可被ERK的抑制剂PD98059所阻断[17]。Li等[18]研究表明, 活化RAF/MEK/ERK信号传导通路在钙诱导的上皮细胞凋亡中发挥关键作用。Shen等[19]研究也证实持续活化的ERK参与β, β-dimethylacrylshikonin对SGC-7901细胞生长抑制和凋亡, 并且ERK的抑制剂U0126能够缓解β, β-dimethylacrylshikonin引起的细胞凋亡。对于ERK发挥着完全相反的作用, 其中具体机制还不明确, 而本实验显示, 利用MAPK 3个家族成员的抑制剂进行预处理再加入GLA, 只有ERK的抑制剂能够减轻GLA诱导C6细胞的凋亡。本实验结果支持ERK途径参与GLA诱导的胶质瘤细胞凋亡。
至此, GLA诱导胶质瘤细胞凋亡是通过ERK途径还是Akt途径? Kim等[20]研究显示, GEF-H1作为MAPK的支架蛋白, 当MAPK途径受到抑制时能够增强PI3K-Akt途径信号通路。这佐证了本研究与Xiao等[6]研究并不矛盾, GLA在激活MAPK途径的时候, 同时抑制了Akt途径, 从而诱导胶质瘤细胞发生凋亡。因此, GLA的抗胶质瘤作用值得进一步深入探讨, 为临床治疗胶质瘤提供一定的依据。
| [1] | Li M, Jiang XG, Gu ZL, et al. Glaucocalyxin A activates FasL and induces apoptosis through activation of the JNK pathway in human breast cancer cells[J]. Asian Pac J Cancer Prev, 2013, 14: 5805–5810. DOI:10.7314/APJCP.2013.14.10.5805 |
| [2] | Gao LW, Zhang J, Yang WH, et al. Glaucocalyxin A induces apoptosis in human leukemia HL-60 cells through mitochondria- mediated death pathway[J]. Toxicol In Vitro, 2011, 25: 51–63. DOI:10.1016/j.tiv.2010.09.006 |
| [3] | Xia W, Wang XZ, Jiang XG, et al. The inhibitory effect of glaucocalyxin A on human cervical carcinoma SiHa cells[J]. Chin Pharmacol Bull (中国药理学通报), 2011, 27: 1035–1036. |
| [4] | Yang WH, Zhang J, Gao LW, et al. Preliminary investigation on glaucocalyxin A-induced cytotoxicity in K562 cells[J]. Chin J Exp Tradit Med Formu (中国实验方剂学杂志), 2011, 17: 181–184. |
| [5] | Ying N, Xu CL, Zhang J, et al. The effects of glaucocalyxin A in hepatic cancer HepG2 cell line[J]. Strait Pharm J (海峡药学), 2012, 24: 235–238. |
| [6] | Xiao X, Cao WD, Jiang XF, et al. Glaucocalyxin A, a negative Akt regulator, specifically induces apoptosis in human brain glioblastoma U87MG cells[J]. Acta Biochim Biophys Sin, 2013, 45: 946–952. DOI:10.1093/abbs/gmt097 |
| [7] | Shen XD, Wang B, Liu CY, et al. Study on chemical constituents from Rabdosia japonica[J]. Chin Tradit Herb Drugs (中草药), 2009, 40: 1883–1885. |
| [8] | Liu WH, Wang Y, Li SM, et al. Label -free quantitative proteomic analysis of acquired herceptin resistance in gastric cancer cells[J]. Acta Pharm Sin (药学学报), 2018, 53: 553–560. |
| [9] | Krendel M, Zenke FT, Bokoch GM, et al. Nucleotide exchange factor GEF-H1 mediates cross-talk between microtubules and the actin cytoskeleton[J]. Nat Cell Biol, 2002, 4: 294–301. DOI:10.1038/ncb773 |
| [10] | Chang ZF, Lee HH. RhoA signaling in phorbol ester-induced apoptosis[J]. J Biomed Sci, 2006, 13: 173–180. DOI:10.1007/s11373-005-9056-4 |
| [11] | Fujishiro SH, Tanimura S, Mure S, et al. ERK1/2 phosphorylate GEF-H1 to enhance its guanine nucleotide exchange activity toward RhoA[J]. Biochem Biophys Res Commun, 2008, 368: 162–167. DOI:10.1016/j.bbrc.2008.01.066 |
| [12] | Gawlak G, Tian Y, O'Donnell Ⅲ JJ, et al. Paxillin mediates stretch-induced Rho signaling and endothelial permeability via assembly of paxillin-p42/44MAPK-GEF-H1 complex[J]. FASEB J, 2014, 28: 3249–3260. DOI:10.1096/fj.13-245142 |
| [13] | Li F, Jiang Q, Shi KJ, et al. RhoA modulates functional and physical interaction between ROCK1 and Erk1/2 in selenite- induced apoptosis of leukaemia cells[J]. Cell Death Dis, 2013, 4: e708. DOI:10.1038/cddis.2013.243 |
| [14] | Cullis J, Meiri D, Sandi MJ, et al. The RhoGEF GEF-H1 is required for oncogenic RAS signaling via KSR-1[J]. Cancer Cell, 2014, 25: 181–195. DOI:10.1016/j.ccr.2014.01.025 |
| [15] | Kim BW, Lee ER, Min HM, et al. Sustained ERK activation is involved in the kaempferol-induced apoptosis of breast cancer cells and is more evident under 3-D culture condition[J]. Cancer Biol Ther, 2008, 7: 1080–1089. |
| [16] | Jeong JC, Kim MS, Kim TH, et al. Kaempferol induces cell death through ERK1/2 and Akt-dependent down-regulation of XIAP and surviving in human glioma cells[J]. Neurochem Res, 2009, 34: 991–1001. DOI:10.1007/s11064-008-9868-5 |
| [17] | Chen MF, Qi L, Li Y, et al. Icaritin induces growth inhibition and apoptosis of human prostatic smooth muscle cells in an estrogen receptor-independent manner[J]. Amino Acids, 2010, 38: 1505–1513. DOI:10.1007/s00726-009-0366-0 |
| [18] | Li DW, Liu JP, Mao YW, et al. Calcium-activated RAF/ MEK/ERK signaling pathway mediates p53-dependent apoptosis and is abrogated by alpha B-crystallin through inhibition of RAS activation[J]. Mol Biol Cell, 2005, 16: 4437–4453. DOI:10.1091/mbc.e05-01-0010 |
| [19] | Shen XJ, Wang HB, Ma XQ, et al. β, β-Dimethylacrylshikonin induces mitochondria dependent apoptosis through ERK pathway in human gastric cancer SGC-7901 cells[J]. PLoS One, 2012, 7: e41773. DOI:10.1371/journal.pone.0041773 |
| [20] | Kim JY, Welsh EA, Fang B, et al. Phosphoproteomics reveals MAPK inhibitors enhance MET- and EGFR-driven AKT signaling in KRAS-mutant lung cancer[J]. Mol Cancer Res, 2016, 14: 1019–1029. DOI:10.1158/1541-7786.MCR-15-0506 |
 2018, Vol. 53
2018, Vol. 53


