2. 中国中医科学院中药研究所, 北京 100700
2. Institute of Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China
小儿生长发育是当今社会所关注的重点问题, 生长发育过程中伴随着机体形态和功能的改变, 影响着机体的代谢。六味地黄丸(Liuwei Dihuang Wan, LW)载于宋代钱乙所著的《小儿药证直诀》, 是滋补肾阴的经典名方, 肾为先天之本, 主骨生髓, 脑为髓之海, 钱乙认为肾脏的功能与人体的生长发育密切相关, 故创立六味地黄丸用于治疗小儿先天肾阴不足所致的“五迟、五软”证[1], 然而随着现代研究的深入, 研究者忽视了其经典疗效, 没有很好地发挥其对小儿生长发育的调控作用。因此本实验将代谢组学应用于六味地黄丸对大鼠生长发育过程中的药效学评价, 在传统的生理研究基础上, 通过研究生长期大鼠在药物干预下的差异标记物及相关代谢通路, 从代谢层面表征六味地黄丸对大鼠生长发育的调控作用, 为中药复方药效评价新体系的建立奠定了实验基础。
材料与方法仪器 PB1501-N型分析天平[梅特勒·托利多仪器(上海)有限公司]; 美国Waters AcquityTM UPLC液相色谱仪(四元梯度泵-在线真空脱气机-自动进样器-二极管阵列检测器-柱温箱); 美国Waters SynaptTM HDMS质谱分析系统; MassLynx V4.1工作站; Waters Progenesis® QI (美国Waters公司); MS 3 digital旋涡混匀器(德国IKA公司); Unique-R20多功能超纯水系统(厦门锐思捷水纯化技术有限公司); 游标卡尺(0~125 mm, 无锡锡工量具有限公司)。
药物与试剂 熟地黄、山茱萸、山药、茯苓、泽泻、牡丹皮, 购于北京同仁堂哈尔滨药店; 羧甲基纤维素钠(天津市致远化学试剂有限公司); 乙腈、甲醇(色谱级, 英国Fisher Scientific公司); 甲酸(色谱级, 中国天津科密欧化学试剂有限公司); 亮氨酸脑啡肽(Sigma公司); 实验所用其他试剂均为分析级。
实验动物 60只21日龄SD雄性大鼠, 体重45 ± 5 g, 由黑龙江中医药大学药物安全性评价中心提供。SPF级环境下饲养, 12 h光照12 h黑暗, 动物自由摄食饮水, 夜晚于代谢笼中适应。
六味地黄丸提取液制备 LW提取液给药剂量设为低、中、高3个剂量, 分别为人类剂量的1倍、5倍、10倍。依照仲景牌六味地黄丸的人体日剂量(9 g生药/日), 根据体表面积折算大鼠给药日剂量(0.81 g·kg-1)。按照原方比例称量药材粗粉充分混合, 即地8山山4、苓泽丹皮3 (熟地黄:山茱萸:山药:茯苓:泽泻:牡丹皮= 8:4:4:3:3:3), 10倍量甲醇浸泡30 min后, 超声提取40 min, 重复3次, 合并滤液, 减压浓缩, 得到LW提取液的浓膏, 用0.5%的羧甲基纤维素钠(CMC-Na)溶液对浓膏稀释混悬, 制备成含生药量0.81 g·mL-1混悬液, 即LW高剂量, 然后逐级稀释成0.405和0.081 g·mL-1, 即LW中剂量和低剂量, 4 ℃保存备用。
动物分组与给药 将60只21日龄雄性SD大鼠连续6天夜晚放于代谢笼中适应, 27日龄时将大鼠按照体重随机分为对照组(C)、LW低剂量组(LWL)、LW中剂量组(LWM)和LW高剂量组(LWH)四组, 每组15只。LW各给药组于每天早上8:00灌胃给予六味地黄丸提取液, 持续16天, 对照组每天给予等量的0.5% CMC-Na水溶液。
生物样品的采集与处理方法 收集各组大鼠给药第0、1、4、7、10、13、16天的12 h夜尿, 于晚上7点放入代谢笼中, 次日早上7点取出, 放置于1.5 mL离心管中, 于4 ℃, 13 000 r·min-1, 离心10 min, 取上清液800 μL过0.22 μm滤膜用于正离子模式下UPLC-HDMS分析; 取上清液200 μL, 加蒸馏水800 μL, 振荡5 min, 过0.22 μm滤膜用于负离子模式下UPLC-HDMS分析。
行为学评价 行为学实验分为悬吊实验、旷场实验、Y迷宫实验和新奇物体识别实验, 用于评价各组大鼠肌力、活动能力、空间辨别学习能力、非空间短期识别记忆能力。每组大鼠均参加行为学评价(n = 15), 悬吊实验和旷场实验于给药16天内进行两次, 分别在给药第8天和15天进行; 当大鼠连续给药16天结束后, 进行Y迷宫实验和新奇物体识别实验, 分别在给药结束后的第1天进行Y迷宫实验, 在给药结束后的第2天进行新奇物体识别实验。
生理指标评价
体重 记录各组大鼠给药第0、1、4、7、10、13和16天时体重, 并进行比较分析。
脏器指数 新奇物体识别实验结束后(即给药结束后的第3天), 采集血液样本, 摘取甲状腺、胸腺、肾上腺、脾脏、肾脏、睾丸、精囊, 称量脏器湿重, 计算脏器指数。
股骨长度 取各组大鼠右侧股骨, 去除肌肉和结缔组织, 使用游标卡尺测量股骨长度, 比较各组大鼠股骨长度。
尿液代谢组学数据采集
色谱条件 色谱柱: Waters AcquityTM UPLCBEH C18 Column (100 mm × 2.1 mm ID, 1.7 μm); 流动相: A为0.1%甲酸乙腈, B为0.1%甲酸水; 梯度洗脱条件: 0~2.5 min, 1%~11% A, 2.5~4.5 min, 11%~25% A, 4.5~8.0 min, 25%~60% A, 8.0~8.5 min, 60%~99% A; 柱温: 40 ℃; 流速: 0.4 mL·min-1; 进样量: 2 μL。
质谱条件 离子源温度110 ℃, 脱溶剂气流量800 L·h-1, 脱溶剂气温度380 ℃。正离子模式下, 毛细管电压2.6 kV, 锥孔电压30 V, 提取锥孔电压3.0 V; 负离子模式下毛细管电压2.0 kV, 锥孔电压35 V, 提取锥孔电压3.5 V。
代谢组学数据处理 利用Progenesis QI软件对所获得的尿液ESI-MS数据进行色谱峰匹配, 提取, 标准化后, 将离子归一化, 应用Ezinfo 2.0对各组数据进行非监督型主成分分析(Principal Components Analysis, PCA), 观察各组大鼠给药前后代谢轮廓的变化, 同时应用监督型模式识别分析(PLS-DA)得到反映各组变化趋势的Score plot图, 进一步应用正交偏最小二乘判别分析(Orthogonal Partial Least Square- Discriminate Analysis, OPLS-DA), 得到能够反映组间贡献率的S-plot图和VIP-plot图, 选取对分组贡献度较大(VIP > 2.0)的离子, 同时结合组间t检验结果(P < 0.05), 应用Human Metabolome Database (HMDB)数据库进行检索, 圈定潜在差异代谢标记物, 进一步利用二级质谱信息并结合Kyoto Encyclopedia of Genes and Genomes (KEGG)以及Metabolomics Pathway Analysis (MetPA)等数据库对潜在差异代谢标记物进行结构鉴定及代谢通路拓扑分析, 阐释其生物学意义, 评价六味地黄丸对大鼠生长发育的影响。
统计学方法 所有实验数据均采用SPSS 19.0软件进行分析, 以均值±标准差(x±s)表示, 组间比较采用t检验分析, P < 0.05具有统计学意义。
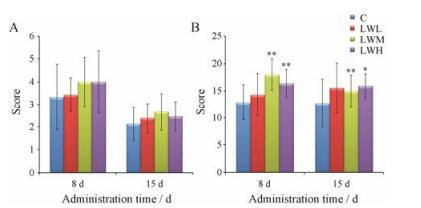
结果 1 六味地黄丸对大鼠行为学影响悬吊实验结果显示, 在大鼠口服LW提取液后, 悬吊时间相对延长, 活动能力较强。具体结果见图 1A。
旷场实验结果显示, 与对照组的大鼠比较, 口服LW提取液后的大鼠在30 s内的活动较多。其中LWM和LWH组的大鼠均表现出较强的认知能力及对周围环境的适应能力, 在两次测试得分均表现显著性差异(P < 0.01, P < 0.05)。具体结果见图 1B。
|
C: Control group; LWL: Low dose of LW (Liuwei Dihuang Wan) group; LWM: Middle dose of LW group; LWH: High dose of LW group. n = 15, x±s. *P < 0.05, **P < 0.01 vs C Figure 1 Results of suspension test (A) and open field test (B). |
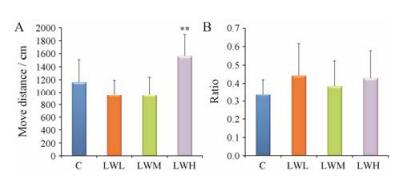
Y迷宫实验结果显示, 与对照组的大鼠比较, LWH组的大鼠在每个臂移动总距离较长具有极显著性差异, 表现出较强的活动能力; 并且口服LW提取液后的大鼠在新奇臂中停留时间相对较长, 可见LW对大鼠的空间辨别能力具有一定影响。具体结果见图 2。
|
A: Moving total distance in each arm of each group of rats; B: Level of spatial recognition memory ability in each group of rats. n = 15, x±s. **P < 0.01 vs C Figure 2 Results of Y-maze test. |
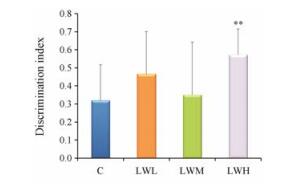
新奇物体识别实验结果显示, 口服LW提取液后的大鼠对新奇物体的辨别指数相对较高, 其中LWH组大鼠对新奇物体的偏爱程度显著高于对照组(P < 0.01), 可见LW能够影响大鼠的非空间短期识别记忆能力。具体结果见图 3。
|
n = 15, x±s. **P < 0.01 vs C Figure 3 Discrimination index of novel object in the rats of each group in Novel Object Recognition Test. |
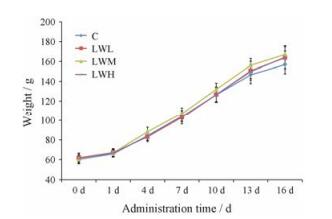
体重结果显示, 持续给予大鼠LW提取液16天, 与对照组比较, 各剂量组的大鼠体重增长迅速, 其中LWM、LWH组的大鼠体重增长较为明显, LWM组的大鼠体重变化表现出极显著性差异(P < 0.01), LWH组的大鼠体重变化表现出显著性差异(P < 0.05), 可以看出LW对大鼠的体重增长具有一定的促进作用。具体结果见表 1和图 4。
| Table 1 Weight changes in each group rats within 16 days. n = 15, x±s. *P < 0.05, **P < 0.01 vs C |
|
Figure 4 Weight changes in each group rats within 16 days |
脏器指数结果显示, 与对照组比较, 口服LW提取液后, 各剂量组的脏器指数呈现不同程度的变化, 其中甲状腺、胸腺、肾脏、睾丸和精囊的指数增加, 脾脏指数降低。LWL组的甲状腺和肾脏指数表现极显著性差异(P < 0.01), 睾丸和精囊指数表现显著性差异(P < 0.05); LWM组的肾上腺和精囊指数表现极显著性差异(P < 0.01), 甲状腺、胸腺和脾脏指数表现显著性差异(P < 0.05); LWH组的甲状腺、脾脏和睾丸指数表现极显著性差异(P < 0.01), 胸腺和肾脏指数表现显著性差异(P < 0.05)。具体结果见表 2。
| Table 2 Viscera index among four groups. n = 15, x±s. *P < 0.05, **P < 0.01 vs C |
股骨长度变化显示, 与对照组比较, LW各剂量组的大鼠股骨长度显著增长, 并表现出极显著性差异(P < 0.01), 可见LW能够促进大鼠的骨骼生长。具体结果见表 3。
| Table 3 Result of the length of femur among group. n = 15, x±s. **P < 0.01 vs C |
通过行为学、体重、脏器指数及股骨长度, 可以看出六味地黄丸对大鼠的生长发育具有一定的促进作用。利用Progenesis QI软件对所获得的各组尿液ESI-MS数据进行处理, 应用Ezinfo 2.0对各组大鼠不同时间点的尿液样品进行代谢组学研究, PCA得分图可以看出大鼠生长过程中及六味地黄丸干预调节下的尿液代谢轮廓的变化, 详见图 5A, B。通过对给药第16天四组大鼠尿液代谢轮廓进行PLS-DA分析, 由图可见各组聚类良好, 对照组与LW各剂量组明显分离, 并且对照组与LWH组偏离最远, 表明LW能够影响大鼠的尿液代谢轮廓, 使大鼠的代谢网络发生明显变化详见图 5C, D。
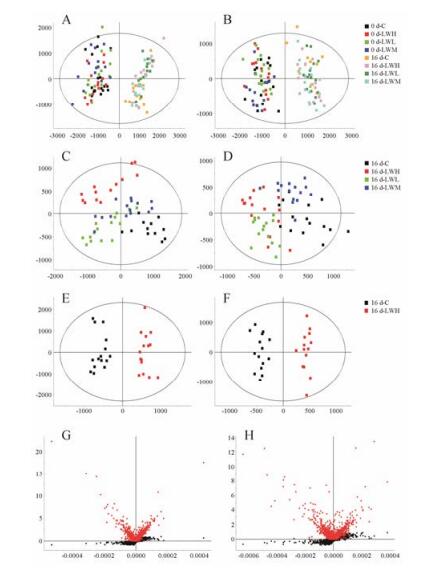
|
A, B: Score plot of urine profile of rats before and after oral administration of LW by PCA scanned; C, D: Score plot of urine profile of rats after oral administration of LW in the 16th day by PLS-DA scanned; E, F: The score plot of urine metabolic profiling of rats after oral administration of LW in the 16th day by OPLS-DA; G, H: S-plot and VIP of urine metabolic profiling of rats after oral administration of LW in the 16th day; A, C, E: Gpositive ion mode; B, D, F: Hnegative ion mode Figure 5 Pattern recognition analysis diagrams. |
进一步对对照组和LWH组大鼠的尿液代谢轮廓数据进行OPLS-DA分析, 得到能够反映组间贡献率的S-plot图和VIP-plot图, 详见图 5E~H, 选取对分组贡献度较大(VIP > 2.0)且t检验P < 0.05的离子进行潜在内源性代谢标记物筛选, 通过HMDB (http://www.hmdb.ca/)、KEGG (http://www.genome.jp/kegg/)等数据库检索, 及Massynx 4.1软件Massfragment模块对潜在差异代谢标记物进行二级结构验证, 最终表征了36个LW干预后的尿液差异代谢标记物, 详见表 4。
4 代谢通路分析将表 4中鉴定出的标记物输入MetPA (http://www.metaboanalyst.ca)数据库中对代谢通路进行拓扑特征分析, 构建代谢通路。将影响值大于0的代谢通路作为潜在的靶标代谢通路, 由图 6可知, 六味地黄丸提取液主要影响机体13个代谢途径, 包括:苯丙氨酸、酪氨酸和色氨酸生物合成, 苯丙氨酸代谢, 泛酸和辅酶A生物合成, 戊糖和葡萄糖醛酸酯转化, 二羧酸代谢, 组氨酸代谢, 三羧酸循环, 维生素B6代谢, 丙氨酸, 天冬氨酸和谷氨酸代谢, 酪氨酸代谢, 卟啉和叶绿素代谢, 淀粉和蔗糖代谢, 嘌呤代谢, 主要涉及氨基酸代谢、维生素代谢、能量代谢和核苷酸代谢, 绘制六味地黄丸提取液对大鼠生长过程中尿液代谢标记物的相关代谢网络图, 详见图 7。
| Table 4 Urine different metabolic biomarkers of rats before and after oral administration of LW scanned. "↑↓" represent higher and lower level in LW rats in comparison with control group, separately. VIP: Variable importance for the projection. *P < 0.05, **P < 0.01 vs C |
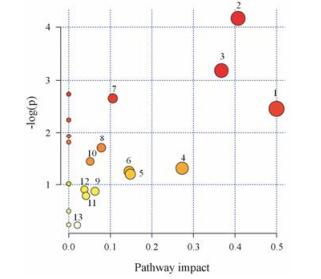
|
1: Phenylalanine, tyrosine and tryptophan biosynthesis; 2: Phenyla lanine metabolism; 3: Pantothenate and CoA biosynthesis; 4: Pentose and glucuronate interconversions; 5: Glyoxylate and dicarboxylate metabolism; 6: Histidine metabolism; 7: Citrate cycle (TCA cycle); 8: Vitamin B6 metabolism; 9: Alanine, aspartate and glutamate metabolism; 10: Tyrosine metabolism; 11: Porphyrin and chlorophyll metabolism; 12: Starch and sucrose metabolism; 13: Purine metabolism Figure 6 Summary of pathway analysis with MetPA. |
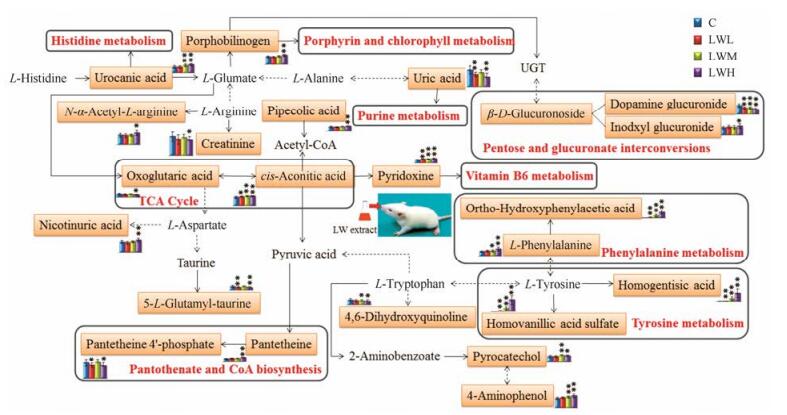
|
*P < 0.05, **P < 0.01 vs C Figure 7 Influenced metabolic network of metabolic markers of rats in growing stages after oral administration of LW. |
生长发育过程伴随着机体形态和功能的变化, 六味地黄丸作为滋补肾阴的经典名方, 对神经系统[2, 3]、生殖泌尿系统[4, 5]、内分泌系统[6]、免疫系统[7]、运动系统[8]、循环系统[9]等具有重要影响。连续给予六味地黄丸16天, 通过对传统的生理指标进行分析, 发现六味地黄丸可以显著提升大鼠的整体行为能力, 加快体重增长, 促进脏器和骨骼发育, 表明六味地黄丸具有促进生长发育的作用。
利用尿液代谢组学研究方法对口服六味地黄丸后大鼠的尿液代谢轮廓进行分析, 发现机体在正常代谢变化的基础上受到药物的影响后, 尿液代谢产物发生明显变化, 从而引起相关代谢通路的扰动, 初步表征了36个LW干预后的代谢标记物, 主要涉及13个代谢通路。其中氨基酸代谢变化最为明显, 氨基酸是蛋白质的基本组成单位, 能够合成激素、抗体等物质, 并且可以转化为碳水化合物和脂肪, 具有促进生长, 维持机体正常生理机能的作用。苯丙氨酸是人体必需氨基酸, 在肝脏等组织经代谢可产生酪氨酸, 进而在神经系统和肾上腺髓质作用合成去甲肾上腺素、肾上腺素和多巴胺等神经递质或激素[10], 影响下丘脑-垂体-甲状腺轴, 尿黑酸和硫酸高香草酸是酪氨酸的代谢产物, 给予LW提取液后, 苯丙氨酸、邻羟基苯乙酸、尿黑酸、硫酸高香草酸含量显著增加, 推测LW干预后诱导机体氨基酸代谢变化, 从而调控中枢神经和肾脏功能, 增加神经递质、激素等合成, 进而影响机体生长发育[11-14]。维生素是维持身体正常生理功能的重要调节物质, 对机体的新陈代谢、生长、发育等均具有极重要作用, 泛酰硫氢乙胺作为泛酸的共轭酰胺物质, 是辅酶A的中间合成体, 是大脑和神经必需的营养物质[15], 吡哆醇作为辅酶的组成成分, 参与神经递质、糖原、神经鞘磷脂、类固醇、核酸等多种代谢反应, 与氨基酸代谢密切相关[16], 泛酰硫氢乙胺和吡哆醇在LW各给药组中排出量增加, 表明机体的泛酸和辅酶A生物合成及维生素B6代谢发生扰动, 促使辅酶的生物合成增加, 进而影响机体的多种代谢反应。顺式乌头酸是二羧酸代谢和三羧酸循环代谢通路中关键代谢产物, 是产生能量的关键环节[17], 给予LW提取液后大鼠尿液中顺式乌头酸的排除显著增加, 表明机体能量代谢发生扰动, 提示LW可能通过调节顺式乌头酸影响三羧酸循环, 从而增强机体能量代谢。尿酸是由嘌呤核苷酸经分解代谢、脱氨基、催化氧化等作用生成的[18], 可在肾小球重吸收或经由肾小管排泄[19], 体液中尿酸含量的变化能够反映机体代谢、免疫等机能状况[20], LW给药组的尿酸排除量降低, 提示LW可能通过调控肾脏系统功能, 促进肾小管重吸收。通过对36个代谢标记物及13个相关的靶标代谢通路进行分析, 最终确定了8个LW影响大鼠生长发育的核心代谢标记物, LW通过调节代谢标记物, 影响相关的代谢通路, 进而调控中枢系统及肾脏系统功能, 从而发挥促进生长发育的作用。
结论六味地黄丸对大鼠的生长发育具有良好的促进作用。在传统的生理生化指标基础上, 利用尿液代谢组学分析技术, 首次阐明了六味地黄丸促进大鼠生长发育的核心标记物及代谢通路, 从代谢层面表征了六味地黄丸对大鼠生长发育的调控作用, 为中药复方药效评价新体系的建立奠定了实验基础。
| [1] | Wang P, Wang XJ. The research status of Liuwei Dihuang Wan[J]. Inf Tradit Chin Med (中医药信息), 2013, 30: 163–165. |
| [2] | Li QJ, Wang P, Wang MJ, et al. Impacts of Liuwei Dihuang Wan (LW) on a rat model of cerebral palsy based on chinmedomics[J]. World Sci Technol Mod Tradit Chin Med (世界科学技术-中医药现代化), 2016, 18: 1684–1696. |
| [3] | Chen Q, Li ZF, Li Q, et al. Effect of Liuwei Dihuang Wan on the learning memory and cholinergic M1 receptor positive neurons of aged rats[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2013, 19: 205–208. |
| [4] | Wang XJ, Zhang N, Sun H, et al. Protective effect of Liuwei Dihuang Wan and its constituents absorbed into blood after oral administration on hydrocortisone inducing renal deficiency in rat[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2008, 14: 33–37. |
| [5] | Ling QZ, Gao LL, Ao ZH, et al. Effect of Liuwei Dihuang Decoction on reproductive system of rats with kidney yin deficiency and spermatozoa[J]. Chin Tradit Pat Med (中成药), 2009, 31: 688–691. |
| [6] | Du YM, Li XH, Zhang JJ. Effect of Liuwei Dihuang Wan on insulin resistance in type 2 diabetic model rats by streptozotocin[J]. Chin Med Pharmacol Clin (中药药理与临床), 2012, 28: 6–9. |
| [7] | Wu WJ, Li LP, Zhao YG. Progress of Immunoregulatory Effect of Liuwei Dihuang Wan[J]. Mod J Integr Tradit Chin West Med (现代中西医结合杂志), 2011, 20: 4180–4182. |
| [8] | Sun H, Li J, Zhang A, et al. Liuwei Dihuang Wan, a traditional Chinese medicinal formula, protects against osteoporosis[J]. Pharm Anal Acta, 2013, 4: 4. |
| [9] | van Wietmarschen HA, van der Greef J, Schro n Y, et al. Evaluation of symptom, clinical chemistry and metabolomics profiles during Rehmannia six formula (R6) treatment:an integrated and personalized data analysis approach[J]. J Ethnopharmacol, 2013, 150: 851–859. DOI:10.1016/j.jep.2013.09.041 |
| [10] | Stonier C, Mc Gale EH, Aber GM. Studies of phenylalanine hydroxylase activity in patients with chronic renal failure:the effect of haemodialysis[J]. Clin Chim Acta, 1984, 143: 115–122. DOI:10.1016/0009-8981(84)90219-5 |
| [11] | Boirie Y, Albright R, Bigelow M, et al. Impairment of phenylalanine conversion to tyrosine in end-stage renal disease causing tyrosine deficiency[J]. Kidney Int, 2004, 66: 591–596. DOI:10.1111/j.1523-1755.2004.00778.x |
| [12] | Gallagher JA, Dillon JP, Sireau N. Alkaptonuria:an example of a "fundamental disease"-A rare disease with important lessons for more common disorders[J]. Semin Cell Dev Biol, 2016, 52: 53–57. DOI:10.1016/j.semcdb.2016.02.020 |
| [13] | Vigorita VW, Marino PD, Lucas PA. The distribution of ochronosis in osteoarthritic articular cartilage in a knee[J]. HSS J, 2016, 12: 76–80. DOI:10.1007/s11420-015-9464-6 |
| [14] | Tang D, Xiao J, Chen Q, et al. Progress of dopamine and its receptors in immune regulation[J]. Basic Clin Med (基础医学与临床), 2016, 36: 537–541. |
| [15] | Yang YH, Xiao CL. The functions and biosynthesis of pantothenate[J]. Chem Life (生命的化学), 2008, 28: 448–452. |
| [16] | Yang LL. Metabolic relationships between vitamin B6 and other nutrients[J]. Animal Sci Abroad (国外畜牧科技), 1993, 20: 19–22. |
| [17] | Simpson DP. Citrate excretion:a window on renal metabolism[J]. Am J Physiol, 1983, 244: 223–224. |
| [18] | Xu H. High serum uric acid level and cerebral arterial thrombosis[J]. J Math Med (数理医药学杂志), 2015, 28: 329–331. |
| [19] | Chen GL, Zhu LR, Na S. Effect of total saponin of Dioscorea on chronic hyperuricemia and expression of URAT1 in rats[J]. China J Chin Mater Med (中国中药杂志), 2013, 78: 128–135. |
| [20] | Okabayashi Y, Yamamoto I, Komatsuzaki Y. A rare case of nephrocalcinosis in th distal tubules caused by hereditary renal hypouricemia three months after kidney transplantation[J]. Nephrology (Carlton), 2016, 21: 67–71. DOI:10.1111/nep.12774 |
 2018, Vol. 53
2018, Vol. 53


