2. 方正医药研究院有限公司, 北京 102206
2. Founder Medical Research Institute Co., Ltd., Beijing 102206, China
药代动力学是定量研究药物在生物体内吸收、分布、代谢和排泄(ADME)的动态变化规律, 并阐明不同部位药物浓度与时间关系的科学。越来越多的数据表明, 建立在血浆药物浓度基础上的传统的药代动力学常常不能完全解释药物对肿瘤、脑和胎盘等[1-5]特定组织的药理作用, 难以真实有效地预测体内药物的药效, 出现药动学/药效学不相关的问题[6]。
药物在不同的细胞系内, 如肠细胞、肝细胞、肿瘤细胞等代谢途径是不一样的[6]; 细胞中的转运体、代谢酶、pH环境和电化学梯度等都是影响药物代谢的重要因素[7, 8]; 药物自身的性质如药物极性、剂型、是否有化学修饰、表面电荷等同样也会影响其在细胞内的代谢[9]。细胞内药物的处置过程及药物与靶点的结合是药物治疗效果的决定因素, 所以针对靶点位于细胞内特定位点的药物, 研究其细胞/亚细胞内的药物浓度经时过程有时比研究血浆药物浓度经时过程更有意义。细胞药代动力学是将细胞看作一个微观的有机整体, 定量研究药物在细胞和亚细胞内的吸收、转运、分布、代谢和排泄的动力学过程, 通过建立数学模型进而阐明药物在细胞内的处置规律, 科学地评价药物的药效的科学[10]。因此, 迫切需要将传统的宏观的药代动力学研究拓展到细胞/亚细胞水平, 进行细胞药代动力学研究。
纳米药物递送系统(nano-DDS)是目前新型药物递送系统研究的热点。与游离药物相比, nano-DDS表现出缓控释性[11]和靶向性[12]等特点, 可以提高药物生物利用度, 降低毒副作用; 其入胞、跨膜途径及药理作用的机制与游离药物相比也有所不同[13, 14]。对nano-DDS细胞药代动力学进行研究, 能够更有效、更全面地评价、预测药物的疗效及可能引起的毒副作用, 对nano-DDS的前期设计提供重要的参考依据。本文主要总结nano-DDS细胞药代动力学的研究内容及相关的研究方法。
1 Nano-DDS细胞药代动力学的研究内容Nano-DDS一般是指粒径在10~1 000 nm的纳米药物[15], 常表现出不同于游离药物的特性。由于载体材料的不同, 有的nano-DDS可以增加药物的溶解度和溶出速度, 有的可以控制药物的释放速度达到缓控释的效果; 在抗肿瘤治疗中, 由于肿瘤组织的EPR效应[16], nano-DDS可以表现出被动靶向效应, 从而改善药效, 降低毒副作用。当药物制成nano-DDS后, 药效的发挥不仅与靶组织的药物浓度有关, 还与药物在特定靶部位的释放密切相关。Nano-DDS中的药物只有在特定部位释放出来并与其作用靶点结合, 才能发挥药效。因此, 将细胞看成一个微观有机体, 研究nano-DDS进入细胞的方式, 胞内及亚细胞靶点处药物含量, 分析nano-DDS在细胞内吸收、转运、分布、代谢及排泄的动力学过程, 并通过建立数学模型阐明nano-DDS在细胞内的处置规律, 对阐明nano-DDS在细胞内的作用机制, 预测、评价nano-DDS的药效, 增加纳米药物研发的成功率具有重大意义。
1.1 吸收与转运Nano-DDS主要通过内吞作用进入细胞, 其内吞途径主要有巨胞饮、网格蛋白介导的内吞、小窝蛋白介导的内吞及网格蛋白/小窝蛋白非依赖的内吞等。其内吞过程与纳米粒本身的性质和细胞的性质都密切相关。
纳米粒本身的性质主要包括表面电荷、粒径、形状和载体的性质等。①表面电荷:电荷可以影响nano-DDS的入胞量和入胞途径。带正电荷的nano- DDS与细胞的相互作用比较强, 更易入胞, 同时其更倾向于通过网格蛋白介导的途径内吞[17]; 电荷对nano-DDS进入细胞后的细胞器定位也有影响, 带负电的nano-DDS更易通过溶酶体降解途径, 而带正电的纳米载体倾向于绕过溶酶体途径。②粒径:颗粒大小对nano-DDS的入胞和转运过程也有很大影响。Gratton等[18]研究发现, 与较小的纳米粒相比, 较大的微粒具有较慢的内化速率; Paillard等[19]发现, 增加固体脂质纳米粒的粒径可以改变其转运途径。③形状:形状对nano-DDS摄取的影响目前为止尚无明确的结论。Gratton等[18]在研究聚乙二醇水凝胶与HeLa细胞的相互作用时发现, 棒状纳米颗粒(d = 150 nm; h = 450 nm)与同体积圆柱形纳米颗粒(d = 200 nm; h = 200 nm)相比内化速率更快。而Chan课题组[20, 21]则报道, 棒状金纳米粒(14 nm × 40 nm和14 nm × 74 nm)与它的球形对应物(d = 74 nm)相比细胞内化速率较低。④载体性质:载体性质包括很多种, 如共聚物单体的组成、取代程度和亲疏水性等。这些因素直接或间接地影响细胞对nano-DDS内吞的量和途径。研究表明, 聚合物胶束的疏水段对转运量和速度起到了重要作用, 亲水段对胞内细胞器定位起到了重要作用[22]。疏水基团的修饰度也会影响纳米载体的摄取。壳聚糖纳米粒的棕榈基团修饰度越高, 摄取的量越多, 且随着疏水性的增加, 小窝蛋白介导的内吞显著增加[23]。
Nano-DDS的细胞摄取不仅取决于纳米粒的性质, 也与细胞的类型有关。Cartiera等[24]在研究不同细胞系对纳米粒摄取的作用时发现, 不同的细胞系对细胞摄取的速度和数量有着很大的差别。OK细胞摄取的速度比较快, 30 min既能检测到纳米粒的摄取, 4 h摄取达到饱和, 之后细胞内的纳米粒的数量逐渐减少。而HBE细胞摄取相对较慢, 直到24 h摄取量还在增加, 说明摄取达到饱和需要的时间较长。相比于OK细胞和HBE细胞, Caco-2细胞的摄取更慢, 摄取量更少。在配体修饰的nano-DDS中, 其摄取与细胞表面受体蛋白表达有很大关系。Xiong等[13]比较了游离多柔比星(DOX)、RGD修饰的DOX脂质体(RGDm-SL-DOX)和没有RGD修饰的DOX脂质体(SL-DOX) 3种制剂在黑色素瘤细胞中的摄取情况。结果显示, 与SL-DOX相比, 游离DOX更易进入肿瘤细胞, 这是因为游离药的扩散入胞一般要快于nano- DDS的内吞入胞过程[25]。RGDm-SL-DOX的肿瘤细胞摄取量比SL-DOX高, 这与肿瘤细胞表面的整合素受体高表达密切相关。
与游离药物相比, nano-DDS在体内血药浓度高低常与细胞水平的入胞量表现出不同的趋势。如静脉给予游离DOX或SL-DOX后[26], 游离DOX被迅速清除, 导致血液中的药物浓度远低于SL-DOX组。由于脂质体的长循环效应, 脂质体组在肿瘤组织的DOX浓度高于游离DOX组, 所以体现出更强的药效。
总之, nano-DDS与游离药物的体内外行为不同, 不同的nano-DDS可能具有相似的体内血药浓度随时间变化曲线, 但nano-DDS本身性质和靶细胞的不同, 可能导致靶向性高的nano-DDS在靶器官及靶细胞的分布会更高, 从而显示出更加显著的药效。通过研究nano-DDS的细胞药代动力学可在一定程度上筛选出靶向性高的nano-DDS, 大大减少药物体内实验的工作量, 提高药物的筛选效率。根据细胞药代动力学的结果, 在设计nano-DDS时可以通过改变制剂的颗粒大小、形状等来尝试改变药物的吸收和转运途径, 从而影响药物在体内的吸收和分布情况。
1.2 分布与代谢与游离药物相比, nano-DDS进入细胞后转运途径可能发生改变, 其分布、代谢过程及药效随之发生改变。Wang等[27]设计了一种包载pH响应型DOX前药的胶束, 并量化了其在内吞体和溶酶体中的分布。该胶束显示出不同于游离药物DOX的胞内转运途径。游离DOX首先穿过细胞膜扩散到胞质中, 然后大部分药物在早期时间点累积在细胞核中, 在溶酶体中的积累慢于在细胞核中的累积。相反, 载药胶束首先通过内吞作用形成内吞小泡, 再与溶酶体融合。在溶酶体中酸触发作用下释放DOX, 通过溶酶体膜扩散到胞质内, 然后到达细胞核, 发挥药效。王广基课题组[10]制备了一种可生物降解的紫杉醇聚合物胶束纳米制剂, 相比于游离紫杉醇, 该紫杉醇胶束在胞浆中分布是游离紫杉醇的4倍以上, 而核内浓度无明显差异, 说明其具有很强的胞浆靶向性。在体研究也证实紫杉醇胶束胞内释放迅速, 能显著增加药物在细胞内的蓄积及胞浆靶向分布, 显著抑制肿瘤生长, 延长存活时间, 体内药效明显优于市售制剂泰素。Zheng等[28]也制备了一种PLGA-PEG包载的紫杉醇胶束, 与游离紫杉醇定量比较在MCF-7细胞中的亚细胞分布情况, 结果显示:紫杉醇胶束在细胞膜和细胞器中的分布远高于游离紫杉醇, 而在细胞核、细胞质和细胞骨架中的分布相差不大。
对于不同作用靶点和不同性质的药物, nano- DDS所引起的胞内转运路径的改变会带来不同的效应。以DOX和紫杉醇为例, 它们本身的理化性质比较稳定, 将其有效递送至细胞内即可发挥药效; 而生物大分子药物(多肽、蛋白、siRNA)在溶酶体低pH和丰富酶的微环境下不稳定, 因此, 在载体设计时要考虑到生物大分子药物的溶酶体逃逸。
总之, 通过分析nano-DDS在细胞中的分布可以对药物发挥药效的机制有更深入地了解, 并不是所有药物只要血浆药物浓度一样, 就会发挥同样的药效, 药物的药效与其作用机制及胞内分布有密切关系。而根据细胞中特异性的内环境来设计不同种类的nano-DDS, 可以达到控制药物在细胞内代谢路径的目的。从细胞水平的智能给药系统出发, 延伸到动物水平, 为药物的设计提供了更加广阔的思路。
1.3 排泄由于各种外排蛋白的作用, 游离药物虽然很容易进入正常细胞, 但却很难在耐药性细胞聚集。Nano-DDS的出现, 可以大大改善这一情况, 这对药物药效的发挥起着重要作用。Mu等[14]比较了多西他赛市售制剂游离药Taxotere和多西他赛胶束在敏感性人口腔表皮癌(KB)细胞和耐药性口腔表皮癌(KBv)细胞中的药物蓄积情况。结果表明, 在KB细胞中, 两种制剂在4 h时多西他赛胞内含量没有显著性差别; 但是在KBv细胞中, 多西他赛胶束4 h时胞内含量比其游离药高1.5倍左右。研究者认为造成这一结果的原因是多西他赛胶束的载体材料Pluronic有抑制P-pg蛋白的功能, 影响药物外排, 从而提高多西他赛胶束的胞内含量。Varshosaz等[29]研究表明, 用叶酸分子修饰过的胶束可以帮助依托泊苷逃离外排泵, 从而增强细胞蓄积。Xu等[30]也通过合成一种pH敏感胶束, 避开了细胞中外排蛋白对DOX快速清除, 从而达到了更好的细胞毒效果。Li等[31]将DOX前药纳米粒与氯尼达明联用, DOX在耐药性细胞中的外排大大减少。在体内实验中, 虽然DOX血浆浓度与非联用制剂保持几乎相同的药时曲线, 但是联用制剂中DOX肿瘤靶向性却大大提高, 表现出更好的药效。
Nano-DDS中加入一定的辅料, 或与其他药物联用, 虽然辅料或联用药物有时并不能产生相应的药效, 但却可以减缓某些耐药细胞的外排作用, 增加药物在靶细胞中的蓄积。药物的浓度在血浆水平虽然没有明显差异, 但是在实际作用靶点的效果却十分突出。因此, 研究nano-DDS在细胞水平的外排过程对改善药物药效, 设计新型制剂有重要意义。
1.4 药物偶联物nano-DDS的细胞药代动力学在nano-DDS的细胞药代动力学研究中, 早期主要关注的是纳米载体药物(借助于载体材料, 药物分散在纳米尺寸的载体中), 重点研究nano-DDS中药物本身在细胞内的转运过程。随着药物偶联物nano-DDS的大量涌现, 药物偶联物nano-DDS的细胞代谢的重要性越来越突出。
药物偶联物nano-DDS主要包括聚合物药物偶联物nano-DDS和小分子药物偶联物nano-DDS。小分子药物偶联物具有分子质量小、载药量高、化学结构明确、易于监测体内代谢过程及进行安全性评价, 可自组装形成纳米粒等特点, 得到了越来越多研究者青睐。根据与药物偶联分子的不同, 药物偶联物nano- DDS可以实现药物靶向递送(多肽-药物偶联物)、共递送(药物-药物偶联物)和诊疗一体化(荧光探针-药物偶联物)等。为了使药物偶联物nano-DDS在特定部位快速有效地释放药物, 研究人员努力设计刺激响应型nano-DDS, 主要使用各种环境响应型连接臂来连接药物和小分子, 如腙键、缩醛键、甲硅烷醚键、二硫键及对肿瘤中过表达的某些酶敏感的肽等。
刺激响应型的nano-DDS可在特定时间和空间实现递送和释放药物, 并促进药物在目标部位的积累, 达到有效的治疗浓度[32]。目前关于药物偶联物nano-DDS的细胞药代动力学研究还很少, 大多在体外水平上进行探讨。Wang等[33]设计了肿瘤氧化还原异质性响应前药nano-DDS用于癌症治疗(图 1), 其中SN-38通过硫醚键与OEG偶联(OEG-2S-SN-38)可自组装成均一的纳米粒。由于硫醚键的双重敏感性, 这些前药纳米载体对谷胱甘肽 (GSH)和活性氧自由基(ROS)均有响应, 导致在肿瘤细胞中SN-38可以智能响应从而快速释放。基于此, Luo等[34]设计了硫醚键(2S)和单硫键连接的油酸(OA)与紫杉醇(PTX)的药物偶联物, 并在体外证明真正起氧化还原双敏感作用的化学键为靠近紫杉醇的单硫键, 以此提出了药物在氧化和还原环境下的释放途径。
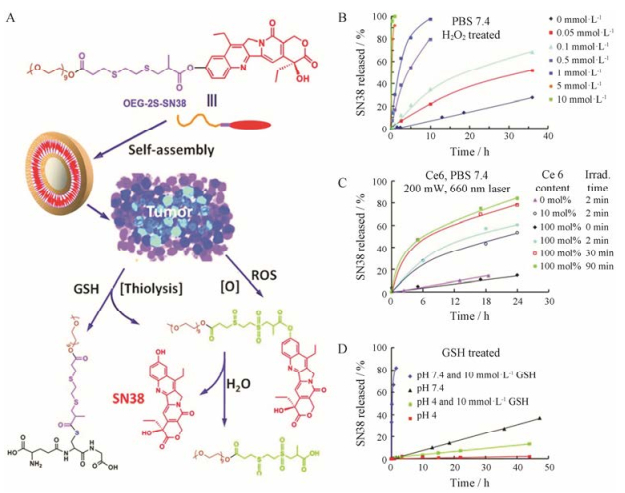
|
Figure 1 The structure of the prodrug and its redox signal-triggered SN38 release[33]. A: Schematic structure of OEG-2S-SN38, its self-assembly into nanocapsules, and response to the tumor redox heterogeneity; B-D: SN38 release from the OEG-2S-SN38 nanocapsules in the presence of (B) various concentrations of H2O2, (C) Ce6 at various concentrations (percentages relative to OEG-2S-SN38) with 660 nm wavelength laser irradiation for different times, (D) 10 mmol·L-1 GSH in PBS 7.4 or 4 at 37 ℃. GSH: Glutathione; ROS: Reactive oxygen species |
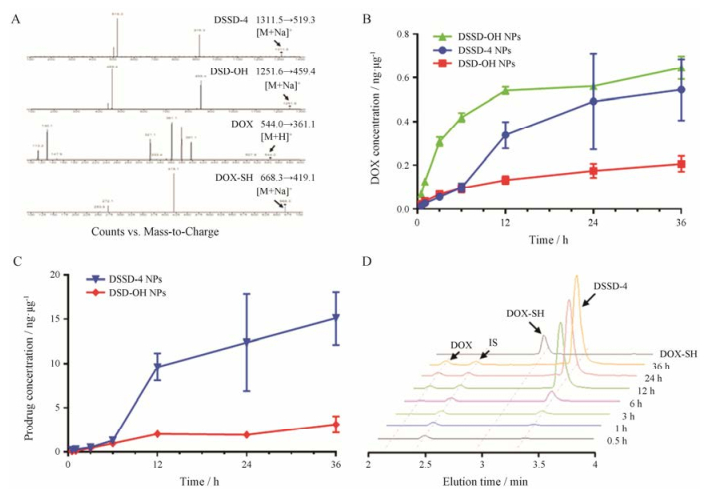
有时体外的降解动力学与细胞水平的降解动力学偏差较大, 体外结果并不能很好地反映药物偶联物纳米粒在细胞内的代谢。以二硫键偶联的DOX纳米粒(DOX-SS-DOX NPs)为例[35], 其在体外研究中表现出很强的还原响应性(2 h释放约25%), 但在GSH-OEt处理过的MCF-7细胞上细胞毒增强非常有限。在后续的系统研究中发现[36], 纳米粒药效的发挥主要与其在溶酶体内的降解有关。酰胺键连接的药物偶联物DSSD-3和DSSD-4纳米粒, 主要依赖于溶酶体内的酰胺酶, 断裂酰胺键释放游离DOX; DSSD-OH纳米粒在溶酶体酸性环境下, 更易于酯键的水解从而释放游离DOX; DSD-OH纳米粒在体内复杂氧化环境的作用下, 形成硫砜, 更易于酯键的水解, 释放游离DOX。结果提示, 在设计药物偶联物纳米粒时应特别关注: ①所响应微环境的位置:如低pH不仅发生在肿瘤细胞间隙, 在胞内内吞体和细胞器也有pH下降的现象; 还原环境主要发生在胞浆中; 不同的酶细胞高表达的位点也不同, 如基质金属蛋白酶2和9一般在细胞外高表达, 而组织蛋白酶B一般在溶酶体高表达。②药物本身的作用位点:有些药物在细胞外就可以发挥作用, 只需将药物有效递送到胞外即可。而有些药物只有到达细胞内或特定的细胞器(如紫杉醇与微管结合, DOX入核)才能发挥作用, 设计药物偶联物时就要考虑到这些因素, 而细胞药代动力学的研究是考察这些因素非常必要的手段。
2 Nano-DDS细胞代谢动力学的研究方法研究药物在细胞内的药代动力学对阐明药物的作用机制, 指导药物设计, 筛选新型药物, 优化给药方案, 促进药物开发和剂型改进有着重要的作用。伴随现代分析仪器的出现及相关学科的发展完善, 这一过程将大大加速。但细胞药代动力学的作用机制复杂、药物浓度低及细胞结构的微观性给其研究带来了一定的困难。下面重点介绍细胞药代动力学的研究方法。
2.1 电镜法随着生物成像技术的发展, 电镜技术已不再局限于单纯的形态结构研究, 而发展为不同水平上的显微学技术综合应用。同时, 显微学技术与细胞生物学、分子生物学等其他生命科学技术的结合应用正在成为研究热点。电镜技术的直观性也为nano-DDS的细胞药代动力学的研究带来了很大的方便。
He等[37]利用透射电镜观察到不同细胞穿膜肽修饰的金纳米粒(GNP@PFV和GNP@R8)在A549细胞中形成100~1 000 nm内吞囊泡(图 2), 并证明这是通过巨胞饮和小窝蛋白途径来介导的内吞。实验还通过透射电镜观察到金纳米粒的细胞摄取与其表面化学修饰有很大关系:用细胞穿膜肽修饰的金纳米粒GNP@PFV和GNP@R8对于细胞膜的黏附量比单用PEG修饰的金纳米粒GNP@PEG要高很多, 这与细胞对GNP@PFV和GNP@R8的摄取量比GNP@PEG高相吻合。通过分析不同时间点金纳米粒在不同细胞器的分布及量, 还可以判断金纳米粒在不同细胞器的胞内分布的经时过程。
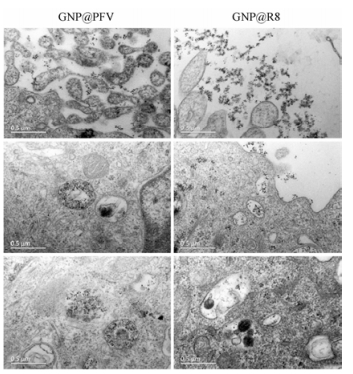
|
Figure 2 From top to down: gold nanoparticles (GNPs) adhere to the membrane of cell and package in endosome and transport to liposome[37] |
流式细胞术是一种在功能水平上对单细胞或其他生物粒子进行定量分析和分选的检测手段, 具有速度快、精度高和准确性好等优点, 是当代最先进的细胞定量分析技术之一。流式细胞术能够快速测定单个细胞或细胞器的生物学性质, 并把特定的细胞或细胞器从群体中加以分类收集; 还可以高速分析上万个细胞, 并能同时从1个细胞中测得多个参数。
流式细胞术可以定量分析nano-DDS在细胞上的摄取。Song等[35]使用流式细胞术来量化游离DOX、DOX脂质体和DOX药物偶联物纳米粒(DOX-SS- DOX纳米粒)在MCF-7耐药性细胞中的积累, 发现游离DOX的累积量远高于DOX脂质体和DOX-SS-DOX纳米粒; 而与DOX脂质体相比, DOX-SS-DOX纳米粒的细胞累积量要显著提高。值得注意的是, 当荧光分子形成纳米粒后, 由于分子间距离拉近, 分子间作用力增强, 纳米粒的荧光会发生自淬灭现象。由于不同的荧光分子间作用力或作用机制不同, 荧光强度淬灭的程度也不同, 荧光强度的变化不能完全反映药物量的变化, 所以对结果需要慎重处理。Wang等[36]通过比较几种不同的DOX药物偶联物形成纳米粒前后的荧光光谱, 将几种nano-DDS通过流式细胞术获得的荧光强度进行归一化处理, 解决了由于DOX荧光强度不同而带来的分析误差。对于自身不发荧光的药物, 研究者常包载荧光物质来指示纳米载体的行为, 如Lu等[38]以香豆素6为荧光探针, 分别用PEG-PLA胶束和PEG-PTX胶束包载香豆素6, 通过流式细胞术比较了两种胶束在细胞中的摄取行为。结果显示, PEG-PTX胶束的摄取量比PEG-PLA胶束高, 这与胶束载药后的体外药效相对应, 但这种情况要求预先验证在实验条件下荧光物质不释放, 以避免假阳性结果的发生。
2.3 激光扫描共聚焦显微镜激光扫描共聚焦显微镜(confocal laser scanning microscopic, CLSM)是在荧光显微镜成像基础上加装了激光扫描装置, 利用计算机进行图像处理, 把光学成像的分辨率提高, 使用紫外或可见光激发荧光探针, 从而得到细胞或组织内部微细结构的荧光图像的研究工具。它在观察细胞或组织内部微细结构, 半定量免疫荧光分析方面有着强大的优势。
利用激光扫描共聚焦显微镜可以进行纳米制剂中药物作用机制的分析。Zhou等[39]通过改变药物的连接臂构建了活性氧响应DOX衍生物纳米粒(ROS-activatable doxorubicin prodrug vesicle, RADV)和非活性氧响应DOX衍生物纳米粒(ROS-inactivatable doxorubicin prodrug vesicle, RIADV)。利用不同的荧光探针DAPI和DCFH-DA分别标记细胞核和活性氧, 并通过共聚焦显微镜观察到RADV和RIADV在不同光照条件下和不同活性氧环境下的细胞内共定位, 证明了RADV在细胞内光照条件下的活性氧响应(图 3)。Luo等[34]在紫杉醇上偶联香豆素6, 用共聚焦显微镜观察一系列紫杉醇前药纳米粒在细胞内的分布, 并通过荧光强度判断紫杉醇前药的摄取量, 用来解释和佐证其细胞毒性。
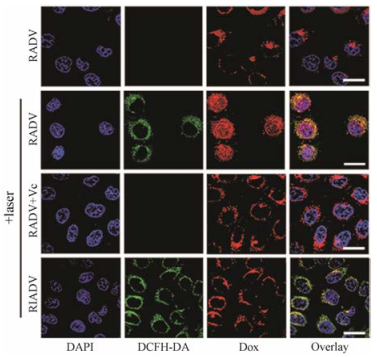
|
Figure 3 Confocal laser scanning microscopic (CLSM) images of intracellular ROS generation and DOX distribution[39] |
利用该技术可以分析nano-DDS在转运过程中的完整性。荧光共振能量转移(Förster resonance energy transfer, FRET)现象是指一对合适的荧光物质, 在空间相互接近到一定距离(1~10 nm)时, 激发供体而产生的荧光能量正好被附近的受体吸收, 使得供体发射的荧光强度衰减, 受体荧光分子的荧光强度增强的现象[40]。利用FRET技术来研究细胞内纳米级的距离及距离变化可以分析nano-DDS在转运过程中的完整性。Deng等[41]用紫杉醇纳晶包裹DiI和DiO荧光对, 通过共聚焦显微镜观察不同时间点DiI和DiO在MDCK细胞中荧光强度的变化, 并计算FRET效率, 通过FRET效率的变化来判断DiI和DiO的距离, 从而验证紫杉醇纳晶随时间在细胞中的完整性, 以探究紫杉醇纳晶在细胞中的转运机制。Li等[42]也利用FRET技术验证了聚乙二醇-聚ε-己内酯[poly (ethylene glycol)-co-poly(ε-caprolactone), PEG-PCL]胶束在MDCK细胞单层上跨膜转运的完整性。
随着荧光标记技术的发展, 可以在活细胞上标记不同内吞细胞器, 用激光扫描共聚焦显微镜实时观察nano-DDS的入胞过程及其在不同内吞体和细胞器上分布, 构建nano-DDS在相应部位的转运动力学。内吞体和溶酶体等细胞器是nano-DDS胞内转运的关键节点。针对网格蛋白囊泡(pH 6.9~7.2)、早期内吞体(pH 6.0~6.5)和晚期内吞体/溶酶体(pH 4.0~5.5)的特定pH, 高金明课题组[43]分别选定pH转变点在6.9、6.2和5.3的3种聚合物, 并分别标记BODIPY、TMR和Cy5探针, 将聚合物混合均匀后制成一个混合胶束。利用hetero-FRET和homo-FRET效应, 使胶束状态下3种荧光探针信号淬灭, 当胶束被细胞摄取, 随着其在各个亚细胞器的转运及相应细胞器的成熟酸化, 胶束逐级解散, 3种荧光信号依次打开。通过共聚焦显微镜对细胞器的实时定位观察, 可以实现nano-DDS在内吞体成熟过程中的数字化成像(图 4)。

|
Figure 4 Schematic of the multispectral hybrid ultra-pH-sensitive (HyUPS) nanoprobe to digitize organelle pH after receptor-mediated endocytosis in tumor cells[43] |
吴伟课题组[44]开发出一种具有荧光自淬灭特性的水淬灭荧光探针。该探针包裹在纳米粒中具有荧光, 在体内或细胞环境中释放后进入水性环境, 荧光淬灭。该课题组把此荧光探针包载在纳米载体中, 通过共聚焦显微镜来追踪纳米粒随时间的跨膜路径。普通荧光探针在纳米粒解散后仍发射荧光, 干扰了纳米粒跨膜的真实路径, 水淬灭荧光探针在纳米粒解散后荧光淬灭, 极大避免了对实验结果的误读。进一步利用该现象, 还可以通过分析不同时间点细胞内的荧光强度, 推断纳米制剂随时间在细胞中的解散情况。高金明课题组[45]构建了一种pH超敏感的比率型荧光胶束, 通过调整BODIPY探针连接聚合物和Cy3.5探针连接聚合物的混合比率实现兼具荧光Always-ON和OFF-ON的功能(图 5)。也就是说, BODIPY探针在胶束状态下因hetero-FRET效应而荧光淬灭, 胶束解散后, BODIPY的荧光信号得以释放, 实现荧光由OFF状态到ON状态的改变。而Cy3.5探针因为胶束内核中BODIPY探针连接聚合物的稀释作用使得其分子间距离大于10 nm, 无homo-FRET效应, 不管在胶束状态还是胶束解散状态都保持荧光不变。该胶束能对肿瘤微环境或细胞内不同细胞器内pH值进行超敏感开关响应, 实现对特定区域的特异性信号放大, 评价纳米制剂在细胞内的摄取和分布情况。
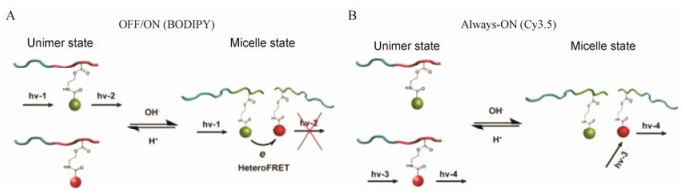
|
Figure 5 Schematic of Always-ON/OFF-ON ultra-pH-sensitive (UPS) nanoparticles. In the micelle state, the Always-ON dyes serve as the quencher for the ON/OFF fluorophores. When the micelle is disassembled, the Always-ON and ON/OFF fluorophores can fluoresce independently. The ON/OFF ratio of BODIPY (A) and Cy3.5 (B) varies when the ratio of polymers conjugated with these two dye varies[45] |
现代高效液相色谱仪(HPLC), 以其高效、快速和自动化等特点成为当代分析仪器中发展最快的仪器之一。HPLC已成为操作方便、准确、快速并能解决样品分离困难问题的强有力的分析手段。HPLC适于分离生物、医学大分子和离子化合物、不稳定的天然产物、种类繁多的其他高分子及不稳定化合物。
利用该技术可定量分析纳米粒在细胞内的摄取和代谢产物。Liang等[46]建立了用HPLC检测美登素(DM1)前药RCCD、RSSD、QCCD和QSSD与其代谢产物DM1在B16细胞、MCF-7细胞和HUVEC细胞中浓度的方法, 并对其前药纳米粒进行细胞摄取实验和药物细胞代谢研究, 实验发现前药纳米粒的摄取量与不同细胞系表面αvβ3受体的表达有关, 细胞代谢产物中DM1量与前药的连接臂有关。Deng等[41]也建立了紫杉醇纳晶的HPLC测定方法, 监测了不同时间点紫杉醇纳晶与紫杉醇微粒跨MDCK单层细胞膜的比例。Wang等[36]将DOX药物偶联物纳米粒DSSD-4 NPs与MCF-7细胞共孵育, 通过HPLC监测细胞内是否有中间代谢产物γ-硫代丁内酯的存在, 来推测纳米粒在细胞内的代谢路径。
2.5 液质联用液质联用(LC-MS/MS)分析技术的发展为药物体内代谢产物的分析鉴别提供了简便、快速的分析方法。LC-MS/MS技术结合了液相色谱的高分离能力和质谱提供结构信息的功能, 具有灵敏度高、选择性强的优势, 进而建立快速、高效的分析研究体系。对于药物代谢物分析, LC-MS/MS技术可以提供更好的分离能力, 降低分析物的检测限, 并提高分析速度。
Zheng等[28]建立了用LC-MS/MS测定紫杉醇在MCF-7细胞中浓度的方法, 通过试剂盒提取细胞器, 分析了紫杉醇胶束和游离紫杉醇在不同时间点、不同细胞器中的分布情况, 发现两种制剂在MCF-7细胞中分布不同, 初步探讨了造成其分布不同的原因, 为阐明紫杉醇胶束和游离紫杉醇在细胞中的作用机制打下了良好的基础。Wang等[36]也建立了DOX药物偶联物DSSD-4、DSD-OH及其代谢产物DOX在MCF-7细胞内浓度测定的LC-MS/MS方法学, 研究和比较了DOX前药纳米粒DSSD-4 NPs和DSD-OH NPs在细胞内的摄取和代谢情况(图 6), 初步阐述了两种DOX前药纳米粒在细胞中的代谢机制。DSSD-4、DSD-OH和其代谢产物DOX有共同的荧光基团, 此法不仅克服了共聚焦显微镜无法区分具有相同荧光基团的前药和代谢产物的光学局限性, 又解决了HPLC检测限偏高的问题, 是分析此类药物细胞药代动力学很好的选择。
|
Figure 6 Metabolism of prodrug NPs in MCF-7 cells[36]. A; Representative mass spectra and proposed fragmentation patterns for prodrugs and their metabolites; B: DOX concentrations per unit protein in MCF-7 cells treated with DSSD-OH NPs, DSSD-4 NPs and DSD-OH NPs; C: DSSD-4 and DSD-OH concentrations per unit protein in MCF-7 cells treated with DSSD-4 NPs and DSD-OH NPs; D: Chromatogram of DSSD-4 NPs and its metabolite in MCF-7 cells |
细胞药代动力学的研究大部分内容为生物样品测试, 而生物样品的特点为药物浓度低、干扰成分多、样本数量大等, 因此, 对分析技术的要求较高。通过流式细胞术可获取nano-DDS在完整细胞中的摄取和外排动力学过程, 获得药物在整体细胞中的代谢情况。电镜可以获得某些特定nano-DDS, 如金纳米粒的亚细胞分布情况。当目标nano-DDS带荧光时, 用特异性染料将细胞器染色[47, 48], 通过激光扫描共聚焦显微镜, 还可以获得nano-DDS与细胞器的共定位情况。激光扫描共聚焦显微镜直观、方便, 但只能提供半定量的数据, 并且对于非荧光药物不可行。对于nano- DDS来说, 很多荧光基团都会发生不同程度的制剂内荧光自淬灭现象, 这对分析的准确性也造成了一定的干扰。除了采用归一化法将不同淬灭程度的荧光基团归一处理外, 还可以通过HPLC或液质联用进行分析。用差速离心法[49]或通过相应试剂盒[28]分离细胞器, 并通过HPLC或液质联用进行分析, 可以获得nano-DDS在亚细胞中的绝对浓度, 并且不受制剂荧光的限制。选择正确的分析仪器将大大缩短样品测试的时间, 提高分析方法的灵敏度和专属性, 提高药物研发的准确性和效率。不同分析技术的综合应用相辅相成, 取长补短, 将在微量药物测定、药物代谢途径和多组分生物样品分析等方面发挥很大的作用。
3 小结与展望与游离药相比, nano-DDS往往表现出不同的细胞药代动力学行为。研究nano-DDS在细胞及亚细胞中的吸收、转运、分布、代谢及排泄过程, 对阐明nano-DDS作用机制及改善药物体内药效都有着重要作用。针对nano-DDS在靶细胞内代谢处置的各个环节, 通过整合现代各种先进的分析技术和细胞分子生物学研究技术, 发挥其在细胞药代动力学各方面的优势, 记录并分析药物的动态分布过程及代谢过程, 并对其进行定量研究, 建立nano-DDS在细胞内代谢的数学模型, 定量揭示nano-DDS在细胞内的动力学过程及规律。进一步结合nano-DDS在细胞中的药理活性和药效结果, 建立细胞内药动-药效模型, 研究nano-DDS的细胞药动-药效相关关系, 对nano-DDS的开发、筛选和临床应用等都具有重大意义。
| [1] | Andersen CA, Perfetti P, Nibbio M, et al. Brain penetration assessment in vivo:a reliable and simple method in anesthetized rats at steady state[J]. J Neurosci Methods, 2014, 232: 199–206. DOI:10.1016/j.jneumeth.2014.04.022 |
| [2] | Lee WH, Loo CY, Young PM, et al. Recent advances in curcumin nanoformulation for cancer therapy[J]. Expert Opin Drug Deliv, 2014, 11: 1183–1201. DOI:10.1517/17425247.2014.916686 |
| [3] | Yang KY, Lin LC, Tseng TY, et al. Oral bioavailability of curcumin in rat and the herbal analysis from Curcuma longa by LC-MS/MS[J]. J Chromatogr B, 2007, 853: 183–189. DOI:10.1016/j.jchromb.2007.03.010 |
| [4] | Carcaboso AM, Elmeliegy MA, Shen J, et al. Tyrosine kinase inhibitor gefitinib enhances topotecan penetration of gliomas[J]. Cancer Res, 2010, 70: 4499–4508. DOI:10.1158/0008-5472.CAN-09-4264 |
| [5] | Wang Y, Liu J, Zhang J, et al. A cell-based pharmacokinetics assay for evaluating tubulin-binding drugs[J]. Int J Med Sci, 2014, 11: 479–487. DOI:10.7150/ijms.8340 |
| [6] | Zhou F, Zhang J, Li P, et al. Toward a new age of cellular pharmacokinetics in drug discovery[J]. Drug Metab Rev, 2011, 43: 335–345. DOI:10.3109/03602532.2011.560607 |
| [7] | Larsen AK, Escargueil AE, Skladanowski A. Resistance mechanisms associated with altered intracellular distribution of anticancer agents[J]. Pharmacol Ther, 2000, 85: 217–229. DOI:10.1016/S0163-7258(99)00073-X |
| [8] | Duvvuri M, Krise JP. Intracellular drug sequestration events associated with the emergence of multidrug resistance:a mechanistic review[J]. Front Biosci, 2005, 10: 1499–1509. DOI:10.2741/1634 |
| [9] | Wang J, Byrne JD, Napier ME, et al. More effective nanomedicines through particle design[J]. Small, 2011, 7: 1919–1931. DOI:10.1002/smll.201100442 |
| [10] | Ni P, Zhang J, Liu J, et al. Research progress in cellular pharmacokinetics[J]. Prog Pharm Sci (药学进展), 2014, 38: 881–885. |
| [11] | Dong J, Wang Y, Zhang J, et al. Multiple stimuli-responsive polymeric micelles for controlled release[J]. Soft Matter, 2012, 9: 370–373. |
| [12] | Wang W, Cheng D, Gong F, et al. Design of multifunctional micelle for tumor-targeted intracellular drug release and fluorescent imaging[J]. Adv Mater, 2012, 24: 115–120. DOI:10.1002/adma.201104066 |
| [13] | Xiong X, Huang Y, Lu W, et al. Preparation of doxorubicin-loaded stealth liposomes modified with RGD m mi etic and cellular association in vitro[J]. Acta Pharm Sin (药学学报), 2005, 40: 1085–1090. |
| [14] | Mu CF, Balakrishnan P, Cui FD, et al. The effects of mixed MPEG-PLA/Pluronic copolymer micelles on the bioavailability and multidrug resistance of docetaxel[J]. Biomaterials, 2010, 31: 2371–2379. DOI:10.1016/j.biomaterials.2009.11.102 |
| [15] | Kreuter J. Nanoparticles-a historical perspective[J]. Int J Pharm, 2007, 331: 1–10. DOI:10.1016/j.ijpharm.2006.10.021 |
| [16] | Duncan R, Sat YN. Tumor targeting by enhanced permeability and retention (EPR) effect[J]. Ann Oncol, 1998, 9: 39. DOI:10.1023/A:1008418325819 |
| [17] | Harushfrenkel O, Debotton N, Benita S, et al. Targeting of nanoparticles to the clathrin-mediated endocytic pathway[J]. Biochem Biophys Res Commun, 2007, 353: 26–32. DOI:10.1016/j.bbrc.2006.11.135 |
| [18] | Gratton SEA, Ropp PA, Pohlhaus PD, et al. The effect of particle design on cellular internalization pathways[J]. Proc Natl Acad Sci U S A, 2008, 105: 11613–11618. DOI:10.1073/pnas.0801763105 |
| [19] | Paillard A, Hindré F, Vignes-Colombeix C, et al. The importance of endo-lysosomal escape with lipid nanocapsules for drug subcellular bioavailability[J]. Biomaterials, 2010, 31: 7542–7554. DOI:10.1016/j.biomaterials.2010.06.024 |
| [20] | Chithrani BD, Ghazani AA, Chan WC. Determining the size and shape dependence of gold nanoparticle uptake into mammalian cells[J]. Nano Lett, 2006, 6: 662–668. DOI:10.1021/nl052396o |
| [21] | Chithrani BD, Chan WC. Elucidating the mechanism of cellular uptake and removal of protein-coated gold nanoparticles of different sizes and shapes[J]. Nano Lett, 2007, 7: 1542–1550. DOI:10.1021/nl070363y |
| [22] | Yu C, He B, Xiong MH, et al. The effect of hydrophilic and hydrophobic structure of amphiphilic polymeric micelles on their transport in epithelial MDCK cells[J]. Biomaterials, 2013, 34: 6284–6298. DOI:10.1016/j.biomaterials.2013.05.006 |
| [23] | Chiu YL, Ho YC, Chen YM, et al. The characteristics, cellular uptake and intracellular trafficking of nanoparticles made of hydrophobically-modified chitosan[J]. J Control Release, 2010, 146: 152–159. DOI:10.1016/j.jconrel.2010.05.023 |
| [24] | Cartiera MS, Johnson KM, Rajendran V, et al. The uptake and intracellular fate of PLGA nanoparticles in epithelial cells[J]. Biomaterials, 2009, 30: 2790–2798. DOI:10.1016/j.biomaterials.2009.01.057 |
| [25] | Zhang J, Liu J, Zhao Y, et al. Plasma and cellular pharmacokinetic considerations for the development and optimization of antitumor block copolymer micelles[J]. Expert Opin Drug Deliv, 2015, 12: 263–281. DOI:10.1517/17425247.2014.945417 |
| [26] | Xiong X, Huang Y, Lu W, et al. Intracellular delivery of doxorubicin with RGD-modified sterically stabilized liposomes for an improved antitumor efficacy:in vitro, and in vivo[J]. J Pharm Sci, 2005, 94: 1782–1793. DOI:10.1002/jps.20397 |
| [27] | Wang J, Bhattacharyya J, Mastria E, et al. A quantitative study of the intracellular fate of pH-responsive doxorubicin-polypeptide nanoparticles[J]. J Control Release, 2017, 260: 100–110. DOI:10.1016/j.jconrel.2017.05.032 |
| [28] | Zheng N, Lian B, Du W, et al. Extraction protocol and liquid chromatography/tandem mass spectrometry method for determining micelle-entrapped paclitaxel at the cellular and subcellular levels:application to a cellular uptake and distribution study[J]. J Chromatogr B, 2018, 1072: 347–354. DOI:10.1016/j.jchromb.2017.12.002 |
| [29] | Varshosaz J, Hassanzadeh F, Sadeghi-Aliabadi H, et al. Uptake of etoposide in CT-26 cells of colorectal cancer using folate targeted dextran stearate polymeric micelles[J]. Biomed Res Int, 2014, 2014: 708593. |
| [30] | Xu P, Van Kirk EA, Zhan Y, et al. Targeted charge-reversal nanoparticles for nuclear drug delivery[J]. Angew Chem Int Ed Engl, 2007, 46: 4999–5002. DOI:10.1002/(ISSN)1521-3773 |
| [31] | Li Y, Xu X, Zhang X, et al. Tumor-specific multiple stimuli-activated dendrimeric nanoassemblies with metabolic blockade surmount chemotherapy resistance[J]. ACS Nano, 2016, 11: 416–429. |
| [32] | Yin Q, Shen J, Zhang Z, et al. Reversal of multidrug resistance by stimuli-responsive drug delivery systems for therapy of tumor[J]. Adv Drug Deliv Rev, 2013, 65: 1699–1715. DOI:10.1016/j.addr.2013.04.011 |
| [33] | Wang J, Sun X, Mao W, et al. Tumor redox heterogeneity-responsive prodrug nanocapsules for cancer chemotherapy[J]. Adv Mater, 2013, 25: 3670–3676. DOI:10.1002/adma.v25.27 |
| [34] | Luo C, Sun J, Liu D, et al. Self-assembled redox dual-responsive prodrug-nanosystem formed by single thioether-bridged paclitaxel-fatty acid conjugate for cancer chemotherapy[J]. Nano Lett, 2016, 16: 5401–5408. DOI:10.1021/acs.nanolett.6b01632 |
| [35] | Song Q, Wang X, Wang Y, et al. Reduction responsive self-assembled nanoparticles based on disulfide-linked drug-drug conjugate with high drug loading and antitumor efficacy[J]. Mol Pharm, 2016, 13: 190–201. DOI:10.1021/acs.molpharmaceut.5b00631 |
| [36] | Wang Y, Wang X, Deng F, et al. The effect of linkers on the self-assembling and anti-tumor efficacy of disulfide-linked doxorubicin drug-drug conjugate nanoparticles[J]. J Control Release, 2018, 279: 136–146. DOI:10.1016/j.jconrel.2018.04.019 |
| [37] | He B, Yang D, Qin M, et al. Increased cellular uptake of peptide-modified PEGylated gold nanoparticles[J]. Biochem Biophys Res Commun, 2017, 494: 339–345. DOI:10.1016/j.bbrc.2017.10.026 |
| [38] | Lu J, Chuan X, Zhang H, et al. Free paclitaxel loaded PEGylated-paclitaxel nanoparticles:preparation and comparison with other paclitaxel systems in vitro and in vivo[J]. Int J Pharm, 2014, 471: 525–535. DOI:10.1016/j.ijpharm.2014.05.032 |
| [39] | Zhou F, Feng B, Wang T, et al. Theranostic prodrug vesicles for reactive oxygen species-triggered ultrafast drug release and local-regional therapy of metastatic triple-negative breast cancer[J]. Adv Funct Mater, 2017. DOI:10.1002/adfm.201770272 |
| [40] | Kedia N, Bagchi S. Time resolved FRET measurement in various heterogeneous media using merocyanine dye as a donor[J]. Spectrochim Acta A Mol Biomol Spectrosc, 2015, 145: 467–472. DOI:10.1016/j.saa.2015.03.075 |
| [41] | Deng F, Zhang H, Wang X, et al. Transmembrane pathways and mechanisms of rod-like paclitaxel nanocrystals through MDCK polarized monolayer[J]. ACS Appl Mater Interfaces, 2017, 9: 5803–5816. DOI:10.1021/acsami.6b15151 |
| [42] | Li R, Song X, Zhang H, et al. The integrity study on PEG-PCL micelles transcellular transported across MDCK epithelial cell monolayer using FRET technology[J]. Acta Pharm Sin (药学学报), 2016, 51: 1316–1324. |
| [43] | Wang Y, Wang C, Li Y, et al. Digitization of endocytic pH by hybrid ultra-pH-sensitive nanoprobes at single-organelle resolution[J]. Adv Mater, 2017. DOI:10.1002/adma.201603794 |
| [44] | Xie Y, Hu X, He H, et al. Tracking translocation of glucan microparticles targeting M cells:implications for oral drug delivery[J]. J Mater Chem B, 2016, 4: 2864–2873. DOI:10.1039/C5TB02706C |
| [45] | Wang C, Wang Y, Li Y, et al. A nanobuffer reporter library for fine-scale imaging and perturbation of endocytic organelles[J]. Nat Commun, 2015, 6: 8524. DOI:10.1038/ncomms9524 |
| [46] | Liang Y, Li S, Wang X, et al. A nanosystem of amphiphilic oligopeptide-drug conjugate actualizing both αvβ3 targeting and reduction-triggered release for maytansinoid[J]. Theranostics, 2017, 7: 3306–3318. DOI:10.7150/thno.20242 |
| [47] | Shen F, Chu S, Bence AK, et al. Quantitation of doxorubicin uptake, efflux, and modulation of multidrug resistance (MDR) in MDR human cancer cells[J]. J Pharmacol Exp Ther, 2008, 324: 95–102. |
| [48] | Shen F, Bailey BJ, Chu S, et al. Dynamic assessment of mitoxantrone resistance and modulation of multidrug resistance by valspodar (PSC833) in multidrug resistance human cancer cells[J]. J Pharmacol Exp Ther, 2009, 330: 423–429. DOI:10.1124/jpet.109.153551 |
| [49] | Duvvuri M, Feng W, Mathis A, et al. A cell fractionation approach for the quantitative analysis of subcellular drug disposition[J]. Pharm Res, 2004, 21: 26–32. DOI:10.1023/B:PHAM.0000012148.12516.3f |
 2018, Vol. 53
2018, Vol. 53


