2. 中国科学院深圳先进技术研究院, 广东 深圳 518055;
3. 包头医学院, 内蒙 包头 014060
2. Shenzhen Institutes of Advanced Technology, Chinese Academy of Sciences, Shenzhen 518055, China;
3. BaoTou Medical College, Baotou 014060, China
脑卒中是一种严重威胁人类健康的疾病, 是我国第一位的死亡原因和致残原因。出血转化(hemorrhagic transformation, HT)是指急性脑梗死后发生的脑内出血现象, 是脑卒中常见的严重并发症。HT的发生会显著增加卒中患者的致死率和致残率, 是影响预后的重要因素。临床研究表明, HT的发生率为13%~43%, 尸检结果显示这一比例高达38%~71%[1]。HT的发生既是脑卒中病理发展的结果, 也与药物治疗有关, 如抗血小板药、抗凝药和溶栓药物的使用。
恢复缺血区的血液供应是目前唯一有效的治疗急性缺血性脑卒中的策略, 但使用溶栓药物治疗能够显著增加HT的发生率。组织纤溶酶原激活剂(tissue plasminogen activator, t-PA)是目前临床上唯一被美国FDA批准用于治疗急性脑缺血的溶栓药物, 也是美国心脏学会和美国卒中学会发布的卒中治疗指南中一级推荐的药物。
临床研究表明, 使用t-PA溶栓能够使HT的发生率增加10倍, 死亡率达60%。即使将治疗时间窗由3 h扩大到4.5 h, 仍然只有约3.4%~5.2%的急性脑卒中患者接受t-PA治疗[2], 较窄的治疗时间窗及较高的HT发生率限制了t-PA的临床应用。溶栓导致HT的发生风险主要与溶栓药物的剂量、给药途径、给药时间和溶栓药物的类型有关。因此, 研究溶栓所致HT的发生机制, 寻找新靶点, 开发新药物对于改善脑卒中的治疗和预后, 增加溶栓治疗的安全性, 对降低致死、致残率具有重要意义。本文就近年来溶栓引起HT的发生机制、靶点和治疗药物进行综述, 为HT的基础研究及药物研发提供参考。
1 HT的分类临床上将HT分为症状型和无症状型HT, 症状型HT的发生率为0.6%~20%, 主要与年龄、血糖水平、溶栓药物使用等相关, 预后差, 死亡率达到45%~83%[3]。根据临床影像学可将HT分为两类:出血性梗死(hemorrhagic infarction, HI)和脑实质血肿(parenchymal hematoma, PH)。其中HI又分为HI1型(小点状出血)和HI2型(多个融合的点状出血); PH分为PH1型(脑血肿 < 30%缺血区域, 并有轻微占位效应)和PH2型(脑血肿≥30%缺血区域, 并有明显占位效应)。在急性缺血性脑卒中患者中, HI的发生率高于PH (9% vs 3%)[3]。
2 HT发生的分子机制研究HT的发生是一个复杂、动态的病理过程, 其确切的病理生理机制尚不清楚。目前的研究认为HT发生的主要机制是血脑屏障(blood-brain barrier, BBB)完整性的丧失和神经血管稳态的破坏[4]。t-PA是一种丝氨酸蛋白酶, 在缺血和非缺血条件下均可通过血脑屏障。t-PA在血管内可使纤溶酶原转化为纤溶酶, 进而使纤维蛋白溶解发挥溶栓作用, 纤溶酶能进一步激活基质金属蛋白酶(matrix metalloproteinases, MMPs)导致BBB的破坏[5]。此外, t-PA所致HT的发生与缺血时间密切相关[4]。临床资料显示, 对于急性缺血性脑卒中患者而言, 随缺血时间的延长, 使用t-PA进行溶栓治疗会使HT的发生率显著升高[2]。因此, 对于急性脑缺血患者, 越早使用t-PA溶栓, HT的发生率越低。已有多项研究表明, t-PA所致HT的发生不仅是再灌注的结果, 还与多种分子机制相关(图 1)。
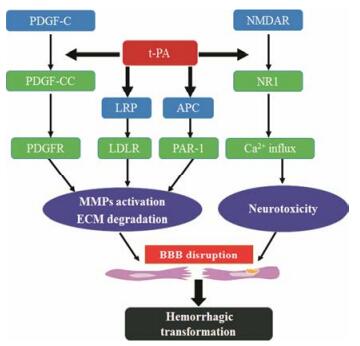
|
Figure 1 The mechanisms of tissue plasminogen activator (t-PA) induced hemorrhagic transformation (HT). PDGF-C: Platelet-derived growth factor C; PDGFR: Platelet-derived growth factor receptor; LRP: Low density lipoprotein receptor- related protein; LDLR: Low density lipoprotein receptor; APC: Activated protein C; PAR-1: protease-activated receptor 1; NMDAR: N-Methyl-D-aspartate receptor; NR1: NMDAR1 subunit |
LDL受体相关蛋白(LDL receptor-related protein, LRP)是一种脂蛋白受体家族成员, 通过与细胞外基质相关的不同配体结合参与脂蛋白的代谢, 是t-PA在细胞表面的主要结合位点之一。t-PA通过与LRP相互作用, 调节BBB的通透性[6, 7]。
缺血条件下, t-PA通过依赖或非依赖LRP的途径进入BBB, 与星形胶质细胞和血管内皮细胞上的LPR结合, 激活核因子-κB (nuclear factor-κB, NF-κB)、蛋白激酶B (protein kinase B, Akt)等通路, 促进MMP-9的表达, 引起紧密连接蛋白(tight junction protein, TJ)的降解, 导致BBB破坏和HT的发生[8, 9]。在小胶质细胞中也发现, t-PA与LRP相互作用引起MMP-3/ MMP-9的表达, 导致TJ蛋白的降解[10]。使用LRP抗体和LRP拮抗剂受体相关蛋白(receptor associated protein, RAP)能够抑制MMP-9的表达, 降低t-PA介导的BBB损伤[7]。此外, LRP还可以介导t-PA与谷氨酸受体的相互作用, 参与t-PA的神经毒性[11]。
2.2 t-PA-APC通路活化蛋白C (activated protein C, APC)是一种血浆丝氨酸蛋白酶, 具有抗凝血、抗炎和抗凋亡的活性。越来越多的证据表明, APC在脑缺血的不同病理过程中发挥重要的调节作用, 参与凋亡、炎症、神经再生和神经功能恢复的过程。APC的调节作用主要通过与蛋白酶激活受体(protease-activated receptor 1, PAR-1)结合实现的。
APC通过抑制神经细胞凋亡减轻t-PA的神经毒性作用[12]。APC及其类似物3K3A-APC能够通过抑制NF-κB介导的MMP-9途径降低t-PA诱导的HT[13, 14]。然而, 在临床中发现, 血浆中高水平的APC与t-PA溶栓后HT发生率增加相关, 这说明升高的APC可能并不足以减轻溶栓后的脑损伤[15]。另外APC具有较长的治疗时间窗, 在缺血后6~72 h仍有神经保护作用, 并介导组织修复, 降低HT的发生[16]。
2.3 t-PA-PDGF-C通路血小板衍生因子C (platelet-derived growth factor C, PDGF-C)是促进间质细胞分裂与存活的主要生长因子, 其基因表达受转录因子Egr-1和Sp-1的调节, 以无活性的PDGF-CC形式分泌到细胞外基质。t-PA可以将无活性的PDGF-CC激活, 与星形胶质细胞上的血小板衍生因子受体结合后磷酸化, 激活磷脂酰肌醇3激酶、丝裂原活化蛋白激酶等信号通路, 导致BBB损伤[17]。正常状态下, PDGF-CC也能够诱导BBB的开放。使用PDGF-CC抗体及其拮抗剂imatinib能够抑制BBB损伤和t-PA引起的HT[18]。此外, 血浆中PDGF-CC的升高也被认为是溶栓患者HT发生的预测因子[19]。
2.4 t-PA-NMDAR通路N-甲基天冬氨酸受体(N-methyl-D-aspartate receptor, NMDAR)是调控突触可塑性与学习记忆功能的谷氨酸受体, 与谷氨酸结合后, 引起兴奋性毒性。兴奋性毒性是脑卒中的主要病理机制之一, 而NMDAR在t-PA诱导的神经毒性中发挥重要作用[20]。t-PA与NMDAR相互作用, 诱导钙内流和细胞外信号调节激酶的激活, 产生兴奋性毒性。NMDAR的不同亚基可以介导t-PA诱导的NMDAR的激活。体外实验发现, t-PA通过剪切NMDAR的NR1亚基, 促进NMDAR介导的钙内流[21, 22]。特异性阻断t-PA与NR1的相互作用可以减轻脑缺血小鼠神经元的死亡[23]。
目前, 对于HT发生机制的研究已经取得了一些进展, 但这些机制并不是特异的, 受氧化应激、炎症等病理过程的调节, 而且针对以上分子机制的干预并未解决t-PA溶栓所致HT的问题。因此, 在临床使用t-PA进行溶栓时, 如何发挥t-PA的溶栓效果并抑制t-PA对神经血管单元的损伤和神经毒性作用仍是值得认真研究的问题。
3 HT的治疗策略及治疗药物进展 3.1 基于BBB保护的HT治疗策略t-PA是一个多效因子, 除了脑卒中后溶栓作用外, 在神经血管单元上还发挥重要的信号和蛋白酶活性。t-PA可以通过直接或间接地激活MMPs, 参与BBB的破坏、水肿形成及HT。此外还能促进血管重构、血管发生、神经发生和轴突再生, 从而促进脑卒中后的恢复。
BBB是介于血液和脑组织之间对物质通过有选择性阻碍作用的动态界面, 由一系列相互作用的细胞(内皮细胞、周细胞和星形胶质细胞等)构成, 维持脑内环境的平衡。BBB破坏是脑卒中的主要病理特征, 也是HT发生的标志。损伤的BBB增加了溶栓过程中致死性HT的发生, 促进脑水肿和神经炎症, 限制了t-PA的使用。因此, 抑制t-PA诱导的BBB的破坏能够降低HT发生。t-PA诱导的BBB破坏是个复杂的病理过程, 是多种因素共同作用的结果。已有的研究发现, 针对BBB损伤的靶点进行干预能够保护BBB进而抑制HT的发生[24-26]。因此保护BBB是目前HT治疗中最主要的策略。
3.2 HT治疗药物的研究进展围绕HT发生机制和相关靶点, 在动物实验中发现了一些药物能够抑制t-PA溶栓引起的HT (表 1)[27-43], 有些药物在初步的临床试验中也得到了进一步确认, 但仍然需要进一步的评价确定其有效性和安全性。下面就对这些药物进行分类介绍。
| Table 1 Drugs that have therapeutic effects on HT in animal experiments. SHR: Spontaneously hypertensive rats; MCAO: Middle cerebral artery occlusion; iv: Intravenous injection; ig: Intragastric administration; ip: Intraperitoneal injection; sc: Subcutaneous injection |
MMPs通过降解细胞外基质和TJ, 破坏BBB的结构和完整性, 是t-PA溶栓后HT发生的直接因素。在MMP家族中, 与BBB损伤关系密切的是MMP-2、MMP-3和MMP-9, 其中MMP-9与HT的发生直接相关[44]。MMP-9在卒中患者血清中显著增加, 且与不良预后相关, 已经成为卒中的生物标志物[45]。
t-PA可以通过多种通路上调炎性细胞、内皮细胞和胶质细胞中MMP-9的表达和活性, 降解TJ, 导致BBB损伤和HT发生。已有许多文献报道MMP-9抑制剂能够保护BBB, 抑制HT的发生, 如巴马司他(batimastat, BB-94)[27]和米诺环素(minocycline)[28]等。但是, Suzuki等[46]用MMP-3和MMP-9的转基因小鼠研究发现, 敲除MMP-3能够降低t-PA诱导的出血, 敲除MMP-9对出血没有影响。同时发现t-PA不影响MMP-9在脑内的表达和分布, 使用MMPs抑制剂GM6001降低野生小鼠的出血风险, 对MMP-3敲除小鼠没有影响。因此认为MMP-3在t-PA治疗引起的出血中发挥关键的作用。MMPs抑制剂虽然在动物水平能够发挥保护BBB和抗HT的作用, 但临床上并未在HT的防治中表现出显著的作用。这可能是由于MMPs本身是一类下游信号分子, 受许多信号通路的调控, 只针对MMPs并不能产生良好的治疗作用。另外, 在缺血后期, MMPs参与了血管再生等组织修复过程, 抑制MMPs反而会加重损伤。
3.2.2 自由基清除剂自由基介导的氧化应激是脑缺血的主要病理机制之一, 在脑缺血损伤中发挥重要作用。t-PA溶栓引起的再灌注能够产生大量的自由基, 引起BBB损伤、神经毒性和炎症反应, 导致HT的发生。依达拉奉(edaravone)作为自由基清除剂, 临床用于脑卒中的治疗。动物实验显示, 依达拉奉与t-PA联用能够保护神经血管单元, 提高神经功能和生存率, 降低HT发生。Okamura等[29]应用高血糖大鼠脑缺血模型, 在缺血同时及再灌和再灌1 h后3次静脉注射依达拉奉, 能够显著降低脑梗死面积及出血面积。但在临床试验中还存在一定争议。Kimura等[47]在一项初步的临床试验中发现, t-PA静滴同时静脉注射依达拉奉30 mg使血管再通率明显提高(56.5% vs 11.8%, t-PA+依达拉奉组vs t-PA组), 具有明显改善的患者数量显著增加(80.1% vs 45.5%), 并认为依达拉奉通过抑制内皮细胞损伤, 维持内皮细胞对t-PA的释放, 从而提高再通率。其他一些研究也发现, 脑卒中3 h内使用t-PA溶栓, 同时24 h内给予依达拉奉能够显著增加再通率, 降低出血风险, 提高神经功能[48, 49]。此外, 其他一些自由基清除剂如NXY-059和尿酸等也具有改善神经功能, 降低HT的作用。NXY-059与t-PA联用能够降低兔脑缺血模型的出血发生率(47% vs 67%, NXY-059+t-PA vs t-PA)[30]。大规模Ⅰ期临床试验发现缺血6 h内给予NXY-059能够降低t-PA溶栓患者的致残率, 降低HT的发生及症状性颅内出血[50]。但在Ⅱ期临床试验中发现NXY- 059不能降低症状性或无症状型出血, 对于急性脑卒中的治疗无效[51]。尿酸是血液中的主要抗氧化剂, 在脑缺血中具有神经保护作用[52]。Ⅱ期临床试验证明与t-PA联用是安全的, 能够使患者获益, 但仍需进一步验证[53]。
3.2.3 抗炎药物t-PA溶栓引起的氧化应激能够激活炎症反应, 引起炎性因子的释放和炎性细胞的浸润, 浸润的炎性细胞通过释放MMP-9引起BBB的破坏, 因此抑制炎症反应能够发挥BBB保护作用。芬戈莫德(fingolimod, FTY720)是一种免疫调节剂, 用于多发性硬化的治疗。芬戈莫德可以通过抑制细胞凋亡和降低血管通透性保护脑缺血损伤。Campos等[31]用小鼠血栓性脑卒中模型, 在缺血后45 min、24 h和48 h后单独腹腔注射芬戈莫德(0.5 mg·kg-1), 能够显著改善神经功能, 降低梗死面积。缺血3 h后与t-PA联用同样可以改善神经功能, 降低HT风险。在一项小规模的临床研究中, 缺血后4.5 h内静注t-PA同时口服芬戈莫德(每天0.5 mg, 连续3天)能够降低循环中的淋巴细胞, 降低梗死体积和出血, 改善神经功能, 无严重不良反应[1]。但是, 仍然需要大规模的临床试验证实。他克莫司(tacrolimus, FK-506)是一种免疫抑制剂, 临床用于器官移植。研究发现他克莫司具有神经保护作用, 低剂量(0.3 mg·kg-1)能够扩大t-PA的治疗时间窗, 并且不增加出血风险[54]。Maeda等[32]用光化反应法在自发性高血压大鼠上制备脑缺血模型, 发现缺血3 h后, 静脉注射t-PA (10 mg·kg-1)与他克莫司(1 mg·kg-1)能够降低HT, 这种作用与保护脑微血管内皮细胞有关。
3.2.4 天然产物HT的发生是一个复杂的病理过程, 涉及氧化应激、炎症等多种病理过程和多个靶点。这些靶点之间可能独立或协同发挥作用, 调节一个靶点可能影响其他靶点, 而不同靶点之间也可能有直接作用。前面介绍的针对单一靶点的药物治疗目前还没有取得较好的治疗效果。因此针对HT的药物治疗, 多靶点可能会产生更好的效果。天然产物具备多靶点的特性, 并且具有较好的安全性和有效性, 目前已经成为创新药物发现的热点。已有许多研究报道了天然产物在HT治疗中的潜力[55]。黄芩苷是来源于黄芩根的一种黄酮类化合物, 研究发现, 在脑缺血模型中, 黄芩苷可以通过作用于活性氧族(reactive oxygen species, ROS)、NF-κB、NMDAR和MMP-9发挥抗氧化、抗炎和抗神经毒性作用, 保护BBB[56]。Chen等[33]在大鼠MCAO模型中的研究发现, 黄芩苷(50、100、150 mg·kg-1)在缺血4.5 h后与t-PA联合给药能够降低死亡率, 抑制t-PA介导的BBB破坏和HT的发生。同时, 黄芩苷能够透过BBB, 因此在HT的治疗中具有很好的潜力[56]。丹参酮IIA是来源于丹参根的一种活性化合物, 通过作用于NF-κB、MMP-9、高迁移率族蛋白B1 (high mobility group box-1, HMGB1)和活性氮族(reactive nitrogen species, RNS)降低脑梗死体积和脑水肿, 改善神经功能, 维持BBB通透性和内皮细胞功能[57]。Tang等[34]在大鼠MCAO模型中发现丹参酮IIA (10、20、30 mg·kg-1)抑制胞间黏附分子1和MMP-9的表达, 抑制紧密连接蛋白ZO-1和occludin的降解, 保护BBB, 具有潜在的抗HT作用。石杉碱甲是来源于石杉中的一种生物碱, 是乙酰胆碱酯酶抑制剂, 临床用于阿尔茨海默病的治疗。在脑缺血模型中, 石杉碱甲抑制ROS的产生保护线粒体; 抑制NF-κB的表达减轻小胶质细胞的激活; 与NMDAR相互作用, 抑制谷氨酸诱导的钙内流和神经毒性。同时, 石杉碱甲也能透过BBB, 具有治疗HT的潜力[35, 58]。此外, 还有一些天然产物如葛根素、厚朴酚和仙茅苷等在脑缺血中都可作用于多个靶点, 发挥保护BBB的作用[55]。本实验室发现的抗脑缺血Ⅰ类新药匹诺塞林是来源于蜂胶中的一种黄酮类化合物, 正在进行Ⅱ期临床试验。最近的研究发现再灌前5 min静脉注射匹诺塞林(10 mg·kg-1)能够扩大t-PA的治疗时间窗, 抑制t-PA诱导的HT[59]。以上研究结果表明, 天然产物通过作用于多靶点保护BBB, 在HT治疗药物的开发中具有广阔前景。
3.2.5 抗凝药抗凝药在HT治疗中的作用尚不明确, 抗凝药本身存在出血的不良反应, 临床上有效抗凝的卒中患者HT发生的风险仍然不清楚。凝血和纤溶系统是t-PA溶栓后HT发生的独立危险因子, 针对凝血系统的治疗能够改善溶栓的安全性, 但是调节凝血系统对卒中患者的神经功能和死亡率也有负面影响。目前抗血小板药物主要在卒中患者溶栓后使用防止复发, 其对HT的作用并不明确。一些回顾性研究发现预先给予抗血小板治疗加重溶栓后HT的风险, 但是另外一些研究发现抗血小板药与t-PA联用也能降低HT的发生。西洛他唑作为磷酸二酯酶抑制剂, 能够抑制血小板聚集, 恢复脑血流。Ishiguro等[36]用小鼠MCAO模型研究发现, 西洛他唑(10 mg·kg-1)在缺血6 h后与t-PA联用能够抑制HT发生, 但对梗死体积无效, 主要通过抑制MMP-9活性保护内皮功能, 抑制TJ蛋白降解保护BBB。临床试验发现脑卒中患者服用西洛他唑能够降低HT发生, 较阿司匹林作用更好[60]。依替巴肽和替罗非班是血小板glycoprotein Ⅱb/Ⅲa受体拮抗剂。Ⅱ期临床试验发现在急性脑卒中患者中, 依替巴肽与t-PA联用能够降低系统性HT的发生, 但有效性还需要进一步评价[61]。替罗非班的Ⅱ期临床结果显示, 脑卒中后2~7天的出血发生率与标准治疗没有差别, 但5个月的死亡率降低[62]。凝血酶抑制剂达比加群是目前临床使用的新型口服抗凝药。Kwon等[37]在大鼠MCAO模型上比较了大面积梗死后华法林与达比加群对出血转化的影响。结果发现, 在缺血前7天每天灌胃达比加群(20 mg·kg-1) 2次, 出血风险低于华法林, 具有更好的安全性。Kono等[38]在大鼠MCAO模型上的研究发现凝血因子Xa抑制剂利伐沙班(2 mg·kg-1)和阿哌沙班(10 mg·kg-1)连续灌胃7天, 能够抑制MMP-9的激活, 保护神经血管单元完整性, 降低t-PA溶栓后HT的发生。目前, 抗凝药在HT治疗中的作用还不明确, 需要谨慎使用, 尤其要考虑使用时间和剂量。
3.2.6 其他药物除了上面提到的作用于不同机制和靶点的药物, 还发现了一些具有潜在治疗HT作用的药物。激素类药物如雌激素、孕酮和褪黑素等均发现在脑缺血模型中与t-PA联用能够保护BBB, 降低HT的发生[39-41]。Rho激酶抑制剂法舒地尔通过抑制Rho激酶降低MMP-9的活性, 保护BBB, 抑制HT[42]。动物实验发现他汀类药物能够降低t-PA诱导的HT, 但在临床试验中并未得到确认[43, 63]。有些研究甚至发现服用他汀类药物患者的HT发生率反而升高, 而且他汀类药物的剂量与HT发生相关, 高剂量增加HT的发生[64]。此外, 近期的一些研究还发现对TLR4[65]、GSK-3β[66]、NURR1[67]、NLRP3[68]、TGF-β1[69]、connexin43[70]和NADPH oxidase[71]等靶点具有调节作用的化合物也具有潜在的治疗HT的作用。
3.2.7 非药物治疗临床对HT的治疗除了药物治疗外, 还有一些非药物疗法。脑低温治疗通过降低脑代谢抑制炎症反应和氧化应激, 保护线粒体, 抑制细胞凋亡发挥神经保护作用[72]。而脑低温治疗可以提高t-PA的治疗作用, 降低HT的发生, 但是治疗时间窗和适合的温度还需要进一步确定[73]。高压氧可以通过抑制炎症和氧化应激、降低脑水肿、抑制细胞凋亡保护BBB, 降低HT的发生[74]。此外, 氢气[75]和硫化氢[76]等也具有一定的治疗潜力。因此, 在HT治疗药物研发受阻的情况下, 非药物的治疗方法为HT的治疗开辟了新的途径。
4 总结与展望HT的病理机制复杂, 是多种机制综合作用的结果。针对当前发现的机制和靶点进行的药物研发并没有解决HT的治疗和预防问题。因此, 需要针对HT发生的各个环节开展新的机制研究, 发现新靶点。对于HT防治药物开发过程中的问题, 也需要进一步的明确和解决。①动物实验与临床试验结果相差较大。有些药物在动物水平证明有效, 而在临床无效甚至加重HT, 这主要与动物模型的选择、人和动物的生理差异以及药效评价标准造成的。因此, 需要尽可能选择符合人类HT发生病理机制的动物模型和与人类接近的药效学评价方法进行HT药物的开发。②药物有效性尚需进一步验证。同一种药物在相同的动物模型中的药效存在差异, 这与药物治疗策略的选择(预防或治疗)、给药时间(缺血后多长时间)、给药剂量和观察指标有关。③天然产物成为研究热点。天然产物以其多靶点的特点已经成为HT治疗药物研究的重点。但是天然产物的研究还需进一步的规范, 尤其是给药剂量, 不同研究中药物剂量差别可达千倍[77, 78]。此外, 尽管天然产物安全性较好, 但与t-PA联用也要考虑药物-药物相互作用。④开发新一代溶栓药物。t-PA作为第二代溶栓药物, 也是唯一被美国FDA批准用于脑卒中溶栓治疗的药物, 其治疗时间窗窄和HT的高发生率限制了临床使用。目前第三代的溶栓药物如瑞替普酶、去氨普酶等, 与t-PA相比特异性更强, 安全性更好。因此, 开发溶栓效果好, 不良反应低的新一代溶栓药物也是重要的研究方向。综上所述, HT治疗药物的开发虽然艰难, 但随着新机制、新靶点的不断发现, 必将促进HT治疗药物的发展。
| [1] | Zhu Z, Fu Y, Tian D, et al. Combination of the immune modulator fingolimod with alteplase in acute ischemic stroke: a pilot trial[J]. Circulation, 2015, 132: 1104–1112. DOI:10.1161/CIRCULATIONAHA.115.016371 |
| [2] | Jickling GC, Liu D, Stamova B, et al. Hemorrhagic transformation after ischemic stroke in animals and humans[J]. J Cereb Blood Flow Metab, 2014, 34: 185–199. DOI:10.1038/jcbfm.2013.203 |
| [3] | Zhang J, Yang Y, Sun H, et al. Hemorrhagic transformation after cerebral infarction: current concepts and challenges[J]. Ann Transl Med, 2014, 2: 81. |
| [4] | Wang W, Li M, Chen Q, et al. Hemorrhagic transformation after tissue plasminogen activator reperfusion therapy for ischemic stroke: mechanisms, models, and biomarkers[J]. Mol Neurobiol, 2015, 52: 1572–1579. DOI:10.1007/s12035-014-8952-x |
| [5] | Suzuki Y, Nagai N, Umemura K. A review of the mechanisms of blood-brain barrier permeability by tissue-type plasminogen activator treatment for cerebral ischemia[J]. Front Cell Neurosci, 2016, 10: 2. |
| [6] | Zhao Y, Li D, Zhao J, et al. The role of the low-density lipoprotein receptor-related protein 1 (LRP-1) in regulating blood-brain barrier integrity[J]. Rev Neurosci, 2016, 27: 623–634. |
| [7] | Yepes M, Sandkvist M, Moore EG, et al. Tissue-type plasminogen activator induces opening of the blood-brain barrier via the LDL receptor-related protein[J]. J Clin Invest, 2003, 112: 1533–1540. DOI:10.1172/JCI200319212 |
| [8] | Wang X, Lee SR, Arai K, et al. Lipoprotein receptor-mediated induction of matrix metalloproteinase by tissue plasminogen activator[J]. Nat Med, 2003, 9: 1313–1317. DOI:10.1038/nm926 |
| [9] | Zhang X, Polavarapu R, She H, et al. Tissue-type plasminogen activator and the low-density lipoprotein receptor-related protein mediate cerebral ischemia-induced nuclear factor-κB pathway activation[J]. Am J Pathol, 2007, 171: 1281–1290. DOI:10.2353/ajpath.2007.070472 |
| [10] | Zhang C, An J, Haile WB, et al. Microglial low-density lipoprotein receptor-related protein 1 mediates the effect of tissue- type plasminogen activator on matrix metalloproteinase-9 activity in the ischemic brain[J]. J Cereb Blood Flow Metab, 2009, 29: 1946–1954. DOI:10.1038/jcbfm.2009.174 |
| [11] | Martin AM, Kuhlmann C, Trossbach S, et al. The functional role of the second NPXY motif of the LRP1 beta-chain in tissue-type plasminogen activator-mediated activation of N- methyl-D-aspartate receptors[J]. J Biol Chem, 2008, 283: 12004–12013. DOI:10.1074/jbc.M707607200 |
| [12] | Liu D, Cheng T, Guo H, et al. Tissue plasminogen activator neurovascular toxicity is controlled by activated protein C[J]. Nat Med, 2004, 10: 1379–1383. DOI:10.1038/nm1122 |
| [13] | Cheng T, Petraglia AL, Li Z, et al. Activated protein C inhibits tissue plasminogen activator-induced brain hemorrhage[J]. Nat Med, 2006, 12: 1278–1285. DOI:10.1038/nm1498 |
| [14] | Wang Y, Zhao Z, Chow N, et al. Activated protein C analog protects from ischemic stroke and extends the therapeutic window of tissue-type plasminogen activator in aged female mice and hypertensive rats[J]. Stroke, 2013, 44: 3529–3536. DOI:10.1161/STROKEAHA.113.003350 |
| [15] | Mendioroz M, Fernández-Cadenas I, Alvarez-Sabín J, et al. Endogenous activated protein C predicts hemorrhagic transformation and mortality after tissue plasminogen activator treatment in stroke patients[J]. Cerebrovasc Dis, 2009, 28: 143–150. DOI:10.1159/000225907 |
| [16] | Wang Y, Zhao Z, Chow N, et al. Activated protein C analog promotes neurogenesis and improves neurological outcome after focal ischemic stroke in mice via protease activated receptor 1[J]. Brain Res, 2013, 1507: 97–104. DOI:10.1016/j.brainres.2013.02.023 |
| [17] | Fredriksson L, Li H, Fieber C, et al. Tissue plasminogen activator is a potent activator of PDGF-CC[J]. EMBO J, 2004, 23: 3793–3802. DOI:10.1038/sj.emboj.7600397 |
| [18] | Su EJ, Fredriksson L, Geyer M, et al. Activation of PDGF- CC by tissue plasminogen activator impairs blood-brain barrier integrity during ischemic stroke[J]. Nat Med, 2008, 14: 731–737. DOI:10.1038/nm1787 |
| [19] | Rodríguez-González R, Blanco M, Rodríguez-Yá ez M, et al. Platelet derived growth factor-CC isoform is associated with hemorrhagic transformation in ischemic stroke patients treated with tissue plasminogen activator[J]. Atherosclerosis, 2013, 226: 165–171. DOI:10.1016/j.atherosclerosis.2012.10.072 |
| [20] | Nicole O, Docagne F, Ali C, et al. The proteolytic activity of tissue-plasminogen activator enhances NMDA receptor- mediated signaling[J]. Nat Med, 2001, 7: 59–64. DOI:10.1038/83358 |
| [21] | Fernández-Monreal M, López-Atalaya JP, Benchenane K, et al. Arginine 260 of the amino-terminal domain of NR1 subunit is critical for tissue-type plasminogen activator-mediated enhancement of N-methyl-D-aspartate receptor signaling[J]. J Biol Chem, 2004, 279: 50850–50856. DOI:10.1074/jbc.M407069200 |
| [22] | Henry VJ, Lecointre M, Laudenbach V, et al. High t-PA release by neonate brain microvascular endothelial cells under glutamate exposure affects neuronal fate[J]. Neurobiol Dis, 2013, 50: 201–208. DOI:10.1016/j.nbd.2012.10.020 |
| [23] | Rodier M, Prigent-Tessier A, Béjot Y, et al. Exogenous t-PA administration increases hippocampal mature BDNF levels. plasmin- or NMDA-dependent mechanism?[J]. PLoS One, 2014, 9: e92416. DOI:10.1371/journal.pone.0092416 |
| [24] | Sifat AE, Vaidya B, Abbruscato TJ. Blood-brain barrier protection as a therapeutic strategy for acute ischemic stroke[J]. AAPS J, 2017, 19: 957–972. DOI:10.1208/s12248-017-0091-7 |
| [25] | Jin R, Yang G, Li G. Molecular insights and therapeutic targets for blood-brain barrier disruption in ischemic stroke: critical role of matrix metalloproteinases and tissue-type plasminogen activator[J]. Neurobiol Dis, 2010, 38: 376–385. DOI:10.1016/j.nbd.2010.03.008 |
| [26] | Zhang L, Zhang ZG, Chopp M. The neurovascular unit and combination treatment strategies for stroke[J]. Trends Pharmacol Sci, 2012, 33: 415–422. DOI:10.1016/j.tips.2012.04.006 |
| [27] | Sumii T, Lo EH. Involvement of matrix metalloproteinase in thrombolysis associated hemorrhagic transformation after embolic focal ischemia in rats[J]. Stroke, 2002, 33: 831–836. DOI:10.1161/hs0302.104542 |
| [28] | Murata Y, Rosell A, Scannevin RH, et al. Extension of the thrombolytic time window with minocycline in experimental stroke[J]. Stroke, 2008, 39: 3372–3377. DOI:10.1161/STROKEAHA.108.514026 |
| [29] | Okamura K, Tsubokawa T, Johshita H, et al. Edaravone, a free radical scavenger, attenuates cerebral infarction and hemorrhagic infarction in rats with hyperglycemia[J]. Neurol Res, 2014, 36: 65–69. DOI:10.1179/1743132813Y.0000000259 |
| [30] | Lapchak PA, Araujo DM, Song D, et al. Effects of the spin trap agent disodium--[tert-butylimino)methyl]benzene-1, 3- disulfonate N-oxide (generic NXY-059) on intracerebral hemorrhage in a rabbit large clot embolic stroke model: combination studies with tissue plasminogen activator[J]. Stroke, 2002, 33: 1665–1670. DOI:10.1161/01.STR.0000017145.22806.AA |
| [31] | Campos F, Qin T, Castillo J, et al. Fingolimod reduces hemorrhagic transformation associated with delayed tissue plasminogen activator treatment in a mouse thromboembolic model[J]. Stroke, 2013, 44: 505–511. DOI:10.1161/STROKEAHA.112.679043 |
| [32] | Maeda M, Furuichi Y, Noto T, et al. Tacrolimus (FK506) suppresses rt-PA-induced hemorrhagic transformation in a rat thrombotic ischemia stroke model[J]. Brain Res, 2009, 1254: 99–108. DOI:10.1016/j.brainres.2008.11.080 |
| [33] | Chen H, Guan B, Chen X, et al. Baicalin attenuates blood-brain barrier disruption and hemorrhagic transformation and improves neurological outcome in ischemic stroke rats with delayed t-PA treatment: involvement of ONOO--MMP-9 pathway[J]. Transl Stroke Res, 2017. DOI:10.1007/s12975-017-0598-3 |
| [34] | Tang C, Xue H, Bai C, et al. The effects of tanshinone ⅡA on blood-brain barrier and brain edema after transient middle cerebral artery occlusion in rats[J]. Phytomedicine, 2010, 17: 1145–1149. DOI:10.1016/j.phymed.2010.03.017 |
| [35] | Wang ZF, Wang J, Zhang HY, et al. Huperzine A exhibits anti-inflammatory and neuroprotective effects in a rat model of transient focal cerebral ischemia[J]. J Neurochem, 2008, 106: 1594–1603. DOI:10.1111/jnc.2008.106.issue-4 |
| [36] | Ishiguro M, Mishiro K, Fujiwara Y, et al. Phosphodiesterase- Ⅲ inhibitor prevents hemorrhagic transformation induced by focal cerebral ischemia in mice treated with tPA[J]. PLoS One, 2010, 5: e15178. DOI:10.1371/journal.pone.0015178 |
| [37] | Kwon I, An S, Kim J, et al. Hemorrhagic transformation after large cerebral infarction in rats pretreated with dabigatran or warfarin[J]. Stroke, 2017, 48: 2865–2871. DOI:10.1161/STROKEAHA.117.017751 |
| [38] | Kono S, Yamashita T, Deguchi K, et al. Rivaroxaban and apixaban reduce hemorrhagic transformation after thrombolysis by protection of neurovascular unit in rat[J]. Stroke, 2014, 45: 2404–2410. DOI:10.1161/STROKEAHA.114.005316 |
| [39] | Li M, Zhang Z, Sun W, et al. 17β-estradiol attenuates breakdown of blood-brain barrier and hemorrhagic transformation induced by tissue plasminogen activator in cerebral ischemia[J]. Neurobiol Dis, 2011, 44: 277–283. DOI:10.1016/j.nbd.2011.07.004 |
| [40] | Won S, Lee JH, Wali B, et al. Progesterone attenuates hemorrhagic transformation after delayed tPA treatment in an experimental model of stroke in rats: involvement of the VEGF-MMP pathway[J]. J Cereb Blood Flow Metab, 2014, 34: 72–80. DOI:10.1038/jcbfm.2013.163 |
| [41] | Chen TY, Lee MY, Chen HY, et al. Melatonin attenuates the post ischemic increase in blood-brain barrier permeability and decreases hemorrhagic transformation of tissue-plasminogen activator therapy following ischemic stroke in mice[J]. J Pineal Res, 2006, 40: 242–250. DOI:10.1111/jpi.2006.40.issue-3 |
| [42] | Ishiguro M, Kawasaki K, Suzuki Y, et al. A Rho kinase (ROCK) inhibitor, fasudil, prevents matrix metalloproteinase- 9-related hemorrhagic transformation in mice treated with tissue plasminogen activator[J]. Neuroscience, 2012, 220: 302–312. DOI:10.1016/j.neuroscience.2012.06.015 |
| [43] | Campos M, García-Bonilla L, Hernández-Guillamon M, et al. Combining statins with tissue plasminogen activator treatment after experimental and human stroke: a safety study on hemorrhagic transformation[J]. CNS Neurosci Ther, 2013, 19: 863–870. DOI:10.1111/cns.2013.19.issue-11 |
| [44] | Turner RJ, Sharp FR. Implications of MMP9 for blood brain barrier disruption and hemorrhagic transformation following ischemic stroke[J]. Front Cell Neurosci, 2016, 10: 56. |
| [45] | Lakhan SE, Kirchgessner A, Tepper D, et al. Matrix metalloproteinases and blood-brain barrier disruption in acute ischemic stroke[J]. Front Neurol, 2013, 4: 32. |
| [46] | Suzuki Y, Nagai N, Umemura K, et al. Stromelysin-1 (MMP-3) is critical for intracranial bleeding after t-PA treatment of stroke in mice[J]. J Thromb Haemost, 2007, 5: 1732–1739. DOI:10.1111/jth.2007.5.issue-8 |
| [47] | Kimura K, Aoki J, Sakamoto Y, et al. Administration of edaravone, a free radical scavenger, during t-PA infusion can enhance early recanalization in acute stroke patients—a preliminary study[J]. J Neurol Sci, 2012, 313: 132–136. DOI:10.1016/j.jns.2011.09.006 |
| [48] | Lee XR, Xiang GL. Effects of edaravone, the free radical scavenger, on outcomes in acute cerebral infarction patients treated with ultra-early thrombolysis of recombinant tissue plasminogen activator[J]. Clin Neurol Neurosurg, 2018, 167: 157–161. DOI:10.1016/j.clineuro.2018.02.026 |
| [49] | Yamaguchi T, Awano H, Matsuda H, et al. Edaravone with and without.6 mg·kg-1 alteplase within 4.5 hours after ischemic stroke: a prospective cohort study (PROTECT4.5)[J]. J Stroke Cerebrovasc Dis, 2017, 26: 756–765. DOI:10.1016/j.jstrokecerebrovasdis.2016.10.011 |
| [50] | Lees KR, Zivin JA, Ashwood T, et al. NXY-059 for acute ischemic stroke[J]. N Engl J Med, 2006, 354: 588–600. DOI:10.1056/NEJMoa052980 |
| [51] | Shuaib A, Lees KR, Lyden P, et al. NXY-059 for the treatment of acute ischemic stroke[J]. N Engl J Med, 2007, 357: 562–571. DOI:10.1056/NEJMoa070240 |
| [52] | Li R, Huang C, Chen J, et al. The role of uric acid as a potential neuroprotectant in acute ischemic stroke: a review of literature[J]. Neurol Sci, 2015, 36: 1097–1103. DOI:10.1007/s10072-015-2151-z |
| [53] | Amaro S, Laredo C, Renú A, et al. Uric acid therapy prevents early ischemic stroke progression: a tertiary analysis of the URICO-ICTUS trial (efficacy study of combined treatment with uric acid and r-tPA in acute ischemic stroke)[J]. Stroke, 2016, 47: 2874–2876. DOI:10.1161/STROKEAHA.116.014672 |
| [54] | Okubo S, Igarashi H, Kanamatsu T, et al. FK-506 extended the therapeutic time window for thrombolysis without increasing the risk of hemorrhagic transformation in an embolic rat stroke model[J]. Brain Res, 2007, 1143: 221–227. DOI:10.1016/j.brainres.2007.01.050 |
| [55] | Chen HS, Qi SH, Shen JG. One-compound-multi-target: combination prospect of natural compounds with thrombolytic therapy in acute ischemic stroke[J]. Curr Neuropharmacol, 2017, 15: 134–156. |
| [56] | Liang W, Huang X, Chen W. The effects of baicalin and baicalein on cerebral ischemia: a review[J]. Aging Dis, 2017, 8: 850–867. DOI:10.14336/AD.2017.0829 |
| [57] | Li DC, Bao XQ, Sun H, et al. Research progress in the study of protective effect of tanshinone ⅡA on cerebral ischemic stroke[J]. Acta Pharm Sin (药学学报), 2015, 50: 635–639. |
| [58] | Wang R, Yan H, Tang XC. Progress in studies of huperzine A, a natural cholinesterase inhibitor from Chinese herbal medicine[J]. Acta Pharmacol Sin, 2006, 27: 1–26. DOI:10.1111/aphs.2006.27.issue-1 |
| [59] | Ma YZ, Li L, Kong LL, et al. Pinocembrin protects blood- brain barrier function and expands the therapeutic time window for tissue-type plasminogen activator treatment in a rat thromboembolic stroke model[J]. Biomed Res Int, 2018. DOI:10.1155/2018/8943210 |
| [60] | Shinohara Y, Katayama Y, Uchiyama S, et al. Cilostazol for prevention of secondary stroke (CSPS 2): an aspirin-controlled, double-blind, randomised non-inferiority trial[J]. Lancet Neurol, 2010, 9: 959–968. DOI:10.1016/S1474-4422(10)70198-8 |
| [61] | Adeoye O, Sucharew H, Khoury J, et al. Recombinant tissue-type plasminogen activator plus eptifibatide versus recombinant tissue-type plasminogen activator alone in acute ischemic stroke: propensity score-matched post hoc analysis[J]. Stroke, 2015, 46: 461–464. DOI:10.1161/STROKEAHA.114.006743 |
| [62] | Siebler M, Hennerici MG, Schneider D, et al. Safety of tirofiban in acute ischemic stroke: the SaTIS trial[J]. Stroke, 2011, 42: 2388–2392. DOI:10.1161/STROKEAHA.110.599662 |
| [63] | Zhang L, Zhang ZG, Ding GL, et al. Multitargeted effects of statin-enhanced thrombolytic therapy for stroke with recombinant human tissue-type plasminogen activator in the rat[J]. Circulation, 2005, 112: 3486–3494. DOI:10.1161/CIRCULATIONAHA.104.516757 |
| [64] | Meier N, Nedeltchev K, Brekenfeld C, et al. Prior statin use, intracranial hemorrhage, and outcome after intra-arterial thrombolysis for acute ischemic stroke[J]. Stroke, 2009, 40: 1729–1737. DOI:10.1161/STROKEAHA.108.532473 |
| [65] | García-Culebras A, Palma-Tortosa S, Moraga A, et al. Toll-like receptor 4 mediates hemorrhagic transformation after delayed tissue plasminogen activator administration in in situ thromboembolic stroke[J]. Stroke, 2017, 48: 1695–1699. DOI:10.1161/STROKEAHA.116.015956 |
| [66] | Wang W, Li M, Wang Y, et al. GSK-3β inhibitor TWS119 attenuates rtPA-induced hemorrhagic transformation and activates the Wnt/β-catenin signaling pathway after acute ischemic stroke in rats[J]. Mol Neurobiol, 2016, 53: 7028–7036. DOI:10.1007/s12035-015-9607-2 |
| [67] | Merino-Zamorano C, Hernández-Guillamon M, Jullienne A, et al. NURR1 involvement in recombinant tissue-type plasminogen activator treatment complications after ischemic stroke[J]. Stroke, 2015, 46: 477–484. DOI:10.1161/STROKEAHA.114.006826 |
| [68] | Guo Z, Yu S, Chen X, et al. Suppression of NLRP3 attenuates hemorrhagic transformation after delayed rtPA treatment in thromboembolic stroke rats: involvement of neutrophil recruitment[J]. Brain Res Bull, 2018, 137: 229–240. DOI:10.1016/j.brainresbull.2017.12.009 |
| [69] | Cai Y, Liu X, Chen W, et al. TGF-β1 prevents blood-brain barrier damage and hemorrhagic transformation after thrombolysis in rats[J]. Exp Neurol, 2015, 266: 120–126. DOI:10.1016/j.expneurol.2015.02.013 |
| [70] | Yang X, Chu H, Tang Y, et al. The role of connexin43 in hemorrhagic transformation after thrombolysis in vivo and in vitro[J]. Neuroscience, 2016, 329: 54–65. DOI:10.1016/j.neuroscience.2016.04.040 |
| [71] | Tuo YH, Liu Z, Chen JW, et al. NADPH oxidase inhibitor improves outcome of mechanical reperfusion by suppressing hemorrhagic transformation[J]. J Neurointerv Surg, 2017, 9: 492–498. DOI:10.1136/neurintsurg-2016-012377 |
| [72] | Hong JM, Lee JS, Song HJ, et al. Therapeutic hypothermia after recanalization in patients with acute ischemic stroke[J]. Stroke, 2014, 45: 134–140. DOI:10.1161/STROKEAHA.113.003143 |
| [73] | Cai L, Thibodeau A, Peng C, et al. Combination therapy of normobaric oxygen with hypothermia or ethanol modulates pyruvate dehydrogenase complex in thromboembolic cerebral ischemia[J]. J Neurosci Res, 2016, 94: 749–758. DOI:10.1002/jnr.v94.8 |
| [74] | Soejima Y, Hu Q, Krafft PR, et al. Hyperbaric oxygen preconditioning attenuates hyperglycemia-enhanced hemorrhagic transformation by inhibiting matrix metalloproteinases in focal cerebral ischemia in rats[J]. Exp Neurol, 2013, 247: 737–743. DOI:10.1016/j.expneurol.2013.03.019 |
| [75] | Chen CH, Manaenko A, Zhan Y, et al. Hydrogen gas reduced acute hyperglycemia-enhanced hemorrhagic transformation in a focal ischemia rat model[J]. Neuroscience, 2010, 169: 402–414. DOI:10.1016/j.neuroscience.2010.04.043 |
| [76] | Liu H, Wang Y, Xiao Y, et al. Hydrogen sulfide attenuates tissue plasminogen activator-induced cerebral hemorrhage following experimental stroke[J]. Transl Stroke Res, 2016, 7: 209–219. DOI:10.1007/s12975-016-0459-5 |
| [77] | Liou KT, Shen YC, Chen CF, et al. Honokiol protects rat brain from focal cerebral ischemia-reperfusion injury by inhibiting neutrophil infiltration and reactive oxygen species production[J]. Brain Res, 2003, 992: 159–166. DOI:10.1016/j.brainres.2003.08.026 |
| [78] | Cui HS, Huang LS, Sok DE, et al. Protective action of honokiol, administered orally, against oxidative stress in brain of mice challenged with NMDA[J]. Phytomedicine, 2007, 14: 696–700. DOI:10.1016/j.phymed.2007.03.005 |
 2018, Vol. 53
2018, Vol. 53


