微针[1]是指包含多个微型针头的阵列, 是一种高效、安全的新型经皮给药技术。微针不但打破了角质层的屏障, 大大提升递送效率[2], 而且由于其微小的结构特点可以实现无痛微创给药, 提高患者顺应性[3]。可溶性微针采用可溶、可降解的材料[4], 微针刺入皮肤后可自行降解, 解决了金属或硅微针等生物相容性不好、断裂后的材料留在皮内造成不良影响等问题[5], 并可以通过不同的基质材料合用使其具有不同的释放特性[6-8]。另外, 相比涂层微针[9], 可溶性微针载药量相对较大[10], 可以通过控制加载入微针中的药物剂量达到精确给药[11]。
本文以盐酸利多卡因作为可溶性微针的模型药物, 制备了基于微针技术的快速局麻起效制剂, 并展开系统的评价。盐酸利多卡因[12]是临床上应用最广泛的局麻药物, 目前用于皮肤浅表局麻的剂型主要有注射剂和乳膏, 注射剂易造成局麻药中毒、疼痛, 导致患者顺应性差, 且需要较高的麻醉技能[13]; 经研究表明, 乳膏中有5%~10%药物被吸收, 起效时间需要1~2 h[14]。基于此, 研制一种可以起到快速局麻药效的制剂具有一定的意义。
材料与方法仪器与设备 80-2离心机沉淀器(梅香仪器有限公司); TDZ5-WS台式低速离心机(湘仪离心机仪器有限公司); 1010-2电热鼓风干燥箱(上海市实验仪器总厂); S-4700 (Ⅱ)场发射扫描电子显微镜(日本Hitachi公司); 515-717-486 Waters高效液相色谱仪(美国Waters公司); TA.XT Plus物性分析仪(英国SMS公司); YD-355AT全自动切片机、YD-A生物组织摊片机(益迪医疗设备有限公司); EG1150H石蜡包埋机、ST0510全自动染色机、E1150C冷台(德国LEICA公司); CK41组织培养用显微镜(日本Olympus公司)。
动物 SD大鼠, 雄性, 体重200~250 g, 购自浙江省实验动物中心, 动物生产许可证: SCXK (浙) 2014-0001, 动物合格证: No.1703310011。豚鼠, 雌雄各半, 体重300~350 g, 购自浙江省实验动物中心, 动物生产许可证: SCXK (苏) 2015-0004, 动物合格证: No.201715728。动物饲养环境:温度20~25 ℃、相对湿度60%~80%, 12 h昼夜明暗交替。新鲜猪耳皮肤, 取自当地屠宰场。
药品与试剂 盐酸利多卡因(LIDH, 批号: 021020, 江苏济州制药有限公司); 甲基乙烯基醚-马来酸酐共聚物(Gantrez S-97, 批号: 0002088062;上海举微国际贸易有限公司); 羟丙基甲基纤维素(HPMC, 批号: 0303-50, 泰安瑞泰纤维素厂); 聚二甲基硅氧烷(PDMS, 批号: 0008706865, 美国道康宁公司); 亚甲基蓝(批号: 20110302, 上海三爱思试剂有限公司); 复方利多卡因乳膏(批号: 170506, 北京紫光制药有限公司); 甲醇、乙腈(色谱纯, 美国TEDIA公司); 其他试剂均为分析纯。
色谱条件 依利特BDS-C18色谱柱(5 μm, 150 mm × 4.6 nm), 流动相为磷酸盐缓冲液(PBS) -乙腈(55: 45), 用磷酸调节pH至8.0, 检测波长为263 nm, 流速为1.0 mL·min-1, 温度为25 ℃, 进样量为20 μL。
对照品、供试品和空白溶液制备 对照品溶液:精密称取LIDH对照品0.020 79 g, 用PBS溶解定容至10 mL, 得质量浓度为2.079 mg·mL-1的LIDH对照品溶液。供试品溶液:将LIDH可溶性微针充分溶于PBS, 并定容至5 mL。取上述溶液稀释5倍后备用。空白溶液采用空白微针同法制备。
LIDH可溶性微针的制备及表征 以PDMS制备微针阴模具, 采用倒模浇注法[15]制备可溶性微针。将35% (w/w) LIDH、12% (w/w) Gantrez S-97和3% (w/w) HPMC溶解于50% (w/w)蒸馏水中, 室温静置溶胀10 h, 配制成均一的基质溶液, 3 000 r·min-1离心10 min去除基质溶液中的气泡。再取0.2 g基质溶液均匀涂布到PDMS阴模具上, 3 000 r·min-1离心10 min入模, 40 ℃下通风干燥。干燥后脱模, 保存于干燥器中。制备的LIDH可溶性微针置于扫描电子显微镜下观察, 考察其微观形态。
压变性能考察 采用物性分析仪进行微针的压变性能考察[16]。将可溶性微针针面朝上放置, 使针的方向与探头的轴向平行, 进行压变测定, 记录过程中位移与针受到的压力。同时采用新鲜猪耳朵进行皮肤穿刺力的测定。将处理好的猪耳朵皮肤安装在两个Franz扩散池的供给室之间。将该装置水平放置在物性分析仪的水平台面上, 将微针用双面胶小心地固定在探头上, 进行穿刺实验, 记录过程中位移与针受到的压力。
皮肤刺入性能 取健康无损伤大鼠的离体皮肤, 除去皮下脂肪, 角质层朝外平铺。将LIDH可溶性微针垂直皮肤进行穿刺, 微针在皮肤上停留1 min后取出。皮肤立即用亚甲基蓝溶液染色, 用异丙醇除去多余亚甲基蓝染料, 对染色后的皮肤拍照[17]。
组织学检查 取猪耳朵离体皮肤进行穿刺, 将微针以5 N的力垂直刺入皮肤, 皮肤上停留1 min后取出, 穿刺后皮肤用于H & E染色[18], 显微镜下观察。
体外溶解性能 将微针刺入parafilm石蜡封口膜, 用封口膜将微针基底密封, 只留出微针的针部。将处理过的微针放入5 mL PBS中, 使微针针部完全没入液体中, 肉眼观察针的残留情况, 记录微针完全溶解的时间。
LIDH含量测定 取单片LIDH可溶性微针充分溶解于PBS, 并采用HPLC法测定LIDH含量。另取LIDH可溶性微针, 仔细将微针的针部沿基底层割下, 将其溶解于PBS缓冲液中, 采用HPLC法测定微针针部LIDH含量。
LIDH可溶性微针的药效学研究 首次采用豚鼠皮内丘疹法[19]改良后的豚鼠背部皮肤针刺法评价LIDH可溶性微针的药效学。将合格豚鼠随机分为4组, 即实验组(给药时间分别为1、3、5和10 min)、阳性对照组、空白对照组和阴性对照组, 每组6只豚鼠; 实验组采用LIDH可溶性微针(750 μm, 1片/只); 阳性对照组为市售复方利多卡因乳膏(含利多卡因25 mg·g-1, 0.14 g/只); 空白对照组为不含药的可溶性微针(750 μm, 1片/只); 阴性对照组采用生理盐水(0.2 mL/只)。将豚鼠放置于鼠板上, 在裸露皮肤上给药。LIDH可溶性微针和不含药微针于给药后手指按压保持不脱落, 并用半透膜和医用胶带固定。取市售复方利多卡因乳膏在裸露皮肤上涂抹均匀, 涂药面积约为1 cm2, 用半透膜加以固定; 用面积约为1 cm2的两层纱布吸附生理盐水, 贴于裸露皮肤上, 用半透膜加以固定。实验组分别于1、3、5和10 min后去除微针贴片, 而空白对照组于10 min后去除微针贴片, 并开始针刺测试; 阳性对照组于给药1 h后开始进行针刺测试。
采用针灸针测试给药部位的皮肤痛觉反应, 痛觉尚存在时, 刺激处皮肤区有收缩现象。每次每只豚鼠刺激给药部位的10个位点, 记录每只豚鼠对刺激的负反应数(即针刺后豚鼠背部皮肤无收缩现象)。实验组和空白对照组在去除药物后每分钟测试1次, 阳性对照组于给药1 h后每10 min测试1次。记录豚鼠的负反应数。起效时间为给药后与阴性对照值相比首次出现显著性差异的时间; 失效时间为给药后与阴性对照值相比末次出现显著性差异的时间; 药效维持时间为起效时间到失效时间的时间段。
统计学分析 所有数据均用x±s表示, 数据采用IBM SPSS Statistics 21.0分析。P < 0.05被认为具有显著性差异。
结果 1 方法学考察专属性实验表明, LIDH的分离度符合要求, 峰形良好, 无拖尾, 且微针中的辅料对药物的检测无干扰。分别取对照品溶液5、10、15、20、30和40 μL进样, 按色谱条件测定LIDH色谱峰面积, 以进样量为横坐标, 峰面积为纵坐标, 绘制标准曲线, 得到LIDH的含量与峰面积的线性方程为Y = 69 646.7 X + 569 187.4, R = 0.999 (n = 6), 表明其在10.395~83.160 μg内线性范围良好。高、中、低剂量(84、70和56 mg)可溶性微针中LIDH的平均回收率为99.93%, RSD为1.52% (n = 3), 精密度、重复性和稳定性实验的RSD均小于2.0 % (n = 6)。经方法学验证, 本文建立的含量测定方法专属性强、精密度高和重复性好, 可以灵敏、准确地测定出可溶性微针中的LIDH含量。
2 微针的外观形态表征如图 1所示, LIDH可溶性微针贴片呈圆形, 微针的长度为742.6 ± 7.6 μm, 针基底部的直径为283.4 ± 5.7 μm (n = 6)。微针贴片直径为1 cm, 于该0.8 cm2的圆形区域内排列了32根针。SEM结果显示, 制得的LIDH可溶性微针针体呈圆锥形, 长度均一, 针体表面光滑, 形态良好。

|
Figure 1 Morphological characterization of lidocaine hydrochloride (LIDH) dissolving microneedles. A: Schematic diagram of microneedles cross-section; B: Schematic diagram of microneedles longitudinal section; C: Scanning electron micrograph of microneedles patch (×30); D: Scanning electron micrograph of single microneedles (×200) |
将测得的可溶性微针在压变过程中所受的力对位移作图, 得到微针的位移-力曲线。图 2A为LIDH可溶性微针的压变性能曲线图。从图中可知, 开始时, 可溶性微针所受的力随位移的增加而增加; 但当所受的力达到大约4 N时, 压力突然减少, 这是由于可溶性微针的断裂造成的; 之后又随着位移的增加而增加。压力下降前的压力值被称为微针的断裂力。由实验得出LIDH可溶性微针的断裂力为4.35 ± 0.36 N (10根针, n = 3)。
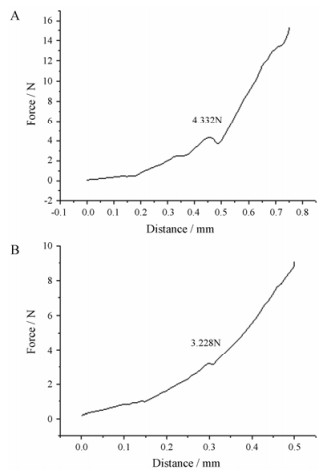
|
Figure 2 The pressure-displacement curve of LIDH dissolving microneedles (A) and punctured skin (B) |
测定皮肤穿刺力, 将其与微针的断裂力进行比较, 可以在理论上预测微针的穿刺有效性。采用物性分析仪可以监测微针在穿刺皮肤时需要的力, 将测得的力对位移作图可得到皮肤穿刺的位移-力图, 如图 2B所示。由图可知, 当压力为3.23 N (10根针)时, 压力突然下降, 说明皮肤被刺穿, 此时的压力视为皮肤的穿刺力。
4 皮肤刺入性能在角质层和表皮层的厚度上, 猪耳皮肤更加接近于人体皮肤。因此在上述的皮肤穿刺力测定实验中, 作者采用离体猪耳皮肤来模拟真实人体皮肤。但是在皮肤染色实验中, 由于猪耳皮肤的毛孔过大容易对皮肤染色效果造成影响, 所以作者采用除猪耳皮肤外与人体角质层和表皮层厚度较为接近的离体大鼠皮肤。采用亚甲基蓝对微针穿刺过的皮肤进行染色, 以便直观地判断微针的穿刺性能。图 3为微针穿刺后的皮肤亚甲基蓝染色图。如图所示, 皮肤表面的蓝点清晰可见, 颜色较深, 呈规律排列, 且与微针阵列的排列一致, 说明LIDH可溶性微针能良好穿刺皮肤。

|
Figure 3 The picture of skin treated with microneedles after staining (×5.5) |
由750 μm LIDH可溶性微针处理后经H & E染色的猪皮肤切片见图 4。图中可以明显看出皮肤的结构:皮肤最外层为薄薄的一层角质层; 中间较薄的紫色为表皮层; 最下面很厚的淡紫色为真皮层。由图可知, LIDH可溶性微针刺破了角质层和表皮层并贯穿至真皮层, 在皮肤中形成了与微针形状相似的微孔通道。
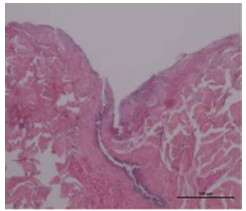
|
Figure 4 Histological section of porcine cadaver skin after H & E staining |
实验结果显示LIDH可溶性微针针部的溶解时间为28.28 ± 1.12 s (n = 6), 说明微针在体外能在30 s内溶解, 具有快速溶解的特性, 为其快速起效提供了基础。
测定可溶性微针中含LIDH 68.19 ± 1.55 mg (n = 6);而可溶性微针针尖部含LIDH 3.57 ± 0.21 mg (n = 6)。
7 LIDH可溶性微针的药效学研究本研究建立的豚鼠背部针刺法是一种以刺激动物皮肤是否产生收缩现象来判断局部麻醉药效的模型。豚鼠是一种对刺激非常敏感的动物, 因此本研究采用豚鼠来研究LIDH微针的药效。实验组采用不同的给药时间进行LIDH可溶性微针给药, 研究LIDH可溶性微针的最佳给药方式。实验组、阳性对照组及空白对照组的豚鼠负反应数分别与阴性对照组的豚鼠负反应数相比, 如果具有显著性差异则说明具有麻醉效果, 反之则不具有麻醉效果。由图 5可知, 相比阳性对照药复方利多卡因乳膏, LIDH可溶性微针给药具有即时起效的特点, 阳性对照药的起效时间需要100 min左右; 不同给药时间的LIDH可溶性微针的药效维持时间不同, 可溶性微针刺入豚鼠时间分别为1、3、5和10 min时, 对应的药效维持时间分别为4、7、10和11 min。微针分别刺入1、3和5 min后取出, 药效维持时间上升趋势明显, 而刺入10 min后取出, 相比刺入5 min药效维持时间只上升了1 min。分析其原因可能是可溶性微针刺入豚鼠皮内1、3和5 min未完全溶解导致药效维持时间不同。再次操作观察微针给药后取出残留来判断微针在豚鼠皮内的溶解情况, 发现微针在刺入豚鼠皮内5 min时可以完全溶解, 至于刺入10 min比5 min药效维持时间稍长原因可能是由于制备的可溶性微针为一体式微针, 背衬层中也含有药物, 其中少量的LIDH也溶解了。
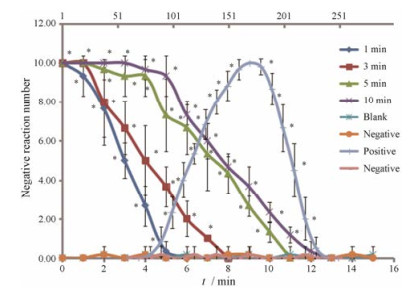
|
Figure 5 The anesthetic effect picture of positive control group (compound lidocaine cream), negative control group, blank control group and experimental groups that microneedles stayed on the skin for 1, 3, 5, and 10 min (the negative control group was plotted on the two X-axes, the positive control group was plotted on the X-axis above, and the remaining groups were plotted on the X-axis below). n = 6, x±s. *P < 0.05 vs negative control group |
虽然可溶性微针相比复方利多卡因乳膏, 起效时间大幅度缩短, 从100 min缩短至1 min, 但是药效维持时间较短, 可溶性微针刺入5 min后取出局麻药效果仅能维持10 min, 这可能是微针密度不够, 本研究制备的微针贴片上只有32根微针, 另外, 由于本研究制备的可溶性微针属于速释制剂, 导致微针刺入皮内即溶解完全使得药物浓度局部积累, 随后扩散至其他部位, 而其他部位浓度过低难以起效。进一步研究可以通过提高微针的密度及开发具有缓控释的可溶性微针制剂以起到微针刺入皮内即达到起效浓度, 随后缓慢释放药物, 使得给药局部一直维持有效浓度, 来提高局麻药物微针的药效维持时间。
结论本研究制备了基于可溶性微针技术的LIDH快速局麻起效制剂, 并通过微针的载药量、机械强度、溶解性能和药效等方面进行了系统评价, 为后续同类制剂的研究提供参考。所制备的LIDH可溶性微针具有完整平滑的外观形态、优良的机械性能和皮肤刺入性能, 能在皮内快速溶解、快速起效, 且局麻效果好, 解决了目前利多卡因外用制剂起效慢的问题, 具有深入研究的前景和临床意义。
| [1] | Indermun S, Luttge R, Choonara YE, et al. Current advances in the fabrication of microneedles for transdermal delivery[J]. J Control Release, 2014, 185: 130–138. DOI:10.1016/j.jconrel.2014.04.052 |
| [2] | Dou JJ, Yan JH, Xu K, et al. Transdermal delivery of Gentiana macrophylla complex components system under micro-needle conditions[J]. Acta Pharm Sin (药学学报), 2011, 46: 1137–1143. |
| [3] | Hwa KY, Chang VHS, Cheng YY, et al. Analyzing polymeric matrix for fabrication of a biodegradable microneedle array to enhance transdermal delivery[J]. Biomed Microdevices, 2017, 19: 84. DOI:10.1007/s10544-017-0224-x |
| [4] | Zhang J, Ma FS, Zhan HH, et al. Matrix materials and their composites for dissolvable microneedle construction:a review[J]. Mat Rev (材料导报), 2017, 31: 129–134, 161. |
| [5] | Huang YC, Ma FS, Zhan HH, et al. Microneedle array used for transdermal delivery of biomacromolecules[J]. Pros Biochem Biophys (生物化学与生物物理进展), 2017, 44: 757–768. |
| [6] | Hong X, Wei L, Wu F, et al. Dissolving and biodegradable microneedle technologies for transdermal sustained delivery of drug and vaccine[J]. Drug Des Devel Ther, 2013, 7: 945–952. |
| [7] | Ke CJ, Lin YJ, Hu YC, et al. Multidrug release based on microneedle arrays filled with pH-responsive PLGA hollow microspheres[J]. Biomaterials, 2012, 33: 5156–5165. DOI:10.1016/j.biomaterials.2012.03.056 |
| [8] | Rejinold NS, Shin JH, Seok HY, et al. Biomedical applications of microneedles in therapeutics:recent advancements and implications in drug delivery[J]. Expert Opin Drug Del, 2016, 13: 109–131. DOI:10.1517/17425247.2016.1115835 |
| [9] | Kusamori K, Katsumi H, Sakai R, et al. Development of a drug-coated microneedle array and its application for transdermal delivery of interferon-a[J]. Biofabrication, 2016, 8: 015006. DOI:10.1088/1758-5090/8/1/015006 |
| [10] | Dangol M, Yang H, Li CG, et al. Innovative polymeric system (IPS) for solvent-free lipophilic drug transdermal delivery via dissolving microneedles[J]. J Control Release, 2016, 223: 118–125. DOI:10.1016/j.jconrel.2015.12.038 |
| [11] | Kim JH, Shin JU, Kim SH, et al. Successful transdermal allergen delivery and allergen-specific immunotherapy using biodegradable microneedle patches[J]. Biomaterials, 2018, 150: 38–48. DOI:10.1016/j.biomaterials.2017.10.013 |
| [12] | Ke GM, Wang L, Wang P, et al. In vitro transdermal permeation of lidocaine-dodecanol binary eutectic system[J]. Acta Pharm Sin (药学学报), 2005, 40: 764–768. |
| [13] | Hasan B, Asif T, Hasan M. Lidocaine-induced systemic toxicity:a case report and review of literature[J]. Cureus, 2017, 9: e1275. |
| [14] | He YJ. Comparison of the In Vitro Percutaneous Penetration of Compound Lidocaine Cream and the Prescription Optimization (复方利多卡因乳膏经皮渗透比较研究及处方优化)[D]. Jinan: Shandong University of Traditional Chinese Medicine, 2015. |
| [15] | Tsioris K, Raja WK, Pritchard EM, et al. Fabrication of silk microneedles for controlled-release drug delivery[J]. Adv Funct Mater, 2012, 22: 330–335. DOI:10.1002/adfm.201102012 |
| [16] | Larra eta E, Moore J, Vicente-Pérez EM, et al. A proposed model membrane and test method for microneedle insertion studies[J]. Int J Pharm, 2014, 472: 65–73. DOI:10.1016/j.ijpharm.2014.05.042 |
| [17] | Pearton M, Saller V, Coulman SA, et al. Microneedle delivery of plasmid DNA to living human skin:formulation coating, skin insertion and gene expression[J]. J Control Release, 2012, 160: 561–569. DOI:10.1016/j.jconrel.2012.04.005 |
| [18] | Leeladurga V, Teja UC, Sultana SKA, et al. Application of microneedle arrays for enhancement of transdermal permeation of insulin:in vitro experiments, scaling analyses and numerical simulations[J]. AAPS PharmSciTech, 2016, 17: 915–922. DOI:10.1208/s12249-015-0416-8 |
| [19] | Xu SY, Bian RL, Chen X. Methodology of Pharmacological Experiment (药理实验方法学)[M]. 3rd ed. Beijing: People's Medical Publishing House, 2002: 797. |
 2018, Vol. 53
2018, Vol. 53


