2. 中山大学药学院, 广东 广州 510006;
3. 中山大学附属第二医院, 广东 广州 510080;
4. 中山大学附属第一医院, 广东 广州 510080
2. School of Pharmaceutical Sciences, Sun Yat-sen University, Guangzhou 510006, China;
3. Department of Pharmacy, The Second Affiliated Hospital, Sun Yat-sen University, Guangzhou 510080, China;
4. Department of Pharmacy, the First Affiliated Hospital, Sun Yat-sen University, Guangzhou 510080, China
五酯片(Wuzhi tablet, WZ)是华中五味子的乙醇提取物制剂, 是常用的五味子制剂(国药准字Z20025766), 主要活性成分包括五味子酯甲(schisantherin A, 质控成分)、五味子甲素(schisandrin A)、五味子乙素(schisandrin B)、五味子丙素(schisandrin C)、五味子醇甲(schisandrol A)、五味子醇乙(schisandrol B)等木脂素[1]。通过LC-MS/MS及HPLC法进一步测定了五酯片中各木脂素活性成分的含量及指纹图谱, 五酯片中含五味子酯甲(12.97±1.20) mg·g-1、五味子甲素(12.57±1.59) mg·g-1、五味子乙素(0.027±0.003 1) mg·g-1、五味子丙素(0.047±0.005 4) mg·g-1、五味子醇甲(0.077±0.008 6) mg·g-1及五味子醇乙(0.89±0.10) mg·g-1[2]。国内外研究表明五酯片及其木脂素活性成分具有抗肝细胞损伤、改善肝细胞代谢的作用, 可降低转氨酶, 对乙醇和对乙酰氨基酚等化学物质引起的肝损伤及自身免疫性肝损伤有全面的保护作用, 是常用的护肝药物[1, 3-5]。
在我国, 五酯片常常与免疫抑制剂他克莫司(tacrolimus, FK506)合用, 以防治肾移植患者中高发的药源性肝功能损害。作者及国内其他研究小组的临床研究表明:合用五酯片或五酯胶囊能显著提高肾移植患者他克莫司的血药浓度2~3倍, 且对患者的生化指标无显著影响[4, 6]。动物实验亦证实五酯片及其活性成分可以使大鼠体内他克莫司的血药浓度显著升高, 提示五酯片及其活性成分是潜在的他克莫司节约剂(tacrolimus-sparing agent)[2, 3, 7]。目前, 在我国, 由于他克莫司价格昂贵, 五酯片在经验丰富的医生指导下被谨慎地用作他克莫司的节约剂, 在不影响他克莫司疗效的同时减少移植患者的医疗费用[4, 6]。然而, 这种有益的中-西药药物相互作用的潜在机制仍不清楚。体外实验表明:五酯片各木脂素活性成分可以抑制他克莫司在Caco-2细胞中的转运, 提示五酯片各木脂素活性成分可能通过抑制P-gp介导的他克莫司的外排而使他克莫司血药浓度升高[2, 3]。
然而, 以上结论均间接由五酯片各活性成分对他克莫司的体内体外实验结果推测而来, 并未考察五酯片各活性成分对P-gp活性的直接影响。虽然许多体外研究表明五味子各活性成分能够抑制P-gp的活性[5, 8-11]。然而, 五酯片各木脂素活性成分对体内P-gp的活性是否有影响?目前尚未见相关报道。此外, 由于药物(中药)与药物的相互作用程度可能因给药途径不同而有很大差异, 五酯片各木脂素活性成分对肠道和肝肾P-gp活性的作用是否存在差异, 目前亦尚未清楚。
地高辛(digoxin, DG)是一种常用的治疗心力衰竭的强心苷类药物, 不经CYP3A代谢, 是公认的P-gp经典底物, 被广泛用作体内和体外检测P-gp活性的探针[12-14]。因此, 本研究利用P-gp经典探针药地高辛考察五酯片6个木脂素活性成分对大鼠灌胃和静脉给药后地高辛药代动力学过程的影响, 评价五酯片木脂素活性成分对大鼠肠道和肝肾P-gp活性的影响; 并利用体外Caco-2细胞模型考察五酯片各木脂素活性成分对地高辛转运的影响。最终, 利用体内体外实验确证五酯片各木脂素活性成分是否可通过P-gp途径影响他克莫司血药浓度, 从而为研究五酯片对他克莫司影响的作用机制提供直接证据。
材料与方法药品与试剂 五味子甲素(≥98%, 批号: 090209)、五味子乙素(≥98%, 批号: 091109)、五味子丙素(≥98%, 批号: 090528)、五味子醇甲(≥98%, 批号: 090722)、五味子醇乙(≥98%, 批号: 090927)、五味子酯甲(≥98%, 批号: 090826), 上述6个五酯片活性成分均购自上海融禾医药科技有限公司; 地高辛(digoxin, DG, 98.8%, Sigma-Aldrich); 肝素钠注射液(常州千红生化制药股份有限公司, 批号: 090625); PE插管(polythene 0.98 mm OD, 浙江安莱科技有限公司); 叔丁基甲醚及二氯甲烷(色谱纯, Tedia公司); DMEM (Dulbecco's modified Eagle's medium)培养基(高糖)、胎牛血清(优级)、胰蛋白酶、非必需氨基酸及磷酸盐缓冲液(PBS)均购自美国Gibco; 色谱分析实验中所用试剂均为色谱纯。
仪器设备 Surveyor高效液相-质谱联用仪(Finnigan公司); 5417-R低温高速离心机(德国Eppendorf公司); 超净化工作台(SW-CJ-2FD型, 苏州苏净集团安泰公司); 恒温水浴振荡器(SHA-C型, 金坛市富华仪器有限公司); Milli Q-plus超纯水净化系统(Millipore, Bedford, MA, USA)。
实验动物 清洁级Sprague-Dawley (SD)雄性大鼠, 220~280 g, 由中山大学实验动物中心提供[合格证号: SCXK (粤) 2009-0011], 于SPF级环境饲养, 动物室内温度20~25 ℃、相对湿度40%~70%、换气次数10~15次/h, 保持12 h光照循环; 期间自由饮水进食, 提供实验室标准动物饲料, 符合我国《实验动物管理条例》和《医学实验动物管理实施细则》。
五酯片木脂素活性成分对大鼠体内地高辛药动学的影响 大鼠随机分成9组, 分别灌胃给予蒸馏水(control)、五味子甲素、乙素、丙素、醇甲、醇乙、酯甲(0.024 mmol·kg-1), 再灌胃给予地高辛(0.25 mg·kg-1)。于给药前(0 h)、给药后0.25、0.5、1、2、3、4、5、6、8和12 h从右颈静脉取血约0.25 mL。
另外2组则分别灌胃给予蒸馏水(control)、五味子醇乙(0.024 mmol·kg-1), 再静脉注射地高辛(0.1 mg·kg-1)。于给药前(0 h)、给药后0.033、0.083、0.17、0.25、0.5、0.75、1、1.5、2、3、4、5、6、8和12 h从右颈静脉取血约0.25 mL。
血样按已经建立的LC-MS/MS方法[15]检测血浆地高辛的浓度。血药浓度数据用PKPP药代动力学软件包进行处理, 根据数据特点采用非房室模型, 计算出主要的药代动力学参数[2, 3, 16]。达峰浓度Cmax、达峰时间tmax均取实测值; 对药物浓度-时间曲线进行半对数作图, 用最小二乘法对末端点进行线性回归处理, 末端消除速率常数Ke = -2.303 × (对数血药浓度-时间曲线末端直线部分的斜率), t1/2 = 0.693/Ke; AUC0-t采用梯形法计算; AUC0-∞ = AUC0-t + Ct/Ke, Ct为最后一个时间点t对应的血药浓度; 清除率CL为Dose/AUC0-∞; 表观分布容积Vz为CL/Ke; 平均滞留时间MRT为AUMC0-t/AUC0-t。
细胞培养 Caco-2细胞来源于ATCC (American Type Culture Collection), 22代。采用DMEM培养基, 培养基中含12%胎牛血清、1%非必需氨基酸及100 U·mL-1青霉素和100 μg·mL-1链霉素双抗液。用75 cm2卡式培养瓶培养Caco-2细胞, 置于37 ℃培养箱中, 通入5% CO2 (相对湿度90%), 隔天换一次培养基。当细胞覆盖培养瓶底部80%~90%时, 用0.25%胰酶消化, 将细胞接种在12孔Transwell板上[Transwell板预先用Ⅰ型鼠尾胶原蛋白(2 μg·cm-2)包被], 接种密度为每孔5×105。Transwell板A面含0.5 mL DMEM培养基, B面含1.5 mL DMEM培养基, 种板后, 所用培养基中含20%胎牛血清、1%非必需氨基酸及100 U·mL-1青霉素和100 μg·mL-1链霉素双抗液。每天换液一次, 第4天更换肠上皮细胞分化培养基(differentiation medium), 每天换液[17]。种板培养7天后, 细胞形成紧密单层, 在每种药物的转运实验进行前及结束后, 均用细胞电位仪测定跨上皮细胞电阻TEER (transepithelial electrical resistance), 以确定单层细胞的紧密性与完整性, 当TEER≥250 Ω·cm2认为细胞模型符合条件, 可用于实验。
五酯片木脂素活性成分对地高辛在Caco-2细胞模型吸收的影响 转运实验参照本实验室发表的文献[17]进行。在相同条件下, 分别测定药物从Caco-2细胞层刷状缘端(apical side, AP)→基底端(basolateral side, BL)和BL面→AP面的双向转运特性。实验前, 用Hank's缓冲液(HBSS, Hank's balanced salt solution)洗3次, 最后一次置37 ℃孵箱中孵育30 min后取出, 用EVOM测定跨上皮细胞电阻(TEER)确定细胞单层的紧密性及完整性。进行实验用的细胞TEER≥250 Ω·cm2。实验后再次测定TEER以保证细胞的完整性及实验的准确性。
根据设计, 分别在细胞两侧加入100 μmol·L-1的P-gp经典阳性抑制剂维拉帕米或100 μmol·L-1的五酯片活性成分溶液及含4%牛血清白蛋白(BSA, bovine serum albumin)的HBSS液, 预孵育60 min后取出, 将两侧溶液吸干后于A面或B面加入1 μmol·L-1地高辛HBSS溶液, 放入37 ℃孵箱孵育, 于给药后(地高辛) 30、60、90和120 min从B面(AP→BL)或A面(BL→AP)精密吸取溶液100 μL, 并测定其中的地高辛浓度, 每次取样后补足同样体积的含4% BSA的HBSS液至Transwell板中。
由于细胞实验样本的介质是HBSS液, 因此对该方法进行了部分方法学验证, 用以检测HBSS液中地高辛的浓度。
根据下式计算药物双向转运的表观渗透系数Papp (apparent permeability coefficient):
| $ {P_{{\rm{app}}}} = ({\rm{d}}C/{\rm{d}}t \times V)/(A \times {C_0}) $ |
其中, C0是待测药物所在端(donor)的初始浓度, dC/dt是在接收端(receiver)待测药物出现的速率, V是接收端的溶液体积, A是Transwell多聚碳酸酯膜的表面积1.12 cm2。
由于每次取样后都要补液, 对药物的通透产生了稀释作用, 因而药物的累计通透量TRcum (ng·mL-1)可由以下公式校正:
| $ {\rm{T}}{{\rm{R}}_{{\rm{cum}}}} = {A_n} + \frac{{V{{\rm{s}}_n}}}{{{V_{\rm{R}}}}}\sum\limits_{i = 0}^{n - 1} {{A_i}} $ |
其中An为第n个样品通透量的测定值; Vsn为第n个样品的采样体积; VR为接收池的体积。
转运率(transport ratio) = Papp BL-AP/Papp AP-BL。
统计学分析 统计学分析用方差分析及非参数检验, P < 0.05有统计学意义。数据处理软件为SAS 8.1 (SAS Ver.8.1, SAS Institute Inc., Cary, NC, USA)统计学软件。
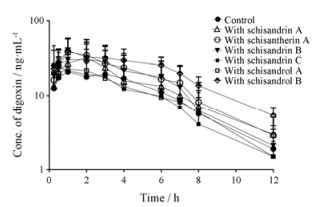
结果 1 五酯片木脂素活性成分对灌胃给药地高辛药动学的影响五酯片活性成分对灌胃给药地高辛药动学的影响结果见表 1及图 1。合用五味子甲素、五味子乙素、五味子醇乙及五味子酯甲分别使灌胃给药组地高辛的血药浓度升高, 其中五味子醇乙升高地高辛血药浓度的作用最强; 然而五味子丙素及五味子醇甲对地高辛药动学影响不大。合用五味子甲素、五味子乙素、五味子醇乙及五味子酯甲使灌胃给药组地高辛的AUC0-12 h从(115.3±71.6) ng·h·mL-1分别升高至(145.0±132.0)、(162.2±97.8)、(229.5±81.1) (P < 0.05)及(178.8±100.7) ng·h·mL-1 (P < 0.05);分别使地高辛的Cmax从(22.3±13.3) ng·h·mL-1升高至(34.4±23.4)、(37.0±14.2)、(41.2±15.1)及(39.0±19.1) ng·h·mL-1; 分别使地高辛的CL/F及Vz/F降低。
| Table 1 Pharmacokinetic parameters of digoxin after a single oral dose of digoxin (0.25 mg·kg-1) to rats with and without an oral dose of lignans of Wuzhi tablet (0.024 mmol·kg-1). n = 5, x±s. *P < 0.05 vs control (digoxin alone) group |
|
Figure 1 Plasma concentration-time profiles of digoxin after a single oral dose of digoxin (0.25 mg·kg-1) to rats with and without an oral dose of lignans of Wuzhi tablet (0.024 mmol·kg-1). n = 5, x±s |
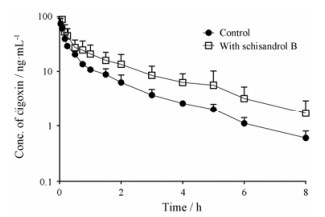
为区分五酯片活性成分对大鼠肠道和肝肾P-gp活性的作用, 选择了对地高辛作用最强的五味子醇乙, 进一步考察其对静脉注射地高辛药动学的影响, 结果见表 2及图 2。合用五味子醇乙升高静脉注射地高辛的血药浓度的程度与其升高灌胃给药地高辛的作用程度相当, 使静脉注射地高辛的AUC从(42.4±12.5) ng·h·mL-1升高至(88.7±39.6) ng·h·mL-1 (P < 0.05);使地高辛的CLiv及Vz分别从(2.4±0.9) L·h-1·kg-1及(4.6±2.4) L·kg-1降低至(1.0±0.4) L·h-1·kg-1 (P < 0.05)及(2.6±1.1) L·kg-1, 提示五味子醇乙显著抑制了地高辛的消除。
| Table 2 Pharmacokinetic parameters of digoxin after a single intravenous dose of digoxin (0.1 mg·kg-1) to rats with and without an oral dose of schisandrol B (0.024 mmol·kg-1). n = 5, x±s. *P < 0.05 vs control (digoxin alone) group |
|
Figure 2 Plasma concentration-time profiles of digoxin after a single intravenous dose of digoxin (0.1 mg·kg-1) to rats with and without an oral dose of schisandrol B (0.024 mmol·kg-1). n = 5, x±s |
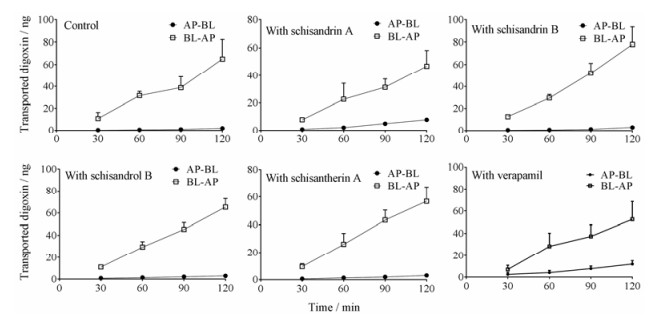
五酯片活性成分对地高辛在Caco-2细胞模型转运的影响结果见表 3及图 3。Caco-2细胞转运实验表明, 空白对照、维拉帕米(阳性对照)、五味子甲素、五味子乙素、五味子醇乙、五味子酯甲处理组地高辛在Caco-2细胞的转运率分别为36.07±9.62、4.44±1.33、6.03±1.44、27.79±5.60、22.67±2.70及18.77±3.48。提示维拉帕米、五味子甲素、五味子乙素、五味子醇乙及五味子酯甲可以抑制地高辛在Caco-2细胞的转运, 表明五味子甲素、五味子乙素、五味子醇乙及五味子酯甲可直接抑制P-gp的活性。
| Table 3 Effects of 100 μmol·L-1 lignans of Wuzhi tablet and verapamil on transport of digoxin (1 μmol·L-1) across Caco-2 cell monolayers. AP: Apical side; BL: Basolateral side. n = 3, x±s |
|
Figure 3 The time profile of the AP-BL and BL-AP transport of digoxin (1 μmol·L-1) across Caco-2 cell monolayers with 100 μmol·L-1 lignans of Wuzhi tablet and verapamil. n = 3, x±s |
本实验通过评价五酯片各活性成分对灌胃给药和静脉注射经典P-gp探针药地高辛(P-gp经典底物)药动学的影响来区分五酯片各活性成分对肠道和肝肾P-gp活性的影响程度, 并利用体外Caco-2细胞模型考察五酯片各活性成分对地高辛转运实验的影响, 进一步验证五酯片各活性成分对P-pg活性的影响。体内体外研究结果表明五味子甲素、五味子乙素、五味子醇乙、五味子酯甲可不同程度地升高地高辛的血药浓度, 五味子醇乙作用最强; 五味子醇乙可能通过抑制肝肾P-gp的活性减少地高辛的消除而使地高辛的血药浓度升高。
合用五味子甲素、五味子乙素、五味子醇乙、五味子酯甲均使灌胃给药组地高辛的血药浓度(包括Cmax)、AUC升高, 均使地高辛的CL/F、Vz/F降低, 但作用程度存在差异, 而五味子醇甲及五味子丙素对地高辛药动学无影响。合用五味子甲素、五味子乙素、五味子醇乙、五味子酯甲分别使灌胃给药组地高辛的AUC分别升高25.8%、40.7%、99.0% (P < 0.05)、55.1% (P < 0.05)。五味子醇乙升高地高辛血药浓度的作用最强, 其次为五味子酯甲。这与之前五酯片各活性成分升高他克莫司(CYP3A和P-gp的底物)血药浓度的结果一致[2]。
为区分五酯片各其活性成分对肠道及肝肾P-gp活性的影响, 故选择五味子醇乙研究其对静脉注射地高辛药动学的影响。结果表明, 合用五味子醇乙使静脉注射地高辛的AUC升高109.2% (P < 0.05), 使地高辛的CLiv显著降低(P < 0.05)。五味子醇乙对灌胃给药及静脉注射地高辛的AUC的作用程度相似, 提示五味子醇乙并未提高地高辛从肠腔吸收而是通过降低地高辛的清除, 从而使地高辛的血药浓度升高。即五味子醇乙可能抑制肝肾的P-gp对地高辛的消除作用而升高地高辛血药浓度。这也提示, 不能通过改变P-gp底物(如地高辛)的给药途径而减轻五酯片各活性成分对P-gp底物的影响强度。
为进一步确认五酯片各活性成分对P-gp活性的抑制作用, 实验考察了五酯片各活性成分在Caco-2细胞模型中对地高辛转运的影响。本次实验采用了7天Caco-2细胞模型, 该模型的可靠性已进行充分的验证[17]。细胞毒性实验表明100 μmol·L-1的五酯片各活性成分及1 μmol·L-1的地高辛对Caco-2细胞无毒性作用。转运实验表明, 100 μmol·L-1五味子甲素、乙素、醇乙及酯甲使地高辛的转运率从36.07分别降低至6.03、27.79、22.67及18.77, 说明五味子甲素、乙素、醇乙及酯甲抑制了P-gp对地高辛的外排作用, 其中五味子甲素抑制P-gp外排的作用最强。这与之前的文献报道一致, Yoo等[5]的研究表明五味子木脂素(包括五味子甲素、五味子醇乙及五味子酯甲)显著抑制罗丹明-123在Caco-2细胞中的外排, 其中五味子甲素的抑制作用最强。然而, 体内动物实验表明五味子醇乙升高地高辛、他克莫司血药浓度的作用最强[2]。体内实验和体外实验结果的这种差异可能是由于五酯片各木脂素活性成分在体外和体内的生物利用度和代谢途径不同所致, 五酯片各木脂素活性成分的生物利用度和代谢途径有待进一步研究。此外, 由于他克莫司是CYP3A及P-gp的底物[18, 19], 本实验仅研究五酯片及其活性成分通过影响P-gp途径而影响他克莫司血药浓度, 五酯片及其活性成分是否通过抑制CYP3A的活性及以何种机制抑制CYP3A活性而使他克莫司血药浓度升高有待进一步研究。
总之, 作者研究表明合用五酯片木脂素活性成分(五味子甲素、五味子乙素、五味子醇乙及五味子酯甲)能提高地高辛的血浆浓度, 其中五味子醇乙的作用最强。五味子醇乙可能通过抑制肝肾P-gp活性从而使地高辛的血药浓度升高, 改变给药途径并未能改变五酯片各木脂素活性成分与P-gp底物的相互作用强度。五酯片及其活性成分可通过P-gp途径影响他克莫司血药浓度。在临床中, 应注意五酯片及其木脂素活性成分与P-gp底物药物的相互作用。
| [1] | Huyke C, Engel K, Simon-Haarhaus B, et al. Composition and biological activity of different extracts from Schisandra sphenanthera and Schisandra chinensis[J]. Planta Med, 2007, 73: 1116–1126. DOI:10.1055/s-2007-981559 |
| [2] | Qin XL, Chen X, Wang Y, et al. In vivo to in vitro effects of six bioactive lignans of Wuzhi tablet (Schisandra sphenanthera extract) on the CYP3A/P-glycoprotein-mediated absorption and metabolism of tacrolimus[J]. Drug Metab Dispos, 2014, 42: 193–199. |
| [3] | Qin XL, Bi HC, Wang XD, et al. Mechanistic understanding of the different effects of Wuzhi tablet (Schisandra sphenanthera extract) on the absorption and first-pass intestinal and hepatic metabolism of tacrolimus (FK506)[J]. Int J Pharm, 2010, 389: 114–121. DOI:10.1016/j.ijpharm.2010.01.025 |
| [4] | Xin HW, Li Q, Wu XC, et al. Effects of Schisandra sphenanthera extract on the blood concentration of tacrolimus in renal transplant recipients[J]. Eur J Clin Pharmacol, 2011, 67: 1309–1311. DOI:10.1007/s00228-011-1075-7 |
| [5] | Yoo HH, Lee M, Lee MW, et al. Effects of Schisandra lignans on P-glycoprotein-mediated drug efflux in human intestinal Caco-2[J]. Planta Med, 2007, 73: 444–450. DOI:10.1055/s-2007-967178 |
| [6] | Li J, Chen S, Qin X, et al. Wuzhi tablet (Schisandra sphenanthera extract) is a promising tacrolimus-sparing agent for renal transplant recipients who are CYP3A5 expressers:a two-phase prospective study[J]. Drug Metab Dispos, 2017, 45: 1114–1119. DOI:10.1124/dmd.117.076737 |
| [7] | Qin XL, Yu T, Li LJ, et al. Effect of long-term co-administration of Wuzhi tablet (Schisandra sphenanthera extract) and prednisone on the pharmacokinetics of tacrolimus[J]. Phytomedicine, 2013, 20: 375–379. DOI:10.1016/j.phymed.2012.11.008 |
| [8] | Pan Q, Lu Q, Zhang K, et al. Dibenzocyclooctadiene lingnans:a class of novel inhibitors of P-glycoprotein[J]. Cancer Chemother Pharmacol, 2006, 58: 99–106. DOI:10.1007/s00280-005-0133-1 |
| [9] | Qiangrong P, Wang T, Lu Q, et al. Schisandrin B - a novel inhibitor of P-glycoprotein[J]. Biochem Biophys Res Commun, 2005, 335: 406–411. DOI:10.1016/j.bbrc.2005.07.097 |
| [10] | Sun M, Xu X, Lu Q, et al. Schisandrin B:a dual inhibitor of P-glycoprotein and multidrug resistance-associated protein 1[J]. Cancer Lett, 2007, 246: 300–307. DOI:10.1016/j.canlet.2006.03.009 |
| [11] | Wan CK, Zhu GY, Shen XL, et al. Gomisin A alters substrate interaction and reverses P-glycoprotein-mediated multidrug resistance in HepG2-DR cells[J]. Biochem Pharmacol, 2006, 72: 824–837. DOI:10.1016/j.bcp.2006.06.036 |
| [12] | Cem KY, Kubilay O, Ozlem E, et al. Effect of repeated low- dose organophosphorothionate pesticide exposure on digoxin pharmacokinetics in rats; a possible interaction involving P-glycoprotein[J]. Toxicol Mech Methods, 2007, 17: 459–466. DOI:10.1080/15376510701190755 |
| [13] | Hori R, Okamura N, Aiba T, et al. Role of P-glycoprotein in renal tubular secretion of digoxin in the isolated perfused rat kidney[J]. J Pharmacol Exp Ther, 1993, 266: 1620–1625. |
| [14] | Kirby B, Kharasch ED, Thummel KT, et al. Simultaneous measurement of in vivo P-glycoprotein and cytochrome P4503A activities[J]. J Clin Pharmacol, 2006, 46: 1313–1319. DOI:10.1177/0091270006292625 |
| [15] | Xue X, Huang M, Xiao H, et al. Rapid and simultaneous measurement of midazolam, 1'-hydroxymidazolam and digoxin by liquid chromatography/tandem mass spectrometry:application to an in vivo study to simultaneously measure P-glycoprotein and cytochrome P4503A activity[J]. J Pharm Biomed Anal, 2011, 55: 187–193. DOI:10.1016/j.jpba.2011.01.018 |
| [16] | Xue XP, Qin XL, Xu C, et al. Effect of Wuzhi tablet (Schisandra sphenanthera extract) on the pharmacokinetics of cyclosporin A in rats[J]. Phytother Res, 2013, 27: 1255–1259. DOI:10.1002/ptr.v27.8 |
| [17] | Cai Y, Xu C, Chen P, et al. Development, validation, and application of a novel 7-day Caco-2 cell culture system[J]. J Pharmacol Toxicol Methods, 2014, 70: 175–181. DOI:10.1016/j.vascn.2014.07.001 |
| [18] | Iwasaki K. Metabolism of tacrolimus (FK506) and recent topics in clinical pharmacokinetics[J]. Drug Metab Pharmacokinet, 2007, 22: 328–335. DOI:10.2133/dmpk.22.328 |
| [19] | Jeong H, Chiou WL. Role of P-glycoprotein in the hepatic metabolism of tacrolimus[J]. Xenobiotica, 2006, 36: 1–13. DOI:10.3109/00498250500485115 |
 2018, Vol. 53
2018, Vol. 53


