随着社会的发展和人类对健康的关注, 传统给药系统已经不能满足日益多样化的临床需求, 越来越多的新型给药系统被设计和应用。但是现阶段新型药物递送系统设计复杂、制备工序繁多、控释性能的重现性和稳定性较差, 而传统制造技术并不具备良好的微观制备与调控能力, 与复杂的剂型设计不相匹配, 因此更多地停留在理念构思与实验研究阶段, 真正实现还需要药剂学提供新思路和新策略[1]。近年来, 随着与药剂学相关的工程学、材料学等学科的不断进步与发展, 始于20世纪80年代末的快速成型(rapid prototyping, RP)技术, 尤其以3D (three dimensional)打印技术为代表的新技术日益完善并在医药领域受到越来越多的关注与重视, 2015年8月3日首款由3D打印技术研发制备的左乙拉西坦(levetiracetam, SPRITAM)速溶片获得美国食品药品监督管理局(Food and Drug Administration, FDA)批准于2016年正式上市, 加快了3D打印技术在制剂领域的应用研究[2]。本文综述了近年来3D打印技术的制剂设计研究进展, 并对未来制剂工程化研究中的应用进行展望。
1 3D打印技术 1.1 简介美国麻省理工学院Sachs等[3]首先提出的3D打印技术是快速成形技术的一种, 依据“逐层打印, 层层叠加”的理念, 通过计算机辅助绘图设计及控制直接制备具有特殊外型或复杂内部结构的物体, 也常常被称为计算机自动化制造或分层制造技术。3D打印技术可以以金属、陶瓷、塑料、聚合物甚至活细胞等作为打印材料, 可打印材料多、灵活性高的特点使其在多项科技领域中都有应用。制药工业使用3D打印技术有助于解决传统制剂工艺中与释药机制和释药速率相关的若干问题, 同时也使制剂研发和生产更为便利。如:在研发阶段, 其高度灵活性的特点可使多设备协调加工简化为单一机器不断重复, 忽略原料药和辅料与器械之间的相互作用, 易于设计和研究; 在工业生产阶段, 由于与研发阶段打印原理相同, 可省去放大生产的工艺研究, 节约成本[4]。这些优势都促使3D打印技术在制药领域中的应用受到越来越多的关注。
1.2 发展现状目前, 国内外有关3D打印的大多数研究仍处于初级阶段, 对于药物载入方式、工艺参数操作控制、剂型设计构建等方面都有待深入并拓宽研究范畴。随着近年来药剂学与材料学的不断互动与交叉发展, 为了进一步增加药物载体可控性, 获取更精确、更具针对性的释药方案, 各类新兴的3D打印技术不断涌现[5]。
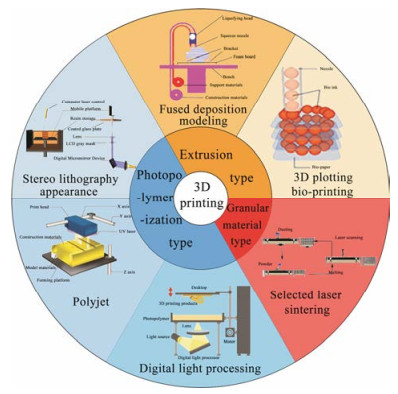
然而, 并非所有的新型3D打印技术都适用于药物制剂设计, 应用最广泛的3D打印技术包括挤压沉积型、光聚合型和颗粒材料结合型3大类, 不同类型的3D打印技术工作原理也有细微的差别(图 1[4, 6], 表 1[5-15])。挤压沉积型3D打印技术主要流程是从打印喷嘴中挤出细丝或微流体来构建2D平面, 层层沉积之后形成3D实物, 该类型包括广泛使用的熔融沉积成型技术(fused deposition modeling, FDM)[6-8]和用于医药领域的3D绘图生物打印技术[5]。光聚合型3D打印技术主要采用光聚合原理, 将液态的光敏聚合物(单体)在光(紫外光、可见光)或高能射线(主要是电子束)的作用下, 经过交联聚合形成固态产物, 层层叠加后形成成品, 在后续的研究中衍生出立体光刻技术(stereo lithography appearance, SLA)[9, 10]、聚合物喷射技术(polyjet)[11-13]和数字光处理打印技术(digital light processing, DLP)[14]等可以广泛应用于制剂设计的新型RP技术。颗粒材料结合型3D打印技术是发展最早的一批RP技术, 原理是在颗粒床上使用物理方法对颗粒型材料进行选择性融合, 由于材料易于获取而广泛应用于各大科技领域, 涉及医药领域并应用于制剂研究主要包括选择性激光烧结技术(selected laser sintering, SLS)[15]。因此, 面对庞大的药品市场需求, 以3D打印为基础的RP技术的应用也进一步促进药物制剂的发展。现阶段有关3D打印机的研究进展迅猛, 尤其是在速度方面已经逐渐能够满足大规模生产要求。如国内华曙高科生产的H1001P型工业级3D打印机, 扫描速度可达15.2 m·s-1 [16], ExOne公司的ProMetalRCT技术打印速度甚至能够达到59 400~108 000 cm3·h-1 [17]。假如将ProMetalRCT技术应用于制药工业, 以0#型实心胶囊(体积约0.68 cm3)为目标产物, 理论产能最高可达每小时158 800粒, 基本能够满足现阶段生产期望。有足够的理由相信随着打印速度的不断加快, 未来产能也将满足工程化应用要求。
| Table 1 Introduction of 3D printing technology for formulation. FDM: Fused deposition modeling; SLA: Stereo lithography appearance; DLP: Digital light processing; SLS: Selected laser sintering |
3D打印技术早在20世纪末期已应用于药物制剂研究, 近年来国内外也陆续发表了相关报道。研究表明, 3D打印可用于制备一些传统制剂工艺难以制备的、具有复杂空间结构的药物剂型。与传统方法相比, 3D打印制备给药系统具有巨大的技术优势, 同时具有药物精确可控、制备工艺自动化高的特点[18]。3D打印技术可通过改变打印参数来调整药物释放特性, 并实现剂量精确控制和药物空间定位。在制备过程中, 研究人员通过聚合物材料、黏合剂和打印区域的正确选择, 实现个性化的药物释放以满足不同需求:酸蚀型、肠溶型、脉冲控释型和即时脉冲控释型等, 这些都符合未来药物研究的个性化、针对性的发展趋势[19]。现阶段医药工作者对3D打印在制剂设计中的研究主要有3个方向, 分别是控速释药、定时释药和靶向释药。
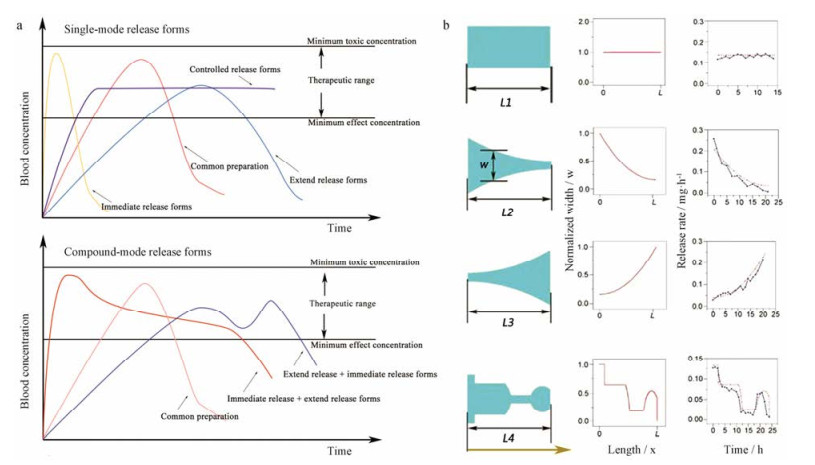
2.1 控速释药控制释药速度以达到治疗目的是现阶段制剂设计的研究热点, 当前对于药物释放速度的研究主要包括单一模式释放型和复合模式释放型。单一模式释放型包括速释型、缓释型和控释型, 而复合模式释放型则是根据患者用药需求结合单一模式释放型中的两种或两种以上设计制造的给药系统, 主要包括“速释型+缓释型”和“缓释型+速释型”[9] (图 2a)。制药工程中的控释制剂通常涉及溶出、扩散、溶蚀和离子交换等释药机制, 具体机制又与给药系统的结构特征和材料密切相关。大体上来说, 相同原理设计的同一给药系统, 结构越精确就越容易实现理想可控的药物释放[16]。传统制剂工艺需要多仪器协调通过一系列流程才能制备复杂制剂, 而3D打印技术在计算机成功建模后仅需3D打印机即可完成更为精确的制剂生产, 甚至能够打印一些传统制剂工艺无法实现的制剂设计以控制释药速率, 如通过改变带孔包衣片中含药内芯的形状实现了不同的释药速率[11] (图 2b)。此外, 改变制剂的外形及材料的打印区域也可以达到控制药物的释放速度的效果。
|
Figure 2 Release mode of rate-controlled drug release. a: Release curve of single-mode and compound-mode release formulations[9]; b: Release behavior of different inner core tablets[11] |
速释型制剂早在20世纪初就已经出现, 此后, 速释剂型经历了从“蜂窝”效应片剂、泡腾崩解片剂、冻干片到速溶材料结合片的发展过程, 但制剂技术始终局限于压片、模塑和冻干, 这些传统工艺大都面临着药用辅料受限和成本过高两大难题[14]。3D打印技术可以使用廉价的3D打印机打印普通辅料, 并通过改变打印参数和调节有效成分与辅料打印区域的方式得到堆密度更低的制剂, 实现更好的速释效果。Aprecia制药公司于2016年上市的SPRITAM速溶片完全采用ZIP DOSE技术制备(图 3a), 使用含水流体结合多层粉末混合物以产生多孔的水溶性固体制剂, 能够在以秒为单位迅速崩解的同时提供精确的定量释药(图 3b), 该制剂不仅具有快速溶解、分解、融化和分裂的特性, 对吞咽性障碍的患者也有明显帮助, 而且易于扩大并实现工业化生产。此后, 更多的学者投身于3D打印速释制剂研究, Sadia等[18]设计了一种具有穿孔通道的囊片, 并通过FDM打印制作, 研究过程中使用速释可增加生物利用度的氢氯噻嗪作为模型药物, 最终制作的囊片与相同材料制作的普通囊片相比表现出更为快速的释药效果, 实验期间研究人员发现增大比表面积、一定限度内降低孔道长度和增加孔道密度可以加速药物释放, 这种速释设计理念为未来速释型制剂的设计与生产提供了新思路。

|
Figure 3 Immediate release preparation. a: Appearance of ZIP DOSE tablet; b: Tablets prepared by ZIP DOSE technique dissolved in seconds |
与速释制剂相同, 缓释制剂的研发也是建立在材料学的基础上并且受限于辅料种类, 药用辅料的推陈出新才能促进缓释效果的提高, 3D打印技术调节参数即可改变制剂释放特性的特点也可以应用于制备缓释制剂, 因此也有很多学者投身于3D打印缓释制剂的研究中。Skowyra等[19]通过FDM制备醋酸泼尼松龙缓释片, 首先将1.9%泼尼松龙溶解在饱和甲醇溶液中, 之后载入聚乙烯醇丝状物(1.75 mm)中用于打印最终制备的3D打印片, 在体外环境中释药持续时间可延长至24 h。进一步研究表明, 释药速度与负载药物量密切相关, 载药量与药物释放速度成反比, 未来缓释制剂工业化生产可以通过工业级3D打印机, 依据这一理念完成对简单制剂的缓释化改良。
现阶段实现药物零级释放通常采用骨架型、渗透泵型、膜控型和植入型4种方式。这些方式大都是通过一定的物理手段使药物的释放持续受限来达到给药周期内匀速释药的效果。然而传统制剂技术很难在实现复杂的制备过程中同时有效地控制剂量与释药速度, 例如骨架型控释制剂在实现较好的释药骨架的同时难以达到剂量的精确性。利用3D打印技术, 可以将药物和生物载体打印进入骨架平台, 在药物、生物载体与支架平台之间构建最适合患者症状的空间结构, 有针对性地设计释药骨架, 有利于骨架内药物在特定患者体内的释放, 提高药物的有效性和安全性。Goyanes等[7]探讨了FDM联合热熔挤出和流化床包衣来制造布地奈德控释剂型的可行性, 研究中首先将布地奈德通过热熔挤出的方式载入聚乙烯醇丝状物中, 之后通过FDM技术将丝状物打印成囊片, 最后在表面打印一层肠溶聚合物。通过Hank's碳酸氢盐缓冲系统测试的研究发现, 3D打印技术制造的囊片首先在小肠中部开始释放, 然后在远端小肠和结肠处持续释放。研究结果证明, 联合热熔挤出和流化床包衣的FDM技术有制造针对肠炎的控释口服剂型的潜力。Goyanes等[6]进一步探索了FDM生产控释药物的潜力, 使用同样的方法将两种用于治疗炎症性肠病的药物5-氨基水杨酸和4-氨基水杨酸的氨基水杨酸异构体成功载入聚乙烯醇细丝中, 在改良的Hank's碳酸氢盐缓冲液中进行溶解测试的结果显示, 两种药物的释药效果可根据药物的填充百分比调控, 同时也证明了FDM作为一种有效的低成本替代方法来制造个性化定制的口服药物及用于生产控释制剂的潜在作用。Wang等[10]研究了使用SLA打印机打印控释片剂的可行性, 使用聚乙二醇二丙烯酸酯作为载体, 同时以二苯基(2, 4, 6-三甲基苯甲酰基)氧化膦作为光引发剂来打印4-氨基水杨酸和扑热息痛控释片剂。结果发现, 对乙酰氨基酚和4-氨基水杨酸在打印片中的负载量分别为5.69%和5.40%时, 可以取得更好的控释效果。不同的3D打印技术都证实了改变原料药与辅料百分比来实现控释的可行性, 为工业化生产前研究提供了更为便捷的处方筛选条件。
2.1.2 复合模式释放制剂随着医药科技的发展及制剂工艺的进步, 单一模式释放制剂已远远不能满足日益多样化的临床需求, 而且在临床用药过程中也逐渐暴露出单一模式释放制剂的一些缺陷, 例如缓释制剂释药速度慢会造成药物起效比普通制剂慢, 药食同服时容易出现“药物倾泻”现象等[20]。为了应对这些缺陷, 制剂研发人员也开始寻找解决方案, 有学者将缓释制剂与速释制剂结合, 在保证药物快速起效的同时, 缓慢释放药物, 提高药物的综合治疗指数。3D打印技术在制备这种复杂制剂方面有独特的优势, Khaled等[21]采用3D打印技术成功制造了多活性固体复合缓释剂型, 该制剂中包含5个区域化药物:阿司匹林、氢氯噻嗪、普伐他汀、阿替洛尔和雷米普利, 由普伐他汀、阿替洛尔和雷米普利组成的复合制剂之间被疏水醋酸纤维素膜组成的可渗透载体分离, 表面则由阿司匹林和氢氯噻嗪隔室覆盖(图 4)。复合制剂具有两个独立可控的释放曲线, 能够使单一个性化制剂应对复杂的用药。该复合制剂具有两个立即释放隔室(阿司匹林和氢氯噻嗪)和3个缓慢释放隔室(普伐他汀、阿替洛尔和雷米普利)。检测结果显示, 该复合制剂药代动力学性质明显优于普通制剂。同一时期, Khaled等[22]采用浓度均为1%的羟丙甲基纤维素2910和2208分别作为速释层和缓释层基质, 同时以羟基乙酸淀粉钠、微晶纤维素和聚丙烯酸分别作为速释层和缓释层崩解剂。最终通过3D打印技术制备的制剂是成本低廉且复杂的多层几何结构, 同时具备缓释和速释的双重释放机制, 有助于实现更具个性化的药物释放。

|
Figure 4 The structural design of the polypill |
为了实现更为有效的复合模式释药方案, 达到更加符合患者病情的释药效果, Kyobula等[23]通过3D打印具有蜂窝结构的片剂, 研究了改变“蜂窝”参数后片剂释放性质的变化, 最终结果证实了使用3D打印制备不同内部结构来实现控制释药速度的猜想。而Goyanes等[24]则研究了不同外观固体制剂对药物释放的影响, 采用FDM技术将含有4%对乙酰氨基酚的聚乙烯醇长丝打印成立方体、金字塔、圆柱体、球体和圆环体, 药物释放通过侵蚀机制完成, 释放过程中发现这些固体制剂的药物释放取决于比表面积, 控制外观形状可达到不同的释药速度。两项研究都表明, 通过3D打印技术设计制造复杂结构制剂可以实现更加个性化的复合型释药, 同时为未来3D打印工业化生产复杂结构制剂控制释药速度提供参考。
2.2 定时释药20世纪50年代“时辰药理学”概念的引入, 为制剂设计提供了新的思路。时辰药理学即是根据生物节律(呼吸心跳、昼夜节律、月经周期等)特性, 研究药物对机体作用的时间函数规律, 以期选择合适的用药时机达到更好的疗效。使用时辰药理学概念指导制备的脉冲或周期释放药物有两个核心技术难点, 分别是如何实现给药时滞和如何确保时滞后的零级或一级释药, 现阶段研究中常制作多层片剂、核-壳结构片剂、多层包衣丸剂和具有隔室的胶囊等通过设置可被生物节律性因素影响的物理屏障来构建给药时滞完成分段释药, 以该机制设计制作的多层包衣丸剂甚至能达到五段脉冲释药的效果。针对前3种剂型, 传统制剂工艺在制作时很容易出现分层或结构松散的情况, 而制作具有精巧隔室的囊壳则需要一系列复杂的工序, 3D打印技术剂量精确性和打印灵活性的特点避免了这些问题的发生。
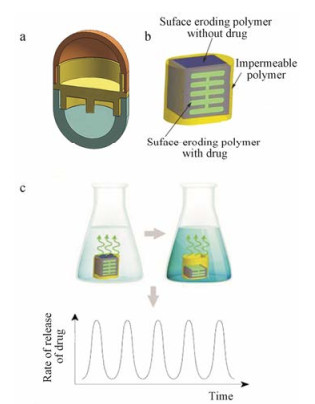
胶囊完成脉冲释药时, 3D打印技术可以在不同的隔室之间打印对节律性因素响应的材料来实现针对某项生物节律的周期性释放效果。Maroni等[25]提出了一种能够调节释放性能的囊状装置, 该结构通过FDM技术以聚乳酸和聚乙烯醇等的混合物为材料打印完成(图 5a), 分开的隔室可以递送不相容的药物或不同的药物制剂, 当组装具有不同壁厚或组成的隔室时能够产生连续的释药脉冲。在该项研究中, 3D打印技术可以通过实时调整壳层特性, 满足不同患者的需求, 实现脉冲给药的同时提高了药物治疗的个性化程度。而Melocchi等[26]使用FDM技术打印羟丙基纤维素制备了类似的侵蚀介导的口服脉冲释放囊壳, 也得到了良好的脉冲释药效果。同时, 脉冲释放也可以通过使用3D打印在聚合物基质内特定部位构建富含药物的区域来实现, 实际工业生产中可以使用多个打印头在粉末床的选定区域中沉积含有药物的溶剂, 剩余体积由单独的打印头打印少量含药聚合物基质, 最终达到期望的脉冲释放效果。利用该原理, 通过使用3D打印在固体制剂中建立分离的富含药物的层或区域可以实现双脉冲甚至多发性脉冲释药。Sun等[9]依据该原理, 使用3D打印技术制备了一种含有“鱼骨状”内芯的多层固体制剂, 该制剂主要由不溶性保护涂层、可溶性辅料和可溶性含药聚合物3部分构成(图 5b), 除了其中一侧的开口之外, 片剂在所有侧面都由不溶性保护涂层包裹。含药聚合物可以根据不同的释药要求设计成不同的形状, 由于药物释放是一维的, 速率和时间都可以依据含药聚合物形状进行调节(图 5c)。研究人员设计的“鱼骨状”含药聚合物制剂可以随着时间的推移实现连续5个释药脉冲, 达到理想的释药效果。工业级3D打印机与桌面级3D打印机相比打印速度更快、精度更高[6], 此类脉冲释药设计思路可以更便捷地完成扩大生产。
|
Figure 5 Pulse preparation[9]. a: Structure of double pulse capsule; b: Structure of "fish bone" pulse preparation; c: Impulse release curve |
靶向给药系统始终是医药行业的研究热点, 3D打印高度灵活性与个性化的特点在应用于靶向给药时也有诸多的优势。从微观层面讲, 3D打印技术可以通过细胞层面的操作打印更加个性化的药物载体实现靶向给药; 从宏观层面来说, 利用3D打印技术设备要求少、易于工业化转化的特点可以使复杂的靶向制剂迅速实现工业化。现阶段3D打印技术更多的应用于宏观层面, 以便捷地制备复杂制剂的优势来推进靶向给药的发展。Gupta等[27]利用3D打印技术制备了环境响应型的高度单分散核-壳结构胶囊, 这些胶囊由水性核心组成, 聚(乳酸共乙醇酸)外壳可以加载等离子体金纳米棒, 当使用由纳米棒长度确定的激光波长光源照射时, 胶囊会发生选择性破裂。通过外发光可以实现对空间、时间和选择性的精确控制, 该设计还能够打印2D或3D复合酶载胶囊阵列, 之后通过可调激光触发破裂的形式将活性酶释放到靶点。
除了光驱动的靶向型制剂, 传统物理定位的剂型也可以通过3D打印实现更好的疗效, 例如植入剂和胃滞留剂。3D打印可通过控制打印参数改善制剂机械强度的特点, 应用到物理定位制剂中。Kang等[28]提出了一种具有三维框架结构和水凝胶成分的混合植入型药物载体, 用于植入患者体内时有助于提高机械强度和防止免疫性应答。他们将细胞和藻酸盐凝胶注入到三维框架的内部空间, 显示了良好的机械强度, 同时为培养期间的包裹细胞提供了黏附位点。随后的研究证实了应用这种载体与治疗细胞结合的药物传递系统治疗帕金森氏病的可行性, 该结合物可连续8周释放多巴胺。通过3D打印参数的调控, 可以明显延长胃滞留剂型的作用时间以及药代动力学参数。Li等[29]通过3D打印技术打印了新型双嘧达莫低密度晶格内结构胃漂片, 同时设计了3种填充率的片剂, 以羟丙基甲基纤维素K4M和羟丙基甲基纤维素E15作为亲水剂基质; 微晶纤维素PH101作为挤出成型剂。最后通过测定机械性能、含量均匀性和重量变化对胃漂浮片进行体外评估, 此外, 还评估了漂浮能力、漂浮持续时间和药物释放行为, 结果发现制备的片剂可以持续漂浮释药超过8 h, 延长胃滞留时间的同时提高了药物的释放效果, 这些研究也证明了通过3D打印技术打印靶向制剂的便捷性, 同时为工业化生产该类剂型提供了技术参考。
2.4 其他3D打印技术不但能够控制释药时的速度、位置和时间, 而且剂量控制准确、打印灵活度高。这些特点也可以应用到中药制剂和儿童用药的研究中。传统制剂工艺制备复杂结构制剂存在一定的局限性, 中药复方制剂“君臣佐使”的理念使复方制剂中药物释放顺序及含量精确性显得尤为重要, 特别是针对一些需要微量使用的名贵或有毒药材时, 传统制剂手段就显得捉襟见肘, 现阶段工业级3D打印机精度普遍超过0.1 mm, 用于打印中药制剂时完全能够满足微量定量的临床期望[30]。当然, 3D打印技术给药个性化的特点也可以解决现阶段中药制剂不便携带和贮存、患者顺应性差等问题, 患者可以遵循医嘱将中药材粉末或者有效成分浸膏粉打印成针对自己病症的个性化制剂。儿童用药的顺应性一直是制剂研究的瓶颈, 而且不同成长阶段儿童药代动力学参数的差异也影响着儿科制剂的发展, 现阶段“儿童用量减半”的解决方案远不能满足日益多样化的用药需求, 儿童用药个性化、顺应性和精确性的问题亟待解决。Scoutaris等[31]使用FDM技术, 通过模仿Starmix糖果来制备固体制剂, 最终制备了增强顺应性的儿科药物, 后续的研究结果也显示其良好的药物释放。这一思路为儿童用药顺应性问题提供了新的解决方案, 相信随着药代动力学的发展和桌面级3D打印机的普及, 儿童用药用量问题也能依靠3D打印技术得到更好的解决。
3 前景与挑战在给药系统的研究过程中, 3D打印可以通过打印材料的选择、黏合剂的改变和工艺参数的调节来控制研究对象的外观形状、内部结构、各区域材料组成、微观孔隙的物理强度、药物的散布区域和不同药物组分的准确定位等因素, 从而更加准确地控制药物释放的速率、起释时间、释药周期、释药量及体内释药位置等, 在提高药物的疗效、减少毒副作用的同时增加患者顺应性。进一步的研究发现, 通过计算机辅助设计为单个患者制定理想化的治疗方案是可行的[32], 相信随着3D打印技术的不断更新及在制剂设计中的深入研究, 更多、更有效地给药方案将被提出并应用于工业化。
3D打印技术在制剂设计领域备受瞩目, 但依然无法掩盖现阶段使用3D打印技术制备的上市制剂少这一事实。由ZIP DOSE技术设计制备的速溶片获得FDA批准确实是个振奋人心的消息, 但是距离实现由3D打印技术引领的制剂设计与工程化应用领域的“井喷式”发展还很远。现阶段还有很多问题制约着3D打印制剂工程化应用, 首先是材料问题, 根据不同技术原理设计的3D打印机越来越多, 可以大规模应用于制剂领域的却寥寥无几, 深层次的原因就是可打印材料受限, 毒副作用是限制其他领域材料进入制剂领域的鸿沟; 其次是价格问题, 成本始终是制剂工业化考量的重要一项, 某些耗材不可重复利用产生的成本增加也会影响3D打印制剂工业化进程; 最后是打印精度问题, 现阶段3D打印在制剂领域的应用很少, 涉及注射剂的原因之一就是打印精度低, 无法达到理想的细胞和分子层面, 也很难打印更加精巧的药物释放载体。相信随着新型材料的深入研究及3D打印技术的不断改良, 3D打印技术在制剂设计和工程化领域的应用必将走上新的台阶。
| [1] | Petzold R, Zeilhofer HF, Kalender WA. Rapid prototyping technology in medicine-basics and applications[J]. Comput Med Imag Grap, 1999, 23: 277–284. DOI:10.1016/S0895-6111(99)00025-7 |
| [2] | Zhang Q. From the approving of 3D printing tablet to the innovation of drug delivery systems[J]. Acta Pharm Sin (药学学报), 2016, 51: 1655–1658. |
| [3] | Sachs EM, Haggerty JS, Cima MJ, et al. Three-dimensional printing techniques: US, 5204055[P]. 1993-04-20. |
| [4] | Landers R, Mülhaupt R. Desktop manufacturing of complex objects, prototypes and biomedical scaffolds by means of computer-assisted design combined with computer-guided 3D plotting of polymers and reactive oligomers[J]. Macromol Mater Eng, 2000, 282: 17–21. DOI:10.1002/1439-2054(20001001)282:1<17::AID-MAME17>3.0.CO;2-8 |
| [5] | Acosta-Vélez GF, Linsley CS, Craig MC, et al. Photocurable bioink for the inkjet 3D pharming of hydrophilic drugs[J]. Bioengineering, 2017, 4: 11. DOI:10.3390/bioengineering4010011 |
| [6] | Goyanes A, Buanz AB, Hatton GB, et al. 3D printing of modified-release aminosalicylate (4-ASA and 5-ASA) tablets[J]. Eur J Pharm Biopharm, 2015, 89: 157–162. DOI:10.1016/j.ejpb.2014.12.003 |
| [7] | Goyanes A, Chang H, Sedough D, et al. Fabrication of controlled-release budesonide tablets via desktop (FDM) 3D printing[J]. Int J Pharm, 2015, 496: 414–420. DOI:10.1016/j.ijpharm.2015.10.039 |
| [8] | Van Noort R. The future of dental devices is digital[J]. Dent Mater, 2012, 28: 3–12. DOI:10.1016/j.dental.2011.10.014 |
| [9] | Sun Y, Soh S. Printing tablets with fully customizable release profiles for personalized medicine[J]. Adv Mater, 2015, 27: 7847–7853. DOI:10.1002/adma.201504122 |
| [10] | Wang J, Goyanes A, Gaisford S, et al. Stereolithographic (SLA) 3D printing of oral modified-release dosage forms[J]. Int J Pharm, 2016, 503: 207–212. DOI:10.1016/j.ijpharm.2016.03.016 |
| [11] | Fu Y, Yang S, Jeong SH, et al. Orally fast disintegrating tablets:developments, technologies, taste-masking and clinical studies[J]. Crit Rev Ther Drug Carrier Syst, 2004, 21: 433–476. DOI:10.1615/CritRevTherDrugCarrierSyst.v21.i6 |
| [12] | Wunner FM, Bas O, Saidy NT, et al. Melt electrospinning writing of three-dimensional poly(ε-caprolactone) scaffolds with controllable morphologies for tissue engineering applications[J]. J Vis Exp, 2017. DOI:10.3791/56289 |
| [13] | Clark EA, Alexander MR, Irvine DJ, et al. 3D printing of tablets using inkjet with UV photoinitiation[J]. Int J Pharm, 2017, 529: 523–530. DOI:10.1016/j.ijpharm.2017.06.085 |
| [14] | Au AK, Huynh W, Horowitz LF, et al. 3D-printed microflu idics[J]. Angew Chem Int Ed, 2016, 55: 3862–3881. DOI:10.1002/anie.201504382 |
| [15] | Whitley B. Novel three-dimensional modeling technology for advanced simulation, printing, and casting of A356 impeller[J]. Int J Metalcast, 2013, 7: 57–59. DOI:10.1007/BF03355546 |
| [16] | Lu S, Anseth KS. Photopolymerization of multilaminated poly (HEMA) hydrogels for controlled release[J]. J Control Release, 1999, 57: 291–300. DOI:10.1016/S0168-3659(98)00125-4 |
| [17] | Hunan Huasheng Hi-Tech Co., Ltd. has broken through core technologies and promoted in-depth application[J]. Ind Technol Innov, 2017, 04: 137-139. |
| [18] | Sadia M, Arafat B, Ahmed W, et al. Channelled tablets:an innovative approach to accelerating drug release from 3D printed tablets[J]. J Control Release, 2018, 269: 355–363. DOI:10.1016/j.jconrel.2017.11.022 |
| [19] | Skowyra J, Pietrzak K, Alhnan MA. Fabrication of extended- release patient-tailored prednisolone tablets via fused deposition modelling (FDM) 3D printing[J]. Eur J Pharm Sci, 2015, 68: 11–17. DOI:10.1016/j.ejps.2014.11.009 |
| [20] | Shirazi SF, Gharehkhani S, Mehrali M, et al. A review on powder-based additive manufacturing for tissue engineering:selective laser sintering and inkjet 3D printing[J]. Sci Technol Adv Mater, 2015, 16: 033502. DOI:10.1088/1468-6996/16/3/033502 |
| [21] | Khaled SA, Burley JC, Alexander MR, et al. 3D printing of five-in-one dose combination polypill with defined immediate and sustained release profiles[J]. J Control Release, 2015, 217: 308–314. DOI:10.1016/j.jconrel.2015.09.028 |
| [22] | Khaled SA, Burley JC, Alexander MR, et al. Desktop 3D printing of controlled release pharmaceutical bilayer tablets[J]. Int J Pharm, 2014, 461: 105–111. DOI:10.1016/j.ijpharm.2013.11.021 |
| [23] | Kyobula M, Adedeji A, Alexander MR, et al. 3D inkjet printing of tablets exploiting bespoke complex geometries for controlled and tuneable drug release[J]. J Control Release, 2017, 261: 207–215. DOI:10.1016/j.jconrel.2017.06.025 |
| [24] | Goyanes A, Robles Martinez P, Buanz A, et al. Effect of geometry on drug release from 3D printed tablets[J]. Int J Pharm, 2015, 494: 657–663. DOI:10.1016/j.ijpharm.2015.04.069 |
| [25] | Maroni A, Melocchi A, Parietti F, et al. 3D printed multi- compartment capsular devices for two-pulse oral drug delivery[J]. J Control Release, 2017, 268: 10–18. DOI:10.1016/j.jconrel.2017.10.008 |
| [26] | Melocchi A, Parietti F, Loreti G, et al. 3D printing by fused deposition modeling (FDM) of a swellable/erodible capsular device for oral pulsatile release of drugs[J]. J Drug Deliv Sci Technol, 2015, 30: 360–367. DOI:10.1016/j.jddst.2015.07.016 |
| [27] | Gupta MK, Meng F, Johnson BN, et al. 3D printed programmable release capsules[J]. Nano Lett, 2015, 15: 5321–5329. DOI:10.1021/acs.nanolett.5b01688 |
| [28] | Kang KS, Lee SI, Hong JM, et al. Hybrid scaffold composed of hydrogel/3D-framework and its application as a dopamine delivery system[J]. J Control Release, 2014, 175: 10–16. DOI:10.1016/j.jconrel.2013.12.002 |
| [29] | Li Q, Guan X, Cui M, et al. Preparation and investigation of novel gastro-floating tablets with 3D extrusion-based printing[J]. Int J Pharm, 2018, 535: 325–332. DOI:10.1016/j.ijpharm.2017.10.037 |
| [30] | Bell CK, Sahl EF, Kim YJ, et al. Accuracy of implants placed with surgical guides:thermoplastic versus 3D printed[J]. Int J Periodont Restorative Dent, 2018, 38: 113–119. DOI:10.11607/prd.3254 |
| [31] | Scoutaris N, Ross SA, Douroumis D, et al. 3D printed "Starmix" drug loaded dosage forms for paediatric applications[J]. Pharm Res, 2018, 35: 34. DOI:10.1007/s11095-017-2284-2 |
| [32] | Goyanes A, Scarpa M, Kamlow M, et al. Patient acceptability of 3D printed medicines[J]. Int J Pharm, 2017, 530: 71–78. DOI:10.1016/j.ijpharm.2017.07.064 |
 2018, Vol. 53
2018, Vol. 53