2. 首都医科大学中医药学院, 北京 100069;
3. 首都医科大学中医络病研究北京市重点实验室, 北京 100069;
4. 中国中医科学院中药资源中心, 北京 100700
2. School of Traditional Chinese Medicine, Capital Medical University, Beijing 100069, China;
3. Beijing Key Lab of TCM Collateral Disease Theory Research, Capital Medical University, Beijing 100069, China;
4. National Resource Center for Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China
二萜类化合物属于天然化合物中种类丰富的一大类群, 具有多样的生理功能和工业、医用价值, 比如植物激素, 光合色素以及作为工业原料和药品使用等[1, 2]。目前, 大量的二萜化合物在高等、低等植物, 以及真菌、细菌等微生物中被发现报道, 如雷公藤甲素[3]、银杏二萜内酯[4]、lepistal[5]等。二萜化合物结构多样, 其初始生物合成源于简单的异戊二烯单元(C5)、异戊烯基二磷酸(isopentenyl pyrophosphate, IPP)和其异构体二甲丙烯二磷酸(dimethylallyl pyrophosphate, DMAPP)[6]。4个IPP和DMAPP发生1'-4缩合反应, 从而延伸碳链形成二萜的前体物质香叶基香叶基焦磷酸[(E, E, E,)-geranylgeranyl pyro phosphate, GGPP, C20][7]。二萜合酶, 又称为二萜环化酶, 是一类具有催化链状前体GGPP环化, 形成二萜环状基本骨架的关键酶。二萜合酶的环化方式决定了二萜化合物的结构和其立体化学多样性[8, 9];因而, 一直以来, 国内外学者致力于发现和鉴定新型的二萜合酶; 近几年, 随着晶体结构学在二萜合酶研究领域的应用, 对于一些重要的植物二萜合酶, 研究人员已经从蛋白晶体结构角度深入探索, 揭示其催化机制和选择性。本文对近年来有关二萜合酶的分类、作用机制, 尤其是新近解析的植物二萜合酶蛋白结构、结构与功能关联性等方面进行综述。
1 二萜合酶的分类二萜合酶根据其功能域可分为两大类: Class Ⅰ类和Class Ⅱ类。Class Ⅱ类二萜合酶特征功能域是DXDD, 这个富含天冬氨酸的催化功能域在二萜合酶中是保守的[10]; GGPP在Class Ⅱ类二萜合酶催化下, 选择性地生成带有特殊立体构象的环状烃类结构, 如产物柯巴基焦磷酸(copalyl diphosphate, CPP), 目前已知的有nor-CPP、ent-CPP、syn-CPP三种不同的构象[11-13]。而Class Ⅰ类二萜合酶包含DDXXD功能域, 可修饰或者重排Class Ⅱ类二萜合酶的催化产物, 进一步环化生成相应的骨架结构(图 1)[14]。在微生物或低等植物中还存在着一类双功能二萜合酶, 同时具有Class Ⅰ和Class Ⅱ的特征功能域, 这种明显的功能域的融合使其同时具有催化两步反应的作用。Kawaide等[15]发现真菌Phaeosphaeria sp. L487中的双功能酶, 直接催化GGPP生成KS, 参与到赤霉素的生物合成途径当中; Hayashi等[16]在小立碗藓中克隆得到CPS/KS双功能酶, 同时具有DVDD和DDYFD功能域; Hall等[17]研究短叶松和美国黑松中发现其既含有双功能的Class Ⅰ/Class Ⅱ二萜合酶, 又含有单功能的Class Ⅰ二萜合酶, 从系统进化关系上, 此单功能的二萜合酶是从双功能的二萜合酶分值进化而来, 并非与被子植物的赤霉素途径相关代谢酶归为一类。

|
Figure 1 Clustal W alignment of the amino acid sequences of several Class Ⅰ, Class Ⅱ, and bifunctional diterpene synthases. Conserved catalytic motifs are highlighted, that is, DXDD and DDXXD. Sequence data: AtCPS, NP_192187.1| Ent-copalyl diphosphate synthase [Arabidopsis thaliana]; SmCPS, ABV57835.1 copalyl diphosphate synthase [Salvia miltiorrhiza]; SlCPS, BAA84918.1 copalyl diphosphate synthase [Solanum lycopersi cum]; TwCPS, AQW38541.1 copalyl diphosphate synthase 4 [Tripterygium wilfordii]; AtKS, NP_178064.1| Ent-kaur-16-ene synthase [Arabidopsis thaliana]; OsKSL, Q2QQJ5.2|KSL10_ ORYSJ AltName: Full = Ent-kaurene synthase-like 10; Short = OsKSL10; HaKS, CBL42917.1 kaurene synthase [Helianthus annuus]; SmKS, ABV08817.1 kaurene synthase [Salvia miltior rhiza]; AgAS, Q38710.1|TPSDV_ABIGR AltName: Full = (-)- abieta-7(8), 13(14)-diene synthase; GbLS, AAL09965.1|AF331704_1 levopimaradiene synthase [Ginkgo biloba]; SmMDS, BAL41682.1 miltiradiene synthase [Selaginellamoellendorffii]; PpKS, BAF61135.1 ent-kaurene synthase [Physcomitrella patens] |
Class Ⅰ类环化酶包含DDXXD和(N, D) DXX (S, T) XXXE功能域, 其催化反应涉及二磷酸基团的初始离子化和碳正离子中间体的形成[18]。功能域中黑体部分氨基酸一般认为是结合3个Mg2+, 触发底物上二磷酸基团离子化的关键残基[19]。二磷酸基团离子化后, 形成活化的碳正离子中间体, 然后与双键或者水分子反应, 完成环化反应[19, 20]。而Class Ⅱ类环化酶, 如对映柯巴基焦磷酸合酶[ent-copalyldiphos phateynthases (CPS)], 包含DXDD功能域, 天冬氨酸靠近底物GGPP/CPP的异戊烯基双键, 发生质子化反应形成碳正离子; 位于中间位置的天冬氨酸是质子化反应的关键氨基酸[21]。初始质子化后, 在异戊烯基碳链上接着级联反应, 发生多步环化。最终, 质子经消除反应形成双键或被亲核基团俘获, 结束反应[22]。双功能二萜合酶, 如AgAS (图 1), 催化初始的GGPP环化成(+)-CPP, 随后离子化环化形成松香烷型二萜骨架[23]。
3 植物二萜合酶的功能和系统进化在植物体内, 二萜合酶是二萜类化合物生物合成途径上重要的关键酶, 从其催化机制上可以知道它对底物GGPP (C20)有一步或多步环化的功能, 包括两环、三环; 五元环、六元环、七元环等不同的环状结构, 对二萜化合物的多样性有重要的影响力[24]。系统进化树(图 2)显示, 二萜合酶的双功能酶位于Class Ⅰ合酶的相近分支之中, 相对更古老一些, 主要存在于裸子植物、低等植物和真菌体内[25]。在高等植物体内, Class Ⅰ和Class Ⅱ二萜合酶虽然是单功能的二萜合酶, 但是仍保留有双功能酶相似的3个结构, α、β和γ螺旋[26]。一般认为, 古老的二萜合酶基因是以双功能酶的形式存在的, 在进化过程中, 经过不断的复制和亚功能化, 导致出现多样的Class Ⅰ和Class Ⅱ二萜合酶。在真菌或细菌中, 一些仅含有βγ、α的二萜合酶被发现之后, 进一步证实了二萜合酶进化过程的复制和亚功能化学说[27, 28] (图 3)。
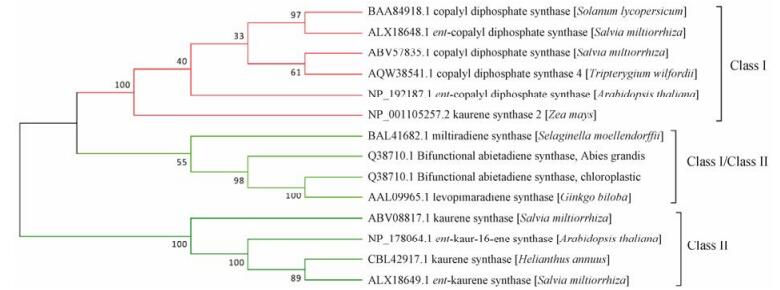
|
Figure 2 Phylogenetic analysis of several Class Ⅰ, Class Ⅱ, and bifunctional diterpene synthases |

|
Figure 3 Superimposition of the overall structure of diterpene synthases. a: Overall structure of ent-copalyl diphosphate synthase PtmT2 from Streptomycs platensis Cb00739 has two domains (βγ; PDB number: 5BP8); b: Overall structure of ent- kaurene synthase (BjKS) from Bradyrhizobium japonicum has single domain (α; PDB number: 4W4R); c: Superimposition of BjKS with taxadiene synthase (TAX) from Taxus brevifolia. Overall structure of TAX has three domains (αβγ; PDB number: 3P5R) |
二萜合酶的多样功能与其内在的蛋白结构密切相关, 从结构生物学和生物化学角度研究二萜合酶蛋白, 对解析二萜合酶的催化机制、功能特点、进化关系具有重要意义。随着越来越多的二萜合酶被挖掘并确定功能, 在二萜合酶蛋白结构上也有了一些前沿的研究, 目前已知有6种二萜合酶的结构得到解析(表 1)。
| Table 1 Summary of diterpene synthase with crystal structure |
拟南芥是植物研究领域常用的模式植物, 其萜类合成途径关键酶常有报道, 包括倍半萜合酶, 二萜合酶CPS和KS等[29-31]。Koksal等[20]对拟南芥中对映柯巴基焦磷酸合酶的结构和催化机制进行研究, 分别得到了AtCPS蛋白与GGPP相似物的复合物晶体, 分辨率为2.25 Å (1 Å = 0.1 nm)和1.55 Å的晶体(图 4);以及AtCPS蛋白与ent-CPP相似物的复合物晶体, 分辨率为2.76 Å[21]。GGPP相似物为(S)-15-aza-14, 15-dihydrogeranyl geranyl thiolodiphosphate (AGP), 与实际的底物相比, 在1号碳位置, 通过硫原子与二磷酸基团连接; 14号由氮原子替代了碳原子, 因而与蛋白不发生发应, 且与GGPP立体化学结构相近[32]。结构解析发现AtCPS蛋白具有三个α-螺旋结构域(α、β和γ), 但是其只具有催化GGPP的单功能酶活性, 活性位点位于β和γ区域的界面, 其中DID379D结构域中的后两个天冬氨酸与AGP距离较近(图 4)。而α结构域上缺乏和金属离子结合的区域, 这是Class Ⅰ类二萜合酶离子化所必须的; 但是功能缺失的α结构域在进化中仍保留在拟南芥的二萜合酶基因中[20, 21]。
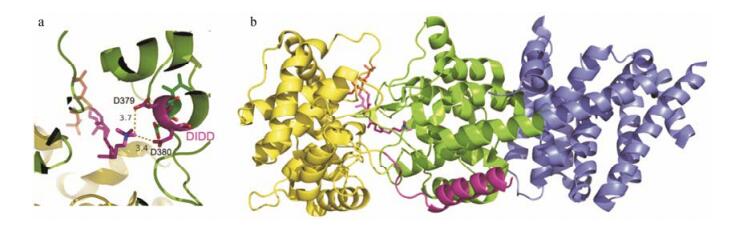
|
Figure 4 Binding of AGP at packing interface of AtCPS structure. a: Cut away view of the packing interface leading to general acid D379 and D380; b: Overall structure of ent-copalyl diphosphate synthase AtCPS from Arabidopsis thaliana Cb00739 (PDB number: 3pya). Color-coded as follows: α domain = blue, β domain = green, γ domain = yellow, N terminal helix= purple, ligand and contiguous acid = magenta |
红豆杉科植物含有丰富的二萜类化合物, 东北红豆杉、曼地亚红豆杉等[33, 34]均含有几十种紫杉烷二萜类化合物; 其中知名而重要的化合物紫杉醇不仅具有促进微管蛋白聚合作用, 还在癌症化疗中具有显著的疗效[35, 36]。紫杉醇的第一步关键合成步骤在于异戊烯基底物GGPP经紫杉合酶(taxadiene synthase from Taxus brevifolia, TbTS)环化, 生成taxa-4(5), 11(12)diene。Koksal等[37]对TbTS的蛋白结构进行研究, 获得了截短体蛋白与GGPP相似物的复合物晶体, 分辨率为1.82 Å;以及TbTS截短体蛋白和FPP相似物的复合物晶体, 分辨率为2.25 Å。TbTS晶体结构揭示了蛋白结构域的组成, 包括三个α-螺旋结构域(图 3)。在蛋白的C末端, 存在Class Ⅰ二萜环化酶的催化功能域, 由两个α-螺旋结构域组成了一个可以结合底物的活性口袋, 在三个金属离子簇下, 结合和活化底物GGPP; 而在N端, 还有另一个插入的结构域, 是Class Ⅱ二萜环化酶的折叠区域, 具有启动质子化的功能。TbTS结构揭示了首个双功能二萜合酶上的两个不同活性功能域值。
4.3 巨冷杉(Abies grandis)巨冷杉中同时含有Class Ⅰ类和Class Ⅱ类以及双功能二萜合酶。其中, 松香二烯合酶, AgAS是一个双功能的二萜合酶, 其晶体结构分辨率为2.3 Å。AgAS蛋白由3个区域组成(α、β和γ)[38], 这个组成和单功能二萜合酶, 如拟南芥AtCPS蛋白的组成相一致[19]。Class Ⅱ类二萜合酶的活性区域的模拟蕴含更多丰富的信息, 观察到良好的外部循环迁移。这种“循环”的构象不仅限制了溶剂通道也大大增加了配体进入构象的数量, 在基底中存在的“循环”构象中的非生产性底物构象不稳定的状态。此外, 这些在Class Ⅱ类蛋白活性区域的构象变化对主动将底物驱动到提出的过渡状态。AgAS结构提供了Class Ⅰ和Class Ⅱ类二萜合酶的催化反应的分子机制, 还对研究植物萜类合酶的进化奠定了基础。
5 其他二萜合酶蛋白结构二萜类化合物是自然界中结构多样的天然产物, 然而它在细菌中的分布仍未得到充分研究。大多数植物二萜合酶由3个α螺旋结构组成(α、β和γ), 被认为是起源于古老细菌中不连续的Class Ⅰ类萜类合酶(α)和Ⅱ型萜类合酶(β和γ)的融合。细菌起源的Class Ⅱ类二萜合酶相关结构研究较少, 是萜类合酶结构进化中的缺失部分。Jeffery等[27]研究链霉菌(Streptomyces platensis CB00739)中Class Ⅱ二萜合酶PtmT2的晶体结构。PtmT2具有催化GGPP生成对映柯巴基焦磷酸(ent-CPP)的功能, 并参与了平板霉素和平板素的生物合成。PtmT2的晶体分辨率为1.80 Å (图 3)。但是蛋白与底物的复合晶体并未获得, 只是通过已有蛋白晶体结构, 分子对接预测表明催化GGPP过程和关键位点; 然后点突变确认了涉及结合GGPP二磷酸基团的K402位点和DXXXXE是潜在的Mg2+结合区域。PtmT2的结构为进一步了解细菌来源的萜类合酶、机制以及在萜类合酶进化过程中的角色奠定了基础。
Tomita等[39]在2017年新得到了黑孢链霉菌(Streptomyces melanosporofaciens MI614-43F2)二萜环化酶CotB2的晶体结构, 其产物较为特殊, 是三环二萜结构, 5-8-5稠环骨架结构。晶体结构进一步展现了GGPP类似物折叠成独特的S形结合在蛋白中。在GGPP离子化之前, 其周围环绕着疏水性的氨基酸残基, 以及几个芳香族和天冬酰胺残基, 起到稳定一系列反应中碳阳离子中间体的作用(图 5)。依据结构信息, 对F107、N103、F149、F185、W186、W288进行多种突变, 突变体可生成7种新的骨架结构。
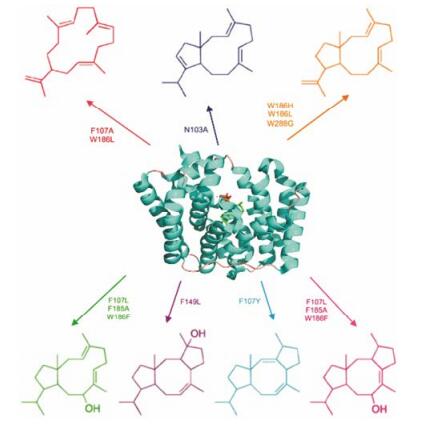
|
Figure 5 Active site mutations of cyclooctatenol synthase (CotB2) (PDB number: 4OMG) to generate alternative diterpene products |
大豆根瘤菌(Bradyrhizobium japonicum)中存在Class Ⅰ类二萜环化酶, 对映贝壳杉烯合酶(BjKS), BjKS具有催化对映贝壳杉烯生成贝壳杉烯的功能[28]。目前BjKS蛋白已经获得, 分辨率为1.9~2.0 Å。蛋白仅仅由一个α螺旋结构组成, 这个结果与许多植物二萜环化酶可能来自细菌二萜环化酶一致, BjKS以二聚体的形式存在, 如图 6所示。BjKS蛋白的结合口袋是疏水性的, 由天冬氨酸和精氨酸这类侧链为芳香基团组成, 可以特异性结合底物GGPP类似物, 而形成的碳正离子由Leu、Tyr和Phe残基保护; 产物类似物BPH-629也可特异性结合在此疏水口袋中(图 6)。点突变实验验证DDXXD的重要性, 同时发现, R204是高度保守的功能位点, 突变后蛋白活性显著降低。
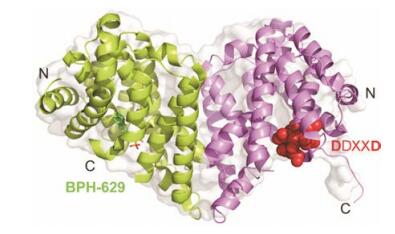
|
Figure 6 Dimer structure of ent-kaurene synthase from Bradyrhizobium japonicum. PDB number: 4W4S WT, the bisphosphonate inhibitor, BPH-629 and the catalytic motifs DDXXD, red are shown |
二萜合酶的结构多是α、αβγ、βγ等模块化结构域组成, 其在真菌、裸子植物和被子植物中模块化结构域和分类具有各自的特点。因而, 对二萜合酶蛋白的研究尚需要许多新的晶体结构信息。然后, 受限于蛋白质晶体的形成、二萜合酶反应的底物和产物小分子的获取, 目前得到结构解析的二萜合酶仍然较少, 仅为表 1中的6种。随着这一研究热点的持续性拓展, 利用合成生物学、化学合成等手段有助于获得底物和产物小分子; 此外, 利用同位素标记技术, 可极大丰富我们对于催化机制的研究, 有助于定位行使催化功能的关键氨基酸位点。随着研究人员的深入研究及技术的不断更新, 二萜合酶的结构和功能将更多地被探明, 二萜合酶在植物进化中的发展规律也将越来越清晰。
二萜类化合物不仅在生物与生物之间相互作用具有重要作用; 而且在医学、工业、农业等方面应用广泛[40]。二萜合酶是二萜成分多样性的重要原因, 研究这类决定二萜类化合物基本骨架和立体构象的合酶, 对于整体研究二萜化合物的生物合成途径以及通过生物工程手段合成二萜化合物具有重要意义和价值[41]。此外, 在功能研究上, 通过对植物或真菌的二萜环化酶进行活性位点替代和化学策略, 可以组合催化多样的类异戊二烯环化反应, 对于生物合成已有重大价值化合物和产生新的化合物具有重要意义。
| [1] | Bian G, Deng Z, Liu T. Strategies for terpenoid overproducetion and new terpenoid discovery[J]. Curr Opin Biotechnol, 2017, 48: 234–241. DOI:10.1016/j.copbio.2017.07.002 |
| [2] | Guo Q, Major IT, Howe GA. Resolution of growth-defense conflict:mechanistic insights from jasmonate signaling[J]. Curr Opin Plant Biol, 2018, 44: 72–81. DOI:10.1016/j.pbi.2018.02.009 |
| [3] | Zhao F. Study on the Mechanism of Triptolide-Induced Apoptosis and Autophagy in Cancer Cells (雷公藤甲素诱导肿瘤细胞凋亡和自噬的分子机制研究)[D]. Yangling: Northwest A & F University, 2016. |
| [4] | Ye B, Aponte M, Dai Y, et al. Ginkgo biloba and ovarian cancer prevention:epidemiological and biological evidence[J]. Cancer Lett, 2007, 251: 43–52. DOI:10.1016/j.canlet.2006.10.025 |
| [5] | Shen JW, Ruan Y, Ma BJ. Diterpenoids of macromycetes[J]. J Basic Microbiol, 2009, 49: 242–255. DOI:10.1002/jobm.v49:3 |
| [6] | Cheng Q, Tong Y, Wang Z, et al. Molecular cloning and functional identification of a cDNA encoding 4-hydroxy-3- methylbut-2-enyl diphosphate reductase from Tripterygium wilfordii[J]. Acta Pharm Sin B, 2017, 7: 208–214. DOI:10.1016/j.apsb.2016.12.002 |
| [7] | He Y, Gao W, Liu T, et al. Research advances of diterpene synthase[J]. Acta Pharm Sin (药学学报), 2011, 46: 1019–1025. |
| [8] | Wu Y, Zhou K, Toyomasu T, et al. Functional characterization of wheat copalyl diphosphate synthases sheds light on the early evolution of labdane-related diterpenoid metabolism in the cereals[J]. Phytochemistry, 2012, 84: 40–46. DOI:10.1016/j.phytochem.2012.08.022 |
| [9] | Jia M, Tufts S, Schulte S, et al. A pair of residues that interactively affect diterpene synthase product outcome[J]. Acs Chem Biol, 2017, 12: 862–867. DOI:10.1021/acschembio.6b01075 |
| [10] | Sallaud C, Giacalone C, Topfer R, et al. Characterization of two genes for the biosynthesis of the labdanediterpene Z-abienol in tobacco (Nicotianatabacum) glandular trichomes[J]. Plant J, 2012, 72: 1–17. DOI:10.1111/tpj.2012.72.issue-1 |
| [11] | Su P, Guan H, Zhao Y, et al. Identification and functional characterization of diterpene synthases for triptolide biosynthesis from Tripterygium wilfordii[J]. Plant J, 2018, 93: 50–65. DOI:10.1111/tpj.2018.93.issue-1 |
| [12] | Fu J, Ren F, Lu X, et al. A tandem array of ent-kaurene synthases in maize with roles in gibberellin and more specialized metabolism[J]. Plant Physiol, 2016, 170: 742–751. DOI:10.1104/pp.15.01727 |
| [13] | Potter KC, Jia M, Hong YJ, et al. Product rearrangement from altering a single residue in the rice syn-copalyl diphosphate synthase[J]. Org Lett, 2016, 18: 1060–1063. DOI:10.1021/acs.orglett.6b00181 |
| [14] | Zhou YJ, Gao W, Rong Q, et al. Modular pathway engineering of diterpenoid synthases and the mevalonic acid pathway for miltiradiene production[J]. J Am Chem Soc, 2012, 134: 3234–3241. DOI:10.1021/ja2114486 |
| [15] | Kawaide H, Imai R, Sassa T, et al. Ent-kaurene synthase from the fungus Phaeosphaeria sp. L487. cDNA isolation, characterization, and bacterial expression of a bifunctional diterpene cyclase in fungal gibberellin biosynthesis[J]. J Biol Chem, 1997, 272: 21706–21712. DOI:10.1074/jbc.272.35.21706 |
| [16] | Hayashi K, Kawaide H, Notomi M, et al. Identification and functional analysis of bifunctional ent-kaurene synthase from the moss Physcomitrella patens[J]. FEBS Lett, 2006, 580: 6175–6181. DOI:10.1016/j.febslet.2006.10.018 |
| [17] | Hall DE, Zerbe P, Jancsik S, et al. Evolution of conifer diterpene synthases:diterpene resin acid biosynthesis in lodgepole pine and jack pine involves monofunctional and bifunctional diterpene synthases[J]. Plant Physiol, 2013, 161: 600–616. DOI:10.1104/pp.112.208546 |
| [18] | Meguro A, Tomita T, Nishiyama M, et al. Identification and characterization of bacterial diterpenecyclases that synthesize the cembrane skeleton[J]. ChemBioChem, 2013, 14: 316–321. DOI:10.1002/cbic.v14.3 |
| [19] | Christianson DW. Structural biology and chemistry of the terpenoidcyclases[J]. Chem Rev, 2006, 106: 3412–3442. DOI:10.1021/cr050286w |
| [20] | Koksal M, Hu H, Coates RM, et al. Structure and mechanism of the diterpene cyclase ent-copalyl diphosphate synthase[J]. Nat Chem Biol, 2011, 7: 431–433. DOI:10.1038/nchembio.578 |
| [21] | Koksal M, Potter K, Peters RJ, et al. 1.55Å-resolution structure of ent-copalyl diphosphate synthase and exploration of general acid function by site-directed mutagenesis[J]. Biochim Biophys Acta, 2014, 1840: 184–190. DOI:10.1016/j.bbagen.2013.09.004 |
| [22] | Reuben P. Structure and evolution guided investigations of terpene synthase mechanism (769.11)[J]. FASEB J, 2014, 28: 769–711. |
| [23] | Tholl D. Terpene synthases and the regulation, diversity and biological roles of terpene metabolism[J]. Curr Opin Plant Biol, 2006, 9: 297–304. DOI:10.1016/j.pbi.2006.03.014 |
| [24] | Trapp SC, Croteau RB. Genomic organization of plant terpene synthases and molecular evolutionary implications[J]. Genetics, 2001, 158: 811–832. |
| [25] | Banks JA, Nishiyama T, Hasebe M, et al. The Selaginella genome identifies genetic changes associated with the evolution of vascular plants[J]. Science, 2011, 332: 960–963. DOI:10.1126/science.1203810 |
| [26] | Jia M, Peters RJ. Extending a single residue switch for abbreviating catalysis in plant ent-kaurene synthases[J]. Front Plant Sci, 2016, 7: 1765. |
| [27] | Rudolf JD, Dong LB, Cao H, et al. Structure of the ent-copalyl diphosphate synthase PtmT2 from Streptomyces platensis CB00739, a bacterial type Ⅱ diterpene synthase[J]. J Am Chem Soc, 2016, 138: 10905–10915. DOI:10.1021/jacs.6b04317 |
| [28] | Liu W, Feng X, Zheng Y, et al. Structure, function and inhibition of ent-kaurene synthase from Bradyrhizobium japonicum[J]. Sci Rep, 2014, 4: 6214. |
| [29] | Aubourg S, Lecharny A, Bohlmann J. Genomic analysis of the terpenoid synthase (AtTPS) gene family of Arabidopsis thaliana[J]. Mol Genet Genomics, 2002, 267: 730–745. DOI:10.1007/s00438-002-0709-y |
| [30] | Tholl D, Chen F, Petri J, et al. Two sesquiterpene synthases are responsible for the complex mixture of sesquiterpenes emitted from Arabidopsis flowers[J]. Plant J, 2005, 42: 757–771. DOI:10.1111/tpj.2005.42.issue-5 |
| [31] | Roy A, Roberts FG, Wilderman PR, et al. 16-Aza-ent-beyerane and 16-aza-ent-trachylobane:potent mechanism-based inhibitors of recombinant ent-kaurene synthase from Arabidopsis thaliana[J]. J Am Chem Soc, 2007, 129: 12453–12460. DOI:10.1021/ja072447e |
| [32] | Mann FM, Prisic S, Hu H, et al. Characterization and inhibition of a class Ⅱ diterpene cyclase from Mycobacterium tuberculosis:implications for tuberculosis[J]. J Biol Chem, 2009, 284: 23574–23579. DOI:10.1074/jbc.M109.023788 |
| [33] | Shen T, Qiu F, Chen M, et al. Cloning and functional characterization of a cDNA encoding isopentenyl diphosphate isomerase involved in taxol biosynthesis in Taxus media[J]. Acta Pharm Sin (药学学报), 2015, 50: 621–626. |
| [34] | Wu D, Li YN, Wu LJ, et al. Isolation and identification of chemical constituents from Taxus cuspidta Sibe et Zucc[J]. Acta Pharm Sin (药学学报), 2010, 45: 1398–1401. |
| [35] | Kai G, Zhao L, Zhang L, et al. Characterization and expression profile analysis of a new cDNA encoding taxadiene synthase from Taxus media[J]. J Biochem Mol Biol, 2005, 38: 668–675. |
| [36] | Mei M, Xie D, Zhang Y, et al. A new 2alpha, 5alpha, 10beta, 14beta-tetraacetoxy-4(20), 11-taxadiene (SIA) derivative overcomes paclitaxel resistance by inhibiting MAPK signaling and increasing paclitaxel accumulation in breast cancer cells[J]. PLoS One, 2014, 9: e104317. DOI:10.1371/journal.pone.0104317 |
| [37] | Koksal M, Jin Y, Coates RM, et al. Taxadiene synthase structure and evolution of modular architecture in terpene biosynthesis[J]. Nature, 2011, 469: 116–120. DOI:10.1038/nature09628 |
| [38] | Zhou K, Gao Y, Hoy JA, et al. Insights into diterpene cyclization from structure of bifunctional abietadiene synthase from Abiesgrandis[J]. J Biol Chem, 2012, 287: 6840–6850. DOI:10.1074/jbc.M111.337592 |
| [39] | Tomita T, Kim SY, Teramoto K, et al. Structural insights into the CotB2-catalyzed cyclization of geranylgeranyl diphosphate to the diterpene cyclooctat-9-en-7-ol[J]. ACS Chem Biol, 2017, 12: 1621–1628. DOI:10.1021/acschembio.7b00154 |
| [40] | Andersen-Ranberg J, Kongstad KT, Nielsen MT, et al. Expanding the landscape of diterpene structural diversity through stereochemically controlled combinatorial biosynthesis[J]. Angew Chem Int Ed, 2016, 55: 2142–2146. DOI:10.1002/anie.201510650 |
| [41] | Zerbe P, Bohlmann J. Plant diterpene synthases:exploring modularity and metabolic diversity for bioengineering[J]. Trends Biotechnol, 2015, 33: 419–428. DOI:10.1016/j.tibtech.2015.04.006 |
 2018, Vol. 53
2018, Vol. 53


