2. 福建中医药大学药学院, 福建 福州 350122;
3. 佳木斯大学药学院, 黑龙江 佳木斯 154007
2. Department of Pharmacy, Fujian University of Traditional Chinese Medicine, Fuzhou 350122, China;
3. Department of Pharmacy, Jiamusi University, Jiamusi 154007, China
骨质疏松症(osteoporosis, OP)是以骨量减少、骨的微观结构退化, 致使骨的脆性增加, 及易于发生骨折的代谢性疾病, 其发生与雌激素缺失和衰老导致的氧化应激紧密相关[1]。近年有证据表明体内铁蓄积可引起骨丢失, 进而导致骨质疏松症的发生。如体内铁超载的绝经后妇女骨丢失更为严重[2], 去卵巢骨质疏松大鼠血清铁的含量较高, 去除过量铁可缓解大鼠的骨丢失[3]。大多数患有地中海贫血症的儿童和青少年血清铁的水平较高, 但其骨密度降低, 骨质厚度增加, 骨矿化作用减弱[4]。铁超载对骨代谢的影响是由于其增加了活性氧的产生, 使机体处于高氧化应激状态[5]。活性氧降低骨代谢中成骨细胞的活性和骨矿化作用[6], 增加破骨细胞的形成、分化和骨吸收作用[7], 进而导致骨丢失。
中药淫羊藿是小檗科植物淫羊藿Epimedium brevicornu Maxim.的干燥叶, 具有补肾健骨的作用, 常用于预防和治疗骨质疏松症。淫羊藿黄酮为抗骨质疏松的有效成分, 其代表性化合物为淫羊藿苷。中国药典规定淫羊藿中淫羊藿苷的含量不得少于0.5%。淫羊藿苷具有植物雌激素和抗氧化的作用, 能够减少去卵巢骨质疏松大鼠的骨丢失, 促进成骨细胞的增殖、分化及骨矿化作用, 抑制破骨细胞的形成和骨吸收作用[8-10]。然而, 淫羊藿苷对铁超载骨质疏松小鼠骨代谢的影响尚不清楚。本研究应用右旋糖酐铁复制小鼠铁超载模型, 观察淫羊藿苷对铁超载小鼠骨代谢的作用, 为中药淫羊藿及其有效成分淫羊藿苷的应用提供科学依据。
材料与方法仪器 ELx800型连续波长酶标仪(美国Bio- TEK公司); 小动物Micro-CT扫描仪(美国GE公司, eXplore Locus SP); 万能力学分析仪(日本岛津公司, AGS-X); 5415R型高速冷冻离心机、移液枪(德国Eppendorf公司)。
药品和试剂 淫羊藿苷(上海源叶生物科技有限公司, 纯度98.8%); N-乙酰半胱氨酸(N-acetyl-L- cysteine, NAC)和右旋糖酐铁(美国Sigma公司); 血清铁、钙和磷测定试剂盒(上海创烨生物有限公司); 血清骨钙素(osteocalcin, OCN)、抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase-5b, TRACP-5b) ELISA试剂盒, 多聚甲醛固定液、超氧化物歧化酶(superoxide dismutase, SOD)及丙二醛(malondialdehyde, MDA)试剂盒(南京建成生物工程研究所)。
动物 8周龄, 体重25~30 g的雄性C57/BL6小鼠, 购买于上海斯莱克动物有限责任公司, 许可证号: SCXK (沪) 2012-0005, 饲养于第二军医大学实验动物中心。饲养条件为室温22~25 ℃, 湿度45%~50%, 小鼠自由获取灭菌水和食物。本研究中所有实验动物的使用严格按照第二军医大学实验指南进行。
铁超载骨质疏松小鼠模型的建立及药物干预 C57/BL6小鼠随机分成6组, 每组10只, 各组分笼单独喂养。①正常对照组: 0.5% CMC-Na; ②模型组:右旋糖酐铁(100 mg·kg-1); ③ NAC组:右旋糖酐铁(100 mg·kg-1) + NAC (100 mg·kg-1); ④ ICA-50:右旋糖酐铁(100 mg·kg-1) + ICA (50 mg·kg-1); ⑤ ICA- 100:右旋糖酐铁(100 mg·kg-1) + ICA (100 mg·kg-1); ⑥ ICA-200:右旋糖酐铁(100 mg·kg-1) + ICA (200 mg·kg-1)。第2~6组小鼠每周腹腔注射右旋糖酐铁1次, 剂量为100 mg·kg-1。同时各组小鼠灌胃给药, 阳性药对照药NAC及受试药物ICA分别混悬于0.5% CMC-Na溶液中, 按照10 mL·kg-1体重对小鼠给药, 每周6天, 正常对照组和模型组小鼠给予相同体积的0.5% CMC-Na溶液, 每周称量小鼠体重1次, 籍以调节给药量。给药3个月后, 各组小鼠眼眶取血, 离心, 血清保存于-80 ℃冰箱, 以备血清生化指标测定。处死小鼠后, 取小鼠各脏器及双侧股骨, 迅速称量小鼠的脏器重量。左侧股骨固定于4%多聚甲醛溶液中, 以备Micro-CT检测骨密度和骨组织形态计量参数。右侧股骨用PBS浸湿的纱布包裹, 4 ℃保存, 用于骨生物力学分析。
骨组织的Micro-CT和骨生物力学分析 将小鼠左侧股骨放入Micro-CT样本杯中, 在相同条件下进行扫描重建, 评价和分析骨密度及骨小梁计量参数。扫描的分辨率: 6 μm; 机器的工作条件: 80 kV和80 Μa, 每次扫描400个片层。扫描完成后, 采用Micview V2.1.2三维重建处理软件对每个样本进行三维图像重建, 并用ABA专用骨骼分析软件进行数据分析处理。采用万能力学分析仪对小鼠右侧股骨进行三点弯曲实验, 测定弹性模量(elastic modulus)、弹性载荷(elastic load)、最大载荷(maximum load)、最大应力(maximum stress)和弹性应力(elastic stress)等骨骼生物力学指标。
生化指标检测 按照试剂盒说明书测定血清中铁、钙、磷、TRACP-5b和OCN的含量或活性。将小鼠肝脏匀浆后, 4 000 r·min-1离心15 min, 收集上清液, 按照试剂盒说明书测定组织液中SOD的活性及MDA的含量。
统计学处理 采用SPSS 21.0软件进行统计学分析, 结果以均数±标准差表示, 组间比较采用单因素方差分析。
结果 1 淫羊藿苷对铁超载小鼠骨密度和骨组织形态结构参数的影响图 1A和B所示, 铁超载小鼠股骨的骨组织结构显著退化, 骨小梁厚度降低, 间隙增大, NAC和淫羊藿苷能够对抗铁超载引起的小鼠股骨骨小梁的结构退化。从骨组织结构参数的测定结果来看(图 1C~H), 铁超载小鼠的骨密度、骨体积分数、骨小梁厚度和数目显著降低, 骨表面积和体积的比值及骨小梁分离度显著增加, NAC可显著改善铁超载小鼠的骨组织形态结构参数, 减缓骨小梁结构的退化。淫羊藿苷可增加铁超载小鼠的骨密度、骨小梁数目和骨小梁厚度, 降低骨小梁间隙, 并在高剂量(200 mg·kg-1)下, 与模型组比较有显著性差异(P < 0.05)。
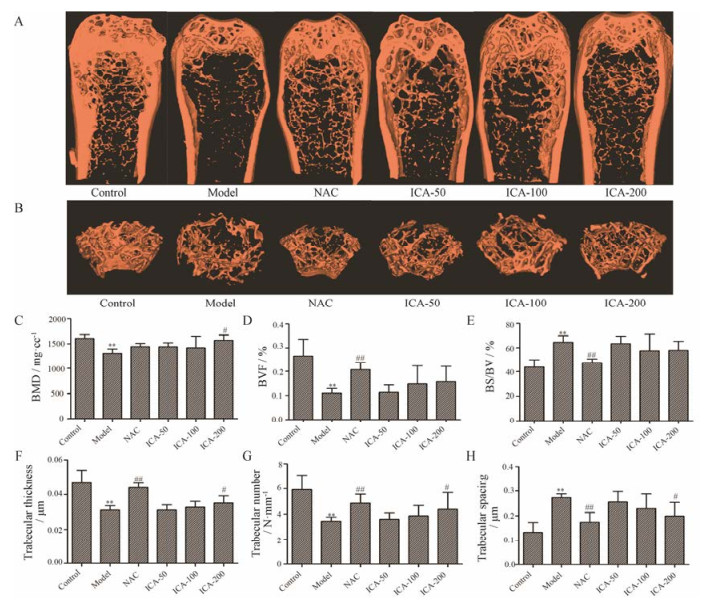
|
Figure 1 Effects of icariin (ICA) on bone micro-architecture of femur in iron overload mice. Representative three-dimensional reconstructed images derived by micro-CT of femurs (A and B), bone mineral density (BMD) (C), bone volume fraction (BVF) (D), the ratio of bone surface to bone volume (BS/BV) (E), trabecular thickness (F), trabecular number (G), trabecular spacing (H). The data are expressed as x± s, n = 10. **P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs model group. NAC: N-Acetyl-L-cysteine; ICA-50: Icariin-50 mg·kg-1; ICA-100: Icariin-100 mg·kg-1; ICA-200: Icariin-200 mg·kg-1 |
图 2A~E所示, 铁超载显著降低小鼠股骨的弹性模量、弹性载荷、弹性应力、最大载荷和最大应力等生物力学指标。NAC和淫羊藿苷可以增加铁超载小鼠股骨的生物力学参数, 淫羊藿苷在高剂量(200 mg·kg-1)下对铁超载小鼠股骨的生物力学参数均有显著的增加作用(P < 0.05, P < 0.01)。
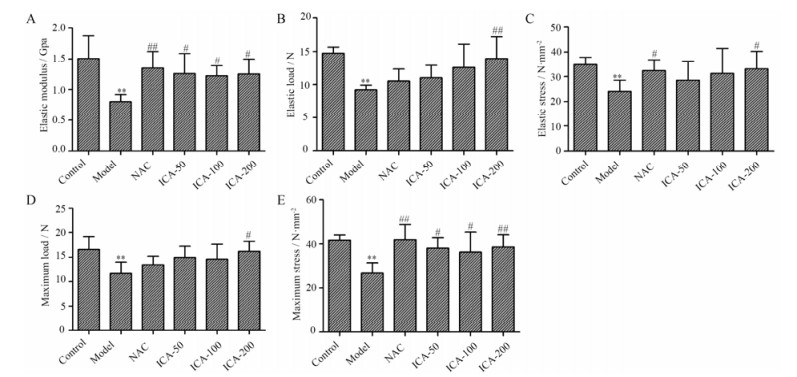
|
Figure 2 Effects of ICA on mechanical properties of the femurs in iron overload mice. Elastic modulus (A), elastic load (B), elastic stress (C), maximum load (D) and maximum stress (E) of the femurs were derived from the three-point bending test. Results are represented as x± s, n = 10. **P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs model group |
图 3A~C所示, 铁超载对小鼠血清中钙的含量无显著性影响, 但可显著增加小鼠血清无机磷及铁的含量(P < 0.01), NAC可降低铁超载小鼠血清中无机磷和铁的含量(P < 0.01), 淫羊藿苷在50~200 mg·kg-1内可剂量依赖地降低铁超载小鼠血清中无机磷和铁的含量(P < 0.05, P < 0.01)。图 3D和E所示, 铁超载显著增加小鼠血清TRACP-5b的活性, 降低OCN的含量(P < 0.01); NAC显著降低铁超载小鼠血清TRACP-5b的活性, 显著增加血清OCN的含量(P < 0.01)。淫羊藿苷在高剂量(200 mg·kg-1)下显著降低铁超载小鼠血清TRACP-5b的活性, 在50~200 mg·kg-1剂量下显著增加血清OCN的含量(P < 0.05, P < 0.01), 但在100 mg·kg-1剂量下对小鼠血清OCN的作用最为显著。
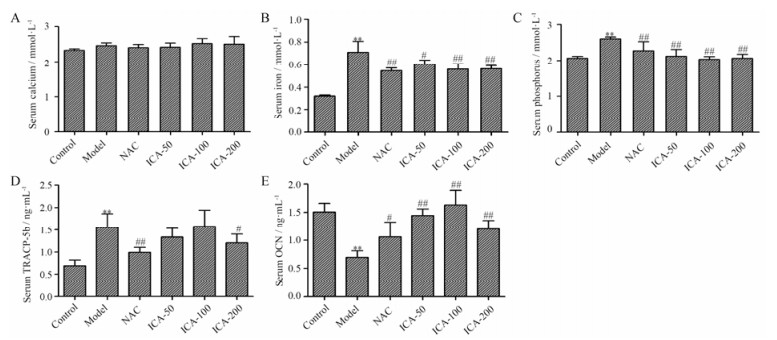
|
Figure 3 Effect of ICA on the serum levels of calcium (A), iron (B), phosphorus (C), TRACP-5b (D) and OCN (E) in iron overload mice. Results are represented as x± s, n = 10. **P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs model group. TRACP-5b: Tartrate resistant acid phosphatase-5b; OCN: Osteocalcin |
图 4A所示, 长期的铁超载处理使小鼠体重显著下降, NAC和淫羊藿苷对铁超载小鼠的体重没有显著的影响。与正常对照组相比, 铁超载小鼠肝脏、脾脏及肾脏重量显著增加(P < 0.01), NAC和淫羊藿苷可显著降低铁超载小鼠肝脏和脾脏重量(P < 0.01), 但对肾脏重量没有显著的影响(图 4B~D)。铁超载对小鼠肺脏和心脏重量没有显著的影响, NAC和淫羊藿苷对铁超载小鼠肺脏和心脏重量也没有明显的影响(图 4E和F)。
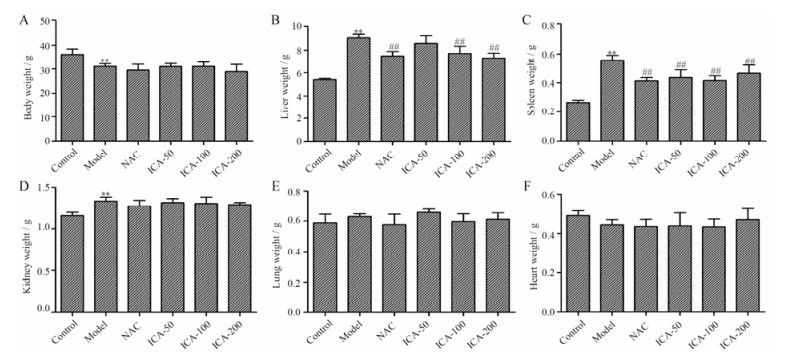
|
Figure 4 Effects of ICA on body weight (A), liver weight (B), spleen weight (C), kidney weight (D), lung weight (E) and heart weight (F) in iron overload mice. Results are represented as x± s, n = 10. **P < 0.01 vs control group; ##P < 0.01 vs model group |
铁超载显著降低小鼠肝组织中SOD的活性(P < 0.01), NAC可显著升高铁超载小鼠肝组织中SOD活性(P < 0.01), 淫羊藿苷可增加铁超载小鼠肝组织SOD的活性, 但与模型组相比, 没有显著性差异(图 5A)。铁超载可显著增加肝组织MDA的含量(P < 0.01), 淫羊藿苷在200 mg·kg-1剂量下, 显著降低铁超载小鼠肝组织MDA的含量(P < 0.05, 图 5B)。
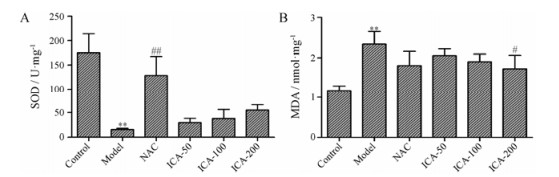
|
Figure 5 Effects of ICA on the levels of superoxide dismutase (SOD, A) and malondialdehyde (MDA, B) in the liver tissues of iron overload mice. Results are represented as x± s, n = 10. **P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs model group |
本研究通过腹腔注射右旋糖酐铁复制小鼠铁超载模型, 观察铁超载对骨代谢的影响及淫羊藿苷的调控作用。结果表明铁超载小鼠机体抗氧化能力降低, 骨吸收作用增强, 骨形成能力减弱, 骨密度降低, 骨组织微结构和生物力学性能退化。淫羊藿苷在高剂量(200 mg·kg-1)下能有效改善铁超载小鼠的机体高氧化应激状态, 抑制骨吸收, 增加骨形成和骨密度, 改善骨组织微结构和生物力学性能。
在铁超载状态下, 铁在肝脏中不断积累, 引起氧化应激, 造成肝组织损伤。在前期预实验过程中, 根据文献[11], 每周1次给小鼠注射1 000 mg·kg-1和100 mg·kg-1右旋糖酐铁诱导骨丢失, 结果发现右旋糖酐铁在1 000 mg·kg-1剂量下, 使小鼠的肝组织肿大, 造成部分小鼠死亡; 右旋糖酐铁在100 mg·kg-1剂量下作用2个月时, 小鼠的骨量有所下降, 但与正常对照组比较没有显著性差异。研究延长至3个月时, 铁超载小鼠的骨量丢失与正常组比较有显著差异, 因此, 每周1次注射右旋糖酐铁100 mg·kg-1, 3个月后可成功建立铁超载小鼠的骨丢失模型。本研究也发现长期的铁超载显著降低小鼠体重, 增加小鼠肝脏、脾脏及肾脏的重量。NAC和淫羊藿苷能降低铁超载小鼠肝脏和脾脏重量, 减轻铁超载对肝、脾脏的毒性损伤。
骨密度和骨组织形态结构参数是表征骨骼性能的重要指标。在注射右旋糖酐铁复制的铁超载小鼠模型中, 小鼠骨密度降低, 骨组织微结构明显退化[12]。本研究发现正常小鼠股骨骨小梁分布整齐, 结构状态良好, 铁超载小鼠的股骨骨小梁数目减少、厚度降低, 骨小梁间隙增加, 连结度降低。NAC和淫羊藿苷可显著增加铁超载小鼠骨密度, 增加骨小梁数目和厚度, 降低骨小梁分离度, 改善骨组织的微结构。骨骼的生物力学性能也是评价骨骼质量的重要因素。铁超载小鼠股骨三点弯曲实验中弹性模量、弹性载荷、最大载荷、弹性应力和最大应力显著降低, 表明铁超载小鼠股骨的生物力学性能退化, NAC和淫羊藿苷(200 mg·kg-1)可显著改善铁超载小鼠股骨的生物力学性能, 增强骨骼的承载能力。
近年研究表明铁超载影响骨代谢, 增加骨丢失。在铁超载联合切除卵巢(ovariectomized, OVX)大鼠模型中, 铁超载能增加血清的TRACP-5b的含量, 增强OVX大鼠的骨吸收, 抑制OVX大鼠的骨形成, 最终导致OVX大鼠的骨量减少和骨质疏松症[13]。铁超载表现为铁在体内的蓄积, 使得血清中铁含量显著升高, NAC和淫羊藿苷在一定程度上降低血清铁的含量, 减缓铁超载对机体的损伤和对骨代谢的影响。TRACP在血液循环中以TRACP-5b和TRACP-5a两种形式存在, TRACP-5b来源于破骨细胞, 为骨吸收的关键酶, 可表征破骨细胞的骨吸收活性[14]。铁超载小鼠血清中TRACP-5b的水平显著升高, 表明其破骨细胞性的骨吸收活性增强。NAC和淫羊藿苷显著降低铁超载小鼠血清TRACP-5b的活性, 降低破骨细胞的活性和骨吸收作用。OCN是由成骨细胞产生, 参与成骨细胞分化和骨基质的矿化[15]。铁超载降低小鼠血清中OCN的水平, 抑制成骨细胞的骨形成和骨基质矿化。NAC及淫羊藿苷可以有效增加小鼠血清OCN的水平, 增加骨形成。综上, 铁超载显著增加小鼠的骨吸收, 减少骨形成, 淫羊藿苷能够对抗铁超载对小鼠骨代谢的影响, 减少骨量的丢失。
铁超载对机体的损伤作用主要是高铁诱导产生活性氧, 引起脂质过氧化, 导致蛋白质结构的变化和核酸损伤[16]。对骨骼系统的影响在于铁超载诱导的活性氧可增加成骨细胞的凋亡, 抑制成骨细胞的分化和骨基质的矿化[17], 并促进破骨细胞的形成、分化和骨吸收活性[18]。肝脏是铁的主要储存器官, 机体依靠肝脏巨噬细胞清除体内过多的铁。本研究发现铁超载小鼠肝脏组织中SOD的活性显著降低, MDA的含量显著增加, 表明铁超载降低了肝脏组织的抗氧化能力。NAC和淫羊藿苷均显示出一定程度的增加铁超载小鼠肝脏组织抗氧化能力的作用, 因此, 这些药物减少铁超载小鼠骨丢失的作用可能与其增强机体的抗氧化能力, 减缓机体的氧化损伤有关。
文献报道淫羊藿苷具有抗氧化作用, 在氧化损伤的成骨细胞中能增加SOD的活性, 减少活性氧和脂质过氧化物的产生, 抑制成骨细胞的凋亡, 增加成骨细胞的分化和骨矿化结节形成[19]。本研究以抗氧化剂NAC作为对照药物, 观察淫羊藿苷对铁超载小鼠骨代谢的影响, 结果显示淫羊藿苷与抗氧化剂NAC相似, 能够减缓铁超载小鼠的氧化应激状态, 增加骨形成, 减少骨吸收, 改善骨组织的微结构和生物力学性能。因此, 在铁超载小鼠模型中, 淫羊藿苷调节骨代谢, 减少骨丢失的作用与其抗氧化活性有关。
| [1] | Lin J, Zhu J, Wang Y, et al. Chinese single herbs and active ingredients for postmenopausal osteoporosis:from preclinical evidence to action mechanism[J]. Biosci Trends, 2017, 11: 496–506. DOI:10.5582/bst.2017.01216 |
| [2] | Cheng Q, Zhang XF, Jiang J, et al. Postmenopausal iron overload exacerbated bone loss by promoting the degradation of type Ⅰ collagen[J]. Biomed Res Int, 2017, 5: 1–9. |
| [3] | Koskenkorva-Frank TS, Weiss G, Koppenol WH, et al. The complex interplay of iron metabolism, reactive oxygen species, and reactive nitrogen species:insights into the potential of various iron therapies to induce oxidative and nitrosative stress[J]. Free Radic Biol Med, 2013, 65: 1174–1194. DOI:10.1016/j.freeradbiomed.2013.09.001 |
| [4] | Mahachoklertwattana P, Sirikulchayanonta V, Chuansumrit C, et al. Bone histomorphometry in children and adolescents with β-thalassemia disease:iron-associated focal osteomalacia[J]. J Clin Endocrinol Metab, 2003, 88: 3966–3972. DOI:10.1210/jc.2002-021548 |
| [5] | Yarjanli Z, Ghaedi K, Esmaeili A, et al. Iron oxide nanoparticles may damage to the neural tissue through iron accumulation, oxidative stress, and protein aggregation[J]. BMC Neurosci, 2017, 18: 51. DOI:10.1186/s12868-017-0369-9 |
| [6] | Jomova K, Valko M. Advances in metal-induced oxidative stress and human disease[J]. Toxicology, 2011, 283: 65–87. DOI:10.1016/j.tox.2011.03.001 |
| [7] | Zhao GY, Di DH, Wang B, et al. Effects of mouse hepcidin 1 treatment on osteoclast differentiation and intracellular iron concentration[J]. Inflammation, 2015, 38: 718–727. DOI:10.1007/s10753-014-9982-2 |
| [8] | Song LG, Zhao JS, Zhang XZ, et al. Icariin induces osteoblast proliferation, differentiation and mineralization through estrogen receptor-mediated ERK and JNK signal activation[J]. Eur J Pharmacol, 2013, 714: 15–22. DOI:10.1016/j.ejphar.2013.05.039 |
| [9] | Chen GG, Wang CP, Wang JF, et al. Antiosteoporotic effect of icariin in ovariectomized rats is mediated via the Wnt/β-catenin pathway[J]. Exp Ther Med, 2016, 12: 279–287. DOI:10.3892/etm.2016.3333 |
| [10] | Yang QX, Liu YQ, Wang L, et al. Screening of bioactive components in Epimedium for osteoporosis treatment by model population analysis[J]. Acta Pharm Sin (药学学报), 2012, 9: 1205–1209. |
| [11] | Tsay J, Yang ZW, Ross FP, et al. Bone loss caused by iron overload in a murine model:importance of oxidative stress[J]. Blood, 2010, 116: 2582–2589. DOI:10.1182/blood-2009-12-260083 |
| [12] | Zhao L, Wang Y, Wang ZJ, et al. Effects of dietary resveratrol on excess-iron-induced bone loss via antioxidative character[J]. J Nutr Biochem, 2015, 26: 1174–1182. DOI:10.1016/j.jnutbio.2015.05.009 |
| [13] | Isomura H, Fujie K, Shibata K, et al. Bone metabolism and oxidative stress in postmenopausal rats with iron overload[J]. Toxicology, 2004, 197: 93–100. |
| [14] | Lee S, Kumagai T, Hashimoto J, et al. A change of osteocalcin (OC) and tartrate resistant acid phosphatase 5b (TRACP-5b) with the menstrual cycle[J]. Horm Metab Res, 2012, 44: 699–703. DOI:10.1055/s-0032-1311606 |
| [15] | Song SH, Wang D, Mo YY, et al. Antiosteoporotic effects of naringenin on ovariectomy-induced osteoporosis in rat[J]. Acta Pharm Sin (药学学报), 2015, 50: 154–161. |
| [16] | Tian Q, Wu SL, Dai ZP, et al. Iron overload induced death of osteoblasts in vitro:involvement of the mitochondrial apoptotic pathway[J]. Peer J, 2016, 4: 2611. DOI:10.7717/peerj.2611 |
| [17] | Yamasaki K, Hagiwara H. Excess iron inhibits osteoblast metabolism[J]. Toxicol Lett, 2009, 191: 211–215. DOI:10.1016/j.toxlet.2009.08.023 |
| [18] | Wang X, Fei BB, Shen GS, et al. Iron overload increases osteoclastogenesis and aggravates the effects of ovariectomy on bone mass[J]. J Endocrinol, 2015, 226: 121–134. DOI:10.1530/JOE-14-0657 |
| [19] | Ma HP, Ma XN, Ge BF, et al. Icariin attenuates hypoxia-induced oxidative stress and apoptosis in osteoblasts and preserves their osteogenic differentiation potential in vitro[J]. Cell Prolif, 2014, 47: 527–539. DOI:10.1111/cpr.2014.47.issue-6 |
 2018, Vol. 53
2018, Vol. 53


