瞬时受体电位通道(transient receptor potential, TRP)是一类在外周和中枢神经系统分布很广泛的通道蛋白, 与诸多细胞功能和遗传性疾病相关[1]。到目前为止有大约30个TRP通道家族成员, 主要由TRPV (vanilloid)、TRPA (ankyrin)、TRPM (melastatin)、TRPC (canonical)、TRPP (polycystin)、TRPN (NOMPC-like)和TRPML (mucolipin) 7个亚家族组成[2]。它们均为6次跨膜蛋白, 其N末端和C末端均在胞内由第五和第六跨膜结构域共同构成非选择性阳离子孔道[3]。细胞内的C末端和N末端长度不等且含有多种不同的结构域[4]。瞬时受体电位香草酸型通道(transient receptor potential vanilloid, TRPV)由于其与伤害性感受、热感受等重要生理功能的密切关系而成为TRP家族中被广泛研究的亚家族[5]。TRPV亚家族包括TRPV1~TRPV6 6个成员, 根据同源性和生理特性, 可分为两大类: TRPV1~4可通透包括Ca2+在内的阳离子, TRPV5~6则只通透Ca2+[6, 7]。热敏的瞬时受体电位通道(temperature-sensitive transient receptor potential, Thermo-TRP)是TRP家族中能被热所激活的一类离子通道[8], 其中TRPV1~4、TRPA1和TRPM8就是典型的热敏瞬时受体电位通道[4]。炎症/癌症等引发的病理性疼痛表现为热敏性的痛觉过敏, 从而导致这些离子通道的功能失调[9], 因此热敏的TRP通道也成为了关键的药物作用靶点[3], 备受学术界和工业界的关注[10]。
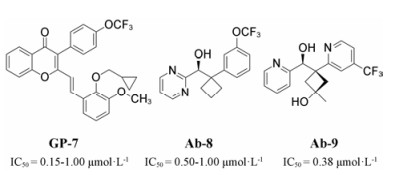
TRPV3与TRPV1具有43%的序列同源性[11-14], TRPV3广泛地表达在皮肤角质细胞/口腔和鼻黏膜[11, 15-17]。它在多次重复刺激下的敏化特性在TRPV通道中独一无二; 它在体内的表达分布也不同于其他TRPV通道。TRPV3广泛表达在皮肤的角质细胞、口腔和鼻腔的上皮细胞。TRPV3通道能够被中、高温激活, 在角质细胞中, TRPV3被激活后将释放多种物质, 其功能包括:温度调节、皮肤瘙痒和疼痛感知、皮肤屏障的建立、毛发生长、伤口愈合等[2, 18, 19]。TRPV3是具有多模式的受体蛋白, 能够被具有刺激性的化合物所激活, 比如非特异性的TRP激动剂[20-23], 樟脑和香芹酚或特异性激动剂如百里酚和丁子香酚[24-27]。此外, 角质细胞释放的炎症介质, 包括ATP/前列腺素PGE2和IL-1b等, 对TRPV3都有刺激作用, 可见TRPV3在皮肤炎症信号传导和疼痛转导过程中起到的关键作用, 因此该靶点对于相关疾病的治疗具有重要意义[2]。HC-001403在体实验中被确定为有效的TRPV3拮抗剂, 但截至目前没有其用于治疗疼痛的进一步研究发展[28]。Glenmark制药公司申报了一系列化合物专利, 都是针对TRPV3选择性的拮抗剂, 比如GP-7[29-35]。Abbott公司也申报了一系列TRPV3调节剂的专利, 代表化合物为Ab-8和Ab-9[36, 37]。最新研究表明, TRPV3功能增强突变体或细胞内H+增加导致细胞内钙超载, 从而导致细胞凋亡和相关的皮肤疾病。然而与其他TRP通道相比, 由于缺乏有效的拮抗剂, TRPV3的研究进展相当缓慢。
由于TRPV3晶体结构尚未解析, TRPV3与拮抗剂的活性结合位点尚未确定, 因此选择了基于配体的虚拟筛选[38, 39]。基于配体的虚拟筛选可以快速地评估数百万个分子, 基于已知拮抗剂的结构, 通过形状/静电匹配方法发现新型的选择性TRPV3拮抗剂。小分子配体和受体之间的结合相互作用可能导致受体的活化或抑制。为了发现受体调节剂及其结合构象, 在此使用TRPV1的晶体结构作为模板, 通过同源模建建构了TRPV3单体模型。本研究中发现的TRPV3选择性拮抗剂和TRPV3与拮抗剂的结合模式将有助于开发基于TRPV3调节的治疗药物。
结果与讨论 1 第一轮虚拟筛选和生物活性评价第一轮虚拟筛选选择了Specs化合物库, 该化合物库共有约27万个化合物。基于已知拮抗剂结构的问询式对Specs化合物库进行ROCS形状相似的高通量虚拟筛选, 随后运用EON将打分排名前10%的化合物进行静电匹配, 最后将EON打分排名前1%的化合物进行筛选和生物测活。每个问询式在Specs中经过形状和静电匹配后将产生约400个化合物, 根据化合物骨架和化学属性的相似性, 作者采用Pipeline Pilot and Cluster (Discovery Studio 2.5, Accelrys Software, Inc.)进行分类分析, 最终挑选出36个化合物进行生物活性测试, 这36个化合物的结构详见附加文件(supporting information)。
经过钙荧光FlexStation实验, 发现3个化合物对TRPV3具有拮抗作用, 分别为V-13、V-16和V-29, 见图 1。在表达TRPV3的细胞实验中, 使用2-APB将TRPV3激活, 钙离子将进入到细胞内, 表现出荧光的增强。对比添加0.4% DMSO的空白对照组, 这3个化合物均显著抑制细胞内钙荧光的增强, 见图 2。钙荧光实验的结果表明, 这3个化合物可能是TRPV3的拮抗剂。
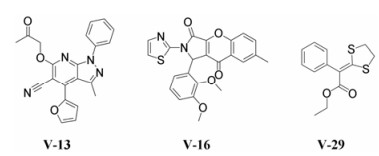
|
Figure 1 Structures of compounds V-13, V-16, and V-29 |
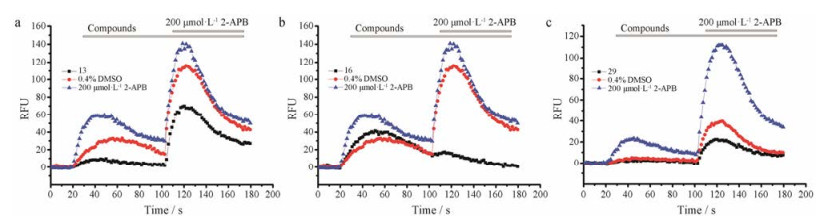
|
Figure 2 Fluorescent calcium FlexStation assay results of compounds V-13, V-16, and V-29. Inhibition of calcium intensity in TRPV3 channel expressed HEK-293T cells in response to the mixture of the tool compound 2-APB (200 μmol·L-1) and test compounds by FlexStation3 fluorescent calcium assay. (a), (b) and (c) correspond to compound V-13, V-16 and V-29, respectively. The screening scheme consists of 80 seconds (from 100 s to 180 s) for test compounds. After bath application of 2-APB that activates TRPV3 in 100 s, fluorescence intensity of test compounds was smaller than that of blank control with 0.4% DMSO respectively. The final concentration of these three compounds V-13, V-16 and V-29 was 54, 46 and 75 μmol·L-1, respectively |
为了进一步确定这3个化合物对TRPV3的拮抗作用, 采用全细胞膜片钳技术对表达TRPV3的HEK-293T细胞进行电生理实验。如图 3所示, 60 μL和40 μL V-13 (537 μmol·L-1), 60 μL和40 μL V-16 (460 μmol·L-1), 以及20 μL V-29 (751 μmol·L-1)分别滴入~600 μL电生理实验的细胞反应池中, 因此V-13、V-16和V-29的作用浓度分别约为54、45和25 μmol·L-1。电生理实验结果显示, V-29显著抑制了2-APB激活TRPV3的电流, 而另外两个化合物V-13和V-16并未表现出抑制作用。
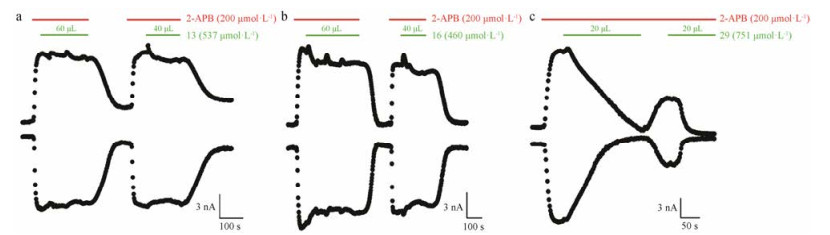
|
Figure 3 Electrophysiological assay results of three compounds, V-13, V-16 and V-29. Whole-cell current of TRPV3 in response to 2-APB (200 μmol·L-1) and compounds. The current decreased as soon as compound V-29 was added into the bath, where TRPV3 was activated by 2-APB and current increased accordingly. The final concentration of these three compounds V-13, V-16 and V-29 were approximately 54, 45 and 25 μmol·L-1, respectively |
为了评价化合物V-29对于其他热敏TRP通道蛋白的选择性, 采用同样的方法, 使用不同的工具化合物, 分别对TRPV1、TRPV2、TRPV4、TRPA1和TRPM8离子通道进行钙荧光实验。如图 4, 化合物V-29对其他的热敏TRP离子通道并没有表现出抑制作用, 说明化合物V-29是TRPV3的选择性拮抗剂。
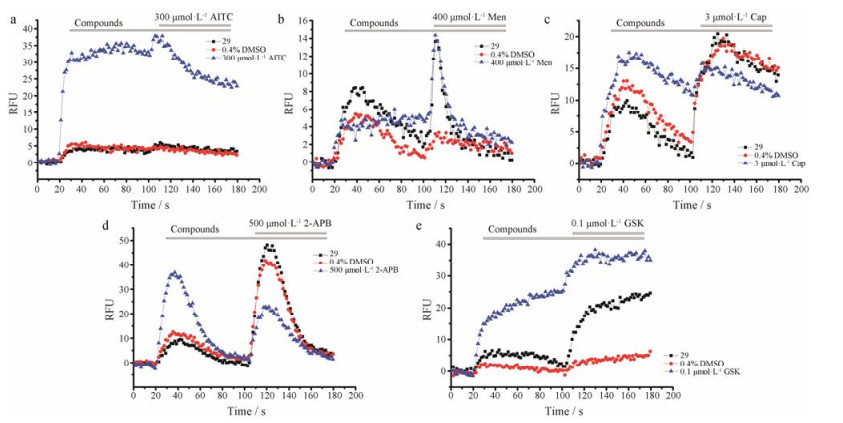
|
Figure 4 Compound V-29 performed no inhibition on TRPA1, TRPM8, TRPV1, TRPV2 and TRPV4 channels. Although the fluorescence intensity of these five channels varies, none of them was inhibited by compound V-29 (75 μmol·L-1). (a) From 100 s to 180 s, fluorescence intensity of compound V-29 was not smaller than that of blank control with 0.4% DMSO after bath application of AITC (300 μmol·L-1) which activates TRPA1, indicating that compound V-29didn't inhibit TRPA1 channel. (b), (c), (d) and (e) correspond to TRPM8, TRPV1, TRPV2 and TRPV4, respectively |
本研究选择已解析出来的TRPV1的两个结构(PDB ID: 3J5P; 3J9J), 作为模板基于知识的序列比对构建TRPV1单体模型。将4N5Q替代了相应的模建ARD区域, 最终构建出TRPV3单体模型: TRPV3_ HM4。因此1~116位的氨基酸残基是缺失的, 同时TRPV3_HM4比完整的hTRPV3单体少116个氨基酸残基。该模型通过PTOCHECK的立体化学验证和残基-残基以及整体结构的几何学分析, 99.8%残基是落在可接受的区域内的, 说明该模型是合理的。
TPRV3与其拮抗剂相互作用的活性口袋还没有被发现, 然而Chung等[40-42]发现了TPRV3和2-APB相互作用的两个关键残基: His-426和Arg-696。2-APB是TRPV3的强效激动剂, 被作为工具化合物广泛地应用于激活TRPV3。如图 3, 化合物V-29对于2-APB激活的TRPV3的抑制作用表现有所延迟, 进一步观察发现, 当再次加入2-APB, 对TRPV3的激活作用有所降低。然而根据现有的研究, TRPV3对于重复性刺激表现出的是高敏感性。与此同时, 对化合物V-29和2-APB进行了结构上的比对, 如图 5 (a)所示, 两个结构的重叠性非常高。经过对单体TRPV3_HM4的linker区域(N端和TM1)以及TRP Box的仔细观察, 认为该区域有可能形成TRPV3与调节剂化合物相互作用的活性口袋。于是将化合物V-29和2-APB分别与TRPV3_HM4进行对接。对接结果显示, 相比于2-APB, 化合物V-29更加深入到该活性口袋中(图 5), 可见化合物V-29通过竞争性地占据2-APB与TRPV3的作用部位从而起到抑制TRPV3的效果。因此, 2-APB与TRPV3相互作用的位置可能是TRPV3与其选择性拮抗剂相互作用的活性口袋。
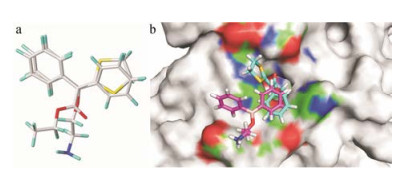
|
Figure 5 Comparison of compound V-29 and 2-APB, including 3D conformations and binding mode. a: V-29 overlapped very well with 2-APB in 3D conformations; b: The binding mode of V-29 and 2-APB with TRPV3_HM4, V-29 is cyan and 2-APB is red. Compound V-29 competitively binds TRPV3 against 2-APB |
基于第一轮的虚拟筛选结果和相互作用分析, 进行了第二轮的虚拟筛选。两个问询式分别为:化合物V-29与TRPV3_HM4相互作用的构象; 2016年报道的TRPV3选择性拮抗剂Ab-9的最低能量构象[35]。经过形状和静电匹配, 最终筛选出63个化合物进行初步的生物测活, 钙荧光FlexStation实验表明其中17个化合物对TRPV3具有抑制作用。结构和钙荧光实验结果详见附加文件(supporting information)。为了进一步验证这些化合物对于TRPV3的抑制作用, 采用全细胞膜片钳技术对表达TRPV3的HEK- 293T细胞进行电生理实验。如图 6所示, 20 μL V-39 (691 μmol·L-1)、V-46 (593 μmol·L-1)和V-53 (480 μmol·L-1)分别被滴入~600μL的细胞反应池中, 因此V-39、V-46和V-53的作用浓度分别约为23、20和16 μmol·L-1。这3个化合物V-39、V-46和V-53对2-APB激活的电流的显著抑制作用(图 6、7), 可见这3个化合物确实是TRPV3的拮抗剂。
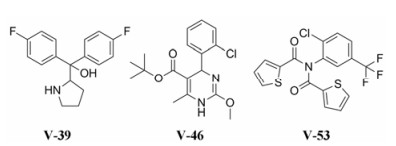
|
Figure 6 Structures of compounds V-39, V-46 and V-53 |
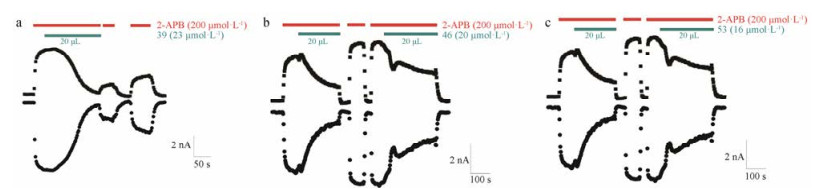
|
Figure 7 Electrophysiological assay results of compounds V-39, V-46 and V-53. Whole-cell current of TRPV3 in response to the mixture of 2-APB (200 μmol·L-1) with compounds. The current decreased as soon as test compound was added into the bath, where TRPV3 was activated by 2-APB and current increased accordingly. The final concentration of these three compounds V-39, V-46 and V-53 were approximately 23, 20 and 16 μmol·L-1 respectively |
为了评价这3个化合物V-39、V-46和V-53对于其他热敏TRP离子通道的选择性, 采用同样的方法, 使用不同的工具化合物, 分别对TRPV1、TRPV2、TRPV4、TRPA1和TRPM8离子通道进行钙荧光实验。如图 8, 这3个化合物V-39、V-46和V-53对其他的热敏TRP离子通道并没有表现出抑制作用, 说明V-39、V-46和V-53是TRPV3的选择性拮抗剂。
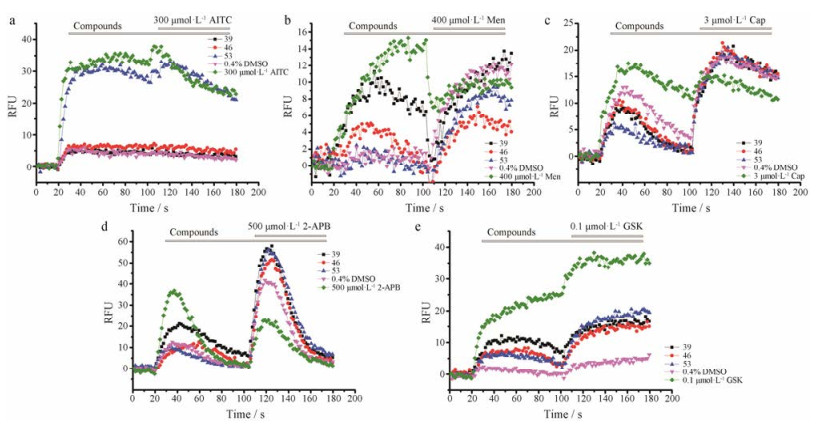
|
Figure 8 These three compounds, V-39, V-46 and V-53, performed no effect on TRPA1, TRPM8, TRPV1, TRPV2 and TRPV4 channels. Although the fluorescence intensity of these five channels varies, none of them was inhibited by these three compounds, V-39 (57 μmol·L-1), V-46 (59 μmol·L-1) and V-53 (48 μmol·L-1), respectively. (a) From 100 s to 180 s, fluorescence intensity of compound V-39 was not smaller than that of blank control with 0.4% DMSO after bath application of AITC (300 μmol·L-1) which activates TRPA1, indicating that compound V-39 didn't inhibit TRPA1 channel. The effect of V-46 (59 μmol·L-1) was the same as V-39. As to V-53 (48 μmol·L-1), fluorescence intensity even increased, indicating it may activate TRPA1. (b), (c), (d) and (e) correspond to TRPM8, TRPV1, TRPV2 and TRPV4, respectively |
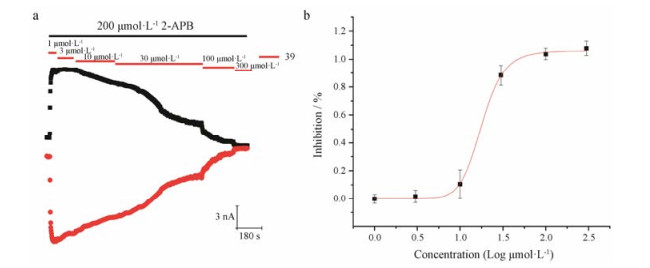
通过更加全面的电生理实验, 证实了不同浓度的化合物V-39对2-APB激活的TRPV3的抑制作用。如图 9, 从1 μmol·L-1到300 μmol·L-1不同浓度的化合物V-39对TRPV3的抑制作用呈现出浓度依赖性, 通过Hill方程的计算方法进行曲线模拟匹配, 计算出化合物V-39对TRPV3的IC50为18.0 ± 1.1 μmol·L-1 (n = 4)。
|
Figure 9 The dose-dependent inhibition of TRPV3 current by compound V-39 in HEK-293T cells expressing TRPV3 channel. a: Representative whole-cell currents of TRPV3 channels inhibited by increasing the concentrations of compound V-39 from 1.0 μmol·L-1 to 300.0 μmol·L-1; b: Curve fitting in red represents dose-dependent inhibition of TRPV3 by compound V-39 with an IC50 of 18.0 ± 1.1 μmol·L-1 (n = 4 for all data points) |
通过基于配体的虚拟筛选和生物测活验证, 发现了4个全新结构的TRPV3选择性拮抗剂V-29、V-39、V-46和V-53。目前已知的TRPV3拮抗剂GP-7、Ab-8和Ab-9在针对包括关节疼痛在内的疼痛治疗的临床试验均以失败告终, 虽然这4个化合物V-29、V-39、V-46和V-53分别从基于Ab-8、V-29和Ab-9的结构虚拟筛选所得, 但它们的结构都与目前已知的TRPV3拮抗剂结构不同, 其中GP-7虚拟筛选所得的化合物对于TRPV3不具有抑制作用的原因可能是它们的结构太大, linker和TRP Box所形成的活性口袋无法容纳。本研究不仅提出了TRPV3与其拮抗剂的相互作用模式, 同时也指出了在化合物V-39结构基础上进行优化从而得到TRPV3更加强效的选择性拮抗剂的可能性。
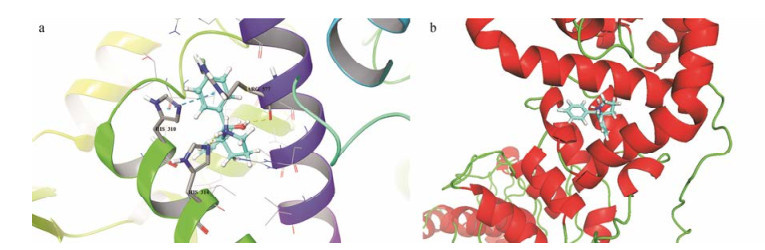
4 TRPV3关键氨基酸残基和潜在的活性口袋采用了Induced Fit Docking进行分子对接, 对接结果表明相互作用的活性口袋可能位于linker (N末端和TM1)和TRP Box之间。化合物V-39和该活性口袋的氨基酸残基具有π-π堆叠和氢键相互作用, 化合物V-39的苯环和氨基酸残基His-310的咪唑环具有π-π堆叠相互作用(图 10), V-39四氢吡咯环上的氨基作为氢键供体, 与His-314的咪唑环上的N-3具有氢键相互作用, V-39的羟基作为氢键供体, 与Arg-577的羰基氧具有氢键相互作用。
|
Figure 10 Putative binding sites for compound V-39 in TRPV3 channel. a: Location of 3 key residues mapped to TRPV3_HM4, the TRPV3 monomeric model. His-310, His-314 and Arg-577 correspond to His-426, His-430 and Arg-693 of complete hTRPV3. Compound V-39 and the key residues are presented in the form of stick. Hydrogen bonds are drawn in yellow dashed lines, and π-π stacking interaction is drawn in a cyan dashed line. b: Side view of molecular docking of compound V-39 into TRPV3_HM4 using Maestro Suite software. The helices are colored by red. The ligand is depicted as a stick presenting in cyan. The binding pocket is composed of residues located in linker domain (of N-terminus and TM1) and TRP Box. Compound V-39 is deep in the pocket |
分子对接结果表明, 化合物V-39通过图 10所示的方式与TRPV3相互作用。其中化合物V-39和2-APB显示出一些结构相似性, 它们都拥有两个芳香基团和三键交汇形成的大基团。不同的是, 2-APB比V-39少了一个环状基团, 这可能是其较低结合稳定性的原因。在未来的结构修饰中, 可延长化合物V-39的-OH取代基或在四氢吡咯环上的氨基位置引入更好的氢键供体, 以增强其对TRPV3的抑制作用。此外, 手性异构体的拆分研究将更深入地了解TRPV3与其拮抗剂之间的相互作用机制。
5 小结本研究基于配体的虚拟筛选和生物活性评价发现了新型的TRPV3选择性拮抗剂。采用目前已知的TRPV3拮抗剂结构生成问询式, 基于形状和静电匹配, 对Specs和PKU-CNCL化合物库进行虚拟筛选。在第一轮虚拟筛选中发现了新型的TRPV3选择性拮抗剂化合物V-29。在第二轮的虚拟筛选过程中, 采用V-29和最新报道的TRPV3选择性拮抗剂(Ab-9)生成问询式进行虚拟筛选。最终得到最具潜力的TRPV3选择性拮抗剂V-39, 其IC50为18.0 ± 1.1 μmol·L-1 (n = 4)。基于精确的序列比对, 以TRPV1晶体结构为模板, 构建了TRPV3单体模型TRPV3_HM4, 并进行了结构验证表明该模型的合理性。分子对接的结构表明TRPV3与其拮抗剂相互作用的活性口袋可能位于linker区(N末端和TM1)和TRP Box之间, 化合物V-39与该活性口袋的氨基酸残基具有π-π堆叠和氢键相互作用。TRPV3_HM4的关键性残基为His-310、His-314和Arg-577, TRPV3_HM4可用于进一步研究TRPV3结构、功能及其与调节剂相互作用机制。
实验部分 1 虚拟筛选用于虚拟筛选的化合物库的准备是所有的基础[43-45]。本研究选择了两个化学库, PKU-CNCL[46]和Specs数据库。请参考附加文件(supporting information)获取详细的化合物库准备流程。本研究中运用了两轮虚拟筛选。第一轮虚拟筛选包含两个阶段:第一阶段是初步形状匹配, 基于图 11中所示的已知拮抗剂结构的最小能量构象的分子形状; 第二阶段是优化, 通过与已知骨架进行静电匹配, ROCS打分排名, 去除不理想的结构式[47-50]。基于已知拮抗剂结构的形状和静电匹配能够有效地筛选出潜在的拮抗剂骨架[51]。用于形状和静电匹配的最小能量构象是由Sybyl-X 2.0的分子能量最小化模块产生的。除化合物问询式的产生有所不同外, 第二轮虚拟筛选的过程与第一轮的过程相同。化合物V-29是从第一轮虚拟筛选发现的TRPV3选择性拮抗剂。使用化合物V-29与TRPV3单体结构的结合构象来产生问询式。
|
Figure 11 Representatives of known TRPV3 antagonists |
TRPV3通道是一种阳离子非选择性通道, 可以大量通透Ca2+[52]。Flex Station3技术是一种基于钙荧光的高通量筛选技术, 可应用该方法对TRPV3通道的调节剂进行筛选。采用FlexStation 3微孔板读数器(molecular devices)中的Calcium 5测定试剂盒通过荧光钙敏感染料测量细胞群中细胞内钙水平([Ca2+]i)的变化。电生理技术主要应用全细胞式记录方法, 应用HEKA EPC10放大器系统及PatchMaster记录软件(玻璃微电极阻值为3~5 MΩ, 细胞钳制电位为0 mV, 使用-80 mV和+80 mV方波电压记录)。
化合物活性初筛和选择性评价采用的是钙荧光FlexStation实验。初筛所用的细胞是HEK293T细胞, 接种于24孔板中, 37 ℃、5% CO2培养过夜。瞬时转染pIRES-EGFP/hTRPV3质粒, 换液时传代至96孔板, 细胞密度约为每孔50 000个。转染后24 h时进行染料孵育, 所用染料为Cal-520 assay kit。吸出40 μL培养基, 此时96孔板中剩余60 μL培养基, 加入等量的Cal-520染料, 孵箱孵育1.5 h时可上机检测。FlexStation系统激发波长495 nm, 发射波长525 nm, 每间隔1.6 s读数一次。17 s时加入待测化合物(终浓度40~90 μmol·L-1不等), 100 s时加入TRPV3激动剂2-APB (终浓度200 μmol·L-1), 每次测试共计180 s。对于拮抗剂, 其筛选实验的荧光特征应为加入2-APB后, 与空白对照0.4% DMSO组对比荧光值没有明显上升。采用各个化合物同样的终浓度(40~90 μmol·L-1不等), 分别对TRPV1、TRPV2、TRPV4、TRPA1、TRPM8这5个进行抑制活性的评测, 在表达TRPV1、TRPV2、TRPV4、TRPA1、TRPM8的细胞上测定这些化合物的通道选择性, 以筛选出对TRPV3具有选择性拮抗作用的小分子。
为了进一步验证这些化合物对于TRPV3的作用, 采用全细胞膜片钳技术对表达TRPV3的HEK-293T细胞进行电生理实验。应用瞬时转染pIRES-EGFP/ hTRPV3质粒的HEK293T细胞, 于转染后24 h开始测试。电极内液及外液的组成成分为130 mmol·L-1 NaCl、0.2 mmol·L-1 EDTA和3 mmol·L-1 HEPES, pH为7.4。测试开始待基线平稳后, 给予2-APB激活TRPV3通道。在假阳性评价中, 待电流平稳后, 分别滴加不同化合物, 观察其对通道的抑制作用, 以判断该化合物在初筛中表现出来的TRPV3的拮抗作用是否为假阳性。活性的定量测定中, 待电流平稳后, 分别重力灌流给予不同化合物观察其对通道的抑制作用。IC50曲线的绘制由重力灌流不同浓度的化合物制得。
3 同源模建从RCSB蛋白质数据库中检索选定的用于建模的TRPV1晶体结构, 包括两种结构(PDB ID: 3J5P; 3J9J)[53-55]。apo模型是基于知识的序列比对和同源性建模而建立的。TRPV3同源模建的主要步骤如下: ①模板识别:将hTRPV3序列作为查询基本局部比对搜索工具(BLAST)的模板; ②目标-模板比对; ③模型构建; ④模型改进和验证:在替换ARD结构域之前, 在已知的TRPV3 ARD结构(PDB ID: 4N5Q)上叠加了apo模型, 4N5Q是TRPV3细胞内N端的锚蛋白重复序列结构域[56]。运用Accelrys Discovery Studio 2.5中的Align and Superimpose Proteins模块将4N5Q替代相应的模建的ARD区域, 最终构建了TRPV3单体模型: TRPV3_HM4。
4 分子对接基于同源模建得到的蛋白质三维结构和文献报道的重要氨基酸残基, 尝试探索蛋白质的活性口袋, 并运用Schrödinger Glide 6.7和Schrödinger Maestro 10.2的Induced Fit Docking组建进行刚性对接和柔性对接, 其中配体由Sybyl X-2.0绘画并进行Ligprep优化, 受体则按照Induced Fit Docking的标准流程进行优化。最终通过Grids得到小分子拮抗剂与蛋白质相互作用的可能的活性构象, 并将之应用于基于三维形状相似性搜索的虚拟筛选。
| [1] | Veldhuis NA, Poole DP, Grace M, et al. The G pro-tein-coupled receptor-transient receptor potential channel axis:molecular insights for targeting disorders of sensation and inflammation[J]. Pharmacol Rev, 2015, 67: 36–73. |
| [2] | Nilius B, Szallasi A. Transient receptor potential channels as drug targets:from the science of basic research to the art of medicine[J]. Pharmacol Rev, 2014, 66: 676–814. DOI:10.1124/pr.113.008268 |
| [3] | Baez D, Raddatz N, Ferreira G, et al. Gating of thermally activated channels[J]. Curr Top Membr, 2014, 74: 51–87. DOI:10.1016/B978-0-12-800181-3.00003-8 |
| [4] | Moran MM, McAlexander MA, Biro T, et al. Transient receptor potential channels as therapeutic targets[J]. Nat Rev Drug Discov, 2011, 10: 601–620. DOI:10.1038/nrd3456 |
| [5] | Eijkelkamp N, Quick K, Wood JN. Transient receptor potential channels and mechanosensation[J]. Annu Rev Neurosci, 2013, 36: 519–546. DOI:10.1146/annurev-neuro-062012-170412 |
| [6] | Ma L, Lee BH, Clifton H, et al. Nicotinic acid is a common regulator of heat-sensing TRPV1-4 ion channels[J]. Sci Rep, 2015, 5: 8906. DOI:10.1038/srep08906 |
| [7] | Feng Z, Pearce LV, Xu X, et al. Structural insight into tetrameric hTRPV1 from homology modeling, molecular docking, molecular dynamics simulation, virtual screening, and bioassay validations[J]. J Chem Inf Model, 2015, 55: 572–588. DOI:10.1021/ci5007189 |
| [8] | Ferrandiz-Huertas C, Mathivanan S, Wolf CJ, et al. Trafficking of ThermoTRP channels[J]. Membranes (Basel), 2014, 4: 525–564. DOI:10.3390/membranes4030525 |
| [9] | Luo J, Hu H. Thermally activated TRPV3 channels[J]. Curr Top Membr, 2014, 74: 325–364. DOI:10.1016/B978-0-12-800181-3.00012-9 |
| [10] | Bonvini SJ, Birrell MA, Smith JA, et al. Targeting TRP channels for chronic cough:from bench to bedside[J]. Naunyn Schmiedebergs Arch Pharmacol, 2015, 388: 401–420. DOI:10.1007/s00210-014-1082-1 |
| [11] | Nilius B, Biro T, Owsianik G. TRPV3:time to decipher a poorly understood family member![J]. J Physiol, 2014, 592: 295–304. DOI:10.1113/jphysiol.2013.255968 |
| [12] | Peier AM, Reeve AJ, Andersson DA, et al. A heat-sensitive TRP channel expressed in keratinocytes[J]. Science, 2002, 296: 2046–2049. DOI:10.1126/science.1073140 |
| [13] | Xu H, Ramsey IS, Kotecha SA, et al. TRPV3 is a calcium- permeable temperature-sensitive cation channel[J]. Nature, 2002, 418: 181–186. DOI:10.1038/nature00882 |
| [14] | Smith G, Gunthorpe M, Kelsell R, et al. TRPV3 is a tem-perature-sensitive vanilloid receptor-like protein[J]. Na-ture, 2002, 418: 186–190. |
| [15] | Agarwala MK, George R, Pramanik R, et al. Olmsted syn-drome in an Indian male with a new de novo mutation in TRPV3[J]. Br J Dermatol, 2016, 174: 209–211. DOI:10.1111/bjd.2016.174.issue-1 |
| [16] | Yang YS, Cho SI, Choi MG, et al. Increased expression of three types of transient receptor potential channels (TRPA1, TRPV4 and TRPV3) in burn scars with post-burn pruritus[J]. Acta Derm Venereol, 2015, 95: 20–24. DOI:10.2340/00015555-1858 |
| [17] | Gao L, Yang P, Qin P, et al. Selective potentiation of 2-APB- induced activation of TRPV1-3 channels by acid[J]. Sci Rep, 2016, 6: 20791. DOI:10.1038/srep20791 |
| [18] | Brederson JD, Kym PR, Szallasi A. Targeting TRP channels for pain relief[J]. Eur J Pharmacol, 2013, 716: 61–76. DOI:10.1016/j.ejphar.2013.03.003 |
| [19] | Sun S, Dong X. Trp channels and itch[J]. Semin Immunopathol, 2016, 38: 293–307. DOI:10.1007/s00281-015-0530-4 |
| [20] | Cao NK, Wei NN, Li J, et al. Natural modulators of transient receptor potential channels[J]. Acta Pharm Sin (药学学报), 2017, 52: 673–684. |
| [21] | Nadler MJ, Hermosura MC, Inabe K, et al. LTRPC7 is a Mg·ATP-regulated divalent cation channel required for cell viability[J]. Nature, 2001, 411: 590–595. DOI:10.1038/35079092 |
| [22] | Togashi K, Inada H, Tominaga M. Inhibition of the transient receptor potential cation channel TRPM2 by 2-aminoethoxydiphenyl borate (2-APB)[J]. Br J Pharmacol, 2008, 153: 1324–1330. |
| [23] | Maruyama T, Kanaji T, Nakade S, et al. 2APB, 2-aminoethoxydiphenyl borate, a membrane-penetrable modulator of Ins (1, 4, 5) P3-induced Ca2+ release[J]. J Biochem, 1997, 122: 498–505. DOI:10.1093/oxfordjournals.jbchem.a021780 |
| [24] | Vogt-Eisele A, Weber K, Sherkheli M, et al. Monoterpenoid agonists of TRPV3[J]. Br J Pharmacol, 2007, 151: 530–540. |
| [25] | Klein AS, Tannert A, Schaefer M. Cholesterol sensitizes the transient receptor potential channel TRPV3 to lower temperatures and activator concentrations[J]. Cell Calcium, 2014, 55: 59–68. DOI:10.1016/j.ceca.2013.12.001 |
| [26] | Stotz SC, Vriens J, Martyn D, et al. Citral sensing by tran-sient receptor potential channels in dorsal root ganglion neurons[J]. PLoS One, 2008, 3: e2082. DOI:10.1371/journal.pone.0002082 |
| [27] | Macpherson LJ, Hwang SW, Miyamoto T, et al. More than cool:promiscuous relationships of menthol and other sensory compounds[J]. Mol Cell Neurosci, 2006, 32: 335–343. DOI:10.1016/j.mcn.2006.05.005 |
| [28] | Chong J, Fanger C, Larsen G, et al. Compounds for modu-lating TRPV3 function: WO, 056124[P]. 2007-03-18. |
| [29] | Lingam VSP, Thomas A, Khatik JY, et al. Chromane derivatives as TRPV3 modulators: WO, 004379[P]. 2010-01-14. |
| [30] | Lingam VSP, Thomas A, Gharat LA, et al. Chromane derivatives as TRPV3 modulators: WO, 084034[P]. 2009- 07-09. |
| [31] | Lingam VSP, Thomas A, More DA, et al. Fused pyrimidine derivatives as TRPV3 modulators: WO, 109987[P]. 2009- 09-11. |
| [32] | Chaudhari SS, Thomas A, Kadam AB, et al. Chromenone derivatives as TRPV3 antagonists: WO, 055384[P]. 2010- 05-20. |
| [33] | Chaudhari SS, Thomas A, Kadam AB, et al. Fused imida-zole carboxamides as TRPV3 modulators: WO, 070452[P]. 2010-06-24. |
| [34] | Lingam VSP, Thomas A, Phatangare SK, et al. Fused imidazole derivatives as TRPV3 antagonist: WO, 073128[P]. 2010- 07-01. |
| [35] | Lingam VSP, Chaudhari SS, Thomas A, et al. Fused pyrimidineone compounds as TRPV3 modulators: WO, 130560[P]. 2009-10-29. |
| [36] | Gomtsyan A, Schmidt RG, Bayburt EK, et al. Synthesis and pharmacology of (pyridin-2-yl)methanol derivatives as novel and selective transient receptor potential vanilloid 3 antagonists[J]. J Med Chem, 2016, 59: 4926–4947. DOI:10.1021/acs.jmedchem.6b00287 |
| [37] | Bayburt EK, Clapham B, Cox PB, et al. Novel TRPV3 modulators: WO, 019315[P]. 2012-02-16. |
| [38] | Horvath DA. Virtual screening approach applied to the search for trypanothione reductase inhibitors[J]. J Med Chem, 1997, 40: 2412–2423. DOI:10.1021/jm9603781 |
| [39] | Ripphausen P, Nisius B, Peltason L, et al. Quo vadis, virtual screening? A comprehensive survey of prospective applications[J]. J Med Chem, 2010, 53: 8461–8467. DOI:10.1021/jm101020z |
| [40] | Chung MK, Lee H, Mizuno A, et al. 2-Aminoethoxydiphenyl borate activates and sensitizes the heat-gated ion channel TRPV3[J]. J Neurosci, 2004, 24: 5177–5182. DOI:10.1523/JNEUROSCI.0934-04.2004 |
| [41] | Hu H, Grandl J, Bandell M, et al. Two amino acid residues determine 2-APB sensitivity of the ion channels TRPV3 and TRPV4[J]. Proc Natl Acad Sci U S A, 2009, 106: 1626–1631. DOI:10.1073/pnas.0812209106 |
| [42] | Hu HZ, Gu Q, Wang C, et al. 2-Aminoethoxydiphenyl borate is a common activator of TRPV1, TRPV2, and TRPV3[J]. J Biol Chem, 2004, 279: 35741–35748. DOI:10.1074/jbc.M404164200 |
| [43] | Schneider G. Virtual screening:an endless staircase?[J]. Nat Rev Drug Discov, 2010, 9: 273–276. DOI:10.1038/nrd3139 |
| [44] | Hou T, Xu X. Recent development and application of virtual screening in drug discovery:an overview[J]. Curr Pharm Des, 2004, 10: 1011–1033. DOI:10.2174/1381612043452721 |
| [45] | McInnes C. Virtual screening strategies in drug discovery[J]. Curr Opin Chem Biol, 2007, 11: 494–502. DOI:10.1016/j.cbpa.2007.08.033 |
| [46] | Hu J, Lv C, Liu Z, et al. Cheminformatics analysis of the Chinese national compound library of Peking University[J]. J Chin Pharm Sci, 2016, 25: 696–675. |
| [47] | Lemmen C, Lengauer T, Klebe G. FlexS: a method for fast flexible ligand superposition[J]. J Med Chem, 1998, 41: 4502–4520. DOI:10.1021/jm981037l |
| [48] | Sastry GM, Dixon SL, Sherman W. Rapid shape-based ligand alignment and virtual screening method based on atom/feature-pair similarities and volume overlap scoring[J]. J Chem Inf Model, 2011, 51: 2455–2466. DOI:10.1021/ci2002704 |
| [49] | Grant JA, Gallardo MA, Pickup BT. A fast method of molecular shape comparison:a simple application of a Gaussian description of molecular shape[J]. J Comput Chem, 1996, 17: 1653–1666. DOI:10.1002/(ISSN)1096-987X |
| [50] | Hawkins PCD, Skillman AG, Nicholls A. Comparison of shape-matching and docking as virtual screening tools[J]. J Med Chem, 2006, 50: 74–82. |
| [51] | Venkatraman V, Pérez-Nueno VI, Mavridis L, et al. Com-prehensive comparison of ligand-based virtual screening tools against the DUD data set reveals limitations of current 3D methods[J]. J Chem Inf Model, 2010, 50: 2079–2093. DOI:10.1021/ci100263p |
| [52] | Gees M, Colsoul B, Nilius B. The role of transient receptor potential cation channels in Ca2+ signaling[J]. Cold Spring Harb Perspect Biol, 2010, 2: a003962. |
| [53] | Cao E, Liao M, Cheng Y, et al. TRPV1 structures in distinct conformations reveal activation mechanisms[J]. Nature, 2013, 504: 113–118. DOI:10.1038/nature12823 |
| [54] | Liao M, Cao E, Julius D, et al. Structure of the TRPV1 ion channel determined by electron cryo-microscopy[J]. Nature, 2013, 504: 107–112. DOI:10.1038/nature12822 |
| [55] | Barad BA, Echols N, Wang RY, et al. EMRinger:side chain-directed model and map validation for 3D cryo-electron microscopy[J]. Nat Methods, 2015, 12: 943–946. DOI:10.1038/nmeth.3541 |
| [56] | Shi DJ, Ye S, Cao X, et al. Crystal structure of the N-terminal ankyrin repeat domain of TRPV3 reveals unique conformation of finger 3 loop critical for channel function[J]. Protein Cell, 2013, 4: 942–950. DOI:10.1007/s13238-013-3091-0 |
 2018, Vol. 53
2018, Vol. 53


