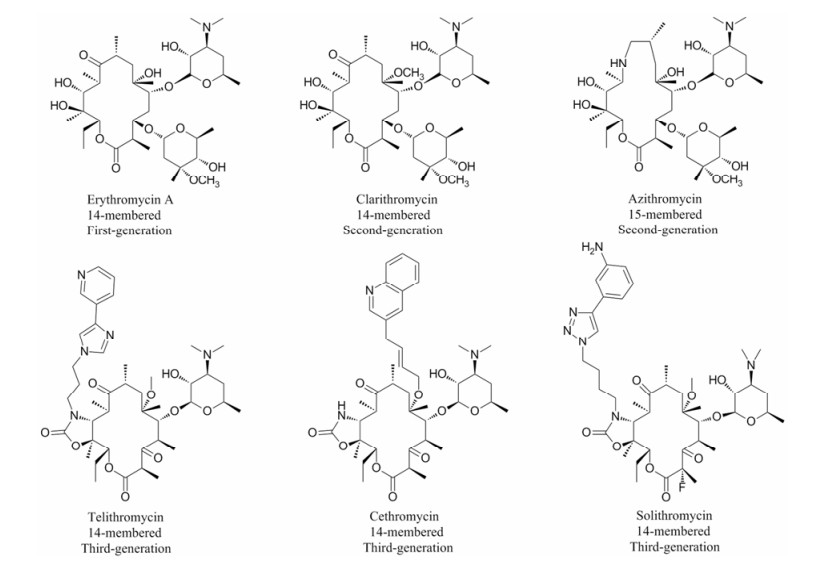
红霉素A (erythromycin A, 图 1)是第一个临床应用的大环内酯类抗生素, 其疗效确切、毒性较低、安全性好。但由于红霉素A在酸性条件下结构不稳定, 导致其降解从而产生胃肠道不良反应[1, 2]。针对该问题, 研究者们合成了一系列红霉素A衍生物, 由此开发出了以克拉霉素(clarithromycin)[3]、阿奇霉素(azithromycin)[4]为代表的第二代大环内酯类抗生素, 这些药物成功地增强了红霉素在酸性条件下的稳定性, 扩大了药物的抗菌谱, 同时还改善了药代动力学性质的不足[5]。随着抗生素的长期和广泛使用, 大环内酯类抗生素的耐药菌不断被发现[6-9]。针对细菌耐药现象, 研究者开发出了第三代大环内酯类抗生素即酮内酯抗生素。结构特征为: ①脱除了内酯环上3-位克拉定糖, 并将3-位羟基氧化成羰基; ② 11, 12-位形成环氨基甲酸酯结构, 并在不同的位置引入了具有一定长度的芳杂环侧链, 此侧链可以与细菌核糖体产生新的结合作用。药理研究表明, 代表药物泰利霉素(telithromycin)与喹红霉素(cethromycin, 图 1), 不仅保持了大环内酯抗菌谱宽的特点, 还增强了对大环内酯耐药菌的抗菌活性[10-13]。
尽管研究者们对此进行了很多研究, 但抗生素耐药形势仍很严峻, 为寻找新的抗耐药菌药物, 近年来, 研究者不断开展对酮内酯抗生素的结构改造, 主要集中在: 4, 8, 10-位对甲基的修饰和11, 12-位芳杂环侧链的修饰。本综述主要从对酮内酯以上位置的结构改造进行总结。
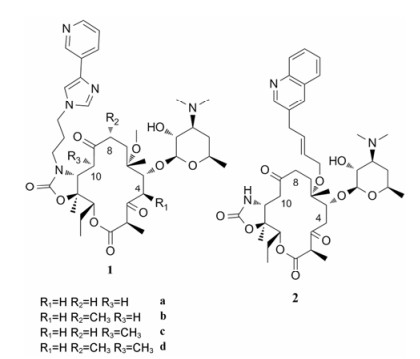
1 酮内酯4, 8, 10-位修饰 基于酮内酯抗生素的结构特征, Andrade课题组猜想酮内酯结构中4, 8, 10位上的三个甲基可能会增大酮内酯分子的空间位阻, 影响分子与细菌核糖体的紧密结合, 因此, 去甲基修饰后的酮内酯衍生物可能会增强对细菌的抗菌活性。于是, 该课题组通过全合成的方法, 得到了4, 8, 10-三去甲基1a[14]、4, 10-二去甲基1b[15]、4, 8-二去甲基1c[16]、4-去甲基1d[17]4种泰利霉素类似物(图 2), 这4种类似物的体外抗菌活性检测结果发现, 它们的抗菌活性相较对照药物泰利霉素均有不同程度的下降(表 1)。但化合物的抗菌活性随甲基数目的增加而明显上升。作者推测的原因可能是:去甲基修饰, 可能会降低分子的空间位阻, 但也会降低分子的刚性, 影响分子与细菌核糖体之间的相互作用, 从而导致抗菌活性的降低。由此认为, 4, 8, 10三个位置上的甲基对保持化合物的抗菌活性是十分必要的[18]。
表1(Table 1)
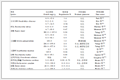
Table 1 In vitro antibacterial activity of compounds 1a-1d (MIC/µg·mL-1)
| Bacteria |
Wt/mauant |
MIC/µg·mL-1
|
| 1a
|
1b
|
1c
|
1d
|
Telithromycin |
| E. coli
|
SQ171/2058G |
512 |
256 |
256 |
256 |
256 |
| E. coli
|
DK/pK3535 |
32 |
8 |
4 |
0.5 |
0.5 |
| E. coli
|
DK/2058G |
64 |
16 |
32 |
4 |
1 |
| S. aureu
|
UCN14 |
32 |
256 |
256 |
256 |
128 |
| S. aureu
|
ATCC33591 |
128 |
128 |
64 |
128 |
128 |
|
Table 1 In vitro antibacterial activity of compounds 1a-1d (MIC/µg·mL-1)
|
随后, 该课题组又通过全合成的方法经41步得到了4, 8, 10-三去甲基喹红霉素衍生物2[19](图 2), 体外活性测定显示, 该化合物的体外抗菌活性明显高于此前合成的去甲基泰利霉素衍生物, 对大部分所测菌株的抗菌活性与对照药物泰利霉素相当, 但对大肠杆菌pKK3535型的抗菌活性(MIC = 2 µg·mL-1)低于泰利霉素(MIC = 0.5 µg·mL-1, 表 2)。
表2(Table 2)

Table 2 In vitro antibacterial activity of compound 2 (MIC/ µg·mL-1)
| Strain |
Bacteria |
Wt/mutant |
Telithromycin |
2
|
| SQ171/2058G |
E.coli
|
A2058G |
> 512 |
> 256 |
| DK/pKK3535 |
E.coli
|
Wt |
0.5 |
2 |
| DK/2058G |
E.coli
|
A2058G |
1 |
1 |
| UCN14 |
S.aureus
|
A2058U |
> 256 |
> 256 |
| ATCC33591 |
S.aureus
|
ermA |
> 128 |
> 64 |
|
Table 2 In vitro antibacterial activity of compound 2 (MIC/ µg·mL-1)
|
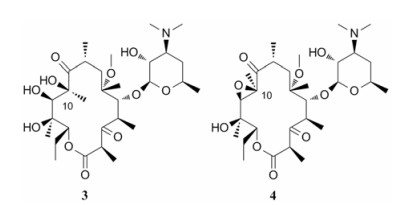
除了去甲基化修饰外, Jiang等[20]也对10-位进行了修饰。他们认为, 将羟基引入酮内酯结构中亲水性的一侧可以扩大其抗菌谱范围, 改善药代动力学性质。在四氧化锇的作用下, 10, 11-位的碳碳双键转化为10, 11-双羟基酮内酯衍生物3 (图 3), 继续进行修饰, 形成10, 11-环氧酮内酯衍生物4 (图 3)。但相较于对照药物泰利霉素(MIC: 2~64 µg·mL-1), 衍生物的抗菌活性(MIC≥128 µg·mL-1)均大幅下降。可能的原因是, 10-位引入羟基虽然能增强分子的亲水性, 但也有可能导致分子构象发生改变, 从而无法与细菌核糖体紧密结合。
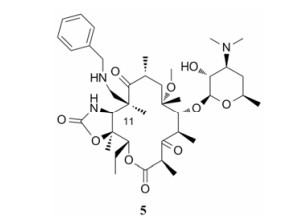
Anwar等[21]在11, 12位形成环氨基甲酸酯结构的同时, 分别将10-位甲基修饰成了乙烯基、胺基与氮杂螺环, 从而合成了一系列酮内酯衍生物。大部分衍生物对肺炎链球菌与金葡菌呈现出了与对照药物克拉霉素相当的抑菌活性。而对于efflux耐药型的肺炎链球菌, 衍生物的抗菌活性略有提高, 其中化合物5 (图 4)的活性最为突出(表 3), 除对肺炎链球菌3914型、金葡菌ATCC29213型外, 对其余所测菌株的抑菌活性均优于克拉霉素。
表3(Table 3)

Table 3 In vitro antibacterial activity of compound 5 (MIC/µg·mL-1)
| Compound |
S. pneumoniae
|
|
S. aureus
|
| ATTC4961 |
BAA1402 M (mef)
|
3914MLS |
|
ATCC29213 |
BAA976 M (mef)
|
BAA977 iMLS (erm)
|
ND048910 cMLS (erm)
|
| 5
|
< 0.007 |
< 0.007 2 |
64 |
|
0.25 |
0.5 |
1 |
> 64 |
| Clarithromycin |
0.015 |
2 |
> 16 |
0.125 |
64 |
> 64 |
> 64 |
|
Table 3 In vitro antibacterial activity of compound 5 (MIC/µg·mL-1)
|
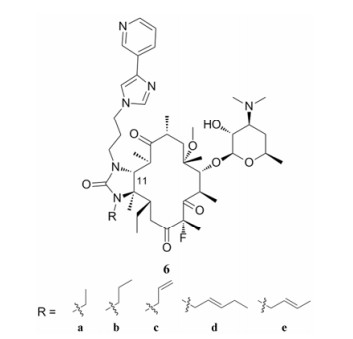
2 酮内酯11, 12-位的修饰 泰利霉素是第一个上市的酮内酯类抗生素, 主要用于治疗社区获得性肺炎。其11, 12-位形成环氨基甲酸酯结构并伸出了一条芳环侧链, 受到这点的启发, 辉瑞公司着眼于酮内酯11, 12-位的结构改造。他们设计并合成了11, 12环脲酮内酯类似物6, 并在2-位进行氟化, 12-位氮上进行烷基化。所得到的大部分衍生物呈现出与泰利霉素相当的抗菌活性。其中, 化合物6a (图 5)的抑菌活性优于泰利霉素, 对金葡菌0052的抗菌活性(MIC = 0.024 µg·mL-1)是泰利霉素(MIC = 0.049 µg·mL-1)的2倍, 对erm基因介导耐药的化脓性链球菌的抗菌活性(MIC = 8 µg·mL-1)是泰利霉素(MIC = 32 µg·mL-1)的4倍[22]。
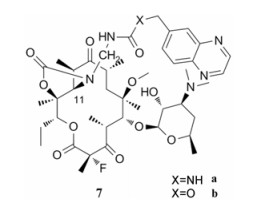
接着, 该公司利用Curtius重排反应合成了一系列2-位氟取代, 11, 12-位含亚甲基氨基甲酸酯结构的衍生物。所得到的部分化合物保持与泰利霉素相当的抗菌活性。在这些化合物中, 化合物7a (图 6)的活性最为突出, 对肺炎链球菌1175的抗菌活性(MIC = 0.063 µg·mL-1)是泰利霉素(MIC = 0.378 µg·mL-1)的6倍, 对化脓性链球菌1079的活性(MIC = 1.0 µg·mL-1)泰利霉素(MIC = 18 µg·mL-1)的18倍, 对流感嗜血杆菌1325的活性(MIC = 2.0 µg·mL-1)是泰利霉素(MIC = 3.9 µg·mL-1)的2倍[23]。
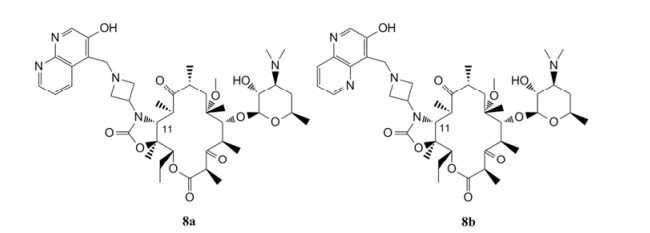
该公司继续合成了一系列11, 12-位侧链含氮杂四元环取代的酮内酯衍生物8a、8b。该系列衍生物对所测的肺炎链球菌均表现显著的抗菌活性(MIC≤ 0.5 µg·mL-1), 其中化合物8a (图 7)的抗菌活性最为突出(表 4), 对化脓性链球菌1079的抗菌活性(MIC≤ 0.25 µg·mL-1)是泰利霉素(MIC≤32 µg·mL-1)的128倍。而化合物8b对ermB介导的化脓性链球菌1079的抗菌活性(MIC = 0.5 µg·mL-1)小于8a (MIC≤ 0.25 µg·mL-1), 对其余菌株的抗菌活性与8a相当[24]。
表4(Table 4)

Table 4 In vitro antibacterial activity of compounds 8a and 8b (MIC/µg·mL-1)
| Compound |
S. pneumoniae 1016
(susceptible)
|
S. pneumoniae 1095
ermB |
S. pneumoniae 1175
mef A |
S. pyogenes 1079
erm B |
H. influenzae
1325 |
| Telithromycin |
≤0.06 |
≤0.06 |
≤0.06 |
32 |
4 |
| Clarithromycin |
≤0.06 |
> 64 |
16 |
> 64 |
16 |
| 8a
|
≤0.06 |
≤0.06 |
≤0.06 |
0.25 |
4 |
| 8b
|
≤0.06 |
≤0.06 |
≤0.06 |
0.5 |
4 |
|
Table 4 In vitro antibacterial activity of compounds 8a and 8b (MIC/µg·mL-1)
|
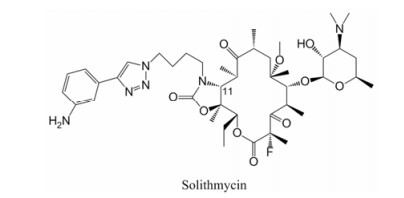
与泰利霉素的结构不同, Cempra公司研发的索利霉素(solithromycin, 图 8)在2-位引入氟原子, 同时11, 12-位侧链中的咪唑-吡啶部分替换为3-氨苯基-[1, 2, 3]-三唑[25]。体外研究结果表明, 对于erm基因介导红霉素耐药的肺炎链球菌, 索利霉素的抗菌活性(MIC90 = 1 µg·mL-1)是左氧氟沙星的2倍(MIC90 = 2 µg·mL-1)。对mef基因介导红霉素耐药的肺炎链球菌, 索利霉素的抗菌活性(MIC90 = 0.25 µg·mL-1)高于对照药物左氧氟沙星(MIC90 = 1 µg·mL-1)、泰利霉素(MIC90 = 2 µg·mL-1)、阿奇霉素(MIC90≥64 µg·mL-1); 对金葡菌的抑菌活性(MIC50 = 0.12 µg·mL-1)是泰利霉素(MIC50 = 0.25 µg·mL-1)的2倍; 对红霉素耐药的流感嗜血杆菌也具有突出的活性(MIC90 = 4 µg·mL-1), 是泰利霉素、阿奇霉素(MIC90 = 16 µg·mL-1)的4倍[26-28]。
研究表明, 索利霉素与细菌核糖体有3个结合位点: 5-位二甲胺糖与核糖体Ⅴ区A2058/A2059残基相互作用、11, 12-位伸出的芳杂环侧链与核糖体23S rRNA的结构域Ⅱ区相互作用并与碱基A752-U2609相互作用。索利霉素的2-位氟也可以与核糖体紧密结合提供额外的相互作用。相较于其他酮内酯抗生素与核糖体只有2个结合位点, 索利霉素具有3个结合位点, 因此可以减少耐药性, 增强抑菌活性[29-32]。此外, Bertrand等[33-35]证明了泰利霉素的不良反应是其芳杂环侧链中的吡啶环结构所引发, 从而抑制乙酰胆碱受体, 产生视觉干扰、重症肌无力、肝毒性等不良事件的发生, 而索利霉素结构中不含吡啶环, 不良反应可能会得以改善。
索利霉素的开发公司Cempra对其进行了充分的研究, Ⅰ期临床结果表明, 口服索利霉素的耐受性良好, 安全性较高, 食物不会影响其生物利用度[36, 37]。该公司对比口服索利霉素与口服左氧氟沙星治疗社区获得性肺炎的有效性与安全性的Ⅱ期临床试验, 结果表明, 索利霉素对社区获得性肺炎的治疗效果与左氧氟沙星疗效相似, 安全性更好、耐受性较高, 且不良反应的发生率也更低[38]。将莫西沙星作为对照药物与索利霉素进行Ⅲ期非劣效性试验, 通过观察患者的早期临床反应发现, 口服索利霉素进行治疗72 h后, 部分症状(包括咳嗽、呼吸困难、胸痛、痰液)得以缓解, 并且没有其他症状恶化, 不良事件(包括头痛、腹泻、恶心、结肠炎)的发生率低于对照组口服莫西沙星。但静脉注射索利霉素的疗效不及莫西沙星静脉注射, 不良反应发生率也较高。结果还发现, 增加索利霉素口服剂量不仅无法提高治疗效果, 还可能会增加不良反应发生率[39-41]。
但FDA未批准Cempra公司对于索利霉素的新药申请, 尽管专家组认可了索利霉素对于社区获得性肺炎具有显著的疗效, 也对耐大环内酯类非典型致病菌存在抑制活性, 但缺乏足够的肝脏安全性数据以及药品合成路线复杂, 产率不高等生产问题未能有效解决是该药未获批准的主要原因。FDA认为, 920例的试验规模难以说明问题, 应将样本数据扩大至9 000例, 以充分评估该药物的安全性。此外, 根据临床研究, 还应增加使用期限超过7天的警告[42]。
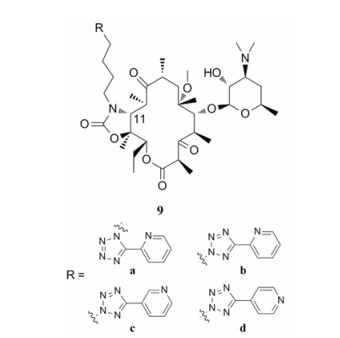
Song等[43]设计并合成了一系列11, 12-位四唑环取代的酮内酯衍生物。四唑是一种非常重要的药效团, 广泛存在于各种药物结构中。作者认为, 用四唑环来取代其他芳杂环结构, 有望增强衍生物对敏感菌及耐药菌的抗菌活性。经体外活性测试后发现化合物9a~9d (图 9)具有显著的抗菌活性(表 5)。化合物9a的抗菌活性尤为突出, 对金葡菌ATCC6538p的抗菌活性(MIC≤0.031 µg·mL-1)是泰利霉素(MIC = 0.125 µg·mL-1)的4倍; 对铜绿假单胞菌1317的抗菌活性(MIC = 4 µg·mL-1)是泰利霉素(MIC = 32 µg·mL-1)的8倍。对其他所测菌株也表现出不弱于泰利霉素的抗菌活性。
表5(Table 5)

Table 5 In vitro antibacterial activity of compounds 9a-9d (MIC/µg·mL-1)
| Compd.
|
S. aureus
|
|
P. aeruginosa
|
|
E. coli
|
| ATCC29213 |
ATCC6538p |
ATCC26001 |
5676 |
5677 |
AD-08 |
|
ATCC27853 |
ATCC9027 |
1317 |
|
ATCC8739 |
ATCC25922 |
| 9a
|
0.063 |
≤0.031 |
≤0.063 |
4 |
8 |
> 128 |
|
4 |
8 |
4 |
|
4 |
2 |
| 9b
|
0.063 |
≤0.031 |
≤0.063 |
8 |
8 |
> 128 |
8 |
64 |
8 |
8 |
4 |
| 9c
|
≤0.031 |
≤0.031 |
≤0.063 |
8 |
8 |
> 128 |
8 |
64 |
8 |
8 |
16 |
| 9d
|
≤0.031 |
≤0.031 |
≤0.063 |
4 |
8 |
> 128 |
8 |
32 |
8 |
8 |
16 |
| Erythromycin A |
0.5 |
0.5 |
≤0.063 |
> 128 |
> 128 |
> 128 |
16 |
128 |
> 128 |
16 |
8 |
| Clarithromycin |
0.25 |
0.5 |
≤0.063 |
> 128 |
> 128 |
> 128 |
8 |
64 |
128 |
8 |
4 |
| Telithromycin |
0.125 |
0.125 |
0.031 |
2 |
16 |
128 |
4 |
32 |
32 |
4 |
4 |
|
Table 5 In vitro antibacterial activity of compounds 9a-9d (MIC/µg·mL-1)
|
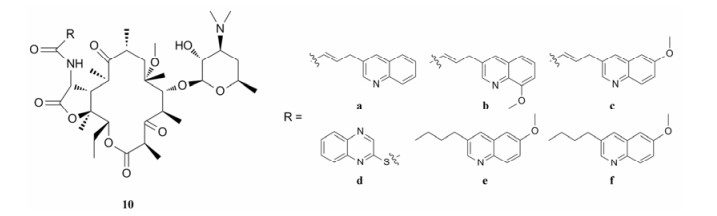
Pavlović等[44]设计并合成了一系列11, 12-位形成内酯环, 然后伸出一个含酰胺基侧链取代的酮内酯衍生物。作者猜想, 在酰胺基上引入一系列不同的芳杂环, 可能会影响衍生物的抗菌活性。结果显示, 在α-胺基上引入芳杂环侧链可以增强衍生物对efflux型和MLSB型耐药的肺炎链球菌与化脓性链球菌的抑菌活性。尤其是化合物10d (图 10), 不仅对红霉素敏感的金葡菌(MIC = 0.125 µg·mL-1)、肺炎链球菌(MIC = 0.06 µg·mL-1)、化脓性链球菌(MIC = 0.06 µg·mL-1)呈现强有力的活性, 而且对耐药菌的活性也十分突出:对MLSB型耐药化脓性链球菌的抑菌活性(MIC = 0.25 µg·mL-1)是阿奇霉素(MIC = 64 µg·mL-1)的256倍, 对MLSB型耐药的肺炎链球菌的抗菌活性(MIC = 0.125 µg·mL-1)是阿奇霉素(MIC = 64 µg·mL-1)的512倍。此化合物有待进一步开发。
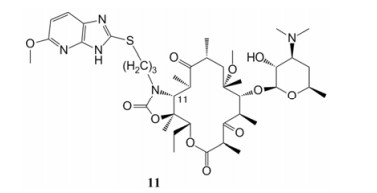
Xu等[45]设计并合成了一系列11, 12-位含咪唑并吡啶侧链取代的酮内酯类衍生物, 并将其进行体外活性测试。结果发现, 化合物11 (图 11)对多种测试菌株呈现出与泰利霉素相当水平的抗菌活性, 对红霉素敏感的肺炎链球菌ATCC49619 (MIC = 0.016 µg·mL-1)是对照药物泰利霉素(MIC = 0.031 µg·mL-1)的2倍、对红霉素敏感的化脓性链球菌07U086的抗菌活性(MIC = 0.031 µg·mL-1)是泰利霉素(MIC = 0.25 µg·mL-1)的8倍; 对红霉素耐药的化脓性链球菌07Z014, 化合物11的抗菌活性(MIC = 0.062 µg·mL-1)是泰利霉素(MIC = 0.125 µg·mL-1)的2倍。
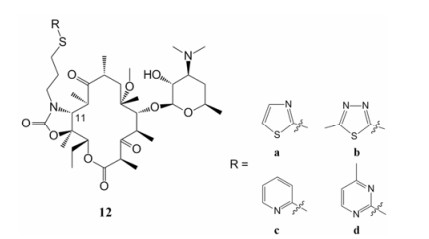
Xu等[45]将硫原子引入11, 12位环氨基甲酸酯侧链可能有助于增强该化合物的抑菌活性。因此Chen等[46]设计并合成了一系列11, 12位含硫原子的芳环侧链取代的酮内酯衍生物, 将其进行体外活性测试。结果发现, 部分化合物对所测菌株显示出良好的抗菌活性。化合物12a~12d (图 12)的抗菌谱与泰利霉素相似(表 6)。化合物12a和12c的抗菌活性最为突出, 对化脓性链球菌的抗菌活性(MIC≤0.016 µg·mL-1)是对照药物泰利霉素(MIC = 0.062 µg·mL-1) 4倍。对其他所测菌株的抗菌活性也表现出与泰利霉素相当的水平。
表6(Table 6)

Table 6 In vitro antibacterial activity of compounds 12a-12d (MIC/µg·mL-1)
| Compd.
|
S. aureus
|
|
S. epidermidis
|
|
S. pyogenes
|
| ATCC29213 |
ANS46 |
|
07C134 |
07T202 |
07R066 |
07A006 |
|
07U084 |
07U086 |
03-233 |
01-533 |
| 12a
|
0.125 |
> 32 |
|
0.125 |
> 32 |
0.062 |
0.125 |
|
≤0.016 |
≤0.016 |
> 32 |
0.5 |
| 12b
|
0.25 |
> 32 |
0.125 |
> 32 |
2 |
0.125 |
≤0.016 |
0.031 |
> 32 |
1 |
| 12c
|
0.125 |
> 16 |
0.125 |
> 16 |
0.125 |
0.125 |
0.016 |
0.016 |
Nt |
nt |
| 12d
|
0.5 |
> 32 |
0.25 |
> 32 |
0.25 |
0.5 |
0.125 |
0.125 |
2 |
2 |
| Clarithromycin |
0.25 |
> 32 |
0.25 |
> 32 |
0.125 |
8 |
0.031 |
0.031 |
> 32 |
2 |
| Telithromycin |
0.125 |
> 16 |
0.125 |
> 16 |
0.125 |
0.125 |
0.062 |
0.062 |
2 |
0.25 |
|
Table 6 In vitro antibacterial activity of compounds 12a-12d (MIC/µg·mL-1)
|
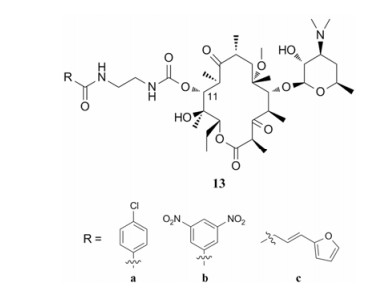
除了修饰11, 12-位的侧链外, 许多研究者还分别对11-位或12-位进行修饰。Jia等[47]设计并合成了一系列11-氧-氨基甲酰结构取代的酮内酯衍生物。其用各种醛与丙二酸进行反应, 得到了对应的丙烯酸。再以克拉霉素为起始原料, 经5步反应得克拉霉素衍生物作为关键中间体, 该中间体与丙烯酸在HOBT与DCC的作用下缩合, 得到目标化合物13 (图 13), 将其进行活性测定。大部分衍生物对红霉素敏感的化脓性链球菌与盘尼西林敏感的枯草芽孢杆菌呈现出显著的活性。其中化合物13b的抗菌活性最为卓越, 对敏感型化脓性链球菌的抗菌活性(MIC = 0.125 µg·mL-1)是对照药物阿奇霉素的3倍(MIC = 0.3 µg·mL-1), 对肺炎链球菌A22072型的抗菌活性(MIC = 0.5 µg·mL-1)是阿奇霉素的4倍(MIC = 2 µg·mL-1), 是克拉霉素的8倍(MIC = 4 µg·mL-1)。化合物13a对枯草芽孢菌ATCC9372型的抑菌活性最为显著, 其MIC值为0.25 µg·mL-1与阿奇霉素相当(MIC = 0.25 µg·mL-1)。化合物13c对金葡菌ATCC29213型的MIC值为16 µg·mL-1, 其活性是克拉霉素(MIC = 64 µg·mL-1)的4倍。
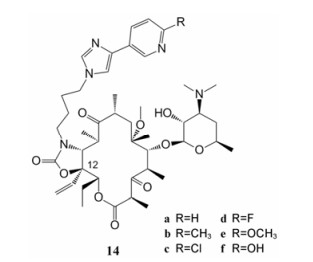
Plattner课题组在12-位乙烯基取代的基础上, 在11, 12-位环氨基甲酸酯的N上引入芳杂环侧链, 合成了一系列酮内酯衍生物14 (图 14)。结果发现, 化合物14c的体外抗菌活性最为突出(表 7), 对金葡菌29213、33591, 表皮葡萄球菌14990、F50654, 肺炎链球菌3427, 化合物14c的抗菌活性(MIC≤0.05 µg·mL-1)是泰利霉素(MIC = 0.1~0.2 µg·mL-1)的2倍, 化合物14c对肠粪球菌Bc11148-2的抗菌活性(MIC = 0.1 µg·mL-1)是泰利霉素(MIC = 0.4 µg·mL-1)的4倍。化合物14b与14c在以小鼠肺部感染为模型的体内活性实验中, 对肺炎链球菌及流感嗜血杆菌相较于泰利霉素表现出更好的药代动力学性质、更长的药物代谢半衰期(表 8)。因此, 12-位乙烯基取代这一修饰, 值得进行更为深入的研究[48]。
表7(Table 7)

Table 7 In vitro antibacterial activity of compounds 14a-14d (MIC/µg·mL-1)
| Strain |
14a
|
14b
|
14c
|
14d
|
14e
|
14f
|
Telithromycin |
Clarithromycin |
| S. aureus
|
29213 |
0.1 |
0.2 |
≤0.05 |
0.1 |
0.1 |
0.4 |
0.1-0.2 |
0.7-0.78 |
|
|
33591 |
> 50 |
> 50 |
> 50 |
> 50 |
> 50 |
> 50 |
> 50 |
> 50 |
| S. epidermidis
|
14990 |
0.2 |
0.2 |
≤0.05 |
0.1 |
0.2 |
0.2 |
0.1-0.2 |
0.2-0.4 |
|
|
F50654 |
0.2 |
0.2 |
≤0.05 |
0.1 |
0.1 |
0.2 |
0.1-0.2 |
0.2-0.4 |
| E. faecalis
|
29212 |
0.1 |
0.1 |
≤0.05 |
0.1 |
≤0.05 |
0.2 |
≤0.05-0.1 |
0.78-1.56 |
|
|
Bc11148-2 |
0.78 |
0.78 |
0.1 |
0.4 |
0.78 |
3.13 |
0.4 |
> 50 |
| S. pyogenes
|
8668 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
| S. pneumo
|
9619 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
|
|
297-749 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
|
|
280-962 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
|
|
Erm 6849 |
0.2 |
0.4 |
0.1 |
0.78 |
0.4 |
12.5 |
0.1-0.4 |
> 50 |
|
|
Mef 5654 |
0.4 |
0.78 |
0.2 |
0.4 |
0.78 |
3.13 |
0.4-0.78 |
6.25-12.5 |
|
|
Mef S 3427 |
0.1 |
0.1 |
≤0.05 |
0.1 |
0.1 |
1.56 |
0.1-0.2 |
3.13-6.25 |
| H. influenzae
|
49247 |
3.13 |
6.25 |
3.13 |
3.13 |
6.25 |
6.25 |
3.13-6.25 |
6.25-12.5 |
|
|
2762 |
1.56 |
1.56 |
0.78 |
1.56 |
0.78 |
1.56 |
0.4-1.56 |
0.78-3.13 |
|
Table 7 In vitro antibacterial activity of compounds 14a-14d (MIC/µg·mL-1)
|
表8(Table 8)

Table 8 The pharmacokinetics parameters of compounds 14c and 14d
| Compd.
|
Dose/mg·kg-1
|
Plasma AUC, iv
/μg·h·mL-1
|
L/P AUC Ratio, iv |
CL
/mL·min-1·kg-1
|
Vss
/L·kg-1
|
t1/2/h |
F, po/%
|
| iv |
po
|
iv plasma |
po plasma |
po lung |
| Telithromycin |
5 |
15 |
2.5 |
16 |
100 |
5 |
1 |
1.5 |
1.3 |
11 |
| 14c
|
5 |
15 |
2.1 |
80 |
115 |
14 |
1.6 |
2.4 |
3.4 |
35 |
| 14d
|
5 |
15 |
2.3 |
94 |
107 |
12 |
1.3 |
1.7 |
1.4 |
26 |
|
Table 8 The pharmacokinetics parameters of compounds 14c and 14d
|
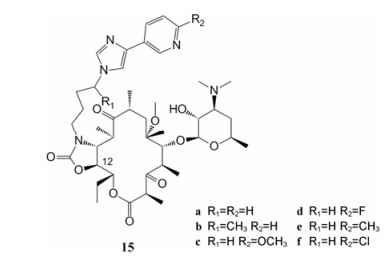
该课题组还对12-位进行了去甲基化修饰, 合成了12-位去甲基、11, 12-位环氨基甲酸酯芳烷基侧链取代的酮内酯类似物15 (图 15)。大部分化合物都保持与泰利霉素相似的抗菌谱。其中化合物15a具有与泰利霉素相同的侧链结构, 对绝大部分的检测菌株具有与泰利霉素相当的抗菌活性(表 9), 但对肠粪球菌Bc11148-2的抗菌活性(MIC > 50 µg·mL-1)要明显弱于泰利霉素(MIC = 0.4 µg·mL-1), 其余衍生物的抗菌活性相较于泰利霉素并无明显增强。因此12-位去甲基修饰可能无法增强酮内酯的抗菌活性[49]。
表9(Table 9)

Table 9 In vitro antibacterial activity of compounds 15a-15f (MIC/µg·mL-1)
| Strain |
15a
|
15b
|
15c
|
15d
|
15e
|
15f
|
Telithromycin |
Clarithromycin |
| S. aureus
|
29213 |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
0.1-0.2 |
0.7-0.78 |
|
|
33591 |
> 50 |
> 50 |
> 50 |
> 50 |
> 50 |
> 50 |
> 50 |
> 50 |
| S. epidermidis
|
14990 |
0.78 |
0.1 |
0.1 |
0.2 |
0.2 |
0.1 |
0.1-0.2 |
0.2-0.4 |
|
|
F50654 |
0.2 |
0.1 |
0.2 |
0.78 |
0.2 |
0.2 |
0.1-0.2 |
0.2-0.4 |
| E. faecalis
|
29212 |
0.1 |
0.1 |
≤0.05 |
≤0.05 |
0.1 |
≤0.05 |
≤0.05-0.1 |
0.78-1.56 |
|
|
Bc11148-2 |
> 50 |
1.56 |
6.25 |
25 |
3.13 |
0.4 |
0.4 |
> 50 |
| S. pyogenes
|
8668 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
| S. pneumo
|
9619 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
|
|
297-749 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
|
|
280-962 |
≤0.05 |
≤0.05 |
≤0.05 |
0.2 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
|
|
Erm 6849 |
0.2 |
0.4 |
50 |
12.5 |
50 |
0.4 |
0.1-0.4 |
> 50 |
|
|
Mef 5654 |
1.56 |
1.56 |
0.78 |
0.78 |
1.56 |
0.78 |
0.4-0.78 |
6.25-12.5 |
|
|
Mef S 3427 |
0.2 |
0.2 |
0.1 |
0.78 |
0.4 |
0.1 |
0.1-0.2 |
3.13-6.25 |
| H. influenzae
|
49247 |
3.13 |
3.13 |
6.25 |
3.13 |
3.13 |
6.25 |
3.13-6.25 |
6.25-12.5 |
|
|
2762 |
1.56 |
1.56 |
1.56 |
0.78 |
1.56 |
1.56 |
0.4-1.56 |
0.78-3.13 |
|
Table 9 In vitro antibacterial activity of compounds 15a-15f (MIC/µg·mL-1)
|
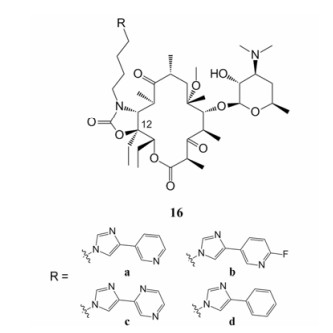
接着, 该课题组将12-甲基修饰成乙基, 合成了12-位乙基、11, 12,-位环氨基甲酸酯芳香侧链取代的酮内酯类似物16 (图 16)。化合物16a的侧链结构与泰利霉素相同, 抗菌活性也与泰利霉素一致(表 10)。该结果指示出将12-位修饰成乙基对增强化合物的抗菌活性并无明显作用[50]。
表10(Table 10)

Table 10 In vitro antibacterial activity of compounds 16a-16d (MIC/µg·mL-1)
| Strain |
16a
|
16b
|
16c
|
16d
|
Telithromycin |
Clarithromycin |
| S. aureus
|
29213 |
0.4 |
0.4 |
0.2 |
0.2 |
0.1-0.2 |
0.7-0.78 |
|
|
33591 |
> 50 |
> 50 |
> 50 |
> 50 |
> 50 |
> 50 |
| S. epidermidis
|
14990 |
0.2 |
0.2 |
0.2 |
0.2 |
0.1-0.2 |
0.2-0.4 |
|
|
F50654 |
0.2 |
0.2 |
0.2 |
0.1 |
0.1-0.2 |
0.2-0.4 |
| E. faecalis
|
29212 |
0.1 |
0.1 |
0.2 |
0.1 |
≤0.05-0.1 |
0.78-1.56 |
|
|
Bc11148-2 |
0.4 |
0.78 |
1.56 |
0.78 |
0.4 |
> 50 |
| S. pyogenes
|
8668 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
| S. pneumo
|
9619 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
|
|
297-749 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
|
|
280-962 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
≤0.05 |
|
|
Erm 6849 |
0.4 |
0.4 |
0.2 |
0.2 |
0.1-0.4 |
> 50 |
|
|
Mef 5654 |
0.4 |
0.4 |
0.4 |
0.4 |
0.4-0.78 |
6.25-12.5 |
|
|
Mef S 3427 |
0.1 |
0.1 |
0.1 |
≤0.05 |
0.1-0.2 |
3.13-6.25 |
| H. influenzae
|
49247 |
6.25 |
3.13 |
3.13 |
3.13 |
3.13-6.25 |
6.25-12.5 |
|
|
2762 |
0.4 |
0.78 |
nt |
Nt |
0.4-1.56 |
0.78-3.13 |
|
Table 10 In vitro antibacterial activity of compounds 16a-16d (MIC/µg·mL-1)
|
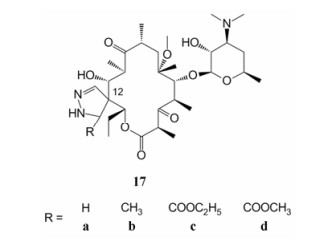
Hu等[51]设计合成了一系列12-位吡唑啉螺环取代的酮内酯衍生物。他们先用硼氢化钠将9-位羰基还原成羟基, 并用丙酮叉保护9-位和11-位羟基, 然后消除12-位羟基生成碳碳双键, 再进行[2+3]环加成反应, 即得一系列12-螺环取代的酮内酯类似物17 (图 17), 将这些化合物进行体外活性测定。结果显示(表 11), 所有衍生物对金葡菌的抗菌活性优于红霉素A与克拉霉素, 而对于肺炎链球菌和流感嗜血杆菌, 衍生物也保持与克拉霉素相当的抗菌活性。在这些衍生物中, 酯取代衍生物(17c、17d)对金葡菌ATCC29213、ATCC6538P的抗菌活性(MIC = 0.12 µg·mL-1)强于烷基取代类似物(17a、17b, MIC = 0.25~0.5 µg·mL-1)。其中化合物17d的抗菌活性最为突出, 金葡菌5676、5677的抗菌活性(MIC = 4 µg·mL-1)远高于克拉霉素(MIC > 1 024 µg·mL-1); 化合物17d对肺炎链球菌6268、673的抗菌活性(MIC = 8 µg·mL-1)是克拉霉素的2倍(MIC > 16 µg·mL-1), 由此结果可以看出, 对12-位螺环修饰可能对增强化合物的抗菌活性有所帮助。
表11(Table 11)

Table 11 In vitro antibacterial activity of compounds 17a-17d (MIC/µg·mL-1)
| Strain |
17a
|
17b
|
17c
|
17d
|
Erythromycin A |
Clarithromycin |
| S. aureus
|
ATCC 29213 |
0.25 |
0.5 |
0.12 |
0.12 |
0.5 |
0.25 |
|
|
ATCC 6538P |
0.25 |
0.25 |
0.12 |
0.12 |
0.5 |
0.5 |
|
|
26001 |
0.12 |
0.12 |
0.12 |
0.03 |
≤0.063 |
≤0.063 |
|
|
5676 |
4 |
8 |
8 |
4 |
> 1024 |
> 1024 |
|
|
5677 |
8 |
8 |
8 |
4 |
> 1024 |
> 1024 |
|
|
AD-08 |
512 |
512 |
512 |
256 |
> 1024 |
> 1024 |
| S. pneumonia
|
1210 |
> 64 |
> 64 |
> 64 |
> 64 |
> 32 |
> 16 |
|
|
2860 |
0.5 |
0.5 |
0.5 |
0.5 |
0.25 |
0.125 |
|
|
6268 |
> 64 |
> 64 |
8 |
8 |
> 32 |
> 16 |
|
|
673 |
> 64 |
> 64 |
8 |
8 |
> 32 |
> 16 |
| H. influenza
|
2412 |
> 8 |
> 8 |
> 8 |
> 8 |
4 |
8 |
|
|
5096 |
0.06 |
0.06 |
0.06 |
0.06 |
0.06 |
0.06 |
|
Table 11 In vitro antibacterial activity of compounds 17a-17d (MIC/µg·mL-1)
|
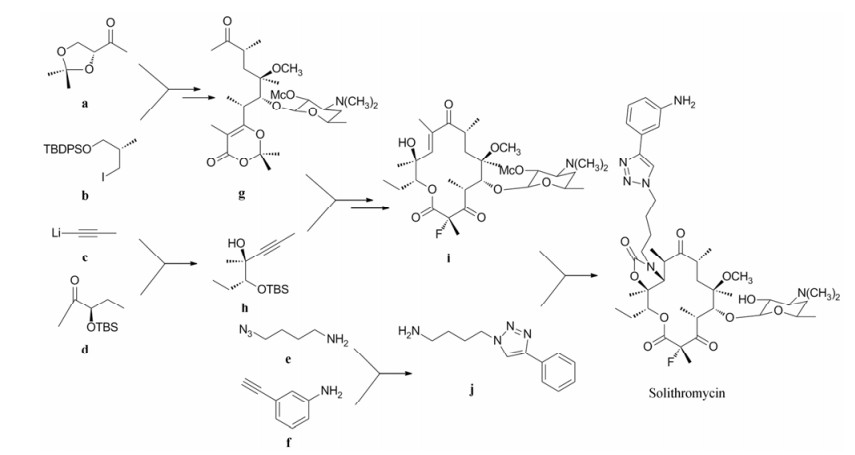
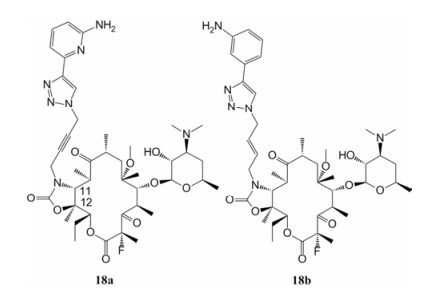
3 酮内酯类抗生素的全合成 以上对酮内酯抗生素的结构修饰, 都是在大环内酯结构的基础上通过半合成的途径进行的, 但受限于酮内酯复杂大环结构的影响, 衍生化进度慢, 衍生物种类少, 且很多修饰工作因所用的化学方法不能适用于大环底物而无法开展。为了提高新药研发效率, 哈佛大学Seiple等[52]建立了“模块式”合成大环内酯衍生物的策略:作者通过合理设计, 将大环内酯结构拆分成多个模块, 并将结构修饰转移到模块水平进行, 最后将这些已修饰好的化学模块汇聚组装成大环内酯结构, 得到多样化的衍生物。通过该全合成的手段, 作者快速得到了包括已获批的药物泰利霉素、临床候选药物索利霉素在内的300多个大环内酯衍生物。本文以索利霉素为例进行该全合成策略的简介(图 18):模块a、b经7步反应, 得到关键中间体g; 模块c、d经加成反应, 合成出关键中间体h; 模块e、f经Click反应形成五元三唑环, 得到侧链j。然后以上三部分结构再逐步组装, g与h通过加成反应经6步组装出大环结构, 最后在DBU与咪唑的作用下引入侧链j, 得到目标产物索利霉素(共计14步反应, 收率为16%)。然后作者以红霉素、阿奇霉素、泰利霉素、索利霉素为对照药物, 对所得到的305个衍生物进行体外活性测定。83%的衍生物对待测的敏感型肺炎链球菌的抗菌活性为MIC≤4 µg·mL-1, 其中索利霉素衍生物18a、18b (图 19)的抗菌活性最为卓越(表 12), 对ermB和mefA基因介导耐药的肺炎链球菌的抗菌活性十分突出(MIC≤0.03 µg·mL-1); 对金葡菌ATCC29213及BAA-977的MIC均为0.06 µg·mL-1; 对化脓性链球菌ATCC19615的抑菌活性也与4种对照药物的活性相当; 此外对所测的流感嗜血杆菌、鲍曼不动杆菌、肺炎克雷伯菌、大肠杆菌、铜绿假单胞菌等革兰阴性菌也具有良好抗菌活性, 均高于所选的4种对照药物。由于这两个化合物的抗菌活性十分突出, 该课题组将其选做先导物, 进行更多的活性研究。
表12(Table 12)

Table 12 In vitro antibacterial activity of compounds 18a and 18b (MIC/µg·mL-1)
| Species |
Strain |
18a
|
18b
|
Erythromycin A |
Azithromycin |
Telithromycin |
Solithromycin |
| S. aureus
|
ATCC 29213 |
0.06 |
0.06 |
0.5 |
1 |
0.125 |
0.125 |
|
|
BAA-977 |
0.06 |
0.06 |
> 256 |
> 256 |
0.06 |
≤0.03 |
|
|
MP513 |
16 |
64 |
> 256 |
> 256 |
256 |
> 64 |
|
|
NRS384 |
0.06 |
0.125 |
64 |
128 |
0.125 |
0.25 |
| S. pneumoniae
|
ATCC 49619 |
≤0.03 |
≤0.03 |
0.03 |
0.06 |
≤0.03 |
≤0.03 |
|
|
UNT-042 |
≤0.03 |
≤0.03 |
> 256 |
> 256 |
0.125 |
0.25 |
| S. pyogenes
|
ATCC 19615 |
≤0.03 |
≤0.03 |
≤0.03 |
≤0.03 |
≤0.03 |
≤0.03 |
| E. faecalis
|
ATCC 29212 |
0.03 |
≤0.03 |
1 |
1 |
≤0.03 |
≤0.03 |
|
|
UNT-047 |
1 |
4 |
> 256 |
> 256 |
16 |
32 |
| H. influenzae
|
ATCC 49247 |
2 |
2 |
4 |
2 |
2 |
4 |
| A. baumannil
|
ATCC 19606 |
2 |
4 |
16 |
32 |
4 |
16 |
| K. pneumoniae
|
ATCC 10031 |
2 |
4 |
4 |
2 |
4 |
4 |
| E. coli
|
ATCC 25922 |
8 |
16 |
64 |
4 |
16 |
32 |
| P. aeruginosa
|
ATCC 27853 |
16 |
32 |
64 |
64 |
64 |
64 |
|
Table 12 In vitro antibacterial activity of compounds 18a and 18b (MIC/µg·mL-1)
|
4 总结与展望 科研工作者对酮内酯类抗生素进行了大量结构修饰的工作, 以期发现抑菌作用更强、药代动力学性质更好、抗菌谱更广的新型酮内酯抗生素。但抗生素的研发速度难以解决日益严重的细菌耐药问题, 泰利霉素又因为存在肝毒性问题被减少适应症, 因此寻找新的抗生素资源刻不容缓。前人的工作有助于加深了解酮内酯的构效关系与作用机制, 在此基础上进一步寻找合适的修饰方向、加大对酮内酯的研发力度, 从而促进开发具有更优抗耐药菌效果和更小不良反应的酮内酯抗生素, 这对于解决当前的抗生素耐药难题是十分必要的。
 2018, Vol. 53
2018, Vol. 53


