2. 山西大学 化学化工学院, 山西 太原 030006;
3. 山西大学 地产中药功效物质研究与利用山西省重点实验室, 山西 太原 030006;
4. 山西大学 化学生物学与分子工程教育部重点实验室, 山西 太原 030006;
5. 美国路易斯维尔大学医学院, 路易斯维尔 40292;
6. 中国医学科学院、中国协和医科大学药物研究所, 北京 100050
2. College of Chemistry and Chemical Engineering, Shanxi University, Taiyuan 030006, China;
3. Key Laboratory of Effective Substances Research and Utilization in TCM of Shanxi Province, Shanxi University, Taiyuan 030006, China;
4. Key Laboratory of Chemical Biology and Molecular Engineering of Ministry of Education, Shanxi University, Taiyuan 030006, China;
5. Medical College, University of Louisville, Louisville 40292, USA;
6. Institute of Materia Medica, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
黄芪是我国常用大宗药材之一, 中国是商品黄芪唯一的产地和出口国, 《神农本草经》列其为上品[1]。2015版《中国药典》规定其为豆科植物蒙古黄芪Astragalus membranaceus (Fisch.) Bge. var. mongholicus (Bge.) Hsiao或膜荚黄芪Astragalus membranaceus (Fisch.) Bge.的干燥根[2]。蒙古黄芪作为市场主流商品, 传统为野生和仿野生(种子直播生长6年以上)种植方式, 其道地产区主要是山西和内蒙古。然而由于黄芪在医药、保健品等行业均有大量需求, 传统黄芪的产量已远远供不应求。在甘肃等地快速发展的移栽芪(育苗移栽2年)因生长年限短、产量大、成本低, 一度占领商品黄芪市场。分布在山西北部的“恒山黄芪”主要作为高端礼品芪, 远销国际市场, 具有鞭杆态、粗壮、柔韧如绵、金井玉栏、粉性、味甘、豆腥气浓等道地特性[3]。
目前, 针对两类商品黄芪质量评价指标均以化学评价为主, 药典项下的含量测定指标为黄芪甲苷和毛蕊异黄酮葡萄糖苷, 文献[4, 5]报道以上两种成分是黄芪中的有效成分, 其含量受原植物种属、产地、生长年限、种植方式等多种因素影响[6]。然而, 市场商品黄芪药材的化学指标含量测定结果却与中医药行业传统道地药材质量评价方式存在矛盾: Niu等[7]考察了不同等级黄芪皂苷与黄酮两大类10种成分含量的差异, 发现黄芪商品等级越低、直径越细, 黄芪甲苷的量越高, 黄酮类成分的结果未呈现出规律性变化。Wang课题组[8]发现不同商品规格黄芪中毛蕊异黄酮葡萄糖苷和黄芪甲苷与商品规格的划分无显著性相关性。这都提示目前的质量评控指标并不能体现黄芪药材的质量优劣。许多学者提出中药指纹图谱可以更合理地评价药材的真实性、一致性和稳定性[9]。然而, 这种化学检测手段表征的中药化学成分信息与中药药效、中医临床疗效之间仍缺乏科学的关系, 且药材质量评价的最终标准是生物效应, 因此, 建立生物效应(药效)评价指标, 对更全面的建立中药材质量评价标准具有重要意义。
传统中医认为黄芪是补气良药, 素有“十药八芪”之称, 现代药理研究以及临床应用表明, 黄芪具有抗疲劳、抗心衰、抗病毒等多种生物活性[10, 11]。Yan等[12]对浑源仿野生蒙古黄芪、武川栽培蒙古黄芪、土默特右旗栽培蒙古黄芪及野生蒙古黄芪的抗疲劳作用通过负重力竭游泳实验进行比较研究, 发现4种不同产地的蒙古黄芪均可显著延长小鼠力竭游泳时间, 同时4个产地黄芪均可显著降低运动后小鼠血液乳酸、尿素氮含量, 增加乳酸脱氢酶活性。但是, 传统药理学实验存在灵敏度不高、重现性差等问题, 因此引入代谢组学技术来补充传统药效评价指标的不足。代谢组学是一种用于全面定量分析生物体中代谢物变化的系统评价方法, 其特点在于可以利用样品的整体生物信息, 通过模式识别客观地进行分类, 并能寻找出对分类有较大贡献的一组化合物[13]。其中, 1H NMR代谢组学具有良好的客观性和重现性, 可同时检测多种代谢物, 并对所有化合物的灵敏度一致, 图谱中的信号峰强度与其浓度成正比, 可直接比较相应浓度进行定量分析[14], 是当前代谢组学研究中的主要技术。
因此, 本文通过“游泳劳损加限制饮食”方式造模, 采用1H NMR代谢组学技术结合多元统计方法分析大鼠腓肠肌中代谢产物的变化规律, 筛选黄芪抗疲劳作用的最佳给药剂量, 寻找生物标志物, 探索其可能的作用机制, 为不同产地以及不同等级黄芪的抗疲劳药效比较奠定基础, 为商品标准建立和中药材“辨状论质”科学内涵阐释提供依据。
材料与方法材料 黄芪, 由山西省浑源县泽清芪业开发有限公司赵贵富提供, 样品采自山西省浑源县官儿乡, 样本编号为HQ-SX-111, 仿野生6年, 经山西大学中医药现代研究中心秦雪梅教授鉴定为蒙古黄芪Astragalus membranaceus (Fisch.) Bge. var. mongholicus (Bge.) Hsiao, 样品保存于山西大学中医药现代研究中心。
仪器 Bruker 600-MHz Avance Ⅲ NMR Spectrometer (600.13 MHz质子频率, 德国布鲁克公司600兆核磁仪), TGL高速台式冷冻离心机(湖南湘仪离心机仪器有限公司), UP-250手持式超声波细胞粉碎机(宁波新芝生物科技股份有限公司), KYL-3氮吹仪专用空气源及SPT-24氮吹空扫浓缩仪(北京斯波特科技有限公司), 自动生化分析仪(Thermor Scitific; 型号: Prime30)。
试剂 磷酸二氢钠、磷酸氢二钠(天津市化学试剂六厂, 分析纯), 甲醇(天津市大茂化学试剂厂, 分析纯), 重水(D2O, Norell, 美国), 氘代氢氧化钠(Armar, 瑞士), 3-(三甲基硅基)氘代丙酸钠(TSP, Cambridge Isotope Laboratories Inc., 美国)。
动物与分组 SPF (无特定病原体)级雄性SD大鼠180~200 g若干只, 购自北京维通利华实验动物技术有限公司, 动物许可证号SCXK (京) 2017-0012。饲养室环境:温度25 ± 2 ℃、湿度50% ± 10%、12 h明暗交替光照。适应一周后, 首先进行游泳能力筛选, 剔除不会游泳的和游泳能力特别强的, 筛选出50只SD大鼠, 开始实验, 分为空白组(NS)、模型组(MS)、黄芪低剂量组(AL, 3 g·kg-1)、黄芪中剂量组(AM, 6 g·kg-1)和黄芪高剂量组(AH, 12 g·kg-1), 每组10只。所有大鼠每天早上按0.1 mL·kg-1体重灌胃一次, 连续3周, 给药组灌胃黄芪水提物, 空白组和模型组给予等体积的生理盐水。
负重力竭游泳实验 每天给药1 h后, 所有大鼠(除空白组外)进行负重游泳至力竭, 自由饮水, 模型组和各给药组给予空白组一半的饲料量, 持续21天, 期间每隔2天称一次体重, 最后一天灌胃1 h后, 称重, 并负铅块, 置于水温25 ± 1 ℃的圆形水槽中进行游泳, 开始计时, 直至大鼠沉入水底且10 s内不再浮出水面为止, 记录得到大鼠负重游泳力竭时间。从游泳缸里取出大鼠, 用干毛巾擦干, 腹腔注射20%乌拉坦(0.75 mL/100 g体重), 使其麻醉, 迅速股动脉取血, 离心, 分装; 剥离所有大鼠的肌肉(腓肠肌)组织, -80 ℃保存, 备用。
血清生化指标的测定 血清中的总胆固醇(TC)、甘油三酯(TG)、葡萄糖(GLU)、尿素氮(BUN)以及肌酸激酶(CK)、乳酸脱氢酶(LDH)均使用市售试剂盒, 通过全自动生化分析仪测定。
样本制备 肌肉组织解冻后, 取200 mg, 剪碎(冰上操作), 于2 mL EP管中, 加入甲醇-水(v/v, 2:1) 1 mL, 冰浴上匀浆提取两次, 匀浆液于4 ℃、13 000 r·min-1离心15 min, 合并上清液, 转移至5 mL EP管中氮吹, 吹干后的样品用磷酸盐缓冲液(pH 7.40, 包含D2O, 0.1 mol·L-1, Na2HPO4/NaH2PO4, 0.01%TSP) 750 μL溶解, 于4 ℃、13 000 r·min-1离心20 min, 取上清液600 μL, 转移至5 mm的核磁管中, 进行核磁分析。
1H NMR测试条件 Bruker 600 MHz AVANCE Ⅲ NMR谱仪采集数据, 样品采用Noesygppr1d序列以压制水峰, 扫描次数为64, 谱宽12 345.7 Hz, 图谱大小65 536数据点, 脉冲宽度(PW) = 30° (12.7 μs), 傅里叶变换LB = 0.3 Hz, 延迟时间为5.0 s。
1H NMR图谱处理 采用MestReNova核磁图谱处理软件对所有1H NMR图谱进行手动相位和基线调整。所有图谱, 以TSP (δ 0.00)为标准对谱图进行化学位移的校正, 对δ 0.60~9.00区域的谱图进行0.01等宽度分割积分, 水峰δ 4.68~5.20区域切除, 将产生的所有积分数据进行“质量”归一化, 以消除称取组织的重量差异。
数据处理 运用SIMCA-P 13.0 (Umetrics, 瑞典)软件将积分数据进行中心化和归一化后, 进行多元统计分析。主成分分析(principal component analysis, PCA)反映的是样本内部固有的差异性和相似性, 以显示数据的原始分类状态; 进一步采用偏最小二乘法判别分析(partial least squares discriminant analysis, PLS-DA)和正交偏最小二乘法判别分析(orthogonal PLS-DA, OPLS-DA), 结合OPLS-DA的VIP值和相应的S-plot寻找样品间的差异代谢产物。排列实验(permutation tests, 200次)用来验证PLS-DA的有效性。
采用GraphPad Prism (version 6.0, GraphPad Software, Inc.)软件对差异代谢物进行one-way ANOVA分析, 以P<0.05表明有统计学意义。
结果与分析 1 传统药效学研究 1.1 行为学观察随着造模时间的延长, 除空白组外, 其余各组大鼠开始出现背部皮毛粗燥且竖立发黄, 无光泽, 腹部皮毛极不顺滑, 呈撮状, 颜色较黄; 平时在鼠笼里蜷缩懒动, 对于惊吓反应较迟缓, 每天早上灌胃给药对于抓捕的挣扎感不强; 个别粪便不成形, 较稀溏; 有拱背、眯眼、扎堆现象。伴随着给药时间增加, 发现黄芪中剂量和高剂量在给药第二周内大鼠行为活动逐步好转, 而低剂量黄芪在第3周内大鼠行为活动有所好转。
1.2 黄芪对大鼠体重的影响随着造模时间和给药时间的增加, 除空白组外, 其余4组大鼠的体重呈现逐渐下降趋势, 从第7天开始, 给药组和模型组体重与空白组相比均显著性降低; 至第21天, 与空白组相比, 其余各组大鼠体重仍呈现显著性下降, 但与模型组相比, 各给药组大鼠体重有显著性升高(图 1)。
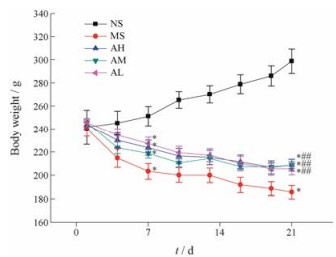
|
Figure 1 Effects of Astragali Radix on the body weight of rats. NS: Control group, MS: Model group, AH: High dose group, AM: Medium dose group, AL: Low dose group. n = 6, x ± s. *P < 0.05 vs control group; ##P < 0.01 vs model group |
由图 2可见, 与模型组相比, 各给药组大鼠的游泳时间均延长, 但黄芪中、高剂量组有极显著性提高。黄芪低剂量干预后, 大鼠力竭游泳时间个体差异较大, 因而与空白组相比, 无统计学差异(P>0.05)。
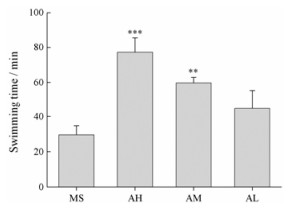
|
Figure 2 Effects of Astragali Radix on exhaustive swimming time of rats. n = 6, x ± s. **P < 0.01, ***P < 0.001 vs model group |
CK和LDH参与能量代谢, 与空白组相比, 模型组的CK水平显著性升高(P<0.001), 黄芪高、中、低剂量干预后均有显著的回调(P<0.001); LDH水平显著性降低(P<0.05), 高剂量和中剂量黄芪对其有回调作用; 与空白组相比, 模型组中血清中BUN显著性升高(P<0.001), 给药后都有显著性回调; 而GLU的水平与空白组相比, 模型组的GLU显著性降低(P<0.05), 只有高剂量的黄芪对其有回调作用; 而参与脂质代谢的TC和TG水平, 与空白组相比, 模型组的TC和TG都有显著性升高(P<0.05), 高剂量和中剂量对二者有显著性回调作用(表 1)。
| Table 1 Effects of Astragali Radix on serum biochemical parameters. CK: Creatine kinase; LDH: Lactate dehydrogenase; BUN: Blood urea nitrogen; GLU: Glucose; TC: Total cholesterol; TG: Triglycerides. n = 6, x ± s. *P < 0.05, ***P < 0.001 vs control group; #P < 0.05, ##P < 0.01, ###P < 0.001 vs model group |
根据Chenomx NMR suite (试用版, Chenmx Inc., Canada)中标准化合物的化学位移, HMDB (the Human Metabolome Database, http://www.hmdb.ca/)和BMRB (Biological Magnetic Resonance Data Bank, http://www.bmrb.wisc.edu/)数据库以及文献[15-17]中数据对图谱进行指认, 在大鼠腓肠肌中共指认出32种代谢产物, 包含大量的氨基酸、碳水化合物、有机酸、核苷酸等化合物(图 3和表 2)。
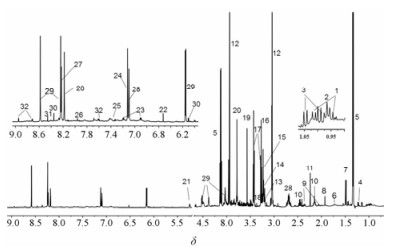
|
Figure 3 1H NMR spectrum of muscle from a rat in control group. The metabolites labeled with numbers are listed in Table 2 |
| Table 2 1H NMR assignments of major metabolites from rat muscle. PC: Phosphatidylcholine; GPC: Glycerophosphocholine; TMAO: Trimethylamine oxide; AMP: Adenosine monophosphate |
由于NMR图谱反映的信息较多, 很难直观地反映出各组之间的差异, 因此借助多元统计分析做进一步的分析。采用PCA散点图对所有样本进行分析, 以显示数据的原始分类状态(图 4), 可以看出空白组与模型组明显分离, 表明模型复制成功; 黄芪低、高剂量在二维空间里更接近于模型组, 而中剂量沿t[2]轴与模型组明显分开, 说明中剂量相对其他剂量组与模型组差异较大, 提示具有明显回调作用。
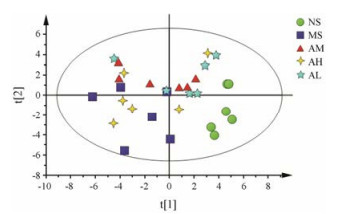
|
Figure 4 PCA score plots of muscle from all rats |
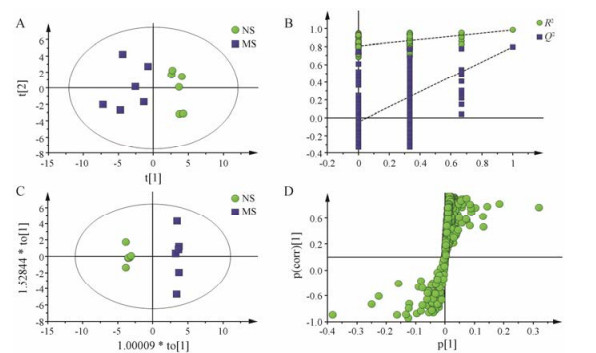
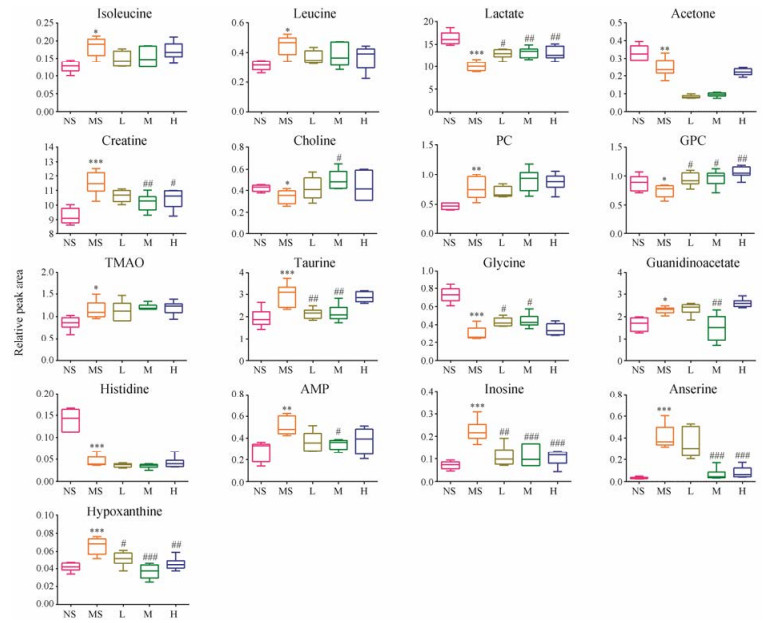
为直观分析模型组与空白组之间的差异, 首先采用PCA散点图(图 5A)观察两组样本的分离趋势, 可以看出模型组与空白组明显分离; 进一步采用OPLS-DA分析, 但其建立在PLS-DA模型成立的基础上, 从图 5B中可以看出, 排列实验表明随机变量y变量产生的R2、Q2均小于原始值(其中, R2和Q2值分别表示对数据的解释程度和对模型的预测能力)证明模型有效可靠。OPLS-DA分析(图 5C)后, 通过S-plot (图 5D)结合VIP值(>1), 并进行独立样本t检验(P<0.05)寻找差异代谢物, 共得到17个具有显著性差异的潜在生物标志物。然后对所有组的17个生物标志物进行one-way ANOVA分析(图 6), 结果显示:与空白组相比, 模型组大鼠腓肠肌中异亮氨酸、亮氨酸、肌酸、磷酸胆碱、氧化三甲胺、牛磺酸、胍基乙酸、AMP、肌苷、组氨酸、次黄嘌呤、鹅肌肽水平升高, 乳酸、丙酮、胆碱、甘磷酸胆碱、甘氨酸、组氨酸水平降低。黄芪干预后能显著回调的有11个, 包括乳酸、肌酸、胆碱、甘磷酸胆碱、甘氨酸、牛磺酸、胍基乙酸、AMP、肌苷、次黄嘌呤和鹅肌肽, 其中, 高剂量能回调6个, 中剂量能回调11个, 低剂量能回调5个, 表明黄芪能够一定程度发挥抗疲劳作用, 且中剂量效果最好。
|
Figure 5 PCA scores plot (A), PLS-DA permutation test (B), OPLS scores plot (C) and corresponding S-plot (D) of muscle of rats in control and model groups |
|
Figure 6 The comparison of relative peak areas of potential biomarkers in 1H NMR spectra of muscle. n = 6, x ± s. *P < 0.05, **P < 0.01, ***P < 0.001 vs control group; #P < 0.05, ##P < 0.01, ###P < 0.001 vs model group |
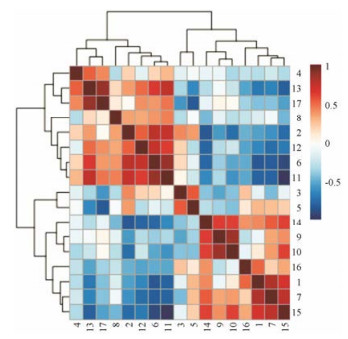
大鼠肌肉中差异性代谢物相关性分析结果如图 7所示, 从此图中可以看出差异性代谢物之间的相关性。从横轴上看, 同一聚类簇的代谢物正相关性最强, 即某一个代谢物的含量升高或降低, 则与之相关性强的代谢物会随之升高或降低。如次黄嘌呤与组氨酸、氧化三甲胺与牛磺酸有较强的正相关性; 肌苷与胆碱、甘氨酸呈负相关。这些结果提示, 黄芪抗疲劳的作用机制可能与多条通路相关, 且这些代谢物与代谢途径相互关联、相互影响。
|
Figure 7 Correlation analysis of differential metabolites. 1: Isoleucine; 2: Leucine; 3: Lactate; 4: Acetone; 5: Creatine; 6: Choline; 7: PC; 8: GPC; 9: TMAO; 10: Taurine; 11: Glycine; 12: Guanidinoacetate; 13: Histidine; 14: AMP; 15: Inosine; 16: Anserine; 17: Hypoxanthine. The horizontal axis and vertical axis represent variable information; the deep color represents strong correlation, and the light color represents weak correlation; the brown denotes positive correlation, and the blue denotes negative correlation |
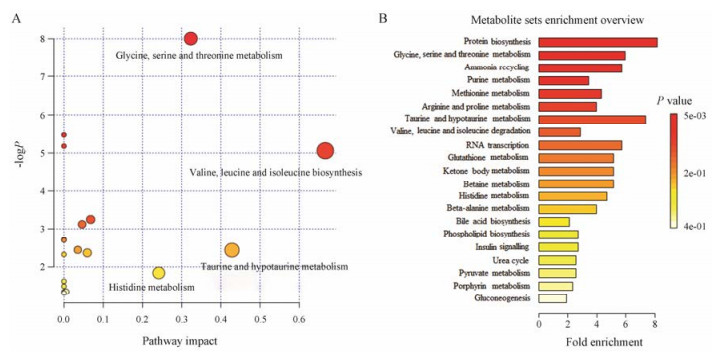
采用1H NMR图谱分析手段检测出32种肌肉代谢产物, 并筛选出17种差异代谢物。将这些差异代谢物输入metaboanalyst中进行通路富集分析, 富集概况图中(图 8B), 富集倍数越大说明参与此条通路的代谢物越多, P值越大(颜色越深), 表示参与其中代谢物或代谢通路发生的变化越明显[18]。MetPA通路分析结果(图 8A)与代谢产物富集结果一致。图A中, 圆点颜色越深参与此通路的代谢物越多, 圆点越大则它在此次机体的整体代谢轮廓中占的比重越大, 作用越明显[19]。其中MetPA共给出18条通路分析的结果, 综合Holm P值、FDR (false discovery rate)和Impact值共发现4条重要的代谢通路:缬氨酸、亮氨酸、异亮氨酸生物合成, 牛磺酸及亚牛磺酸代谢, 甘氨酸、丝氨酸和苏氨酸代谢和组氨酸代谢, 推测黄芪干预疲劳大鼠发挥抗疲劳作用可能与调控氨基酸代谢途径密切相关。
|
Figure 8 MetPA analysis of metabolic pathway (A) and enrichment of metabolite sets (B) |
肌肉作为力竭游泳时直接作用的靶器官, 处于不断收缩和舒张的状态, 与疾病有直接关系, 可以揭示组织特异性代谢过程。因此本研究基于力竭游泳致疲劳大鼠模型, 采用1H NMR代谢组学探讨疲劳大鼠肌肉中代谢物的变化及黄芪抗疲劳可能的作用机制。
负重力竭游泳实验是评价各种生物活性化合物抗疲劳作用的经典有效模型[20], 力竭游泳会导致身体与精神的疲劳, 大鼠体重下降反映疲劳程度, 而游泳持续时间的提高是抗疲劳作用最有力的表现。CK和LDH被认为是评价肌肉损伤程度的两个很重要的指标, 正常状态下, CK处于肌肉中, 它的功能是使肌酸上增加磷酸基团, 进而转化为高能分子磷酸肌酸, 它可以迅速释放能量。当肌肉损伤时, CK不能正常发挥功能, 肌肉细胞破裂, CK进入血液, 在血液中检测到CK含量增加, 暗示肌肉损伤发生。本实验中模型组的CK含量明显高于空白组, 给予黄芪后, CK含量明显降低[21]。LDH是参与糖酵解与糖异生的重要酶, 它能催化丙酮酸与乳酸之间的相互转化[22], 随着运动强度的增加, 无氧代谢产生的乳酸较多, 导致肌肉和血液中pH降低, 对机体产生危害, 因此快速清除大量的乳酸可以缓解疲劳。给予黄芪后, 大鼠血清LDH活性增高, 乳酸积累减少, 因而力竭游泳时间延长, 疲劳延缓。BUN是蛋白质和氨基酸的代谢产物, 用于评价机体遭遇负荷刺激时的承受能力, 运动强度越大时, BUN升高得越显著[23]。模型组中BUN含量明显高于空白组, 给予黄芪可以清除积累的BUN。GLU是机体必要的能源物质, 参与有氧代谢产生较多的能量以满足运动的需要。给予黄芪可以使血液中葡萄糖含量升高, 提高运动能力。血清中的TC和TG都是参与脂肪代谢的指标[24], 模型组中两者含量较高, 说明脂肪没能得到及时的氧化分解, 不能为机体功能。黄芪可能通过加速脂肪酸的氧化分解, 促进脂肪利用从而产生较多能量, 加大运动强度。
缬氨酸、亮氨酸、异亮氨酸是机体必需氨基酸中的3种支链氨基酸, 其中异亮氨酸和缬氨酸是生糖氨基酸, 亮氨酸是生酮氨基酸, 可以调节骨骼肌中葡萄糖的氧化利用, 3种氨基酸的存在提高了机体葡萄糖的产生和利用, 进而产生较多的能量以维持运动[25]。与模型组相比, 给药组的亮氨酸和异亮氨酸水平降低, 提示其可能转化成了葡萄糖, 提供能量, 增强了大鼠的运动耐力。牛磺酸主要在动物生理或劳损状态下维护细胞膜结构的稳定以及调节渗透平衡, 对细胞膜的脂质过氧化具有防护作用[26]。另外, 牛磺酸可以与胰岛素受体结合, 促进肌肉组织对葡萄糖、必需氨基酸的摄取和利用, 加速糖酵解, 增加糖异生[27]。黄芪干预后腓肠肌中牛磺酸水平降低, 说明黄芪能加速牛磺酸的代谢, 促进肌肉组织对葡萄糖的利用。甘氨酸、丝氨酸是生糖氨基酸, 甘氨酸由丝氨酸合成, 甘氨酸和精氨酸可以转化成胍基乙酸, 而胍基乙酸和S-腺苷甲硫氨酸可以转化为肌酸, 甘氨酸和肌酸均为重要的储能物质[28]。给药后甘氨酸含量升高, 说明黄芪能使机体能量增加, 有利于疲劳的恢复。组氨酸是一种碱性杂环氨基酸, 肌肽是由组氨酸和丙氨酸构成的二肽, 它是肌肉组织重要的缓冲物质, 人和多种动物肌肉中均含有肌肽、鹅肌肽。肌肽对保证肌肉收缩, 供给肌肉收缩能量和糖酵解不断进行均有独特的功用[29]。黄芪干预组中, 组氨酸水平提高, 肌肽合成增加, 为肌肉收缩提供能量。综上所述, 黄芪主要通过调节机体氨基酸代谢, 进一步参与糖代谢, 促进糖酵解, 增加糖异生, 在大鼠力竭游泳时提供所需能量。
本文依据1H NMR代谢组学分析技术对黄芪的抗疲劳作用进行了解释, 黄芪干预后, 可以显著延长大鼠的力竭游泳时间, 多元统计分析结果表明高剂量、中剂量和低剂量组分别能显著回调其中6、11、5个病理标志物, 对疲劳大鼠的骨骼肌代谢紊乱起到一定的改善作用, 且中剂量(6 g·kg-1)的改善效果相对更好。代谢通路结果分析显示黄芪主要通过调控大鼠肌肉中氨基酸代谢来缓解疲劳。但是仅仅依据肌肉代谢组来探讨黄芪抗疲劳药效机制略显不足, 这提示可以结合多个样本进一步分析其作用机制。山西野生黄芪作为传统道地药材, 与甘肃移栽芪在同剂量下的抗疲劳效果是否具有一定差异, 仍然需要进一步验证。
| [1] | Chu C, Qi LW, Liu EH, et al. Radix Astragali (Astragalus):latest advancements and trends in chemistry, analysis, pharmacology and pharmacokinetics[J]. Curr Org Chem, 2010, 14: 1792–1807. DOI:10.2174/138527210792927663 |
| [2] | Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. Part 1. 2015 ed. Beijing: China Medical Science Press, 2015: 302-303. |
| [3] | Gao FR, Li K, Hao X, et al. Identification of cultured and natural Astragali Radix based on fingerprint of monosaccharides[J]. Chin Tradit Herb Drug (中草药), 2015, 46: 2134–2142. |
| [4] | Xiong YF, Qin XM, Li K, et al. Analysis on rationality of medicinal product commodity specifications from determination of chemical components in Astragalus Radix[J]. Chin Tradit Herb Drug (中草药), 2016, 47: 2194–2198. |
| [5] | Lee EJ, Jung HS, Kang SS. Phytochemical studies on Astragalus root flavonoids and a lignin[J]. Nat Prod Sci, 2008, 14: 131–137. |
| [6] | Wang XJ, Li ZY, Xue SY, et al. Comparison of the content of major flavonoids in the introduced and cultivated Radix Astragali[J]. Bull Bot Res (植物研究), 2011, 31: 358–362. |
| [7] | Niu QY, Wan YQ, Li ZY, et al. Evaluation of different goods quality grade Astragalus[J]. Chin Med Mat (中药材), 2015, 38: 1186–1190. |
| [8] | Xin B, Ma SJ, Wang WQ, et al. Influence of different growing years on accumulation of flavonoids and saponins in Astragali radix[J]. Chin Med Mat (中药材), 2015, 38: 1366–1369. |
| [9] | Zhao G, Peng LX, Wang S, et al. HPLC fingerprint antioxidant properties study of buckwheat[J]. J Integr Agric, 2012, 11: 1111–1118. DOI:10.1016/S2095-3119(12)60104-X |
| [10] | Zhao XX. Analysis on pharmacological action and clinical application of Radix Astragali[J]. Clin J Chin Med (中医临床研究), 2014, 6: 122–123. |
| [11] | Tian FY. Pharmacological analysis and clinical application on Astragalus membranaceus[J]. Chin Heal Standard Management (中国卫生标准管理), 2016, 7: 148–149. |
| [12] | Yan T, Ren K, Bai XR, et al. Anti-fatigue effects of Astragalus membranaceus (Fisch.) Beg. var. mongholicus (Beg.) Hsiao from different genuine habitats on mice[J]. Mod Chin Med, 2017, 19: 924–928. |
| [13] | Markley JL, Brüschweiler R, Edison AS, et al. The future of NMR-based metabolomics[J]. Curr Opin Biotechnol, 2016, 43: 34–40. |
| [14] | Liu X, Wang YH. The application of NMR-based metabolomics technique to medicinal plants[J]. Acta Pharm Sin (药学学报), 2017, 52: 541–549. |
| [15] | Lardon I, Nilsson GE, Stecyk JAW, et al. 1H NMR study of the metabolome of an exceptionally anoxia tolerant vertebrate, the crucian carp (Carassius carassius)[J]. Metabolomics, 2013, 9: 311–323. DOI:10.1007/s11306-012-0448-y |
| [16] | Eisner R, Stretch C, Eastman T, et al. Learning to predict cancer-associated skeletal muscle wasting from 1H NMR profiles of urinary metabolites[J]. Metabolomics, 2011, 7: 25–34. DOI:10.1007/s11306-010-0232-9 |
| [17] | Lu J, Shi Y, Wang S, et al. NMR-based metabolomic analysis of Haliotis diversicolor exposed to thermal and hypoxic stresses[J]. Sci Total Environ, 2016, 280: 545–546. |
| [18] | Xia J, Wishart DS. MSEA:a web-based tool to identify biologically meaningful patterns in quantitative metabolomic data[J]. Nucleic Acids Res, 2010, 382: 71–77. |
| [19] | Xia J, Wishart DS. MetPA:a web-based metabolomics tool for pathway analysis and visualization[J]. Bioinformatics, 2010, 26: 2342–2344. DOI:10.1093/bioinformatics/btq418 |
| [20] | Tanaka M, Nakamura F, Mizokawa S, et al. Establishment and assessment of a rat model of fatigue[J]. Neurosci Lett, 2003, 352: 159–162. DOI:10.1016/j.neulet.2003.08.051 |
| [21] | You LJ, Zhao MM, Regenstein JM, et al. In vitro antioxidant activity and in vivo anti-fatigue effect of loach (Misgurnus anguillicaudatus) peptides prepared by papain digestion[J]. Food Chem, 2011, 124: 188–194. DOI:10.1016/j.foodchem.2010.06.007 |
| [22] | Brancaccio P, Maffulli N, Limongelli FM. Creatine kinase monitoring in sport medicine[J]. Br Med Bull, 2007, 209: 81–82. |
| [23] | Wang MY, An LG. Effects of Plantago major L. seeds extract on endurance exercise capacity in mice[J]. Med Plants Res, 2011, 5: 1659–1663. |
| [24] | Wang H, Zhao Y, Zhang M, et al. Effect of oviductus ranae on reducing serum lipid and ability of anti-anoxia and antifatigue[J]. Food Res Dev (食品开发与研究), 2012, 33: 201–203. |
| [25] | Campos-Ferraz PL, Bozza T, Nicastro H, et al. Distinct effects of leucine or a mixture of the branched-chain amino acids (leucine, isoleucine, and valine) supplementation on resistance to fatigue, and muscle and liver-glycogen degradation, in trained rats[J]. Nutrition, 2013, 29: 1388–1394. DOI:10.1016/j.nut.2013.05.003 |
| [26] | Jiang L, Huang J, Wang Y, et al. Metabonomic analysis reveals the CCl4-induced systems alterations for multiple rat organs[J]. J Proteome Res, 2012, 11: 3848–3859. DOI:10.1021/pr3003529 |
| [27] | Ito T, Yoshikawa N, Inui T, et al. Tissue depletion of taurine accelerates skeletal muscle senescence and leads to early death in mice[J]. PLoS One, 2014, 9: e107409. DOI:10.1371/journal.pone.0107409 |
| [28] | Van Milgen J. Modeling biochemical aspects of energy metabolism in mammals[J]. J Nutr, 2002, 132: 3195–3202. DOI:10.1093/jn/131.10.3195 |
| [29] | Lee YT, Hsu CC, Lin MH, et al. Histidine and carnosine delay diabetic deterioration in mice and protect human low density lipoprotein against oxidation and glycation[J]. Eur J Pharmacol, 2005, 513: 145–150. DOI:10.1016/j.ejphar.2005.02.010 |
 2018, Vol. 53
2018, Vol. 53


