2. 天士力控股集团有限公司研究院, 天津 300410;
3. 天士力制药集团股份有限公司创新中药关键技术国家重点实验室, 天津 300410
2. TCM Research Center, Tasly Group Co., Ltd., Tianjin 300410, China;
3. State Key Laboratory of Critical Technology in Innovative Chinese Medicine, Tasly Group Co. Ltd, Tianjin 300410, China
水飞蓟宾用于肝脏疾病的治疗已有两千年的历史, 是天然的保肝药物, 其作用机制主要是抗氧化、抗脂质过氧化、清除自由基和稳定细胞膜[1]。同时, 水飞蓟宾还广泛用于非酒精性脂肪肝[2]、抗抑郁、降血脂、保护心肌、抑制癌细胞增殖以及神经保护等多个新适应症的探索开发[3-5]。但由于水飞蓟宾的脂溶性和水溶性均较差[6], 体内生物利用度低, 个体对药物的吸收差异较大, 从而降低了水飞蓟宾的临床疗效。为此, 国内外学者采用各种制剂技术或化学方法对其进行理化性质优化和结构改造, 并系统研究了水飞蓟宾衍生物和不同药理活性之间的构效关系[7], 以期提高生物利用度, 发现新型水飞蓟宾候选药物。
Wang等[8]研究发现水飞蓟宾磷脂酰胆碱复合物对CCl4诱导的小鼠肝脏保护作用明显。Zarrelli等[9]将水飞蓟宾23位羟基基团修饰为硫酸、磷酸二酯等基团, 提高了水飞蓟宾的水溶性, 抗氧化细胞模型实验显示该系列具有更高的抗氧化活性。Zhang等[10]采用高压匀质法制备水飞蓟宾纳米晶体自稳定Pickering乳液, 从而提高水飞蓟宾的口服生物利用度。上述研究均改善了水飞蓟宾在体内的药代动力学行为, 具有一定的应用前景。
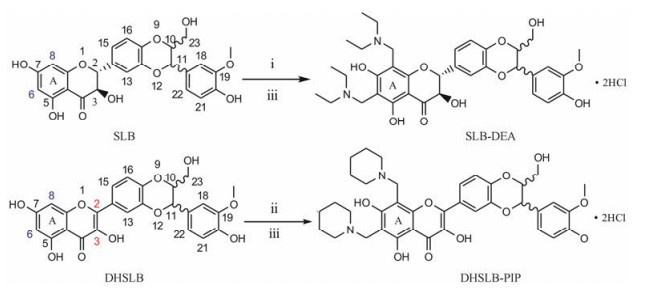
在对水飞蓟宾进行的众多结构改造及构效关系研究中, 尚没有文献报道水飞蓟宾Mannich碱衍生物的合成方法及生物活性。Mannich胺甲基化反应[11]可以在分子中引入N-烷基官能团, 提高母体化合物的溶解度, 增强化合物的生物活性。本文以水飞蓟宾(SLB)和2, 3-脱氢水飞蓟宾(DHSLB)为先导物, 合成两个水飞蓟宾Mannich碱衍生物, 通过CCl4致小鼠急性肝损伤模型评价其保肝活性; 并进一步考察两个衍生物在大鼠体内的药动学行为和相对生物利用度。水飞蓟宾Mannich碱衍生物的合成如合成路线1所示。
|
Scheme 1 Synthesis of target compounds. Reagents and conditions: (ⅰ) Diethylamine, formaldehyde, methanol, rt. 40 h; (ⅱ) Piperidine, formaldehyde, methanol, rt. 40 h; (ⅲ) Hydrochloric acid, methanol, rt. 0.5 h |
分别以水飞蓟宾和脱氢水飞蓟宾为原料, 在甲醛的存在下分别与二乙胺、哌啶发生Mannich反应, 得到水飞蓟宾Mannich碱衍生物SLB-DEA和DHSLB-PIP, 产物经盐酸-甲醇水溶液处理制得其水溶性盐酸盐, 化学结构经1H NMR和HR-MS确证。表征数据见表 1。经测定, SLB-DEA和DHSLB-PIP盐酸盐在纯水中的溶解度大于0.1 g·mL-1, 溶解性显著提高。
| Table 1 Physical properties and 1H NMR and HR-MS data of target compounds |
正常组、模型组、SLB-DEA和DHSLB-PIP高、低剂量组各组间小鼠体质量差异均无统计学意义; 但模型组小鼠肝质量、肝脏指数与正常对照组比较显著增加(P<0.05), 提示小鼠急性肝损伤模型成功建立; 与模型组比较, SLB-DEA和DHSLB-PIP高、低剂量组小鼠肝质量和肝脏指数明显降低(P<0.05);初步说明SLB-DEA和DHSLB-PIP对CCl4致小鼠肝损伤具有保护作用。各组小鼠肝脏指数测定结果见表 2。
| Table 2 Effects of different dose groups on liver index in mice. n = 8, x±s. △△P < 0.01 vs normal; *P < 0.05, **P < 0.01 vs model group |
各剂量组小鼠血清指标测定结果见表 3。测定结果显示, 模型组小鼠腹腔注射CCl4后与正常组比较, 血清中ALT、AST、LDH活性均显著升高(P<0.05), 表明肝细胞已受到破坏, 原位于细胞内的转氨酶大量入血, 提示造模成功。阳性药水林佳对照组与模型组相比较ALT、AST、LDH均显著降低(P<0.05), 表现出良好的肝保护能力; SLB-DEA高、低剂量组与模型组相比较AST、ALT值均降低, 但差异无统计学意义; DHSLB-PIP高、低剂量组ALT、AST、LDH值较模型组均显著降低(P<0.05), 其中高剂量组降低幅度最为明显, 已趋于正常组水平, 说明其对CCl4致肝损伤具有较好的保护作用, 并且存在量效关系。
| Table 3 Effects of SLB-DEA and DHSLB-PIP on the activity of ALT, AST, LDH, TC and TG induced by CCl4 in mice serum. n = 8, x±s. △P < 0.05, △△P < 0.01 vs normal; *P < 0.05, **P < 0.01 vs model group |
各给药组与正常组相比, 血清中TC含量无明显变化。与正常组相比, 模型组血清中TG含量明显升高(P<0.05), 说明CCl4可诱导小鼠肝脏脂质化。SLB-DEA组与模型组相比, TC、TG的含量均无显著差异, 但DHSLB-PIP高剂量组TG含量显著降低(P<0.05), 表明DHSLB-PIP高剂量对小鼠的血脂升高具有明显的抑制作用。上述研究结果充分证明, DHSLB-PIP能够增强肝细胞抗损伤能力, 改善肝损伤小鼠的脂类代谢异常, 具有显著的抗肝损伤活性。
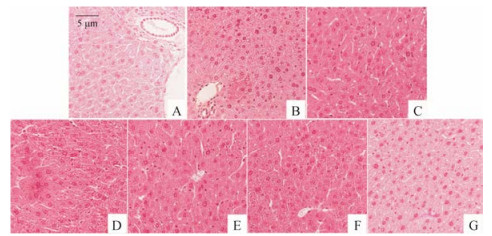
2.3 SLB-DEA和DHSLB-PIP对CCl4致急性肝损伤小鼠肝组织病理学的影响病理切片结果图 1显示:正常组(A)小鼠肝脏肝组织结构清晰, 肝小叶完整, 肝细胞结构及形态正常, 细胞核大而圆且排列有序, 无炎症出现。模型组(B)肝细胞明显损伤, 肝组织结构紊乱, 肝细胞肿胀并出现坏死, 细胞膜不清晰, 细胞核分布杂乱, 并伴随有弥漫性炎症细胞浸润现象。水林佳组(C)小鼠肝脏较红润, 肝组织结构相对清晰, 细胞膜基本清楚, 细胞核排列正常, 炎症细胞浸润现象得到明显改善。与模型组相比, SLB-DEA和DHSLB-PIP高、低剂量组(D、E、F、G)小鼠肝细胞病理损伤程度均减轻, 肝细胞结构比较完整, 肝细胞排列相对整齐, 高剂量组较低剂量组中央静脉周围的炎症细胞浸润情况得到明显改善; 其中DHSLB-PIP高剂量组改善程度与水林佳对照组相似。以上结果表明, SLB-DEA和DHSLB-PIP均能减轻CCl4对小鼠肝组织的损伤程度。
|
Figure 1 Liver histological evaluation of SLB-DEA and DHSLB-PIP treated mice. A: Normal control; B: CCl4 group; C: Positive control; D: SLB-DEA (20 mg·kg-1); E: SLB-DEA (40 mg·kg-1); F: DHSLB-PIP (20 mg·kg-1); G: DHSLB-PIP (40 mg·kg-1) |
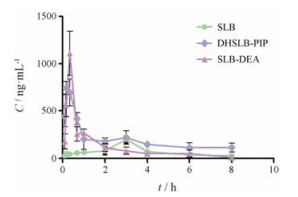
取待测血浆样品, 按血浆处理方法处理后, 按照前期确定的色谱和质谱条件进行测定。3组供试品在大鼠体内的药-时曲线见图 2。
|
Figure 2 Plasma concentration-time curves of three components in rats in vivo in three groups. n = 3, x±s |
采用DAS 3.2.6软件, 以非房室模型拟合处理平均血药浓度数据, 计算各个成分的药动学参数; 采用SPSS 17.0计算各成分组间的显著性差异。结果见表 4; 结果表明, SLB-DEA在大鼠血浆中的tmax、Cmax、AUC0-8 h分别是水飞蓟宾的11%、5.64倍和1.72倍; DHSLB-PIP在大鼠血浆中的tmax、Cmax、AUC0-8 h分别是水飞蓟宾的7.4%、4.11倍和2.60倍, SLB-DEA和DHSLB-PIP在大鼠体内的达峰时间明显缩短, 药物暴露量显著增加。利用公式(相对生物利用度= AUC0-8 h衍生物/AUC0-8 h原型药物×100%)计算相对生物利用度, SLB-DEA和DHSLB-PIP的相对生物利用度分别为172.5%和259.8%;计算结果表明, 与SLB相比, 水溶性SLB-DEA和DHSLB-PIP在大鼠体内的吸收明显增加, 口服生物利用度显著提高。
| Table 4 Pharmacokinetic parameters of three groups of rats. n = 3, x±s. *P < 0.05, **P < 0.01 vs SLB group |
水飞蓟宾和脱氢水飞蓟宾均为黄酮木质素类化合物, 其中A环C-6和C-8为亲核反应中心[12]。本文通过A环C-6和C-8位H原子与二级胺在甲醛水溶液中进行Mannich反应, 将氨甲基引入母体结构中, 并通过酸化成盐得到两个水溶性的水飞蓟宾Mannich碱衍生物SLB-DEA和DHSLB-PIP。1HNMR和HR-MS等数据证明二者均为6, 8-双取代衍生物。氨甲基基团的引入可以提高水飞蓟宾母体的水溶性, 从而提高生物利用度, 同时与各类靶点蛋白结合能力更强的N原子可以大大改善化合物的生物活性。
本文采用经典的CCl4致小鼠急性肝损伤模型评价目标化合物的抗肝损伤活性, 此模型广泛用于肝损伤研究, 能准确稳定地反映肝细胞的功能、代谢和形态学变化[13, 14]。其作用机制是CC14进入体内经肝药酶P-450激活, 产生CCl3自由基和Cl自由基[15], 与肝细胞生物膜上的脂质发生过氧化反应, 生成脂质过氧化物, 同时引起Ca2+的内流, 增加细胞膜的通透性, 使肝细胞内的转氨酶外流入血, 因此血清转氨酶水平的升高在一定程度上能够反映肝细胞损伤程度[16, 17]。而血清中转氨酶的浓度升高, 尤以AST和ALT变化最为显著[18], 因此ALT和AST是衡量肝脏损伤程度的重要指标[19, 20]。
本研究发现小鼠给予SLB-DEA和DHSLB-PIP后均能有效抑制血清中AST、ALT水平的升高, 尤其以DHSLB-PIP高剂量保护作用最为显著(P<0.01), 与阳性对照药物水林佳效果相当。说明SLB-DEA和DHSLB-PIP能增强肝细胞抗损伤能力, 增加膜的稳定性, 对肝脏有一定的保护作用。同时, CCl4造成的肝损伤模型中会产生大量的过氧化物自由基, 这些自由基可造成机体的损害, 诱导小鼠肝细胞发生不同程度的脂肪性变。模型组小鼠血清所含TG显著升高, 而高剂量DHSLB-PIP可改善肝损伤小鼠的脂类代谢异常, TG含量显著降低, 恢复至正常组水平, 其作用机制可能有:降低肝内脂质过氧化反应, 改善细胞免疫功能等。
大鼠体内的药代动力学研究表明, SLB-DEA和DHSLB-PIP相对于SLB的相对生物利用度分别为172.5%和259.8%, Cmax显著增加, Tmax明显缩短, 说明SLB-DEA和DHSLB-PIP体内吸收迅速, 生物利用度显著提高。这可能是因为SLB-DEA和DHSLB-PIP盐酸盐的溶解度得到显著改善, 增加了药物透过胃肠上皮细胞的能力, 从而增加药物的转运、促进药物吸收, 使生物利用度得到明显提升[21-23]。
本研究设计合成的水飞蓟宾衍生物SLB-DEA和DHSLB-PIP具有良好的水溶性及抗肝损伤生物活性, 且生物利用度相较于水飞蓟宾均显著提高, 因此, 可作为新药候选物进一步研究其成药性。
实验部分AB Sciex三重四极杆5500TM LC/MS/MS; SHIMADZU UPLC (日本岛津); 超高效液相色谱(Waters ACQUITY UPLC); Waters Q-TOF Premier质谱仪; Varian INOVA 400 MHz核磁共振仪; 全自动生化仪(7020型, 日立公司生产); Milli-Q超纯水系统(Millipore公司); 超声波清洗器(昆山市超声仪器有限公司)。赛多利斯BT25S型分析天平; HGC24A 24孔氮吹仪(天津市恒奥科技发展有限公司); XW-80A微型漩涡混合仪(上海泸西分析仪器厂有限公司); TG 16W微量高速离心机(长沙平凡仪器仪表有限公司)。
水飞蓟宾胶囊(水林佳), 规格:每粒35 mg, 天津天士力圣特制药有限公司; SLB-DEA, 纯度98%, DHSLB-PIP, 纯度97%, 自行制备。二乙胺、哌啶, 分析纯, 国药集团化学试剂有限公司; 37%甲醛水溶液, 分析纯, 阿拉丁试剂有限公司; 谷丙转氨酶(ALT)、谷草转氨酶(AST)、乳酸脱氢酶(LDH)、总胆固醇(TC)、甘油三酯(TG)测定试剂均购于和光试剂; 其他试剂均为分析纯, 天津康科德科技有限公司。
SPF级雄性ICR小鼠70只, 体重20~22 g, 动物合格证号: SCXK (京) 2017-0001; Wistar大鼠(6周龄) 9只, 体质量300~330 g, 许可证: SCXK (京) 2018-0001, 均由北京维通利华实验动物技术有限公司提供。
1 化学合成 1.1 水飞蓟宾二乙胺Mannich碱(SLB-DEA)的合成将水飞蓟宾(5.0 g, 10.4 mmol)、37%甲醛水溶液(3.37 g, 41.5 mmol)、二乙胺(3.03 g, 41.5 mmol)置于25 mL甲醇中, 室温搅拌。TLC (二氯甲烷-甲醇= 10:1)跟踪反应, 40 h反应完全, 终止反应。减压旋干得粗品5.7 g, 加入乙酸乙酯100 mL打浆2 h, 减压过滤后, 经硅胶柱色谱(CH2Cl2-CH3OH = 10:1~8:1)分离得SLB-DEA 4.1 g (收率60.6%)。将制得的SLB-DEA溶于甲醇-盐酸溶液(100 mL)中, 搅拌0.5 h, 经浓缩干燥得到SLB-DEA盐酸盐4.3 g。
1.2 脱氢水飞蓟宾哌啶Mannich碱(DHSLB-PIP)的合成将脱氢水飞蓟宾(5.0 g, 10.4 mmol)、37%甲醛水溶液(3.38 g, 41.7 mmol)、哌啶(3.55 g, 41.7 mmol)置于25 mL甲醇中, 室温搅拌, TLC (二氯甲烷-甲醇= 10:1)跟踪反应, 40 h反应完全, 终止反应。减压旋干得粗品6.5 g, 加入乙酸乙酯100 mL打浆2 h, 减压过滤后, 经硅胶柱色谱(CH2Cl2-CH3OH = 10:1~7:1)分离得DHSLB-PIP 3.7 g (收率52.9%)。将制得的DHSLB-PIP溶于甲醇-盐酸溶液(100 mL)中, 搅拌0.5 h, 经浓缩干燥得DHSLB-PIP盐酸盐3.9 g。
2 抗CCl4致急性肝损伤活性研究将动物称重, 编号, 随机分组。实验分为7组, 分别为正常组、模型组、阳性药组(水林佳, 40 mg·kg-1)、SLB-DEA低剂量组(20 mg·kg-1)、SLB-DEA高剂量组(40 mg·kg-1)、DHSLB-PIP低剂量组(20 mg·kg-1)、DHSLB-PIP高剂量组(40 mg·kg-1), 每组10只, 适应性饲养3天, 除正常组和模型组分别给予相同体积的纯水和溶媒(2%吐温水溶液)灌胃外, 其余各组给予相应剂量灌胃给药, 每日1次, 连续给药8天。于第8天末次给药2 h后立即采用0.08% CCl4花生油溶液按0.01 mg·kg-1腹腔注射。随即禁食不禁水, 造模后16 h摘眼球取血约1 mL, 4 000 r·min-1离心10 min, 取血清-40 ℃冻存待测。采用全自动生化仪测定血清中ALT、AST、LDH、TC及TG水平; 同时取肝脏, 用生理盐水冲洗组织样品以除去血液, 滤纸吸干并称重, 计算肝脏指数:肝脏指数=肝质量(g) /体质量(g) ×100%。待称重完成后取肝左叶, 固定于组织固定液中, 常规石蜡包埋、切片、HE染色, 在光学显微镜下观察肝组织病理学变化。采用SPSS 17.0统计软件对实验数据进行统计学处理, 小鼠血清中ALT、AST、LDH、TG及TC的活性及小鼠的肝体比指数均以x±s表示, 多组间样本均数比较采用单因素方差分析, 以P<0.05为差异具有统计学意义。
3 大鼠体内药代动力学研究 3.1 色谱条件色谱柱: ACQUITY UPLC BEH C18 1.7 μm, 2.1 mm × 100 mm, 流动相:甲醇(A): 0.1%甲酸水(B); 流速: 0.4 mL·min-1; 梯度洗脱程序: 0~1.5 min为10% (v/v) A, 1.5~2.5 min为10% A~100% A, 2.5~2.9 min为100% A, 2.9~3.3 min为100% A~10% A, 3.3~4.5 min为10% A; 进样量: 10 μL; 柱温: 40 ℃。
3.2 质谱条件检测模式为MRM模式, 质谱扫描方式进行样品分析, 0.1 min前经旁路排出不进质谱。SLB-DEA、DHSLB-PIP和内标艾司唑仑采用正离子模式分析, 电喷雾电压为4 800 V, 离子化温度为480 ℃; 水飞蓟宾和内标地高辛采用负离子模式检测, 电喷雾电压为-4 500 V; 离子化温度为550 ℃; 雾化气与加热气均为氮气, 45 psi (1 psi ≈ 6.9 kPa); 气帘气压20 psi; 用于定量分析的离子反应分别是m/z 481.1 → m/z 300.1 (水飞蓟宾)、m/z 653.0 → m/z 580.3 (SLB-DEA)、m/z 675.2 → m/z 575.1 (DHSLB-PIP)、m/z 779.3 → m/z 649.2 (内标地高辛)、m/z 321.5 → m/z 152.1 (内标艾司唑仑), 碰撞能分别是-27、36、42、-53和47 eV。使用Analyst® 1.6.2软件采集并处理数据。
3.3 血浆样品采集将9只Wistar大鼠随机分为3组, 每组3只, 实验前12 h禁食不禁水。3组大鼠分别等摩尔灌胃给药SLB (50 mg·kg-1)、SLB-DEA (75.1 mg·kg-1)、SLB-PIP (77.3 mg·kg-1)。分别于给药前及给药0.083、0.333、0.667、1.0、2.0、3.0、4.0、6.0、8.0 h后于眼眶静脉丛取血300 μL, 置于肝素离心管中, 血浆4 500 r·min-1离心10 min, 取上层血浆150 μL, 置于-20 ℃保存, 待测。
3.4 血浆样品处理方法取50 μL血浆, 正、负谱分别加入内标(艾司唑仑50 ng·mL-1、地高辛2 μg·mL-1) 100 μL, 加乙酸乙酯3 mL, 涡旋3 min, 于4 500 r·min-1离心10 min, 取上层有机相, 30 ℃氮气吹干, 加入初始比例流动相100 μL复溶, 取10 μL进样。采用DAS 3.2.6软件, 以非房室模型拟合处理平均血药浓度数据, 计算各个成分的药动学参数; 采用SPSS 17.0计算各成分组间的显著性差异。
| [1] | Yuan X, Hao HP, Wang H, et al. Reversing effects of silybin on TAA-induced hepatic CYP3A dysfunction through PXR regulation[J]. Chin J Nat Med, 2013, 11: 645–652. |
| [2] | Salamone F, Galvano F, Cappello F, et al. Silibinin modulates lipid homeostasis and inhibits nuclear factor kappa B activation in experimental nonalcoholic steatohepatitis[J]. Transl Res, 2012, 159: 477–486. DOI:10.1016/j.trsl.2011.12.003 |
| [3] | Shao S, Liu CY, Gao YH. Research advances in silybin in treatment of drug-induced liver injury[J]. J Clin Hepatol (临床肝胆病杂志), 2017, 33: 1179–1182. |
| [4] | Wang HJ, Jiang YY, Lu P, et al. An updated review at molecular pharmacological level for the mechanism of antitumor, antioxidant and immunoregulatory action of silybin[J]. Acta Pharm Sin (药学学报), 2010, 45: 413–421. |
| [5] | Antoszczak M, Klejborowska G, Kruszyk M, et al. Synthesis and antiproliferative activity of silybin conjugates with salinomycin and monensin[J]. Chem Biol Drug Design, 2015, 86: 1378–1386. DOI:10.1111/cbdd.12602 |
| [6] | Ferreira LP, Cunha BPD, Kuster RM, et al. Synthesis and chemical modification of poly(butylene succinate) with rutin useful to the release of silybin[J]. Ind Crops Prod, 2017, 97: 599–611. DOI:10.1016/j.indcrop.2016.12.064 |
| [7] | Kim NC, Graf TN, Sparacino CM, et al. Complete isolation and characterization of silybins and isosilybins from milk thistle (Silybum marianum)[J]. Org Biomol Chem, 2003, 1: 1684–1689. DOI:10.1039/b300099k |
| [8] | Wang Y, Zhang AY, Zhang X, et al. Comparison of the protective effect of silibinin phosphatidylcholine complex and silibinin on mice liver injury by CCl4[J]. Chin J Biochem Pharm (中国生化药物杂志), 2015, 35: 71–73. |
| [9] | Zarrelli A, Sgambato A, Petito V, et al. New C-23 modified of silybin and 2, 3-dehydrosilybin:synthesis and preliminary evaluation of antioxidant properties[J]. Bioorg Med Chem Lett, 2011, 21: 4389–4392. DOI:10.1016/j.bmcl.2011.06.049 |
| [10] | Zhang JF, Liu C, Zhang J, et al. Preparation and evaluation of silybin nanocrystallines self-stabilizing Pickering emulsion[J]. Acta Pharm Sin (药学学报), 2016, 51: 813–820. |
| [11] | Saadatjoo N, Golshekan M, Shariati S, et al. Ultrasoundassisted synthesis of β-amino ketones via a Mannich reaction catalyzed by Fe3O4 magnetite nanoparticles as an efficient, recyclable and heterogeneous catalyst[J]. Arab J Chem, 2017, 10: 735–741. DOI:10.1016/j.arabjc.2012.11.018 |
| [12] | Wu XM, Liu GM, Feng YB, et al. Silybin-derived flavonolignans and their structure-activity relationships:research advances[J]. J Int Pharm Res, 2010, 37: 187–197. |
| [13] | Alrazzuqi RAM, Aljawad FH, Hussaini JAA, et al. Hepatoprotective effect of glycyrrhiza glabra in carbon tetrachlorideinduced model of acute liver injury[J]. J Physiol Pharmacol Adv, 2012, 2: 259–263. |
| [14] | Akihara R, Homma T, Lee J, et al. Ablation of aldehyde reductase aggravates carbon tetrachloride-induced acute hepatic injury involving oxidative stress and endoplasmic reticulum stress[J]. Biochem Biophys Res Commun, 2016, 478: 765–771. DOI:10.1016/j.bbrc.2016.08.022 |
| [15] | Makni M, Chtourou Y, Fetoui H, et al. Evaluation of the antioxidant, anti-inflammatory and hepatoprotective properties of vanillin in carbon tetrachloride-treated rats[J]. Eur J Pharmacol, 2011, 668: 133–139. DOI:10.1016/j.ejphar.2011.07.001 |
| [16] | Beek JH, Moor MH, Geus EJ, et al. The genetic architecture of liver enzyme levels:GGT, ALT and AST[J]. Behav Genet, 2013, 43: 329–340. DOI:10.1007/s10519-013-9593-y |
| [17] | Costa MM, França RT, Silva AS, et al. Rangelia vitalii:changes in the enzymes ALT, CK and AST during the acute phase of experimental infection in dogs[J]. Rev Bras Parasitol Vet, 2012, 21: 243–248. DOI:10.1590/S1984-29612012000300012 |
| [18] | He LY, Guo YX, Li C, et al. Progress in the biomarker discovery for drug-induced liver injury[J]. Acta Pharm Sin (药学学报), 2015, 50: 959–965. |
| [19] | Yang J, Zhu D, Ju B, et al. Hepatoprotective effects of Gentianella turkestanerum extracts on acute liver injury induced by carbon tetrachloride in mice[J]. Am J Transl Res, 2017, 9: 569–579. |
| [20] | Milic N, Milosevic N, Suvajdzic L, et al. New therapeutic potentials of milk thistle (Silybum marianum)[J]. Nat Prod Commun, 2013, 8: 1801–1810. |
| [21] | Wu W, Wang Y, Que L. Enhanced bioavailability of silymarin by self-microemulsifying drug delivery system[J]. Eur J Pharm Biopharm, 2006, 63: 288–294. DOI:10.1016/j.ejpb.2005.12.005 |
| [22] | Wang Y, Wang S, Firempong CK, et al. Enhanced solubility and bioavailability of naringenin via liposomal nanoformulation:preparation and in vitro, and in vivo, evaluations[J]. AAPS Pharm Sci Tech, 2016, 18: 586–594. |
| [23] | Xie Y, Yi Y, Hu X, et al. Synchronous microencapsulation of multiple components in silymarin into PLGA nanoparticles by an emulsification/solvent evaporation method[J]. Pharm Dev Technol, 2016, 21: 672–679. |
 2018, Vol. 53
2018, Vol. 53


