2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
氟是周期表中电负性最高的元素, 它的引入往往会对分子的几何结构和电子分布产生显著影响。在药物化学中, 氟取代已经被广泛的用来设计和改造化合物[1, 2]。自从1957年出现了第一个含氟药物5-氟尿嘧啶(5-fluorouracil, 5-FU)以来(图 1), 目前已有超过150个含氟药物进入市场, 约占所有药物的20%~25%[3, 4]。氟取代会对化合物的物理化学性质, 比如溶解性、亲脂性、稳定性、酸碱性等产生诸多影响, 不仅会提高化合物与靶标的结合亲和力(图 2), 还可能会影响化合物的吸收、分布、代谢、外排和毒性(absorption, distribution, metabolism, excretion and toxicity, ADME/T)等一系列性质[4−9]。药物化学家们在长期的使用摸索中总结出了许多氟取代的运用经验和规则, 比如, 不同类型氟取代对亲脂性带来的不同变化[10, 11], 氟取代对化合物pKa值的影响[3, 12, 13]等。然而氟取代为何会带来这些变化, 对其分子及电子层面上的原因, 研究者们的认识却仍然比较笼统和模糊, 尤其是关于氟原子在非共价相互作用中所扮演的角色, 仍然有许多争议, 还需要更深入的探究。
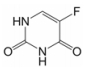
|
Figure 1 The structure of 5-fluorouracil |
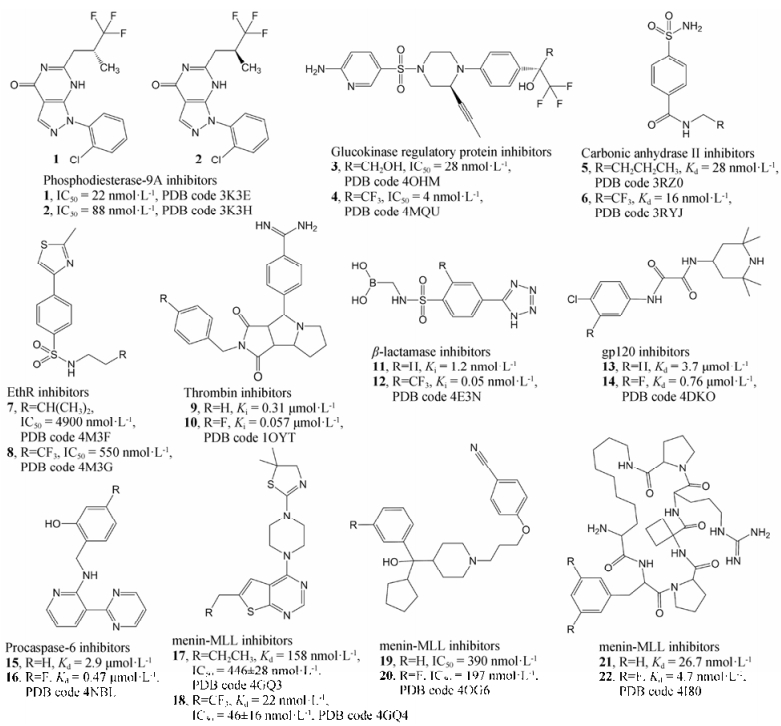
|
Figure 2 The structures and activity data of inhibitors derived from fluorine substitutions which increase the ligand affinity to the target proteins |
目前看来, 有机氟原子不仅会对与其共价相连的基团或原子产生显著的影响, 间接调节其他分子间相互作用, 更会直接参与各种各样的分子间的相互作用。氟原子的强吸电子效应往往会对分子的电子分布产生影响, 自然而然地影响到分子间所形成的非共价相互作用, 可以作为调整分子间作用强度的化合物改造策略使用。对于常见的分子间作用, 比如氢键、卤键和π-π堆积等, 氟取代的调节效应均已有相关文章报道, 引起了人们的广泛关注[14−18]。因其广泛存在且易于理解, 这里将不再赘述。而有机氟形成的非共价相互作用才走进药物化学工作者的视野不久, 就已经历了曲折复杂的过程。早在1997年的时候, Dunitz和Taylor就发表了题为“有机氟几乎从不形成氢键”的文章来质疑氟原子作为氢键受体的能力, 他们对剑桥晶体数据库(Cambridge structural database, CSD)和蛋白质数据库(protein data bank, PDB)进行了高标准的系统搜索, 并详细阐述了结构数据中隐含的各种不确定因素, 后辅以基于分子间微扰理论(intermolecular perturbation theory, IMPT)的量子化学(quantum mechanics, QM)计算, 以支持其观点[19]。然而, 晶体数据库搜索中高频出现的C-H…F作用模式[20−22], 使得研究者们围绕着氟能否形成氢键及氟与氢之间的作用本质展开了各种计算或实验相关的研究。尽管氟可以形成弱氢键的能力已被比较广泛的接受, 然而关于电负性比氧和氮更强的氟为什么形成的氢键会如此之弱, 仍然让人费解。此外, 氟所参与形成的其他一系列特殊的非共价相互作用的出现更是让人们认识到其独特之处, 也同时得到了越来越多的关注。令人意外地是, 作为卤族元素之一, 氟却与氯、溴和碘有着完全不同的表现, 使得人们往往在飞速发展的卤键研究中将其忽略。虽然早在1999年时, Legon就通过实验手段观察到了气相状态下双氟分子中的氟所形成的卤键作用模式[23], 然而却并没有出现有机氟方面的相关研究支持氟作为卤键供体来形成卤键的可能性, 直到2011年, Metrangolo等[24]以晶体结构为有机氟形成卤键提供了有力证据, 并深入展开了系统的计算和数据库搜索, 证实氟在与吸电子基团共价相连时, 其分子静电势表面上存在正电性的σ-hole, 且可以与Lewis碱形成相互吸引的卤键作用[22]。考虑到氟所形成的卤键与经典的重卤形成的卤键的不同之处, 已有研究提出应该称其为‘氟键’更为合适[25]。除此以外, 在一系列的晶体结构数据库的搜索研究中, 还可以看到有机氟在小分子与蛋白的结合中形成的F…F作用、F…π作用和极性相互作用等[21, 26, 27]。总而言之, 氟所直接参与形成的非共价相互作用多种多样, 系统地认识和理解这些作用将会为氟在药物设计、材料化学等领域的广泛应用提供理论基础和指导。
1 氢键氢键作为重要的分子间作用之一, 自20世纪初被提出以来, 相关研究发展迅速, 应用也日益广泛。经典的氢键通常形成于N/OH基团上的H原子与N/O原子或π体系之间, 另外, S、P、C和Cl等也可参与形成氢键。氢键以其广泛存在性在材料领域和药物化学等领域一直发挥着重要作用。
与氧、氮和重卤相比, 有机氟的电负性高且半径小, 其电子对结合紧密, 可极化性低, 质子亲和力弱, 使得其很难形成氢键。Dunitz和Taylor在其1997年对有机氟形成氢键能力的研究中就指出, 在没有其他较强的氢键受体竞争且没有其他相互作用干扰的情况下, 氟形成的弱氢键才有可能稳定存在[19]。而后, Boese和Desiraju团队解出了氟苯在室温下的晶体结构, 观察到了C-H…F的分子间作用模式(图 3a), 并系统对比分析得出当碳氢基团中的碳的酸性达到一定程度时, 这种作用模式才表现为氢键的作用特征, 这为有机氟形成的氢键提供了证据[20]。Bettinger则用从头算(ab initio)的量化计算系统研究了有机氟与H2O和CH3OH所形成的作用, 算得C-F…HOCH3之间的作用能为−3 kcal·mol−1 (图 3b)[28]。中性分子之间的C-H…F作用与带电荷分子之间的C-H…F作用也被进行了系统的研究, 从头算方法计算的结果显示前者强度较弱, 且以色散为主, 而后者作用强度可与经典氢键相比, 除了两个分子带相同电性的电荷时, 则会表现为排斥作用, CSD晶体结构搜索为此提供了证据(图 3c)[29]。Chopra团队更是在强氢键(N-H…O=C)存在的情况下证明了氟所形成的氢键(C-H…F)的存在, 并以实验和计算的手段给出了一系列表征[30]。随后, 他们还系统研究了不同杂化状态的碳参与的C-H…F-C作用, 并指出该作用以色散为主的本质[31]。Dalvit等[32−34]利用NMR的手段研究了F…H-N/O等作用, 为氟作为氢键受体提供了强有力的证据, 并为其应用给出了一系列的指导。Taylor等[35]在其关于C-F…H-N/O模式的作用研究中再次指出, 当没有其他更有力的作用力竞争的情况下, 氟会参与形成氢键作用, 文中同样给出了CSD晶体结构证据(图 3d)。
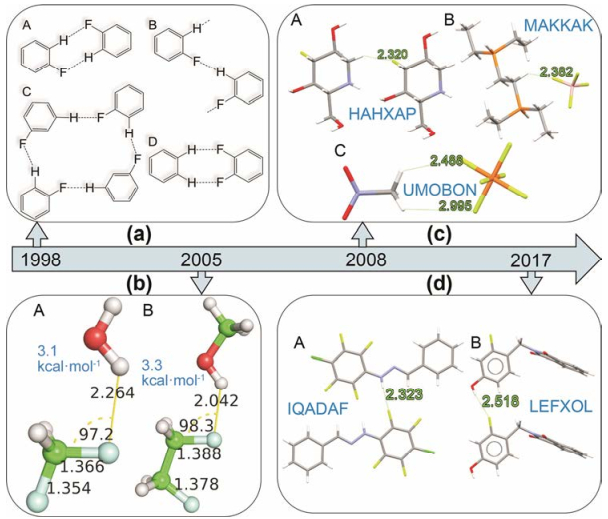
|
Figure 3 The reported typical hydrogen bonds formed by fluorine. (a) The C-H…F interactions in the crystal structures of fluoroben zene. (b) The structures of the C-F…H2O and C-F…HOCH3 interactions with geometric (black) and energetic (blue) data. F, C, O and H atoms are in lightcyan, green, red and white, respectively. (c) Neutral or charge assisted C-H…F interactions in CSD. F, C, O, N, P, B and H atoms are in green, gray, red, purple, orange, pink and white, respectively. CSD refcodes are labeled by blue words and F…H distances are by green words. (d) Typical C-F…H-N/O interactions in CSD. Atoms and words colors are the same with c |
综上所述, 有机氟作为弱氢键受体的能力已得到相当一部分研究的支持, 但关于其作用本质和特性仍然需要更多研究的阐释来指导其应用。另外, 为了改善蛋白小分子的对接效果, 已有研究将蛋白体系中氟参与的F…H相互作用拟合进了GRID力场, 这也反映了大家对该作用重要性的认可[36]。
2 卤键根据IUPAC的定义, 卤键是指共价相连的卤素原子以其头部亲电区域与另一亲核原子或原子的亲核区域形成的相互吸引作用[37]。有机氟原子由于电负性高, 其原子表面往往全部呈现负电性, 很难与Lewis碱形成稳定的吸引作用, CSD数据库的搜索结果也提示了这一点[38], 因此, 氟被认为不形成卤键作用。事实上, 绝大部分关于卤键的研究也往往将氟排除在外, 只关注重卤原子。值得注意的是Legon通过实验手段, 在气相状态下观察到了双氟分子中的氟所形成的卤键作用模式, 随后被大量的计算和实验研究所证实[23, 25, 39]。虽然考虑到双氟分子本身的特殊性, 不能将含氟卤键推广开去, 但也揭示了有机氟原子形成卤键作用的可能性。
Lu等[39]利用从头算的量化计算方法, 证实了一系列含氟分子中的氟作为电子受体与氨气分子之间形成的吸引作用, 除了F2和CH2F+、NH3F+两个带正电荷的分子以外, 还包括NCF、NCCCF、F3CCCF和FCCF 4个有机氟分子, 它们与NH3作用的作用能从−0.13到−9.30 kcal·mol−1不等, 同时基于自然键轨道理论(natural bond orbital, NBO)和分子中的原子的量化理论(quantum theory of atoms in molecules, QTAIM)的分析同样证实了氟与氮之间稳定吸引作用的存在, 需要注意的是, 在NCF等4个有机氟分子与氨气分子的相互作用中, 其氟氮作用距离在3.14到3.39 Å 之间, 均略超出了两者的范德华半径之和3.02 Å (氟: 1.47 Å ,氮: 1.55 Å )。随后, 他们又探讨了NO2、CF3、CN、COOH、CHO和CCH 6种取代基对有机氟作为卤键供体能力的影响, 运用QTAIM和基于电子密度及约化密度梯度的NCIs (noncovalent interactions)分析, 结合CSD搜索证据, 证实有机氟在与强吸电子基团相连时, 其分子表面存在正电性的σ-hole, 可以与Lewis碱形成稳定的卤键作用(图 4)[40]。Metrangolo和Row等则从晶体学出发, 以实验和计算手段为有机氟形成卤键提供了有力证据[22, 24, 41]。运用高分辨率的X射线衍射分析, Pavan等[42]以分子内的Ⅱ型F…F作用(即一个有机卤原子以其成键反方向的头部与另一有机卤原子的成键侧面形成垂直作用)和C-F…S作用为有机氟分子表面正电性的σ-hole的存在提供了第一个实验证据, 给予了氟参与的卤键更多合理的理解和阐释。Metrangolo和Resnati也指出Ⅱ型卤素−卤素作用的本质就是卤键作用, 而两个卤素原子分别扮演了卤键供体和卤键受体的角色[43, 44]。Varadwaj等[45]从理论计算角度系统研究了C6F6分子与不同Lewis碱之间的作用, 证实负电性的有机氟也可与负电性的电子供体形成稳定的吸引作用。而后发表于Science上的文章更是报道了利用基于扫描隧道显微镜(scanning tunneling microscope, STM)的非弹性隧道探针(inelastic tun neling probe, itProbe)技术直接观察到了氟参与的卤键作用在C6F6和C6H3F3两个分子自组装中的稳定作用贡献[46]。Chopra团队对C-F…O作用的一系列研究给予了该作用详细的几何和能量描述, 同时提示了其以色散为主的本质[47]。
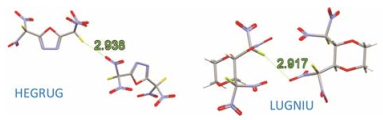
|
Figure 4 The typical halogen bonds formed by fluorine in CSD. Atoms and words colors are the same with Figure 3c |
基于几何结构、QTAIM分析、IQA (interaction quantum atoms)分析和原子偶极矩等得到的F…N作用与经典卤键作用之间的不同之处, Eskandari和Lesani提出应该称该种作用为氟键, 以区别于重卤形成的卤键[25]。Koohi等[48]基于steric charge的理论分析同样支持上述观点。Esrafili等[49]报道了氟与N-甲酰基甲酰胺形成的二叉F…O作用, 他们称其为二叉氟键(bifurcated fluorine bond, BFB)。由此看来, 尽管已知道有机氟可与亲核原子形成稳定的吸引作用, 但对这种作用的特征及本质仍然缺乏充分的认识和理解, 需要更多研究提供强有力的证据, 才可对氟能否形成卤键作用这一问题有确定和清晰的回答。
3 C-F…π作用通过对CSD和PDB数据库的系统搜索, Row团队发现C-F…π作用的数目均明显多于其他卤素原子所形成的C-X…π (X=Cl, Br, I)作用, 且相对于氢键, 有机氟似乎更偏向于形成C-F…π作用(图 5A)[50, 51]。随后, Uchimaru等[52]通过量化计算研究得出氟甲烷中的C-F键与六氟苯分子之间垂直作用的作用能达到−2.43 kcal·mol−1, 同时发现静电作用能贡献显著。Rybalova和Bagryanskaya的研究同样证实了C-F…π吸引作用的存在, 同时给出了晶体结构证据[27]。最近, Lectka团队更是报道了分子内形成C-F…π作用的光谱学和晶体结构证据, 指出了有机氟在亲电取代的芳香性化合物合成方面的定向或者活化作用[53]。而后, Shimizu团队系统研究了C-F…π作用, 利用特殊的分子构建了形成分子内C-F…π作用的体系, 从量化计算以及晶体结构等方面证实了该作用的稳定存在, 并指出其以静电为主要驱动的本质, 不同于其他卤素与π体系的相互作用, 而比较类似于阴离子…π相互作用[54]。
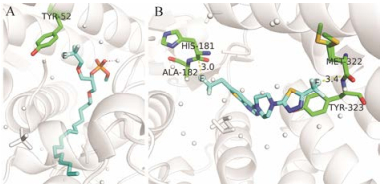
|
Figure 5 (A) The reported typical C-F…π (PDB code 1HN4) interaction. (B) The reported typical C-F…C=O (PDB code 5DDC) interaction. Ligands and the interacted residues are in sticks and the other protein is in white cartoon form. The ligand C atoms are in cyan and the residue C atoms are in green. O, N, P, S and F atoms are in red, blue, orange, yellow and lightcyan, respectively |
考虑到含氟有机小分子数量众多, 且氟的电负性往往比较明显, 因此易与芳香体系形成以静电为主要驱动的C-F…π作用。为了更好地指导应用, 需要对该作用的几何特征等有更加系统的研究和阐释。
4 其他有机氟形成的C-F…H-C、C-F…H-N、C-F…C=O、C-F…C≡N等极性相互作用也已被相关文献报道, 且在CSD等数据库中广泛存在[55]。在氟可以作为氢键受体得到证实以前, C-F…H-C作用的普遍存在及重要性就已被大家认识到。可以确定, 即使在不参与形成氢键作用时, 氟所形成的C-F…H-C这样一种极性作用也是不可以被忽略的。研究结果已经表明, F…H作用往往不能以作用距离小于两者范德华半径之和这一几何特征来判断[20, 56]。
在小分子抑制剂不同位点引入氟后, Diederich团队对这些小分子的活性进行了对比, 探讨了小分子与靶标的结合模式, 以晶体结构和活性数据指出了氟与靶标之间形成的C-F…C=O作用的重要性[57]。另外, 在三环类凝血酶的抑制剂设计中, Diederich团队使用了类似的策略, 同样获得了含氟的活性化合物, 同时他们也为C-F…C≡N作用提供了晶体和计算方面的证据[58]。Cierpicki团队发现氟的引入使得menin-MLL抑制剂的活性提高了5~10倍, 而其中C-F…C=O作用有明显贡献, 基于此, 为了促进药物设计中氟的合理应用, 他们发展了一种名为FMAP的算法来帮助预测与靶标结合的小分子周围哪些位点引入氟可能会形成分子间C-F…C=O作用, 进而获得更高的亲和力, 即所谓亲氟位点的计算预测(图 5B)[9]。
同样受到关注的还有F…F相互作用。根据Ramasubbu对卤素−卤素间作用类型的分类(图 6), Ⅰ型F…F作用, 即两个C-F键接近平行的作用模式, 最初被认为是其他作用力综合所致的一种几何作用, 但已有研究以计算和实验证据指出其可以稳定存在[56, 59]。Frontera团队通过系统计算和数据库搜索指出F…F作用可以与氢键、卤键等作用协同发挥作用[60]。Ⅱ型F…F作用比Ⅰ型F…F作用更加容易形成, 典型代表是C6F6和C6H3F3两个分子自组装中存在的稳定作用[46]。如前所述, Ⅱ型卤素−卤素作用被认为是一种特殊的卤键, 只是其中并未明确提到氟原子, 因此, 关于Ⅱ型F…F作用, 应该还需要更多的研究投入来深入阐释其本质和特点[59]。
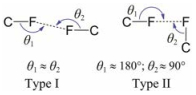
|
Figure 6 The reported two types of F…F interactions |
在药物化学领域, 随着有机氟的应用逐渐扩展, 氟扫描(fluorine scan), 即上述提到的通过在小分子不同位点引入氟来考察其与靶标的结合及活性变化的方法, 越来越多地被用来获得药代性质不变且活性更好的化合物。最近的报道显示其在Bruton酪氨酸激酶(Bruton’s tyrosine kinase, BTK)和人组蛋白酶L (human cathepsin L, hCatL)等抑制剂的设计中均应用顺利, 获得了活性化合物的同时, 还为有机氟所形成的分子间作用提供了更丰富的信息以加深理解[61, 62]。总而言之, 尽管上述这些作用一般强度较弱, 但因其普遍存在, 仍然吸引了越来越多的关注。相关研究在不断增加, 值得注意的是, 相较于药物设计和材料化学等领域的应用研究, 理论研究相对较少, 且不够充分和系统, 以致于这些作用未得到应有的重视和认识。
5 展望氟在药物化学领域应用的快速发展使得越来越多的相关分子间作用被大家认识和探究, 同时也反过来被应用于小分子化合物的设计和改造当中。含氟化合物除了具有药代性质上的优势以外, 其活性也可通过氟扫描等新策略来加以提高, 这样含氟化合物的结构优化过程又会为研究者认识和理解氟所形成的弱相互作用提供更详细的信息。为了更好地指导含氟化合物的应用和改造, 需要对有机含氟小分子与蛋白质之间形成的各种非共价相互作用有充分的认识和理解, 包括其作用特征、本质和强度等。在计算化学方面, 需要将这些作用纳入考虑范围, 开发全新的分子力场和打分函数等, 从而更好地完成计算预测研究, 与实验手段配合, 为后续研究开展打下基础。
尽管有机氟化物中的氟在形成分子间作用时有其特殊的复杂性, 其作用本质也有待进一步探讨, 但随着有机氟化物的合成新策略的不断发展, 实验和理论计算研究的相互促进, 终将揭开有机氟与蛋白之间形成的各种分子间作用的神秘面纱, 为推动氟在药物化学、材料化学等领域得到更广泛更深入的应用和发展提供坚实的理论基础。
| [1] | Wang J, Sanchez-Rosello M, Acena JL, et al. Fluorine in pharmaceutical industry:fluorine-containing drugs introduced to the market in the last decade (2001-2011)[J]. Chem Rev, 2014, 114: 2432–2506. DOI:10.1021/cr4002879 |
| [2] | Ilardi EA, Vitaku E, Njardarson JT. Data-mining for sulfur and fluorine:an evaluation of pharmaceuticals to reveal opportunities for drug design and discovery[J]. J Med Chem, 2014, 57: 2832–2842. DOI:10.1021/jm401375q |
| [3] | Muller K, Faeh C, Diederich F. Fluorine in pharmaceuticals:looking beyond intuition[J]. Science, 2007, 317: 1881–1886. DOI:10.1126/science.1131943 |
| [4] | Purser S, Moore PR, Swallow S, et al. Fluorine in medicinal chemistry[J]. Chem Soc Rev, 2008, 37: 320–330. DOI:10.1039/B610213C |
| [5] | Wang H, Luo X, Ye M, et al. Insight into binding of phosphodiesterase-9A selective inhibitors by crystal structures and mutagenesis[J]. J Med Chem, 2010, 53: 1726–1731. DOI:10.1021/jm901519f |
| [6] | Mecinovic J, Snyder PW, Mirica KA, et al. Fluoroalkyl and alkyl chains have similar hydrophobicities in binding to the "hydrophobic wall" of carbonic anhydrase[J]. J Am Chem Soc, 2011, 133: 14017–14026. DOI:10.1021/ja2045293 |
| [7] | Nishimura N, Norman MH, Liu L, et al. Small molecule disruptors of the glucokinase-glucokinase regulatory protein interaction:3. structure-activity relationships within the aryl carbinol region of the N-arylsulfonamido-N'-arylpiperazine series[J]. J Med Chem, 2014, 57: 3094–3116. DOI:10.1021/jm5000497 |
| [8] | Villemagne B, Flipo M, Blondiaux N, et al. Ligand efficiency driven design of new inhibitors of mycobacterium tuberculosis transcriptional repressor EthR using fragment growing, merging, and linking approaches[J]. J Med Chem, 2014, 57: 4876–4888. DOI:10.1021/jm500422b |
| [9] | Pollock J, Borkin D, Lund G, et al. Rational design of orthogonal multipolar interactions with fluorine in proteinligand complexes[J]. J Med Chem, 2015, 58: 7465–7474. DOI:10.1021/acs.jmedchem.5b00975 |
| [10] | Smart BE. Fluorine substituent effects (on bioactivity)[J]. J Fluorine Chem, 2001, 109: 3–11. DOI:10.1016/S0022-1139(01)00375-X |
| [11] | O'Hagan D, Young RJ. Accurate lipophilicity (log P) measurements inform on subtle stereoelectronic effects in fluorine chemistry[J]. Angew Chem Int Ed Engl, 2016, 55: 3858–3860. DOI:10.1002/anie.201511055 |
| [12] | Hagmann WK. The many roles for fluorine in medicinal chemistry[J]. J Med Chem, 2008, 51: 4359–4369. DOI:10.1021/jm800219f |
| [13] | Pettersson M, Hou X, Kuhn M, et al. Quantitative assessment of the impact of fluorine substitution on P-glycoprotein (P-gp) mediated efflux, permeability, lipophilicity, and metabolic stability[J]. J Med Chem, 2016, 59: 5284–5296. DOI:10.1021/acs.jmedchem.6b00027 |
| [14] | Riley KE, Merz KM. Effects of fluorine substitution on the edge-to-face interaction of the benzene dimer[J]. J Phys Chem B, 2005, 109: 17752–17756. DOI:10.1021/jp052411d |
| [15] | DiMagno SG, Sun H. The strength of weak interactions:aromatic fluorine in drug design[J]. Curr Top Med Chem, 2006, 6: 1473–1482. DOI:10.2174/156802606777951127 |
| [16] | Riley KE, Murray JS, Fanfrlik J, et al. Halogen bond tunability I:the effects of aromatic fluorine substitution on the strengths of halogen-bonding interactions involving chlorine, bromine, and iodine[J]. J Mol Model, 2011, 17: 3309–3318. DOI:10.1007/s00894-011-1015-6 |
| [17] | Calvo-Castro J, Morris G, Kennedy AR, et al. Effects of fluorine substitution on the intermolecular interactions, energetics, and packing behavior of N-benzyl substituted diketopyrrolopyrroles[J]. Cryst Growth Des, 2016, 16: 2371–2384. DOI:10.1021/acs.cgd.6b00157 |
| [18] | Geboes Y, De Proft F, Herrebout WA. The effect of fluorination on the competition of halogen bonding and hydrogen bonding:complexes of fluoroiodomethane with dimethyl ether and trimethylamine[J]. J Phys Chem A, 2017, 121: 4180–4188. DOI:10.1021/acs.jpca.7b03206 |
| [19] | Dunitz JD, Taylor R. Organic fluorine hardly ever accepts hydrogen bonds[J]. Chem Eur J, 1997, 3: 89–98. DOI:10.1002/(ISSN)1521-3765 |
| [20] | Thalladi VR, Weiss HC, Bläser D, et al. CH…F interactions in the crystal structures of some fluorobenzenes[J]. J Am Chem Soc, 1998, 120: 8702–8710. DOI:10.1021/ja981198e |
| [21] | Zhou P, Zou J, Tian F, et al. Fluorine bonding-how does it work in protein-ligand interactions?[J]. J Chem Inf Model, 2009, 49: 2344–2355. DOI:10.1021/ci9002393 |
| [22] | Metrangolo P, Murray JS, Pilati T, et al. Fluorine-centered halogen bonding:a factor in recognition phenomena and reactivity[J]. Cryst Growth Des, 2011, 11: 4238–4246. DOI:10.1021/cg200888n |
| [23] | Legon AC. Prereactive complexes of dihalogens XY with lewis bases B in the gas phase:a systematic case for the halogen analogue B…XY of the hydrogen bond B…HX[J]. Angew Chem Int Ed Engl, 1999, 38: 2686–2714. DOI:10.1002/(ISSN)1521-3773 |
| [24] | Metrangolo P, Murray JS, Pilati T, et al. The fluorine atom as a halogen bond donor, viz. a positive site[J]. CrystEngComm, 2011, 13: 6593–6596. DOI:10.1039/c1ce05554b |
| [25] | Eskandari K, Lesani M. Does fluorine participate in halogen bonding?[J]. Chemistry, 2015, 21: 4739–4746. DOI:10.1002/chem.201405054 |
| [26] | Kortagere S, Ekins S, Welsh WJ. Halogenated ligands and their interactions with amino acids:implications for structureactivity and structure-toxicity relationships[J]. J Mol Graph, 2008, 27: 170–177. DOI:10.1016/j.jmgm.2008.04.001 |
| [27] | Rybalova TV, Bagryanskaya IY. C-F…π, F…H, and F…F intermolecular interactions and F-aggregation:role in crystal engineering of fluoroorganic compounds[J]. J Struct Chem, 2009, 50: 741–753. DOI:10.1007/s10947-009-0113-0 |
| [28] | Bettinger HF. How good is fluorine as a hydrogen-bond acceptor in fluorinated single-walled carbon nanotubes?[J]. Chemphyschem, 2005, 6: 1169–1174. DOI:10.1002/(ISSN)1439-7641 |
| [29] | D'Oria E, Novoa JJ. On the hydrogen bond nature of the C-H…F interactions in molecular crystals. An exhaustive investigation combining a crystallographic database search and ab initio theoretical calculations[J]. CrystEngComm, 2008, 10: 423–436. DOI:10.1039/b717276c |
| [30] | Panini P, Chopra D. Experimental and theoretical characterization of short H-bonds with organic fluorine in molecular crystals[J]. Cryst Growth Des, 2014, 14: 3155–3168. DOI:10.1021/cg5004758 |
| [31] | Shukla R, Chopra D. Crystallographic and computational investigation of intermolecular interactions involving organic fluorine with relevance to the hybridization of the carbon atom[J]. CrystEngComm, 2015, 17: 3596–3609. DOI:10.1039/C4CE02391A |
| [32] | Dalvit C, Vulpetti A. Intermolecular and intramolecular hydrogen bonds involving fluorine atoms:Implications for recognition, selectivity, and chemical properties[J]. ChemMedChem, 2012, 7: 262–272. DOI:10.1002/cmdc.v7.2 |
| [33] | Dalvit C, Invernizzi C, Vulpetti A. Fluorine as a hydrogenbond acceptor:experimental evidence and computational calculations[J]. Chemistry, 2014, 20: 11058–11068. DOI:10.1002/chem.201402858 |
| [34] | Dalvit C, Vulpetti A. Weak intermolecular hydrogen bonds with fluorine:detection and implications for enzymatic/chemical reactions, chemical properties, and ligand/protein fluorine NMR screening[J]. Chem Eur J, 2016, 22: 7592–7601. DOI:10.1002/chem.201600446 |
| [35] | Taylor R. The hydrogen bond between N-H or O-H and organic fluorine:favourable yes, competitive no[J]. Acta Crystallogr B Struct Sci Cryst Eng Mater, 2017, 73: 474–488. DOI:10.1107/S2052520617005923 |
| [36] | Carosati E, Sciabola S, Cruciani G. Hydrogen bonding interactions of covalently bonded fluorine atoms:from crystallo-graphic data to a new angular function in the grid force field[J]. J Med Chem, 2004, 47: 5114–5125. DOI:10.1021/jm0498349 |
| [37] | Desiraju GR, Ho PS, Kloo L, et al. Definition of the halogen bond (IUPAC recommendations 2013)[J]. Pure Appl Chem, 2013, 85: 20. |
| [38] | Lommerse JP, Stone AJ, Taylor R, et al. The nature and geometry of intermolecular interactions between halogens and oxygen or nitrogen[J]. J Am Chem Soc, 1996, 118: 3108–3116. DOI:10.1021/ja953281x |
| [39] | Lu YX, Zou JW, Yu QS, et al. Ab initio investigation of halogen bonding interactions involving fluorine as an electron acceptor[J]. Chem Phys Lett, 2007, 449: 6–10. DOI:10.1016/j.cplett.2007.09.087 |
| [40] | Wang Y, Tong J, Wu W, et al. Organic fluorines as halogen bond donors:theoretical study and crystallographic evidence[J]. Int J Quantum Chem, 2015, 115: 884–890. DOI:10.1002/qua.24925 |
| [41] | Dikundwar AG, Row TNG. Evidence for the "amphoteric" nature of fluorine in halogen bonds:an instance of Cl …F contact[J]. Cryst Growth Des, 2012, 12: 1713–1716. DOI:10.1021/cg3002477 |
| [42] | Pavan MS, Durga Prasad K, Guru Row TN. Halogen bonding in fluorine:experimental charge density study on intermolecular FF and FS donor-acceptor contacts[J]. Chem Commun, 2013, 49: 7558–7560. DOI:10.1039/c3cc43513j |
| [43] | Metrangolo P, Resnati G. Type Ⅱ halogen …halogen contacts are halogen bonds[J]. IUCrJ, 2014, 1: 5–7. DOI:10.1107/S205225251303491X |
| [44] | Mukherjee A, Desiraju GR. Halogen bonds in some dihalogenated phenols:applications to crystal engineering[J]. IUCrJ, 2014, 1: 49–60. DOI:10.1107/S2052252513025657 |
| [45] | Varadwaj A, Varadwaj PR, Jin BY. Can an entirely negative fluorine in a molecule, viz. Perfluorobenzene, interact attracttively with the entirely negative site(s) on another molecule(s)? Like liking like![J]. RSC Adv, 2016, 6: 19098–19110. DOI:10.1039/C5RA27039A |
| [46] | Han Z, Czap G, Chiang C, et al. Imaging the halogen bond in self-assembled halogenbenzenes on silver[J]. Science, 2017, 358: 206–210. DOI:10.1126/science.aai8625 |
| [47] | Sirohiwal A, Hathwar VR, Dey D, et al. Characterization of fluorine-centred 'F…O' sigma-hole interactions in the solid state[J]. Acta Crystallogr B Struct Sci Cryst Eng Mater, 2017, 73: 140–152. DOI:10.1107/S2052520616017492 |
| [48] | Koohi AM, Mahdavifar Z, Noorizadeh S. Can fluorine form halogen bond? Investigation of halogen bonds through steric charge[J]. ChemistrySelect, 2017, 2: 2713–2717. DOI:10.1002/slct.201601840 |
| [49] | Esrafili MD, Mohammadian-Sabet F, Vessally E. An ab initio study on substituent and cooperative effects in bifurcated fluorine bonds[J]. Mol Phys, 2016, 115: 278–287. |
| [50] | Prasanna M, Row TG. C-halogen…π interactions and their influence on molecular conformation and crystal packing:a database study[J]. Cryst Eng, 2000, 3: 135–154. DOI:10.1016/S1463-0184(00)00035-6 |
| [51] | Saraogi I, Vijay VG, Das S, et al. C-halogen…π interactions in proteins:a database study[J]. Cryst Eng, 2003, 6: 69–77. DOI:10.1016/S1463-0184(03)00068-6 |
| [52] | Kawahara S, Tsuzuki S, Uchimaru T. Theoretical study of the CF/π interaction:attractive interaction between fluorinated alkane and an electron-deficient π-system[J]. J Phys Chem A, 2004, 108: 6744–6749. DOI:10.1021/jp047646o |
| [53] | Holl MG, Struble MD, Singal P, et al. Positioning a carbonfluorine bond over the π cloud of an aromatic ring:a different type of arene activation[J]. Angew Chem Int Edit, 2016, 55: 8266–8269. DOI:10.1002/anie.201601989 |
| [54] | Li P, Maier JM, Vik EC, et al. Stabilizing fluorine-pi interactions[J]. Angew Chem Int Ed Engl, 2017, 56: 7209–7212. DOI:10.1002/anie.201702950 |
| [55] | Paulini R, Muller K, Diederich F. Orthogonal multipolar interactions in structural chemistry and biology[J]. Angew Chem Int Ed Engl, 2005, 44: 1788–1805. DOI:10.1002/anie.200462213 |
| [56] | Omorodion H, Twamley B, Platts JA, et al. Further evidence on the importance of fluorous-fluorous interactions in supramolecular chemistry:a combined structural and computational study[J]. Cryst Growth Des, 2015, 15: 2835–2841. DOI:10.1021/acs.cgd.5b00254 |
| [57] | Olsen JA, Banner DW, Seiler P, et al. A fluorine scan of thrombin inhibitors to map the fluorophilicity/fluorophobicity of an enzyme active site:evidence for C-F …C=O interactions[J]. Angew Chem, 2003, 115: 2611–2615. DOI:10.1002/ange.200351268 |
| [58] | Olsen J, Seiler P, Wagner B, et al. A fluorine scan of the phenylamidinium needle of tricyclic thrombin inhibitors:effects of fluorine substitution on p Ka and binding affinity and evidence for intermolecular C-F…CN interactions[J]. Org Biomol Chem, 2004, 2: 1339–1352. DOI:10.1039/B402515F |
| [59] | Karnoukhova VA, Fedyanin Ⅳ, Lyssenko KA. Directionality of intermolecular C-F…F-C interactions in crystals:experimental and theoretical charge density study[J]. Struct Chem, 2015, 27: 17–24. |
| [60] | Bauza A, Frontera A. Electrostatically enhanced FF interactions through hydrogen bonding, halogen bonding and metal coordination:an ab initio study[J]. Phys Chem Chem Phys, 2016, 18: 20381–20388. DOI:10.1039/C6CP03862J |
| [61] | Lou Y, Sweeney ZK, Kuglstatter A, et al. Finding the perfect spot for fluorine:improving potency up to 40-fold during a rational fluorine scan of a bruton's tyrosine kinase (BTK) inhibitor scaffold[J]. Bioorg Med Chem Lett, 2015, 25: 367–371. DOI:10.1016/j.bmcl.2014.11.030 |
| [62] | Giroud M, Harder M, Kuhn B, et al. Fluorine scan of inhibitors of the cysteine protease human cathepsin L:dipolar and quadrupolar effects in the pi-stacking of fluorinated phenyl rings on peptide amide bonds[J]. ChemMedChem, 2016, 11: 1042–1047. DOI:10.1002/cmdc.v11.10 |
 2018, Vol. 53
2018, Vol. 53


