目前, 化疗是临床上治疗恶性肿瘤最常见的方式之一。多柔比星(doxorubicin, DOX)是抗生素类抗癌药物, 作为最常用的化疗药物之一, 可用于多种癌症的治疗[1, 2], 但其靶向性差, 毒副作用强, 而且长期使用会产生耐药性[3-5]。药物传递系统靶向治疗癌症受到了人们的广泛关注。聚合物胶束作为一种常用的药物载体, 有很好的发展前景, 尤其是在药剂学和生物学领域[6]。这类载体一般是两亲性嵌段共聚物在浓度大于临界胶束浓度(critical micelle concentration, CMC)时在水溶液中自组装形成的具有壳核结构的纳米粒[7-9], 疏水性内核可以包载亲脂性药物, 亲水性外壳使载体在静脉注射后有效地避免网状内皮系统的清除, 增加载体在体内的稳定性, 达到长循环的效果[10, 11]。作为一种纳米粒, 聚合物胶束还可以通过渗透与滞留效应(EPR)使药物优先累积到肿瘤组织, 实现被动靶向, 减少毒副作用[12-14]。
然而, 合成型的聚合物胶束材料显现出在体内难以被降解甚至会引起肾脏毒性等缺点[15], 故生物可降解性和生物相容性成为在研究过程中需要考虑的关键性因素[16]。天然多糖作为一种聚合物材料, 因其生物相容性好、生物可降解、无免疫原性被广泛的应用于纳米载体中[17]。Heparosan多糖是硫酸乙酰肝素和肝素的前体, 可通过发酵大肠杆菌heparosan菌株再从其荚膜中分离获得[18, 19]。Heparosan多糖的非硫酸化性质使其与肝素相比有更高的细胞摄取效率[20], 并且没有凝血活性也可以避免肝素在使用中出现的血小板减少症等不良反应, 有更好的生物安全性[21]。另外, heparosan多糖可被肿瘤细胞中过表达的β-葡萄糖醛酸酶降解[22-24]。由于heparosan多糖呈负电性, 可避免在血液中聚集也可防止非特异性吸附到血浆蛋白上[25]。Heparosan多糖亲水骨架上也有很多官能团可以进行疏水性修饰, 故适于作为聚合物胶束的亲水性材料。
维生素E琥珀酸酯(D-α-tocopheryl succinate, vitamin E succinate, VES)是维生素E的酯类衍生物, 作为一种有潜力的预防药物而受到广泛的关注。VES不仅具有抗肿瘤作用, 而且对正常组织无毒副作用[26-28]。VES可以抑制肿瘤细胞的迁移并且还可以从多种途径诱导肿瘤细胞的凋亡[29-31], 抑制肿瘤的浸润、转移, 所以越来越多的研究者将其应用于抗肿瘤药物的传递。
本实验利用疏水性的VES, 通过己二酸二酰肼(adipic dihydrazide, ADH)连接修饰亲水性的天然heparosan多糖合成了两种取代度的两亲性共聚物, 在水溶液中自组装形成聚合物胶束包载抗癌药物DOX, 并对载体胶束的制剂学性质及体外抗肿瘤活性进行了考察。
材料与方法仪器 Aduance Ⅲ核磁共振波谱仪(德国Bruker公司); JEM-2100透射电子显微镜(日本Jeol公司); UV-2550紫外可见分光光度计(日本岛津仪器有限公司); Zetasizer Nano ZS纳米粒度仪(英国Malvern仪器有限公司); DMIL LED倒置荧光显微镜、DMIL LED型荧光显微镜(德国Leica公司); Multiskan GO酶标仪(美国Thermo公司); FreeZone 2.5L冷冻干燥机(美国Labconco公司); FACSCalibur型流式细胞仪(美国BD公司)。
试剂 维生素E琥珀酸酯(阿拉丁试剂有限公司); 己二酸二酰肼(ADH)、1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC·HCl)、N-羟基丁二酰亚胺(NHS) (安耐吉化学试剂有限公司); 多柔比星盐酸盐(DOX·HCl, 浙江海正制药有限公司); 甲酰胺、N, N-二甲基甲酰胺(DMF)、二氯甲烷(DCM)、三乙胺(TEA)、乙醇、四氢呋喃(THF) (国药集团上海试剂公司)。
细胞与菌株 COS7和MGC80-3细胞购自中国科学院典型培养物保藏委员会细胞库; Heparosan多糖为实验室自制, 相对分子质量为5.108×104。
Heparosan多糖-己二酸二酰肼-维生素E琥珀酸酯(heparosan-adipic dihydrazide-vitamin E succinate, KV)的合成 Heparosan多糖(50 mg, -COOH摩尔数1.25×10-4 mol)溶于超纯水溶液中, 60 ℃油浴加热磁力搅拌使其溶解, 冷却至室温。ADH (21.75 mg/ 108.75 mg)加入到反应混合物中。加入EDC (40 mg, 2.5×10-4 mol)和NHS (30 mg, 2.5×10-4 mol), 用0.1 mol HCl时反应液的pH维持在4.75, 反应1 h, 用0.1 mol NaOH调节反应液pH至7.0来终止反应, 反应结束后得到反应液在蒸馏水中透析(MWCO 3 500), 得到聚合物溶液用0.45 μm水系的膜过滤除去不溶性杂质, 冷冻干燥, 得白色粉末heparosan-ADH。
VES (79.56 mg, 1.5×10-4 mol)溶解于20 mL DMF中。EDC (28.6 mg, 3×10-4 mol)和NHS (17.1 mg, 3×10-4 mol)加入溶液中, 避光冰浴下磁力搅拌2 h活化羧基。将heparosan-ADH 50 mg溶于甲酰胺溶液中, 60 ℃油浴加热磁力搅拌使其溶解, 冷却至室温。将heparosan-ADH溶液加入到VES溶液中混合液氮气环境下搅拌反应24 h。反应结束后得到反应液用蒸馏水透析(MWCO 3 500) 2天, 离心, 得白色粉末。采用1H NMR法检测KV结构, 并计算取代度。
临界胶束浓度的测定 将芘溶于丙酮中得浓度为6×10-5 mol·L-1溶液, 在60 ℃温和氮气流下将丙酮充分蒸发, 配制质量浓度范围为5×10-4~2.0 mg·mL-1胶束溶液, 将溶液加入芘中, 得到芘的终浓度为6×10-7 mol·L-1, 超声处理30 min, 静置过夜, 利用荧光分光光度计测定芘的激发光谱, 发射波长为375 nm, 激发波长为280~400 nm。
载药胶束的制备 将DOX·HCl溶于甲醇中得到10 mg·mL-1溶液, 每10 mL溶液中加入TEA 200 μL, 室温下磁力搅拌24 h旋蒸除掉溶剂得到脱盐DOX, 再将其溶于THF中避光保存。
溶剂挥发超声法制备载药胶束。将KV共聚物溶于pH 7.4磷酸盐缓冲溶液(phosphate buffer saline, PBS)中, 室温下磁力搅拌配制成10 mg·mL-1胶束溶液, 10 mL胶束溶液中缓慢滴加DOX的THF溶液2 mL, 室温下避光磁力搅拌12 h至THF挥发完全。冰浴下超声30 min, 离心除去未包入或吸附在表面的药物, 最后用0.22 μm的滤膜过滤得载药胶束DOX/KV。
粒径、zeta电位及微观形态观察 取适量胶束溶液于测量杯中, 利用Zetasizer Nano ZS纳米粒度仪测量胶束的粒径和zeta电位。配制质量浓度为1 mg·mL-1胶束溶液, 将溶液滴在镀碳膜的铜网上, 待液滴自然挥发干后用2%磷钨酸钠溶液进行负染色, 干燥后利用JEM-2100透射电子显微镜(transmission electron microscope, TEM)进行观察。
载药量和包封率测定 利用紫外分光光度法测定载药胶束的包封率(encapsulation efficiency, EE)和载药量(drug loading, DL)。取DOX/KV溶液500 μL, 用甲酰胺定容至10 mL, 避光超声10 min破坏胶束结构释放出药物, 通过紫外分光光度计检测其在481 nm处吸光度, 计算总药量。另取DOX/KV溶液2 mL于超滤杯中(MWCO 3 000), 5 200 r·min-1离心30 min截留载药胶束, 通过紫外分光光度计测定滤出液在481 nm处吸光度, 计算游离DOX的量。最后通过总药量和游离药量分别计算DL和EE。
体外药物释放实验 考察载药胶束的体外释放行为的释放介质为pH 7.4、pH 5.0和β-葡萄糖醛酸酶降解的PBS溶液, 分别模拟正常组织与肿瘤组织内的微环境。取DOX/KV12载药胶束溶液2 mL装入透析袋中(MWCO 3 500), 将透析袋完全浸没于20 mL pH 7.4和pH 5.0 PBS中。为了评估β-葡萄糖醛酸酶对药物释放行为的影响, 将β-葡糖醛酸糖苷酶1 mg加入到含有载药胶束的透析袋中, 降解30 min。37 ℃、100 r·min-1摇床中避光进行, 在设计的时间点吸出1 mL释放介质并补充等量的相同的释放介质以保证漏槽环境。通过测定不同时间点所取PBS中DOX的含量计算DOX的累积释放量。
体外细胞毒性的考察 通过MTT法对体外毒性进行考察, 选择MGC80-3与COS7细胞作为体外细胞模型, 将细胞以每孔7 000个铺于96孔板中, 在37 ℃、5% CO2环境中孵育24 h使其贴壁生长后, 加入含药培养基100 μL, 孵育48 h后吸出培养基加入MTT孵育4 h后吸出MTT, 加入DMSO 100 μL, 测定570 nm处吸光度, 计算细胞存活率。
荧光显微镜定性观察细胞摄取 将对数生长期的细胞以每孔104个铺于24孔板中, 在37 ℃、5% CO2环境中孵育24 h使其贴壁生长后, 加入DOX终质量浓度为5 μg·mL-1的100 μL含药培养基孵育1、2和4 h后, 弃去培养基, 用PBS (pH 7.4)洗掉残留培养基, 加入4%多聚甲醛200 μL固定15 min, 加入PBS (pH 7.4)洗掉多聚甲醛, 加入细胞核染色剂DAPI 200 μL染色30 min, 吸去染色剂并用PBS (pH 7.4)洗掉多余残留染色剂后, 每孔加入PBS 300 μL, 利用荧光显微镜进行观察。
流式细胞仪定量观察细胞摄取 将对数生长期的细胞以每孔4×105个铺于6孔板中, 在37 ℃、5% CO2环境中孵育24 h使其贴壁生长后, 加入DOX终质量浓度为5 μg·mL-1的100 μL含药培养基孵育1、2和4 h后, 弃去培养基, 用PBS (pH 7.4)洗掉残留培养基, 加入胰酶300 μL消化细胞, 加入培养基终止消化, 收集细胞, 离心去除培养基, 将细胞用PBS (pH 7.4)吹散, 转移至流式管中, 利用流式细胞仪进行定量观察。
统计学方法 实验数据表示为x± s。统计分析采用one-way ANOA (SPSS 17.0, Chicago, IL, USA)。统计学的显著、非常显著和极非常显著差异分别表示为P < 0.05、P < 0.01和P < 0.001。
结果与讨论 1 KV的合成两亲性共聚物KV的合成如合成路线1所示, 通过1H NMR确证其结构, 由图 1可知, KV图谱中δ 3.63、3.83和5.31处出现了heparosan多糖氨基葡萄糖上H的特征吸收峰, 1.98处为heparosan多糖氨基葡萄糖甲基(-CO-CH3)的特征吸收峰, 3.29、3.72和4.54处出现了heparosan多糖葡萄糖醛酸上H的特征吸收峰。1.05~1.35和2.85处出现了VES烷烃链上亚甲基(-CH2-)的特征吸收峰, 2.63出现了VES苯环上甲基(-CH3)的特征吸收峰。8.05~8.11之间出现了酰胺基团(-CONH-)的吸收峰, 由此确定两亲性共聚物KV已成功合成。
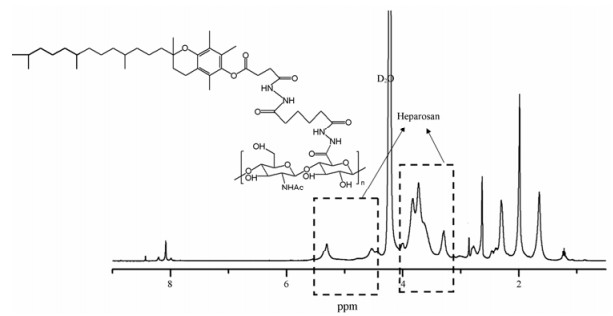
|
Figure 1 1H NMR spectra of KV in D2O |
通过峰面积的积分计算heparosan多糖上VES分子的取代度(degree of substitution, DS), 即平均每个heparosan多糖双糖单元所接枝VES分子的个数, 2.63为VES分子中-CH3中氢原子化学位移, 5.31处为heparosan多糖氨基葡萄糖1号碳上1个氢原子化学位移, 利用峰积分面积比值计算VES的取代度。利用不同的投料比合成了两种取代度的KV共聚物, 取代度为12%与25%, 分别用KV12和KV25表示。
2 载药胶束的性质表征采用溶剂挥发超声法制备载药胶束, 分别利用动态光散射法(dynamic light scattering, DLS)和TEM对胶束的大小和形态进行考察, 胶束的粒径大小如表 1所示, 空白胶束水化半径在120~130 nm之间, 而载药胶束在140~160 nm之间, 比空白胶束略有增加, 随着疏水端取代度的增加, 疏水内核形成更加紧密, 粒径略有减小。载药胶束DOX/KV12粒径分布图见图 2a, TEM形貌见图 2b, 可以看到载药胶束呈均匀球形, 且粒径较为均一。这样的特性可以使胶束在体内有效躲避网状内皮系统的吞噬, 并可通过EPR蓄积到肿瘤组织中[32]。
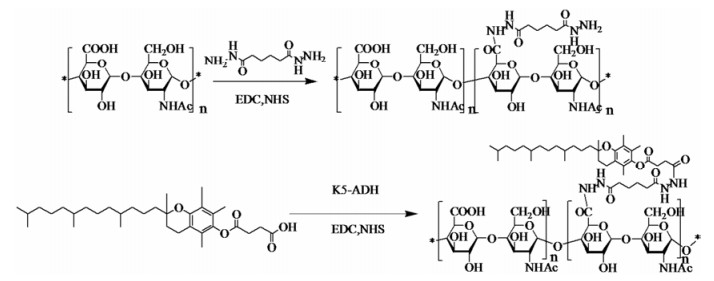
|
Scheme1 Synthetic scheme of heparosan-adipic dihydrazide-vitamin E succinate (KV) copolymers |
| Table 1 Characterization of blank micelles and drug-loaded micelles. aDetermined by dynamic light scattering (DLS); bThe rate of doxorubicin (DOX) to polymers was 2/10 (mg/mg); cPyrene probe method was used to determined micellar critical micelle concentration (CMC). KV: Heparosan polysaccharide-vitamin E succinate; PDI: Polydispersity index; EE: Encapsulation efficiency; DL: Drug loading |
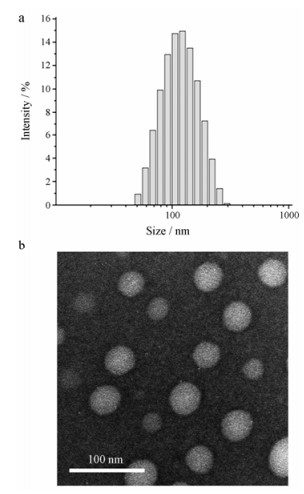
|
Figure 2 Size distribution (a) and TEM image (b) of KV12 |
利用芘探针法测定了两种取代度聚合物形成胶束的CMC, 从表 1可以看到, 两种取代度的聚合物均有较小的CMC值, 说明形成聚合物胶束有较好的热力学稳定性[33], 疏水端的取代度越高, 其CMC值越低, 这是因为随着疏水性分子VES量的增多, 亲水-疏水作用增强, 故KV25相较于KV12可形成更稳定的胶束, 表现为更低的CMC值, 说明取代度是影响heparosan多糖胶束CMC的重要因素。
Heparosan多糖结构中含有羧基, 故其本身带有负电荷, 在对heparosan多糖进行疏水化修饰时, 羧基并非全部被修饰, 形成的以heparosan多糖为亲水外壳的聚合物胶束表面含有大量羧基, 故测得胶束的zeta电位为-20 mV以上(表 1)的负电位, 随着取代度的增大, heparosan多糖链上接枝的VES增多, 链上的羧基含量变少, 从而使胶束表面电荷减少。带有负电荷的聚合物胶束相互排斥不仅可以保证其在体内不会产生聚集, 还可以避免血浆蛋白对其产生吸附[24], 可以使胶束在体内保持稳定且在血液中有更好的循环能力[34]。
由表 1可以看出DOX/KV25和DOX/KV12的包封率在80%左右, 载药量在10%~15%之间, 有较好的载药量和包封率。疏水端的取代度增加, 胶束的疏水内核与药物的亲和力增强, 故DOX/KV25的载药量和包封率略大。
3 体外释放行为选择使用pH 7.4 PBS模拟血液和pH 5.0 PBS模拟肿瘤部位的环境, 加入葡糖醛酸糖苷酶以模拟肿瘤细胞的溶酶体环境, 考察载药胶束DOX/KV12的体外释放行为, 如图 3所示。从图中可以看到, 在释放的初始阶段释放速率稍快, 在10 h时pH 7.4、pH 5.0和β-葡萄糖醛酸酶组释放率分别为40.36%、49.10%和58.13%, 之后是较长时间的缓释阶段, 最终在3组中分别释放了55.32%、68.24%和69.33%。总体而言, 在pH 5.0 PBS中DOX的释放速率和释放量高于在pH 7.4 PBS中的释放速率和释放量, 表明在肿瘤部位促进药物释放行为。由于DOX从胶束中的释放主要是通过自由扩散的方式, 故这种区别可能是由于DOX在不同pH值下的溶解度不同以及heparosan多糖与DOX之间的静电相互作用。已知, DOX在离子化状态和低pH下溶解性较好。因此, 低pH促使包封的DOX从内壳迁移到外壳, 导致释放速率的增加。Heparosan多糖的羧基在低pH环境中为非电离状态, 使得其与DOX之间的静电作用减弱, 药物得到更充分的释放, 故表现出一定的pH敏感药物释放行为。另外, 载有DOX的胶束加入β-葡糖醛酸糖苷酶后还显示出加速释放行为。由于heparosan多糖降解, 在最初10 h内, 超过58%的DOX释放出来。肿瘤部位微环境特征包括低pH和各种过表达的酶等, 且药物释放研究中的现象表明载药胶束可能在肿瘤环境中有较好的释放行为。
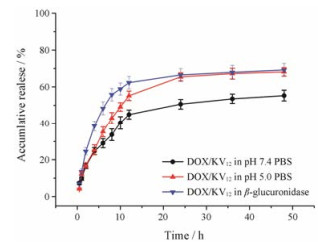
|
Figure 3 In vitro drug release behavior of drug-loaded micelles in pH 7.4 phosphate buffered solution (PBS), pH 5.0 PBS and β-glucuronidase. n = 3, x± s |
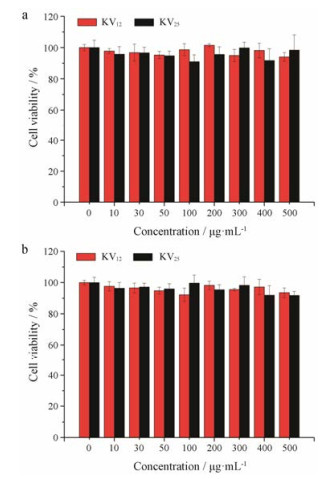
利用MTT法检测空白胶束的细胞毒性, 分别考察了载体对正常细胞COS7 (图 4a)和肿瘤细胞MGC80-3 (图 4b)两种细胞的毒性, 从图中可以看到, 细胞存活率均在90%以上, 说明空白胶束对细胞几乎没有毒性。
|
Figure 4 In vitro cytotoxicity of the blank micelles on COS7 cells (a) and MGC80-3 cells (b). n = 3, x± s |
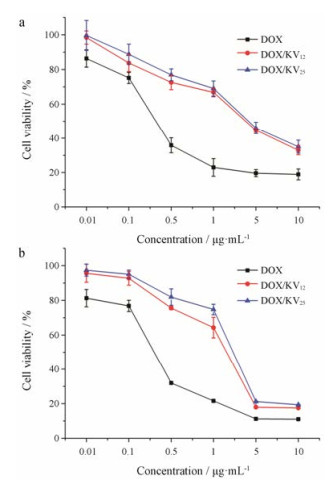
载药胶束的细胞毒性是决定其是否可应用于临床治疗的重要指标之一。为了检测载药胶束的体外抗肿瘤活性, 选择游离DOX作为阳性对照, 同样利用MTT法考察了载药胶束对COS7细胞(图 5a)和MGC80-3细胞(图 5b)的毒性, 从图中可以看到, 随着DOX的浓度不断增大, 细胞毒性也随之增加。游离DOX对两种细胞的毒性都大于载药胶束, 这是由于游离药物可以通过被动扩散快速进入细胞, 发挥作用。
|
Figure 5 In vitro cytotoxicity of the drug-loaded micelles on COS7 cells (a) and MGC80-3 cells (b). n = 3, x± s |
对于DOX/KV25与DOX/KV12胶束而言, 它们对COS7细胞的半数抑制浓度(IC50值)分别为3.6 ± 0.2和3.2 ± 0.1 μg·mL-1, 对于MGC80-3细胞IC50值分别为2.03 ± 0.05和1.46 ± 0.04 μg·mL-1。可以看出, DOX/ KV12对MGC80-3细胞的毒性要大于DOX/KV25, 可能是由于高取代度的衍生物表现出不易水解和聚集的高稳定性[35], 而DOX除了通过自由扩散释放之外还有部分可能是由于胶束的解聚进行释放, 故低取代度的载体具有更大的细胞毒性。此外, 两种不同取代度的胶束对正常细胞的IC50值约为肿瘤细胞的1.5~2倍, heparosan多糖可被肿瘤细胞中过表达的β-葡萄糖醛酸酶降解, 且细胞内的低pH环境也可促进药物的释放, 故对肿瘤细胞有一定的选择性, 可增强对肿瘤细胞的杀伤作用, 并减少毒副作用。
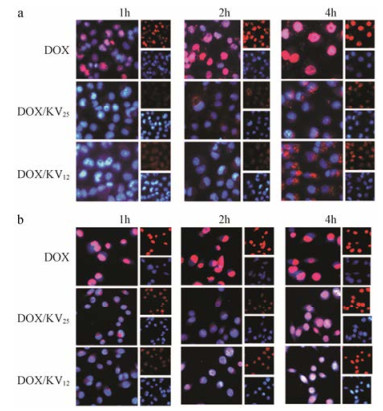
5 细胞摄取实验 5.1 荧光显微镜定性观察利用荧光显微镜定性观察两种载药胶束的细胞摄取情况, 对于COS7细胞(图 6a), 随着时间的增加, 细胞摄取量逐渐增加, DOX进核量也随之增多, 但是两组胶束入胞量远少于DOX, 且在4 h时药物仍基本聚集在细胞质中, 进核量极少。对于MGC80-3细胞(图 6b), 在1 h时各组制剂进胞量较少但DOX已经进核, 2 h时后, 细胞内药物的量明显变多, 更多的药物进入到细胞核或聚集在核膜周围, 这说明随着时间的延长, 肿瘤细胞对各组药物的摄取量增加。且从图 6b中可以看到, 在摄取2 h时, DOX/KV25胶束组还有部分药物未从胶束中释放出来而聚集在细胞质中, 而DOX/KV12胶束组的药物基本释放并进入细胞核, 这与前面实验结果一致。
|
Figure 6 Fluorescence microscopy image of free DOX and drug-loaded micelles incubated with COS7 cells (a), MGC80-3 cells (b) in 1, 2, 4 h, respectively |
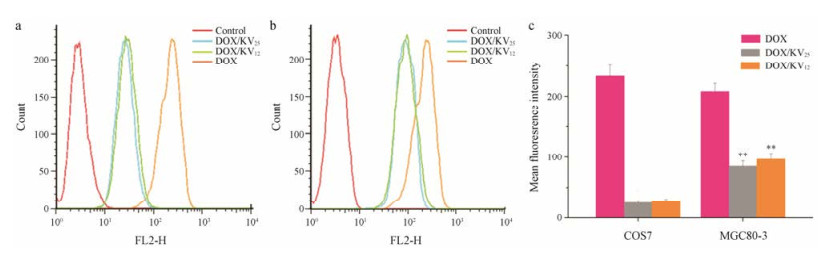
利用流式细胞仪定量考察载药胶束的细胞摄取情况, COS7细胞和MGC80-3细胞在4 h的摄取结果见图 7a, b。从图中可以看出, 游离DOX的摄取量要多于胶束组(图 7c), 可能是由于相对于小分子的游离DOX而言, 大分子的载药胶束的摄取方式为胞饮作用, 具有时间、浓度和能量依赖性等[36], 更不易摄取进入细胞, 但heparosan多糖与其他多糖相比有更高的细胞摄取效率[20]。MGC80-3细胞对载药胶束的摄取量明显大于COS7细胞对其的摄取量(P < 0.01), 与定性观察结果相符。可能的原因是heparosan多糖摄取进入COS7细胞的途径为能量依赖且仅有少量为巨胞饮途径, 而heparosan多糖摄取进入肿瘤细胞为多种途径介导的, 故可选择性地高效摄取进入肿瘤细胞[37]。
|
图 7 Fluorescence intensity of free DOX and drug-loaded micelles incubated with COS7 cells (a), MGC80-3 cells (b), respectively, and fluorescence intensity histograms (c) (n = 3, x± s) in 4 h; **P < 0.01 vs COS7 cells |
本文所设计的药物传递系统KV聚合物胶束采用了天然heparosan多糖和VES, 并考察其制剂学性质及体外抗肿瘤性能结果。体外释放实验表明其有一定的pH响应性和酶敏感性, 可使其在肿瘤组织中释放更多药物。在体外细胞毒性实验中也可以证实, 载药胶束对肿瘤细胞的毒性大于正常细胞, 且相较于正常细胞载药胶束可以更高效地摄入肿瘤细胞, 这样既可保证与游离DOX有相似的抗肿瘤活性又可以减小毒副作用。实验结果表明, 疏水端取代度较低的载体(KV12)在一定程度上具有更好的体外抗肿瘤活性。本研究所设计的载体仅有被动靶向作用, 后续还可将其设计为环境响应型及主动靶向型聚合物胶束, 并且对VES的逆转多药耐药作用进一步研究。
| [1] | Huan ML, Zhou SY, Teng ZH, et al. Conjugation with α-linolenic acid improves cancer cell uptake and cytotoxicity of doxorubicin[J]. Bioorg Med Chem Lett, 2009, 19: 2579–2584. DOI:10.1016/j.bmcl.2009.03.016 |
| [2] | Zhang D, Li JY, Wang XC, et al. Preparation and evaluation of doxorubicin hydrochloride liposomes modified by poly (2-ethyl-2-oxazoline)-cholesteryl methyl carbonate[J]. Acta Pharm Sin (药学学报), 2015, 50: 1174–1179. |
| [3] | Jia N, Ye Y, Wang Q, et al. Preparation and evaluation of poly(L-histidine) based pH-sensitive micelles for intracellular delivery of doxorubicin against MCF-7/ADR cells[J]. Asian J Pharm Sci, 2017, 12: 433–441. DOI:10.1016/j.ajps.2017.05.007 |
| [4] | Peer D, Karp JM, Hong SP, et al. Nanocarriers as an emerging platform for cancer therapy[J]. Nat nanotechnol, 2007, 2: 751–760. DOI:10.1038/nnano.2007.387 |
| [5] | Danhier F, Feron O, Préat V. To exploit the tumor microen-vironment:passive and active tumor targeting of nanocarriers for anti-cancer drug delivery[J]. J Control Release, 2010, 148: 135–146. DOI:10.1016/j.jconrel.2010.08.027 |
| [6] | Hu Y, He X, Lei L, et al. Preparation and characterization of self-assembled nanoparticles of the novel carboxymethyl pachyman-deoxycholic acid conjugates[J]. Carbohydr Polym, 2008, 74: 220–227. DOI:10.1016/j.carbpol.2008.02.014 |
| [7] | Yin XL, Zhang B, Liu YJ, et al. Advances in polymer-drug conjugated micelles in the delivery of anticancer drugs[J]. Acta Pharm Sin (药学学报), 2016, 51: 710–716. |
| [8] | Hehir S, Cameron NR. Recent advances in drug delivery systems based on polypeptides prepared from N-carboxyan-hydrides[J]. Polym Int, 2014, 63: 943–954. DOI:10.1002/pi.2014.63.issue-6 |
| [9] | Li R, Song XN, Zhang H, et al. The integrity study on PEG-PCL micelles transcellular transported across MDCK epithelial cell monolayer using FRET technology[J]. Acta Pharm Sin (药学学报), 2016, 51: 1316–1324. |
| [10] | Mao SR, Tian Y, Wang LL. Research progress on drug nano-container-polymeric micelles[J]. J Shenyang Pharm Univ (沈阳药科大学学报), 2010, 27: 979–986. |
| [11] | Li J, Wang X, Zhang T, et al. A review on phospholipids and their main applications in drug delivery systems[J]. Asian J Pharm Sci, 2015, 10: 81–98. DOI:10.1016/j.ajps.2014.09.004 |
| [12] | Zhang Y, Feng J, Jia Y, et al. Development of tetrahydroiso-quinoline-based hydroxamic acid derivatives:potent histone deacetylase inhibitors with marked in vitro and in vivo antitumor activities[J]. J Med Chem, 2011, 54: 2823–2838. DOI:10.1021/jm101605z |
| [13] | Gao HL, Jiang XG. The development of novel tumor targeting delivery strategy[J]. Acta Pharm Sin (药学学报), 2016, 51: 272–280. |
| [14] | Mishra P, Nayak B, Dey RK. PEGylation in anti-cancer therapy:an overview[J]. Asian J Pharm Sci, 2016, 11: 337–348. DOI:10.1016/j.ajps.2015.08.011 |
| [15] | Richter AW, kerblom E. Polyethylene glycol reactive antibodies in man:titer distribution in allergic patients treated with monomethoxy polyethylene glycol modified allergens or placebo, and in healthy blood donors[J]. Int Arch All Immunol, 1984, 74: 36–39. DOI:10.1159/000233512 |
| [16] | Rong L, Zhang YT, Hu QH. Progress in the research of natural polymer micelle[J]. Chin J Mod Appl Pharm (中国现代应用药学), 2010, 27: 1182–1187. |
| [17] | Baldwin AD, Kiick KL. Polysaccharide-modified synthetic polymeric biomaterials[J]. Biopolymers, 2010, 94: 128–140. DOI:10.1002/bip.21334 |
| [18] | Zhao L, Yan ZQ, Wang C. Progress of study on the heparoson production by E.coli K5[J]. Curr Biotechnol (生物技术进展), 2011, 1: 195–200. |
| [19] | Wang XY, Song HJ. Biosynthesis pathway and structure variability of bacterial endotoxin[J]. J Food Sci Biotechnol (食品与生物技术学报), 2013, 32: 1009–1015. |
| [20] | Raman K, Mencio C, Desai UR, et al. Sulfation patterns determine cellular internalization of heparin-like polysaccharides[J]. Mol Pharm, 2013, 10: 1442–1449. DOI:10.1021/mp300679a |
| [21] | Capila I, Linhardt RJ. Heparin-protein interactions[J]. Angew Chem Int Ed Engl, 2002, 41: 391–412. |
| [22] | Barzu T, Van Rijn J, Petitou M, et al. Heparin degradation in the endothelial cells[J]. Thromb Res, 1987, 47: 601–609. DOI:10.1016/0049-3848(87)90365-3 |
| [23] | DeAngelis PL. HEPtune:a process of conjugating a naturally occurring sugar molecule, heparosan, to a drug for enhanced drug delivery[J]. Drug, 2013, 13: 34–38. |
| [24] | Grinda M, Clarhaut J, Renoux B, et al. A self-immolative dendritic glucuronide prodrug of doxorubicin[J]. Med Chem Commun, 2012, 3: 68–70. DOI:10.1039/C1MD00193K |
| [25] | Blundell CD, Roberts IS, Sheehan JK, et al. Investigating the molecular basis for the virulence of Escherichia coli K5 by nuclear magnetic resonance analysis of the capsule polysaccharide[J]. J Mol Microbiol Biotechnol, 2009, 17: 71–82. DOI:10.1159/000215933 |
| [26] | You H, Yu W, Munoz-Medellin D, et al. Role of extracellular signal-regulated kinase pathway in RRR-α-tocopheryl succinate-induced differentiation of human MDA-MB-435 breast cancer cells[J]. Mol Carcinog, 2002, 33: 228–236. DOI:10.1002/(ISSN)1098-2744 |
| [27] | Gu X, Song X, Dong Y, et al. Vitamin E succinate induces ceramide-mediated apoptosis in head and neck squamous cell carcinoma in vitro and in vivo[J]. Clin Cancer Res, 2008, 14: 1840–1848. DOI:10.1158/1078-0432.CCR-07-1811 |
| [28] | Ni J, Chen M, Zhang Y, et al. Vitamin E succinate inhibits human prostate cancer cell growth via modulating cell cycle regulatory machinery[J]. Biochem Biophys Res Commun, 2003, 300: 357–363. DOI:10.1016/S0006-291X(02)02851-6 |
| [29] | Bao Y, Yin M, Hu X, et al. A safe, simple and efficient doxorubicin prodrug hybrid micelle for overcoming tumor multidrug resistance and targeting delivery[J]. J Control Release, 2016, 235: 182–194. DOI:10.1016/j.jconrel.2016.06.003 |
| [30] | Peng Y, Zhao J, Hou L, et al. Vitamin E succinate induces apoptosis via the PI3K/AKT signaling pathways in EC109 esophageal cancer cells[J]. Mol Med Rep, 2016, 14: 1531–1537. DOI:10.3892/mmr.2016.5445 |
| [31] | Neuzil J, Dong LF, Ramanathapuram L, et al. Vitamin E analogues as a novel group of mitocans:anti-cancer agents that act by targeting mitochondria[J]. Mol Aspects Med, 2007, 28: 607–645. DOI:10.1016/j.mam.2007.02.003 |
| [32] | Yoo HS, Park TG. Biodegradable polymeric micelles composed of doxorubicin conjugated PLGA-PEG block copolymer[J]. J Control Release, 2001, 70: 63–70. DOI:10.1016/S0168-3659(00)00340-0 |
| [33] | Du JZ, Tang LY, Song WJ, et al. Evaluation of polymeric micelles from brush polymer with poly(ε-caprolactone)-b-poly (ethylene glycol) side chains as drug carrier[J]. Biomacro-molecules, 2009, 10: 2169–2174. DOI:10.1021/bm900345m |
| [34] | Lo CL, Huang CK, Lin KM, et al. Mixed micelles formed from graft and diblock copolymers for application in intracel-lular drug delivery[J]. Biomaterials, 2007, 28: 1225–1235. DOI:10.1016/j.biomaterials.2006.09.050 |
| [35] | Huang Q, Li Y, Zhang H, et al. Environmental-responsive behavior of poly(acrylic acid)[J]. Acta Chim Sin (化学学报), 2009, 67: 2421–2426. |
| [36] | Xiao L, Xiong X, Sun X, et al. Role of cellular uptake in the reversal of multidrug resistance by PEG-b-PLA polymeric micelles[J]. Biomaterials, 2011, 32: 5148–5157. DOI:10.1016/j.biomaterials.2011.03.071 |
| [37] | Peng HH, Li Y, Yuan JY, et al. Endocytosis pathway and intracellular distribution of heparosan[J]. Acta Pharm Sin (药学学报), 2017, 52: 474–480. |
 2018, Vol. 53
2018, Vol. 53


