基因治疗是伴随着分子生物学与细胞生物学发展起来的一种新兴的治疗手段, 旨在通过导入治疗基因、沉默或编辑致病基因等方法对机体进行基因修正, 从而达到治疗目的[1]。眼睛是基因治疗的理想部位, 因为眼球体积相对较小, 基因给药剂量低; 作为相对独立的器官, 眼睛具有免疫赦免特权, 可以在一定程度上减少外源性物质引起的炎症和免疫反应; 局部给药方便, 可以有效避免体内复杂的生理环境对基因递送产生干扰。
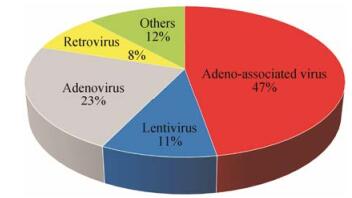
据统计, 目前在全球范围内有将近10亿人口受眼部疾病困扰, 其中失明人数约有4 000万[2], 然而在临床上, 有相当一部分致盲性的眼部疾病如X连锁视网膜劈裂症、老年黄斑变性、Leber先天性黑朦、Leber遗传性视神经病变和无脉络膜症等仍缺乏有效的治疗手段。利用核酸类药物调控基因表达已成为治疗这些致盲性眼部疾病最有前景的策略之一[3], 随着基因诊断和治疗水平的不断提高, 目前已有20余种针对上述眼部疾病的基因药物正在进行临床评价[3] (表 1)。实现眼部疾病有效的基因治疗, 需要克服两方面困难:其一, 基因药物自身分子质量大, 亲水性强, 并且在体内外稳定性差, 不利于递送; 其二, 眼部具有多重阻碍药物吸收的保护性屏障, 包括以泪膜屏障、角膜屏障和结膜屏障为代表的眼前段屏障, 以巩膜屏障和血液-视网膜屏障为代表的眼后段屏障, 以及玻璃体和房水的对流等, 均限制了基因的吸收。单纯的基因药物通过传统的局部滴眼或全身给药很难到达眼内或眼底的病灶部位, 也很难进入细胞发挥其功效, 必须借助适宜的基因载体实现其有效递送。眼部基因治疗的递送载体分为病毒载体和非病毒载体两大类。病毒载体主要包括:腺病毒(adenovirus, Ad)载体、腺相关病毒(adeno-associated virus, AAV)载体、慢病毒(lentivirus, LV)载体以及逆转录病毒(retrovirus)载体等(图 1)。其中, Ad、AAV、LV常用于眼部疾病的基因治疗, 尤其是AAV的使用频率高, 占全部基因载体近50%。病毒载体具有转染效率高、易于纯化、与基因药物结合能力强等优势。但是, 病毒载体的不足之处在于具有潜在的免疫毒性和染色体毒性, 而且调控靶基因表达的能力较差, 因此其临床应用具有明显的局限性[4]; 非病毒载体最突出的优势是可以弥补病毒载体的安全缺陷, 降低免疫原性, 对基因药物的包载量可调节, 但转染效率相对较低。因此, 目前对非病毒载体的研究, 大多侧重通过各种修饰手段改善其对基因药物的携载、释放与转染能力[5]。
| Table 1 Clinical trials of gene therapy for ocular diseases. XLRS: X-Linked juvenile retinoschisis; AMD: Age-related macular degeneration; LCA: Lebercongenital amaurosis; LHON: Leberhereditary optic neuropathy; CHM: Choroideremia; ASO: Antisense oligonucleotides; IVT: Intravitreal injection; SR: Subretinal injection; \: Undisclosed |
|
Figure 1 Viral vectors used in ocular gene therapy clinical trials. Data were collected from the website of Clinical Trials, a service of the U.S. National Institutes of Health (https://clinicaltrials.gov/) |
基因药物具有良好的靶向作用及较低的剂量要求, 为治疗眼部疾病带来了曙光。本文将从基因治疗相关的眼部疾病与基因药物、基因的眼内递送途径与吸收屏障以及眼部基因递送载体与递送策略等几个方面介绍基因治疗眼部疾病的前沿进展。
1 基因治疗相关的眼部疾病 1.1 X连锁视网膜劈裂症X连锁视网膜劈裂症(X-linked juvenile retinoschisis, XLRS)是由RS1基因变异引起的视网膜退行性疾病[6]。RS1基因相对较小, 位于染色体Xp22.2, 含6个外显子, 编码224个氨基酸的蛋白质。视网膜感光细胞分泌RS1蛋白, 该蛋白主要功能是介导细胞间的黏附, 其改变会影响视网膜功能, 表现为视网膜内层劈裂[7]。XLRS的发病率约1/5 000~1/25 000[8], 是引起男性青少年黄斑变性的最主要原因[7]。根据劈裂部位及临床特点可分为先天性视网膜劈裂症和后天性视网膜劈裂症。其特征主要在于视网膜双侧形成囊性腔, 导致视网膜脱离从而引起视力下降[9]。已有研究表明, 借助腺相关病毒载体携带RS1基因, 通过玻璃体注射, 可以有效改善小鼠视网膜退行症状[10]。
1.2 老年黄斑变性老年黄斑变性(age-related macular degeneration, AMD)是发达国家60岁以上人群视力受损甚至失明的主要原因[11], 预计到2020年, 全球患者人数将达2亿左右, 严重影响老年人的生活质量[12]。AMD通常是由于视网膜色素上皮层(retina pigment epithetlium, RPE)随年龄增长发生功能障碍所致, 临床上分为干性AMD和湿性AMD两种[13], 其中干性AMD以产生玻璃膜疣和视网膜地图样萎缩为特征, 通常不会导致失明; 而湿性AMD以脉络膜新生血管化(choroidal neovascularization, CNV)、视网膜下腔渗出为特征, 晚期会使视网膜和脉络膜组织破坏, 导致失明[14]。目前临床上针对湿性AMD的治疗手段主要是眼内注射抗血管内皮生长因子(vascular endothelial growth factor, VEGF)药物。VEGF是诱导脉络膜血管增生的重要因子, 临床上通过眼内注射基因药物哌加他尼钠(Macugen, 一种拮抗VEGF的聚乙二醇化适配体), 可以有效抑制病理性新生血管形成[15]。
1.3 Leber先天性黑朦Leber先天性黑朦(lebercongenital amaurosis, LCA)是发生年龄最低、最严重的遗传性视网膜病变, 是导致儿童先天性失明的主要疾病[16], 在全球新生儿中的发病率高达1/33 000[17], 占遗传性视网膜疾病的1/20, 且盲校儿童中约1/5患有LCA[18]。已有研究表明, 光感受器前体细胞内CEP290基因、视网膜色素上皮层RPE65基因突变均可能导致发生LCA。将正常基因导入相应细胞可以使相关基因的表达恢复到正常水平, 有效改善视力功能[19, 20]。
1.4 Leber遗传性视神经病变Leber遗传性视神经病变(leberhereditary optic neuropathy, LHON)是由线粒体DNA突变引起的视网膜神经节细胞退行性改变的疾病[21], 其主要特征表现为无痛性、视力急性或亚急性下降。该病多发于青少年, 在很多病例中通常一只眼睛先罹患LHON, 随后会波及另一只眼睛, 使视力严重受损[22]。男性患有LHON的概率高于女性, 且在年龄15~30岁发病率最高[23]。目前主要的临床治疗手段为直接增强线粒体功能及阻止氧化损伤[24]。
1.5 无脉络膜症无脉络膜症(choroideremia, CHM)又称全脉络膜血管萎缩或进行性脉络膜萎缩, 是由X染色体长臂上的一个编码rabescort-1 (REP-1)蛋白的CHM基因突变引起的双眼脉络膜视网膜渐进性萎缩疾病, 其发病率约为1/50 000[25]。CHM的主要特征表现为X染色体隐性遗传且随着视网膜光感受器、RPE细胞和脉络膜毛细血管层逐渐萎缩, 视力逐渐丧失[25]。
2 治疗眼部疾病的基因药物 2.1 质粒DNA质粒DNA分子量通常为数千碱基对(base pair, bp), 经载体介导进入细胞后, 可以在宿主细胞的胞浆中表达治疗蛋白, 或者随机插入到宿主细胞的基因中持续表达, 但后者较难实现。一般情况下, 质粒DNA可借助载体进入宿主细胞内并较长时间持续表达相关蛋白, 发挥治疗效果。由于质粒DNA分子量很大, 需要有效地压缩和递送工具帮助其进入细胞内发挥作用[26]。基因编辑技术的问世为精准修复致病基因提供了可能, 可以借助导向RNA (sgRNA)与细胞内的DNA实现特异性结合[27]。
2.2 小干扰RNA小干扰RNA (small interfering RNA, siRNA)是通过化学合成得到的双链RNA, 其单链长度一般为19~21 bp左右, 3'端通常有2个突出核苷酸, 进入胞浆后siRNA结合相关蛋白质形成RNA诱导的沉默复合体(RNA-induced silencing complex, RISC), 在siRNA的引导下, RISC能够识别并降解靶基因的mRNA[28]。siRNA的最大优势在于几乎可以抑制任意类型基因的表达[29]。siRNA-027是第1个进行临床试验的化学合成类siRNA药物, 通过靶向VEGFI型受体来抑制VEGF和胎盘生长因子(placenta growth factor, PGF)诱导的病理性血管生成过程, 用于治疗湿性AMD, 目前已经完成Ⅰ期临床试验。结果显示, 在每只眼最大剂量1 600 μg条件下, 单次玻璃体内注射siRNA-027安全性良好[30]。虽然siRNA在临床试验中获得一定的进展, 但是裸siRNA在体内容易被核糖核酸酶(RNase)降解, 且半衰期短, 抑制表达效率低。因此, siRNA需借助递送载体进入细胞发挥治疗作用[31]。
2.3 反义寡核苷酸反义寡核苷酸(antisense oligonucleotides, ASO)是通过化学合成得到的单链DNA或RNA, 长度通常为13~25 bp左右, 稳定性较好, 与细胞核内或胞浆中的mRNA有一段互补序列, 通过与mRNA结合而终止翻译过程。第1个反义寡核苷酸药物福米韦生(Vitravene)于1998年被美国FDA批准用于治疗巨细胞病毒性视网膜炎。患者需每月眼内注射1次福米韦生, 不良反应为虹膜炎、玻璃体炎等, 发生率约25%[32]。由于反义寡核苷酸在生理环境中容易被快速消除, 又因其携带大量负电荷且亲水性强, 故无法透过细胞膜发挥作用[33]。因此, 针对眼部疾病开发高效、稳定递送反义寡核苷酸的递药系统, 具有巨大的临床应用价值。
2.4 适配体适配体(aptamer)分子质量通常为5~25 kDa, 是从大量DNA或RNA分子中筛选得到的具有三维空间结构的核酸分子, 可以与作用靶点特异性结合并影响其功能[34]。聚乙二醇化的RNA适配体哌加他尼可以靶向VEGF-165相关基因, 已于2004年获FDA批准上市, 通过玻璃体注射的方式治疗湿性AMD, 给药间隔为4~6周, 治疗时间为1年[35]。由于适配体分子量小, 在体内易通过肾排泄被快速消除。可以利用聚乙二醇或胆固醇等对适配体进行化学修饰, 以提高其生物利用度或改善药动学性质[36]。
2.5 基因编辑基因编辑是利用核酸酶识别、剪切特异的DNA序列, 使DNA双链断裂, 随之利用细胞自身的DNA修复功能将靶基因引入、替换或删除的方法。由于基因编辑具有定位准确且能改变生物基因组的功能, 因而在基因研究和遗传性疾病治疗, 尤其是眼部相关遗传性疾病的治疗领域大有作为。目前, 归巢核酸内切酶(HE)、锌指核酸酶(ZFN)、转录激活因子样效应物核酸酶(TALEN)、成簇规律间隔短回文重复序列(CRISPR)及其相关蛋白这4类工具酶在基因编辑技术中应用最多。近年来, CRISPR/Cas9因具有分子量小、操作方便和编辑效率高等优点备受关注[37]。
基因编辑技术用于治疗眼部疾病已取得了一定的进展。多项研究显示, 编码连接蛋白50 (connexin 50)的GJA8基因与常染色体显性遗传先天性白内障存在一定的相关性[38]。有研究[39]通过将Cas9/sgRNA mRNA注射至兔受精卵中, 构建了GJA8基因敲除的兔白内障模型。该实验达到的GJA8基因突变效率在胚胎和幼兔中分别为98.7%和100%, 提示Cas9/sgRNA系统是兔受精卵基因编辑的高效工具, 将成为白内障预防和治疗的重要药物筛选工具。
为了将CRISPR/Cas基因编辑技术更好地服务于临床治疗, 首先必须将其便捷有效地递送至靶部位。通常可以使用基因疗法将表达sgRNA和Cas9蛋白的目的基因递送至细胞内。当前最常见的递送方式是利用病毒载体进行基因递送。病毒载体一般可分为整合型与非整合型两类。整合型病毒一般包括逆转录病毒与慢病毒, 可以将携带的基因整合到宿主基因中, 但是整合基因可能会干扰正常基因的表达, 因此使用整合型病毒载体进行基因递送仍然有很多问题需要解决[40]。
视网膜色素病变会因丧失视锥细胞光感受器而导致失明, 保留视锥细胞功能是主要的治疗目标。有文章报道[41], 利用基因编辑的方法, 以腺相关病毒为载体, 将CRISPR/Cas9靶向递送至有丝分裂后期光感受器的Nrl基因。Nrl基因是光感受器发育过程中决定视杆细胞命运的关键因子。在视网膜处将Nrl下调, 视杆细胞获得部分视锥细胞的特征, 不仅保留了视杆细胞的特异性基因, 并且存活力提高, 从而防止了视锥细胞的退化。在该研究中, 建立了不同视网膜退化程度的3种小鼠模型, 通过治疗大大改善了视杆细胞的存活力并保留了视锥细胞的功能。这提示, 基于CRISPR/Cas9的Nrl基因编辑方法有可能改善视网膜色素病变无法治疗的现状。
近日, 哥伦比亚大学的研究人员[42]利用CRISPR/ Cas9基因编辑技术有效修复了损伤RPGR基因的单一DNA改变, 成功修正了患者机体干细胞中引发失明的基因突变。这项研究的亮点在于, 被修正的组织来自患者自身的干细胞, 可以实现对患者进行移植而不引起组织排斥反应。相关研究结果为后期开发个体化治疗眼部疾病的新疗法提供了思路。
常见的CRISPR-Cas9技术使用的Cas9蛋白因所含的氨基酸数过多, 因而难以利用腺相关病毒装载。近期, 来自韩国的科学家[43]开发出了迄今为止最小的CRISPR-Cas9, 利用腺相关病毒递送到小鼠的眼部, 用以修复引起失明的基因。该研究利用腺相关病毒递送到视网膜的CjCas9基因能够有效抑制小鼠Hif1a和VEGF 基因被激活, 减少脉络膜新血管的形成。该方法还可以用于治疗其他视网膜疾病和全身性疾病, 有望为目前仍无法进行药物治疗的疾病带来曙光。
在过去几年中, CRISPR-Cas9基因编辑技术已经被用于修复致病基因, 但目前仍存在许多挑战, 其中包括在设计、构建特异性核酸酶与单链向导RNA过程中存在的困难, 以及剪切基因时出现的脱靶效应、基因的有效传递等。因此寻找便捷、高效和特异性高的基因编辑工具和载体将是这一技术领域今后的重要研究方向之一。
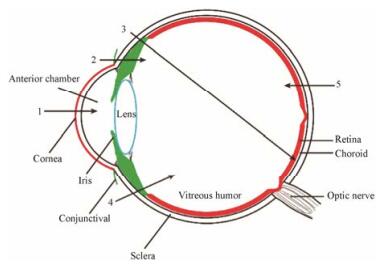
3 基因的眼内递送途径与吸收屏障针对眼部疾病, 不同给药方式存在各自的优势和缺陷, 需采用适合的方法进行治疗(图 2)。与传统的化学药物治疗相比, 基因治疗对药物在靶部位的富集提出了更高的要求。针对眼部疾病的基因治疗通常采取局部给药, 包括滴眼和眼部注射, 全身给药由于存在药物全身暴露的风险, 不适用于作为眼部基因递送的给药途径。
|
Figure 2 Anatomical structure of human eye and administration routes for ocular drug delivery. The numbers refer to some major administration routes as following: 1: Topical instillation via corneal pathway; 2: Topical instillation via non-corneal pathway; 3: Subretinal injection; 4: Intravitreal injection; 5: Systemic administration via blood-retinal barrier |
局部滴眼给药操作简便, 对眼部组织无创伤性, 患者顺应性好, 但由于结膜囊容积有限, 加上泪液冲洗、存在角膜屏障与结膜屏障等原因, 药物生物利用度通常不到5%[44]。核酸类药物由于分子量大、亲水性强, 几乎不能透过角膜上皮到达眼后段病灶部位。因此, 传统滴眼剂主要用于治疗眼前段疾病[45]。
3.2 眼内注射眼内注射借助创伤性的手段突破眼部吸收屏障, 使药物迅速浓集于眼内, 继而在眼内扩散到达作用部位。具有代表性的眼内注射给药途径有视网膜下腔注射和玻璃体内注射等。基因药物经玻璃体内注射后, 可以较快扩散至视网膜或脉络膜部位, 但由于基因药物在玻璃体内半衰期短, 需要反复注射给药, 可能会导致严重并发症如眼内炎、视网膜脱落等, 患者顺应性差[46]。尽管有多种控释制剂如脂质体和植入剂等可以延长药物在玻璃体内滞留时间, 但单次眼内注射也可能产生严重不良反应[47]。
3.2.1 视网膜下腔注射在视网膜色素病变的基因治疗中, 需要利用病毒载体或非病毒载体将基因递送至视网膜和RPE部位。视网膜下腔注射是将基因直接递送至RPE细胞的最佳方法[48]。视网膜下腔注射腺相关病毒介导的基因递送系统在眼部基因治疗中取得了一定的成功, 通过视网膜下腔注射rAAV2-VMD2-hMERTK治疗MERTK (一种酪氨酸激酶受体)相关的视网膜色素变性已经进入Ⅰ期临床试验。
以2型腺相关病毒(AAV2)为递送载体将人类促红细胞生成素(hEPO)基因通过视网膜下腔注射可用于治疗糖尿病视网膜病变[49]。给药后, hEPO在房水、玻璃体及视网膜内的表达具有时间与剂量依赖性。给予AAV2-CMV-hEPO治疗的实验组, 视网膜细胞的凋亡显著下降。视网膜电图显示, 在视网膜下腔注射AAV2-CMV-hEPO病毒1年后, 视网膜的功能未发生改变, 在视网膜和脉络膜未见新生血管生成, 且hEPO能长期表达。
在临床试验中, 视网膜下腔注射主要用于对LCA和CHM的治疗。但是视网膜下腔注射仍存在一些缺陷, 如视网膜下腔注射伴随着视网膜分离, 可能会引起胶质细胞增生、视网膜脱离、光感受器退化及视力功能损伤等[50]。
3.2.2 玻璃体内注射玻璃体液中含有大量胶原蛋白、透明质酸、硫酸乙酰肝素和硫酸软骨素等蛋白质和多糖, 是具有果冻般质感的透明凝胶[51]。尽管玻璃体液较高的黏度和其中荷负电的组分会抑制生物大分子及纳米药物的扩散, 特别是粒径较大或带正电的基因递送载体会与玻璃体内荷负电的蛋白/多糖相互作用, 但由于玻璃体内注射可以避开角膜与巩膜等主要的吸收屏障, 其在眼内基因递送方面展现出良好的应用前景。玻璃体内注射能够使基因药物在视网膜中均匀分布, 对于视网膜病变、玻璃体视网膜病变(vitreoretinopathies)的治疗具有显著的优势, 可以在不引起视网膜分离的情况下实现向整个视网膜递送基因药物[52]。在临床试验中, 治疗AMD和LHON常用到玻璃体内注射。但是, 玻璃体内注射可能会引起相关的并发症, 如眼压升高、眼内炎症和白内障等[53]。
3.3 全身给药通过口服或注射给药后, 由于存在血-眼屏障如血液-视网膜屏障(blood-retinal barrier, BRB)与血液-房水屏障(此屏障主要存在于前葡萄膜血管内皮细胞, 防止血浆蛋白进入房水, 也限制亲水性大分子药物从血浆进入前房), 眼部生物利用度通常在1%~2%左右[54]。为达到理想的治疗效果, 通常需要多次给药以提高眼内的药物浓度, 但同时也不可避免地易导致全身性毒副作用。特别是对于基因药物, 全身给药易诱发严重的免疫反应, 临床应用前途堪忧[55]。
目前, 基因治疗大多是针对眼底或眼后段疾病, 此类疾病一般需要长期治疗以避免视力进一步损伤。视网膜下腔注射和玻璃体注射可以将治疗基因直接递送至眼后段病灶部位, 提高基因药物的生物利用度, 在目前研究中占据主导地位。但由于眼部注射是借助创伤性的手段突破吸收屏障, 对于眼后段慢性疾病, 反复注射可能会导致严重并发症, 患者顺应性差, 并且会造成较大的医疗负担, 存在一定的局限性。而传统滴眼剂给药患者顺应性好, 采用适当方法提高基因药物经此途径向眼后段的递送效率, 具有更好的发展前景。
4 眼部基因递送载体与递送策略目前, 眼部基因治疗多通过视网膜下腔注射或玻璃体内注射等创伤途径给药。对于XLRS、AMD、LCA、LHON和CHM等眼底疾病, 治疗周期长, 反复进行眼内注射对治疗条件的要求高, 患者顺应性差, 且导致白内障、视网膜分离等并发症的风险较大[56]。利用合理的递送载体通过安全的给药途径将基因治疗药物有效递送至眼内, 进而使其发挥理想的治疗效果, 是当前眼科用药研究的重点[57]。尽管病毒载体转染效率高, 但携载基因容量有限, 而且应用于人体存在引起免疫原性等致病风险, 实现临床上广泛应用有一定困难, 而非病毒载体安全性更好, 携载基因量大, 可实现大规模生产, 并且可以通过特定方法提高其基因转染效率, 临床应用前景更为广阔。对于眼表疾病的治疗, 主要通过结膜囊内给药, 角膜渗透能力是药物吸收的关键因素, 同时也受结膜血液分流的影响[58]。对于眼后段或眼底疾病的治疗, 可以采取全身给药, 但是由于BRB存在排列紧密的血管内皮细胞和RPE细胞, 这些屏障阻碍了体循环与视网膜内层之间的物质交换, 从而降低了药物的眼部生物利用度[59]。因此, 若想通过无创的局部滴眼给药进行基因治疗, 必须克服多重吸收屏障, 将基因药物递送至眼后段的作用靶点。
4.1 阳离子脂质体载体阳离子脂质体由带正电荷的磷脂作为膜材料制备而成, 可与带负电荷的基因通过静电作用结合经内吞途径进入细胞, 随后将基因释放至细胞质[60]。阳离子脂质体可以利用其表面的正电荷附着于黏蛋白覆盖的角膜上皮, 进而促进药物的吸收, 使其发挥更好的治疗效果[61]。有研究利用RGD肽修饰的磷脂(RGD-PEG-DSPE)、阳离子化的胆固醇(3β-[N-(N′, N′-dimethylaminoethane)-carbamoyl] cholesterol)与其他膜材料一同制备包载siRNA的脂质体, 体外实验结果显示, 该脂质体在RPE细胞中具有更高的基因递送效率及较低的细胞毒性[62]。
4.2 壳聚糖复合物载体近几十年来, 天然聚合物在眼部药物递送领域的应用取得了长足发展。壳聚糖是天然来源的多糖类聚合物, 在生理条件下带有正电荷, 能与眼表带有负电荷的黏蛋白结合, 延长药物在角膜表面的滞留时间, 减少药物从鼻泪管流失, 进而改善药物的眼部吸收效果。
由乙二醇基壳聚糖(GCS)和质粒DNA (pDNA)通过静电作用制得的纳米复合物能够用于RPE相关疾病的治疗。该纳米复合物的粒径约250 nm, 稳定性良好, 在盐溶液中不会发生聚集, 且不易被DNA酶降解, 能够保持其结构的完整性并将DNA释放至细胞中进行表达。将表达绿色荧光蛋白的pDNA (CBA-eGFP)用GCS纳米粒进行包裹和压缩, 通过视网膜下腔注射到成年白化病小鼠眼部, 在注射后第14天, 仅在用GCS纳米复合物治疗的眼睛中观察到RPE有显著的绿色荧光[63]。
Klausner等[64]以壳聚糖低聚物(NOVAFECT)作为非病毒基因递送载体, 设计了壳聚糖/DNA复合物纳米粒, 其粒径较小, 约98 nm, 带有很强的正电荷, 约44 mV。体外实验证明, 该纳米复合物能够有效转染COS-7细胞。兔角膜注射该纳米复合物后, 其荧光素酶基因的表达量是聚乙烯亚胺(PEI)/DNA复合物的5.4倍, 且细胞能够观察到明显的绿色荧光。该纳米复合物有望为眼前段疾病的基因治疗提供一种潜在的方法。
4.3 脂质聚合物载体脂质聚合物是采用聚合物与脂质成分共同制备纳米粒, 将核酸药物包载在所形成的纳米粒中, 从而提高核酸药物的稳定性及细胞摄取效率, 进而实现更高效地递送核酸药物。Jain等[65]采取聚合电解质稳定脂质载体的方法制备了载基因纳米粒。该纳米粒以(2, 3-二油酰基-丙基)-三甲胺(DOTAP)和磷脂酰胆碱(PC)制成的脂质体为核心, 同时外部应用静电结合的原理修饰了阴离子聚丙烯酸(PAA)和阳离子PEI。相比于单纯的基于DOTAP脂质体或PEI聚合物的载体, 该纳米粒可显著提高基因的入胞效率和细胞核共定位能力, 同时, 该纳米粒的基因转染效率相比于阳离子脂质体提升了5~6倍, 且显示出更低的细胞毒性。
4.4 多肽复合物载体由于眼睛具有特殊的生理结构与保护屏障, 使得大多数药物经局部滴眼给药难以到达眼内的靶部位。通过增加药物对眼部保护屏障的渗透性来促进药物的吸收是改善局部生物利用度的可行方法。吸收促进剂可以影响角膜上皮的完整性, 进而增加角膜摄取, 主要包括肌动蛋白抑制剂、表面活性剂、胆酸盐、螯合剂和有机化合物等。细胞穿膜肽(cell-penetrating peptides, CPPs)是一类序列中富含碱性氨基酸的短肽[66], 能够以非受体依赖的方式被细胞摄取, 转导效率高且不易造成细胞损伤[67]。目前常用的CPPs有人类免疫缺陷病毒的反式转录激活因子(TAT)、来源于果蝇触角足与DNA结合域的penetratin、人工合成的寡聚精氨酸等。利用这些CPPs可将蛋白质、核酸、纳米粒和脂质体等多种生物大分子或纳米载体成功地递送至细胞中[68]。由于CPPs的穿膜作用缺乏选择性, 因此并不适合于全身给药途径应用[69]。但是将CPPs用于局部给药, 如用于构建眼部基因递送系统, 使其直接作用于病灶部位的吸收屏障, 可以规避体内复杂的生理环境, 并最大程度地发挥其优良的促进吸收功能, 且可避免其潜在的全身毒性[70]。
由于CPPs在生理条件下带有正电荷, 能够与核酸药物通过静电相互作用自组装形成非共价复合物。Johnson等[71]设计了一条眼部递药多肽(peptide for ocular delivery, POD), 可用于压缩质粒DNA或siRNA, 并能够将其递送至眼部细胞内。经聚乙二醇修饰后, POD可以压缩质粒DNA形成纳米复合物, 经视网膜下注射, 质粒DNA可以在RPE细胞有效表达[72]。也可以将CPPs修饰在包载基因药物的纳米载体表面, 增强后者的穿膜能力。Cheng等[73]应用穿膜肽修饰的乳酸羟基乙酸共聚物(PLGA)纳米粒包载siRNA, 既实现了核酸药物的持续释放, 也提高了核酸药物在细胞水平与动物水平实验中的基因沉默效率。
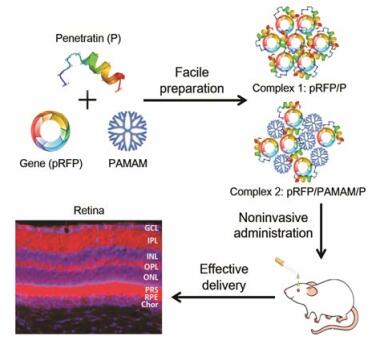
为了寻找安全高效的眼部吸收促进剂, Liu等[74]对TAT、penetratin、低分子量鱼精蛋白(protamine)和8聚精氨酸(R8)等几种穿膜肽的眼部渗透功能进行了体内外比较。实验结果证明, 在上述穿膜肽中, penetratin穿透眼组织的能力最强, 而且在测试浓度下未对眼部细胞产生毒性。经结膜囊内滴入给药, 荧光标记的penetratin能够被迅速吸收进入眼内, 并且在角膜、视网膜等组织中广泛分布, 滞留时间长达6 h以上。利用penetratin对眼部组织的高效穿透能力, 该研究团队[75]设计并制备了一种由低分子量聚酰胺-胺(PAMAM G3.0)与penetratin通过静电作用共同压缩报告基因pRFP质粒形成的自组装纳米复合物。该复合物经结膜囊内给药后, 可使质粒迅速分布于眼后段视网膜等组织, 并表达出红色荧光蛋白(图 3)。该复合物用于眼底疾病的无创基因治疗, 与目前临床采用的玻璃体内注射给药方法相比, 可以有效避免眼内注射带来的一系列并发症, 极大方便患者用药, 提高患者顺应性。
|
Figure 3 Schematic diagram of the penetratin-incorporated complex pRFP/P and pRFP/PAMA/P. After being instilled in the conjunctival sac of rats, pRFP/PAMA/Pexpress RFP in the-posterior segment effectively |
Tai等[76]将penetratin与拮抗荧光素酶的反义寡核苷酸/PAMAM复合物通过静电作用相结合, 形成荷正电的纳米复合物。细胞摄取实验结果显示, 该复合物能够提高反义寡核苷酸在细胞中的摄取效率, 且其在肿瘤球中的穿透深度也提高。在皮下移植瘤模型中, 经瘤旁注射, 肿瘤组织中荧光素酶的表达水平显著降低; 在玻璃体原位瘤模型中, 经眼表滴入给药, 该复合物对眼内肿瘤组织中靶蛋白的表达有抑制作用。在此基础上, 该研究团队[77]进一步采用层层自组装的方法制备了透明质酸与penetratin双重修饰的反义寡核苷酸复合物。经滴眼给药, 该复合物改善了反义寡核苷酸在小鼠眼后段的分布与滞留时间。
4.5 超声微泡载体近年来, 超声微泡介导的靶向基因递送引起了广泛关注。超声微泡作为一种新型的声学造影剂, 不仅可以增强超声显像效果, 还可以增加局部组织的通透性, 使药物在局部达到较高浓度而实现靶向治疗作用[78]。超声微泡造影剂主要利用空化效应, 使液体中的微小气泡在超声作用下瞬间破裂, 同时伴有高速微射流、冲击波和高温现象, 进而产生相应的生物学效应。声场内微泡造影剂被超声破坏后, 产生的空化和机械效应会使细胞膜的通透性增加, 导致内皮细胞间隙变大, 因此基因可以通过破裂的微血管和内皮细胞间隙到达外周组织[79]。该技术可以显著促进基因在靶细胞中发生转染和表达。微泡在血液循环中稳定好, 能够减少基因在达到靶部位前被破坏, 并且能够可逆地打开血-视网膜屏障。携带基因的超声微泡造影剂在眼科的临床研究和眼科疾病的治疗方面展示出了潜在的应用前景[80]。
BRB阻止了大部分全身血液循环中的药物到达视网膜, 有研究用超声微泡打开血液-视网膜屏障, 为靶向递送药物至视网膜提供一种非创伤性的给药方法[81]。该研究通过静脉注射微泡超声造影剂后进行超声造影检查, 观察到微泡可以诱导血液-视网膜屏障出现短暂的破坏, 在停止超声3 h后血液-视网膜屏障会重新修复。Xu等[82]使用阳离子超声微泡技术有效地将内皮抑制素-绿色荧光蛋白(ES-GFP)质粒递送至人视网膜血管内皮细胞。
5 结语眼部基因治疗通过改变基因的表达实现治疗眼部疾病的目的, 特别是对多种退行性视网膜综合征具有很大的治疗潜力, 为眼部疾病的治疗带来了曙光。目前眼部疾病的基因治疗仍迫切需要解决一系列的关键问题, 如寻找有效的治疗基因、开发高效的基因递送载体、调控治疗基因表达的选择性和时机等。眼部疾病基因治疗的研究重点主要是寻找有效且靶向性强的基因药物, 通过物理方法或开发新型药物递送系统, 提高基因药物在眼部的生物利用度, 降低其毒性及免疫原性等。尽管眼部基因治疗获得了一定的进展, 但是仍处于起步阶段, 大部分依然处于实验研究状态。特别是在基因递送过程中, 大部分递送载体效率较低, 成为基因治疗应用于临床的技术瓶颈。在后续的评价过程中, 难以建立具有临床疾病特征的动物模型也是限制该领域发展重要的因素。另外, 如何选择入组基因治疗的患者、在基因治疗前后采用何种手段评价治疗的效果等, 都给眼部基因治疗带来一定的挑战。尽管如此, 相信随着基因编辑技术的发展, 人类不久将有办法通过改变患者的基因组实现对遗传性眼病的治疗。
| [1] | Foldvari M, Chen DW, Nafissi N, et al. Non-viral gene therapy:gains and challenges of non-invasive administration methods[J]. J Control Release, 2016, 240: 165–190. DOI:10.1016/j.jconrel.2015.12.012 |
| [2] | Bourne R, Flaxman SR, Braithwaite T, et al. Magnitude, temporal trends, and projections of the global prevalence of blindness and distance and near vision impairment:a syste-matic review and meta-analysis[J]. Lancet Glob Health, 2017, 5: e888–e897. DOI:10.1016/S2214-109X(17)30293-0 |
| [3] | Rawas-Qalaji M, Williams CA. Advances in ocular drug delivery[J]. Curr Eye Res, 2012, 37: 345–356. DOI:10.3109/02713683.2011.652286 |
| [4] | Campbell JP, McFarland TJ, Stout JT. Ocular gene therapy[J]. Dev Ophthalmol, 2016, 55: 317–321. |
| [5] | Xu L, Anchordoquy T. Drug delivery trends in clinical trials and translational medicine:challenges and opportunities in the delivery of nucleic acid-based therapeutics[J]. J Pharm Sci, 2011, 100: 38–52. DOI:10.1002/jps.22243 |
| [6] | Sauer CG, Gehrig A, Warneke-Wittstock R, et al. Positional cloning of the gene associated with X-linked juvenile retinoschisis[J]. Nat Genet, 1997, 17: 164–170. DOI:10.1038/ng1097-164 |
| [7] | Kim DY, Mukai S. X-linked juvenile retinoschisis (XLRS):a review of genotype-phenotype relationships[J]. Semin Ophthalmol, 2013, 28: 392–396. DOI:10.3109/08820538.2013.825299 |
| [8] | Sikkink SK, Biswas S, Parry NR, et al. X-linked retinoschisis:an update[J]. J Med Genet, 2007, 44: 225–232. DOI:10.1136/jmg.2006.047340 |
| [9] | Byrne LC, Ozturk BE, Lee T, et al. Retinoschisin gene therapy in photoreceptors, muller glia or all retinal cells in the Rs1h-/- mouse[J]. Gene Ther, 2014, 21: 585–592. DOI:10.1038/gt.2014.31 |
| [10] | Dalkara D, Byrne LC, Klimczak RR, et al. In vivo-directed evolution of a new adeno-associated virus for therapeutic outer retinal gene delivery from the vitreous[J]. Sci Transl Med, 2013, 5: 189ra76. |
| [11] | Tuuminen R, Uusitalo-Järvinen H, Aaltonen V, et al. The Finnish national guideline for diagnosis, treatment and fol-low-up of patients with wet age-related macular degeneration[J]. Acta Ophthalmol, 2017, 95: 1–9. |
| [12] | Wong WL, Su X, Li X, et al. Global prevalence of age-related macular degeneration and disease burden projection for 2020 and 2040:a systematic review and meta-analysis[J]. Lancet Glob Health, 2014, 2: e106–e116. DOI:10.1016/S2214-109X(13)70145-1 |
| [13] | Rickman CB, Farsiu S, Toth CA, et al. Dry age-related macular degeneration:mechanisms, therapeutic targets, and imaging[J]. Invest Ophthalmol Vis Sci, 2013, 54: ORSF68–ORSF80. DOI:10.1167/iovs.13-12757 |
| [14] | Van Lookeren Campagne M, LeCouter J, Yaspan BL, et al. Mechanisms of age-related macular degeneration and thera-peutic opportunities[J]. J Pathol, 2014, 232: 151–164. DOI:10.1002/path.4266 |
| [15] | Pedrosa AC, Sousa T, Pinheiro-Costa J, et al. Treatment of neovascular age-related macular degeneration with anti-VEGF agents:predictive factors of long-term visual outcomes[J]. J Ophthalmol, 2017: 2017. DOI:10.1155/2017/4263017 |
| [16] | Den Hollander AI, Roepman R, Koenekoop RK, et al. Leber congenital amaurosis:genes, proteins and disease mechanisms[J]. Prog Retin Eye Res, 2008, 27: 391–419. DOI:10.1016/j.preteyeres.2008.05.003 |
| [17] | Alkharashi M, Fulton AB. Available evidence on leber congenital amaurosis and gene therapy[J]. Semin Ophthalmol, 2017, 32: 14–21. DOI:10.1080/08820538.2016.1228383 |
| [18] | Koenekoop RK. An overview of leber congenital amaurosis:a model to understand human retinal development[J]. Surv Ophthalmol, 2004, 49: 379–398. DOI:10.1016/j.survophthal.2004.04.003 |
| [19] | Burnight ER, Wiley LA, Drack AV, et al. CEP290 gene transfer rescues leber congenital amaurosis cellular pheno-type[J]. Gene Ther, 2014, 21: 662–672. DOI:10.1038/gt.2014.39 |
| [20] | Al-Saikhan FI. The gene therapy revolution in ophthalmology[J]. Saudi J Ophthalmol, 2013, 27: 107–111. DOI:10.1016/j.sjopt.2013.02.001 |
| [21] | Peragallo JH, Newman NJ. Is there treatment for leber hereditary optic neuropathy?[J]. Curr Opin Ophthalmol, 2015, 26: 450–457. DOI:10.1097/ICU.0000000000000212 |
| [22] | Piotrowska A, Korwin M, Bartnik E, et al. Leber hereditary optic neuropathy-historical report in comparison with the current knowledge[J]. Gene, 2015, 555: 41–49. DOI:10.1016/j.gene.2014.09.048 |
| [23] | Dimitriadis K, Leonhardt M, Yu-Wai-Man P, et al. Leber's hereditary optic neuropathy with late disease onset:clinical and molecular characteristics of 20 patients[J]. Orphanet J Rare Dis, 2014, 9: 158. DOI:10.1186/s13023-014-0158-9 |
| [24] | Giordano C, Iommarini L, Giordano L, et al. Efficient mitochondrial biogenesis drives incomplete penetrance in Leber's hereditary optic neuropathy[J]. Brain, 2014, 137: 335–353. DOI:10.1093/brain/awt343 |
| [25] | Barnard AR, Groppe M, MacLaren RE. Gene therapy for choroideremia using an adeno-associated viral (AAV) vector[J]. Cold Spring Harb Perspect Med, 2014, 5: a17293. |
| [26] | Hu CS, Zhang QL, Zhang T. Research progress in large-scale production of plasmid DNA for gene therapy[J]. China Biotechnol (中国生物工程杂志), 2011, 31: 119–123. |
| [27] | Taniyama Y, Azuma J, Kunugiza Y, et al. Therapeutic option of plasmid-DNA based gene transfer[J]. Curr Top Med Chem, 2012, 12: 1630–1637. DOI:10.2174/156802612803531342 |
| [28] | Wu SY, Yang X, Gharpure KM, et al. 2'f-OMe-phosphorodithioate-modified siRNAs show increased loading into the RISC complex and enhanced anti-tumour activity[J]. Nat Commun, 2014, 5: 3459. |
| [29] | Khvorova A, Reynolds A, Jayasena SD. Functional siRNAs and miRNAs exhibit strand bias[J]. Cell, 2003, 115: 209–216. DOI:10.1016/S0092-8674(03)00801-8 |
| [30] | Kaiser PK, Symons RC, Shah SM, et al. RNAi-based treatment for neovascular age-related macular degeneration by siRNA-027[J]. Am J Ophthalmol, 2010, 150: 33–39. DOI:10.1016/j.ajo.2010.02.006 |
| [31] | Yang FF, Huang W, Li YF, et al. Current status of non-viral vectors for siRNA delivery[J]. Acta Pharm Sin (药学学报), 2011, 46: 1436–1443. |
| [32] | Advances in CMV management: fomivirsen (vitravene) approved[J]. Proj Inf Perspect, 1998, (26): 7. |
| [33] | Teixeira H, Dubernet C, Puisieux F, et al. Submicron cationic emulsions as a new delivery system for oligonucleotides[J]. Pharm Res, 1999, 16: 30–36. DOI:10.1023/A:1018806425667 |
| [34] | Dou XQ, Fu J, Song HF. Advances in the study of ap-tamer-based drug for targeting therapy[J]. Acta Pharm Sin (药学学报), 2016, 51: 1068–1076. |
| [35] | Fattal E, Bochot A. Ocular delivery of nucleic acids:antisense oligonucleotides, aptamers and siRNA[J]. Adv Drug Deliv Rev, 2006, 58: 1203–1223. DOI:10.1016/j.addr.2006.07.020 |
| [36] | Healy JM, Lewis SD, Kurz M, et al. Pharmacokinetics and biodistribution of novel aptamer compositions[J]. Pharm Res, 2004, 21: 2234–2246. DOI:10.1007/s11095-004-7676-4 |
| [37] | Osakabe Y, Osakabe K. Genome editing with engineered nucleases in plants[J]. Plant Cell Physiol, 2015, 56: 389–400. DOI:10.1093/pcp/pcu170 |
| [38] | Arora A, Minogue PJ, Liu X, et al. A novel GJA8 mutation is associated with autosomal dominant lamellar pulverulent cataract:further evidence for gap junction dysfunction in human cataract[J]. J Med Genet, 2006, 43: e2. |
| [39] | Yuan L, Sui T, Chen M, et al. CRISPR/Cas9-mediated GJA8 knockout in rabbits recapitulates human congenital cataracts[J]. Sci Rep, 2016, 6: 22024. DOI:10.1038/srep22024 |
| [40] | Hung S, McCaughey T, Swann O, et al. Genome engineering in ophthalmology:application of CRISPR/Cas to the treatment of eye disease[J]. Prog Retin Eye Res, 2016, 53: 1–20. DOI:10.1016/j.preteyeres.2016.05.001 |
| [41] | Yu W, Mookherjee S, Chaitankar V, et al. Nrl knockdown by AAV-delivered CRISPR/Cas9 prevents retinal degeneration in mice[J]. Nat Commun, 2017, 8: 14716. DOI:10.1038/ncomms14716 |
| [42] | Cabral T, DiCarlo JE, Justus S, et al. CRISPR applications in ophthalmologic genome surgery[J]. Curr Opin Ophthalmol, 2017, 28: 252–259. DOI:10.1097/ICU.0000000000000359 |
| [43] | Kim E, Koo T, Park SW, et al. In vivo genome editing with a small Cas9 orthologue derived from Campylobacter jejuni[J]. Nat Commun, 2017, 8: 14500. DOI:10.1038/ncomms14500 |
| [44] | Urtti A. Challenges and obstacles of ocular pharmacokinetics and drug delivery[J]. Adv Drug Deliv Rev, 2006, 58: 1131–1135. DOI:10.1016/j.addr.2006.07.027 |
| [45] | Berdugo M, Valamanesh F, Andrieu C, et al. Delivery of antisense oligonucleotide to the cornea by iontophoresis[J]. Antisense Nucleic Acid Drug Dev, 2003, 13: 107–114. DOI:10.1089/108729003321629647 |
| [46] | Ladas ID, Karagiannis DA, Rouvas AA, et al. Safety of repeat intravitreal injections of bevacizumab versus ranibizumab:our experience after 2000 injections[J]. Retina, 2009, 29: 313–318. DOI:10.1097/IAE.0b013e31819a5f98 |
| [47] | Sigurdsson HH, Konráðsdóttir F, Loftsson T, et al. Topical and systemic absorption in delivery of dexamethasone to the anterior and posterior segments of the eye[J]. Acta Ophthalmol Scand, 2007, 85: 598–602. DOI:10.1111/j.1600-0420.2007.00885.x |
| [48] | Park SW, Kim JH, Park WJ, et al. Limbal ap-proach-subretinal injection of viral vectors for gene therapy in mice retinal pigment epithelium[J]. J Vis Exp, 2015(102): e53030. |
| [49] | Xu H, Zhang L, Gu L, et al. Subretinal delivery of AAV2-mediated human erythropoietin gene is protective and safe in experimental diabetic retinopathy[J]. Invest Ophthalmol Vis Sci, 2014, 55: 1519–1530. DOI:10.1167/iovs.13-13155 |
| [50] | Nakazawa T, Takeda M, Lewis GP, et al. Attenuated glial reactions and photoreceptor degeneration after retinal detachment in mice deficient in glial fibrillary acidic protein and vimentin[J]. Invest Ophthalmol Vis Sci, 2007, 48: 2760–2768. DOI:10.1167/iovs.06-1398 |
| [51] | Peeters L, Sanders NN, Braeckmans K, et al. Vitreous:a barrier to nonviral ocular gene therapy[J]. Invest Ophthalmol Vis Sci, 2005, 46: 3553–3561. DOI:10.1167/iovs.05-0165 |
| [52] | Martens TF, Remaut K, Deschout H, et al. Coating nanocarriers with hyaluronic acid facilitates intravitreal drug delivery for retinal gene therapy[J]. J Control Release, 2015, 202: 83–92. DOI:10.1016/j.jconrel.2015.01.030 |
| [53] | Kompella UB, Amrite AC, Ravi RP, et al. Nanomedicines for back of the eye drug delivery, gene delivery, and imaging[J]. Prog Retin Eye Res, 2013, 36: 172–198. DOI:10.1016/j.preteyeres.2013.04.001 |
| [54] | Kaur IP, Kakkar S. Nanotherapy for posterior eye diseases[J]. J Control Release, 2014, 193: 100–112. DOI:10.1016/j.jconrel.2014.05.031 |
| [55] | Solinís MÁ, Del Pozo-Rodríguez A, Apaolaza PS, et al. Treatment of ocular disorders by gene therapy[J]. Eur J Pharm Biopharm, 2015, 95: 331–342. DOI:10.1016/j.ejpb.2014.12.022 |
| [56] | Fagan XJ, Al-Qureshi S. Intravitreal injections:a review of the evidence for best practice[J]. Clin Exp Ophthalmol, 2013, 41: 500–507. DOI:10.1111/ceo.2013.41.issue-5 |
| [57] | Jager RD, Aiello LP, Patel SC, et al. Risks of intravitreous injection:a comprehensive review[J]. Retina, 2004, 24: 676–698. DOI:10.1097/00006982-200410000-00002 |
| [58] | Del Amo EM, Urtti A. Current and future ophthalmic drug delivery systems. A shift to the posterior segment[J]. Drug Discov Today, 2008, 13: 135–143. DOI:10.1016/j.drudis.2007.11.002 |
| [59] | Hornof M, Toropainen E, Urtti A. Cell culture models of the ocular barriers[J]. Eur J Pharm Biopharm, 2005, 60: 207–225. DOI:10.1016/j.ejpb.2005.01.009 |
| [60] | Korala A, Conley SM, Naash MI. A review of therapeutic prospects of non-viral gene therapy in the retinal pigment epithelium[J]. Biomaterials, 2013, 34: 7158–7167. DOI:10.1016/j.biomaterials.2013.06.002 |
| [61] | Monem AS, Ali FM, Ismail MW. Prolonged effect of liposomes encapsulating pilocarpine HCl in normal and glaucomatous rabbits[J]. Int J Pharm, 2000, 198: 29–38. DOI:10.1016/S0378-5173(99)00348-8 |
| [62] | Chen CW, Lu DW, Yeh MK, et al. Novel RGD-lipid conjugate-modified liposomes for enhancing siRNA delivery in human retinal pigment epithelial cells[J]. Int J Nanomedicine, 2011, 6: 2567–2580. |
| [63] | Mitra RN, Han Z, Merwin M, et al. Synthesis and charac-terization of glycol chitosan DNA nanoparticles for retinal gene delivery[J]. ChemMedChem, 2014, 9: 189–196. DOI:10.1002/cmdc.v9.1 |
| [64] | Klausner EA, Zhang Z, Chapman RL, et al. Ultrapure chitosan oligomers as carriers for corneal gene transfer[J]. Biomaterials, 2010, 31: 1814–1820. DOI:10.1016/j.biomaterials.2009.10.031 |
| [65] | Jain S, Kumar S, Agrawal AK, et al. Enhanced transfection efficiency and reduced cytotoxicity of novel lipid-polymer hybrid nanoplexes[J]. Mol Pharm, 2013, 10: 2416–2425. DOI:10.1021/mp400036w |
| [66] | Bechara C, Sagan S. Cell-penetrating peptides:20 years later, where do we stand?[J]. FEBS Lett, 2013, 587: 1693–1702. DOI:10.1016/j.febslet.2013.04.031 |
| [67] | Ren J, Qin CG, Xu CL, et al. Development of cell-penetrating peptides as vectors for drug delivery[J]. Acta Pharm Sin (药学学报), 2010, 45: 17–25. |
| [68] | Copolovici DM, Langel K, Eriste E, et al. Cell-penetrating peptides:design, synthesis, and applications[J]. ACS Nano, 2014, 8: 1972–1994. DOI:10.1021/nn4057269 |
| [69] | Zhang L, Wei G, Lu WY. Application of activatable cell-penetrating peptide in thefield of tumor therapy[J]. Acta Pharm Sin (药学学报), 2014, 49: 1639–1643. |
| [70] | Fonseca SB, Pereira MP, Kelley SO. Recent advances in the use of cell-penetrating peptides for medical and biological applications[J]. Adv Drug Deliv Rev, 2009, 61: 953–964. DOI:10.1016/j.addr.2009.06.001 |
| [71] | Johnson LN, Cashman SM, Kumar-Singh R. Cell-penetrating peptide for enhanced delivery of nucleic acids and drugs to ocular tissues including retina and cornea[J]. Mol Ther, 2008, 16: 107–114. DOI:10.1038/sj.mt.6300324 |
| [72] | Read SP, Cashman SM, Kumar-Singh R. A poly(ethylene) glycolylated peptide for ocular delivery compacts DNA into nanoparticles for gene delivery to post-mitotic tissues in vivo[J]. J Gene Med, 2010, 12: 86–96. DOI:10.1002/jgm.v12:1 |
| [73] | Cheng CJ, Saltzman WM. Enhanced siRNA delivery into cells by exploiting the synergy between targeting ligands and cell-penetrating peptides[J]. Biomaterials, 2011, 32: 6194–6203. DOI:10.1016/j.biomaterials.2011.04.053 |
| [74] | Liu C, Tai L, Zhang W, et al. Penetratin, a potentially pow-erful absorption enhancer for noninvasive intraocular drug delivery[J]. Mol Pharm, 2014, 11: 1218–1227. DOI:10.1021/mp400681n |
| [75] | Liu C, Jiang K, Tai L, et al. Facile noninvasive retinal gene delivery enabled by penetratin[J]. ACS Appl Mater Interfaces, 2016, 8: 19256–19267. DOI:10.1021/acsami.6b04551 |
| [76] | Tai L, Liu C, Jiang K, et al. Noninvasive delivery of oligonucleotide by penetratin-modified polyplexes to inhibit protein expression of intraocular tumor[J]. Nanomedicine, 2017, 13: 2091–2100. DOI:10.1016/j.nano.2017.04.011 |
| [77] | Tai L, Liu C, Jiang K, et al. A novel penetratin-modified complex for noninvasive intraocular delivery of antisense oligonucleotides[J]. Int J Pharm, 2017, 529: 347–356. DOI:10.1016/j.ijpharm.2017.06.090 |
| [78] | Shen YY, Gao ZG, Rapoport N. Recent advances in the applications of ultrasonic microbubbles as gene or drug vectors[J]. Acta Pharm Sin (药学学报), 2009, 44: 961–966. |
| [79] | Du J, Du LF, Li FH, et al. Ultrasound targeted microbubble destruction-mediated gene delivery system:application to therapy for ocular disease[J]. Asian Biomed, 2011, 5: 577–587. |
| [80] | Wan C, Li F, Li H. Gene therapy for ocular diseases medi-tated by ultrasound and microbubbles (Review)[J]. Mol Med Rep, 2015, 12: 4803–4814. DOI:10.3892/mmr.2015.4054 |
| [81] | Park J, Zhang Y, Vykhodtseva N, et al. Targeted and re-versible blood-retinal barrier disruption via focused ultrasound and microbubbles[J]. PLoS One, 2012, 7: e42754. DOI:10.1371/journal.pone.0042754 |
| [82] | Xu Y, Xie Z, Zhou Y, et al. Experimental endostatin-GFP gene transfection into human retinal vascular endothelial cells using ultrasound-targeted cationic microbubble destruction[J]. Mol Vis, 2015, 21: 930–938. |
 2018, Vol. 53
2018, Vol. 53


