艾滋病由人免疫缺陷病毒(human immunodefi ciency virus, HIV)引起。其中, HIV-1亚型是艾滋病主要的病原体。自1981年首例艾滋病被发现至2016年, 全球约有3 670万HIV携带者。其中, 2016年新增感染人数约180万, 死于艾滋病的人数为100万, 艾滋病已经成为严重威胁人类生命健康的传染病之一[1]。在过去30多年, 随着对HIV-1结构的解析及生命周期研究的深入, 抗艾滋病药物的研发已取得很大发展。目前临床用于治疗艾滋病的药物中, 新化学实体分子已达28个, 具体包括13个逆转录酶抑制剂(RTIs)、1个膜融合抑制剂(FIs)、1个协同受体抑制剂(CRIs)、10个蛋白酶抑制剂(PIs)和3个整合酶抑制剂(INs)。其中逆转录酶抑制剂又可分为核苷(酸)类逆转录酶抑制剂(N(t)RTs)和非核苷类逆转录酶抑制剂(NNRTIs) (表 1)[2]。
| Table 1 HIV inhibitor targets and corresponding drugs |
HIV-1基因的高度变异性致使药物极易产生耐药, 因此, 目前临床上很少单独使用一种药物来治疗艾滋病, 而是将上述两种或两种以上作用于不同靶点的抗HIV-1药物联合使用, 从而达到显著抑制病毒复制, 有效减少患者体内HIV-1载量的目的。此疗法被称为“高效抗逆转录病毒疗法” (highly active antiretroviral therapy, HAART), 又称“鸡尾酒疗法”。该疗法中, 两种RTI和一种PI或IN联合用药的治疗方案应用最广。HAART的出现虽然大大减缓了病程的发展, 降低了死亡率并显著提高了HIV-1感染者的生活质量, 但是该疗法不能将HIV-1从感染者体内彻底清除, 病人需要长期服用多种药物。此外, 昂贵的治疗费用、严重的毒副作用以及耐药病毒株的出现, 都大大阻碍了该疗法的临床应用[3]。因此, 研发具有新的作用机制或新结构骨架的高效低毒的HIV-1抑制剂, 来扩展目前HAART的用药方案, 仍将是目前抗艾滋病药物研发的前沿科研领域。
HIV-1感染宿主细胞主要分为:吸附与融合、逆转录、整合、转录、翻译、组装、出芽及成熟等过程(图 1)[4]。理论上, 阻断病毒复制周期的任何一个环节, 都可以实现抗病毒的目的。随着对HIV-1分子生物学的深入研究, HIV-1复制周期的各个阶段的生物学过程不断被探明, 新的药物干预靶点也不断被发现。本综述根据HIV-1的复制周期, 精选近几年研究实例, 从药物化学的角度总结了抗艾滋病药物新靶标及其小分子抑制剂的前沿进展。
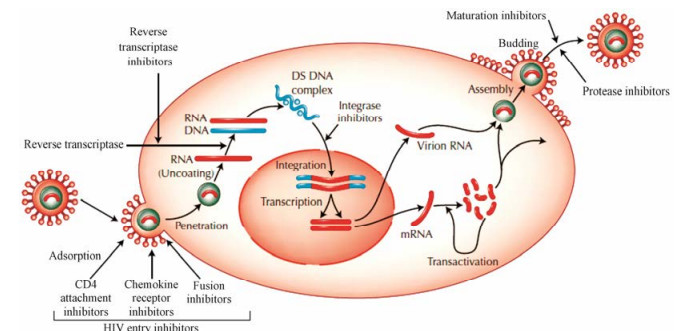
|
Figure 1 The life cycle of HIV-1[4] |
HIV-1侵入宿主细胞是一个多步过程: HIV-1包膜糖蛋白gp120与细胞表面CD4分子结合后, 其构象发生改变, 暴露出趋化因子受体(即协同受体)结合位点, 进而与宿主细胞膜上的协同受体结合。HIV-1的gp120与CD4分子和协同受体结合后, 进一步变构, 使gp41解离下来并诱导病毒包膜和靶细胞膜的融合, 进而侵入宿主细胞。其中, 阻断gp120与协同受体的结合可有效地阻断HIV-1侵入细胞, “御敌于国门之外”[5]。因此, 近几年gp120-CD4相互作用抑制剂备受瞩目。按照化合物结构类型, gp120抑制剂可分为以下几种。
1.1 BMS-378806及其衍生物化合物1 (BMS-378806)是百时美施贵宝公司在优化吲哚类似物时发现的一类苯甲酰基哌嗪化合物。该化合物通过与HIV-1gp120结合, 诱导其构象变化, 阻止其与CD4受体的结合, 而特异性抑制HIV-1的R5、X4、R5/X4毒株及临床上的B亚型病毒(EC50 = 40 nmol·L-1)[6]。该化合物口服生物利用度较高、安全性好、副作用小, 且对已经耐受蛋白酶抑制剂、逆转录酶抑制剂的HIV-1耐药性突变株仍具有显著的抑制作用。但因其代谢稳定性较差、半衰期短, 止步于Ⅰ期临床试验[7]。
近年来, 研究者们通过将BMS-378806的吲哚环替换为氮杂吲哚环, 并对其C-7位进行修饰, 合成了一系列化合物。其中代表性化合物为2 (BMS-488043)、3 (BMS-585248)和4 (BMS-626529)。虽然他们的抗病毒活性较BMS-378806均得到了明显提高, 但其膜渗透性和水溶性较差, 口服生物利用度较低, 药代动力学性质仍未达到预期的标准。为了改善这些问题, 该公司对上述代表性化合物进行了前药修饰(图 2), 得到4的磷酸酯前药5 (BMS-663068), 同原药相比, 化合物5的水溶性和透膜性大幅提高。活性实验表明: 5可以被小肠中的碱性磷酸酶裂解, 释放出原药, 进而在体内发挥作用[8]。近期的临床IIb实验结果表明:该前药耐受性良好, 有望发展为新的抗艾滋病药物[9]。
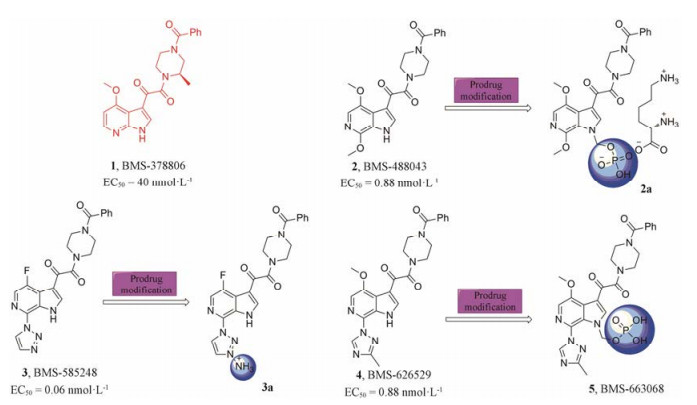
|
Figure 2 Representative derivatives of BMS-378806 and theirprodrugs |
2017年, Pancera等[10]报道了HIV Env蛋白三聚体与化合物4复合物的晶体结构(图 3)。通过结合蛋白的结构生物学和免疫学特征, 发现这一类化合物主要通过变构竞争性机制来抑制CD4引起的HIV Env结构改变, 进而抑制病毒的侵入, 这为该类化合物后续的优化提供了重要的参考依据。
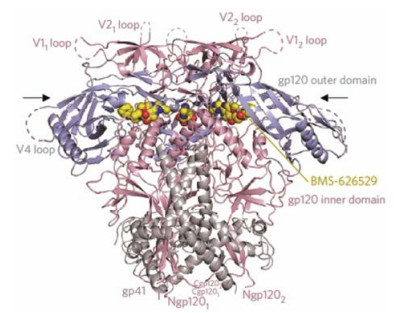
|
Figure 3 Crystal structure of HIV Env protein and BMS-626529[10] |
多价态结合是抗艾滋病药物设计的新策略。2009年, Spiegel等[11]根据多价态结合理论, 设计合成了双功能的抗体募集型HIV侵入抑制剂。该类化合物结构包含三部分:抗体结合端、靶点结合端及化学连接链。其中, 代表性化合物为6 (ARM-H) (图 4)。抗体募集型分子是介导病原体和抗体产生三元复合物的双官能团化合物, 通过靶向gp120中CD4结合位点以及抗体介导的杀灭作用来抑制HIV的感染。虽然该类化合物活性不高, 但为抗艾滋病药物研究开辟了新的方向。
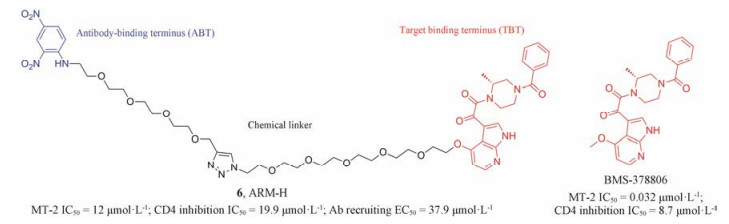
|
Figure 4 The structures of the antibody recruiting molecule (ARM-H) |
7 (NBD-556)、8 (NBD-557)和9 (JRC-Ⅱ-191)是通过化合物库筛选发现的苯基草酰胺类gp120-CD4相互作用抑制剂, 属于CD4功能模拟小分子(图 5)。该类化合物可以中等程度地抑制HIV侵入CD4细胞, 增强与CCR5的结合及CD4非依赖型病毒的感染[12, 13]。其结构可分为三部分: ①卤代苯环, 模拟CD4 β-turn上的Phe43残基, 插入到“Phe43口袋”; ②草酰胺连接基团; ③与gp120蛋白界面残基形成广泛作用的脂肪或芳香环[14]。最新gp120单聚体与该类化合物复合物晶体结构表明:化合物10 (NBD-09027)及11 (NBD-10007)哌啶环上的氮原子与D368残基相毗邻, 但没有形成氢键或者盐桥作用, 活性有待提高[15]。化合物12~15中, (+)-13对gp120的亲和力达到110 nmol·L-1, 抑制HIV毒株clade B和C的侵入(IC50分别为1.7和14.0 μmol·L-1), 但并不促进CD4非依赖型病毒的侵入。另外, (R, R)-构型化合物比(S, S)-异构体更容易与蛋白结合。复合物晶体结构表明: (+)-14通过网状水桥作用与gp120中“桥层”的Met426相互作用, 而(+)-15的胍基直接与Met426的主链羰基形成氢键[16]。
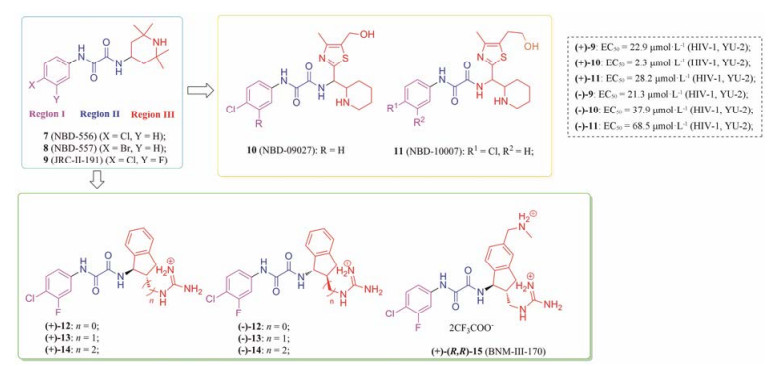
|
Figure 5 The structures of NBD-556 and its derivatives |
对肽类化合物16的结构修饰获得二茂铁三唑肽缀合物17 (UM15), 该化合物可通过阻止gp120-CD4相互作用而抑制多种包括A、B、C和D在内的HIV-1亚型, EC50值为0.08~62.5 μmol·L-1, 并抑制R5和X4趋向性毒株(图 6)。该化合物基本药效团是Ile-Triazole-Pro-Trp, 可同时靶向gp120双重位点[17]。位点1包括gp120的外部区域的两个相邻的氨基酸残基(Thr257和Ser375), 它们参与构成“Phe43口袋”; 位点2是gp120内部区域的一个疏水口袋(Ile109、Trp112、Phe210以及β20/21螺旋上的Met426)。通过对位于溶剂界面的基团环合得到六肽化合物18 (AAR029b), 构象限制使分子始终保持活性构象, 因此抑制能力得到大幅提高。18能有效抑制gp120-CD4相互作用(IC50 = 30 nmol·L-1)及HIV-1假病毒(BaL.01及JR-FL)复制(EC50 = 200 nmol·L-1), 无细胞毒性, 且能耐受蛋白酶的水解。有趣的是, 该类化合物具有独特的杀病毒机制, 通过诱导gp120的脱落, 使p24衣壳蛋白从病毒内腔释放出来, 在与细胞融合之前就可使病毒失活[17]。
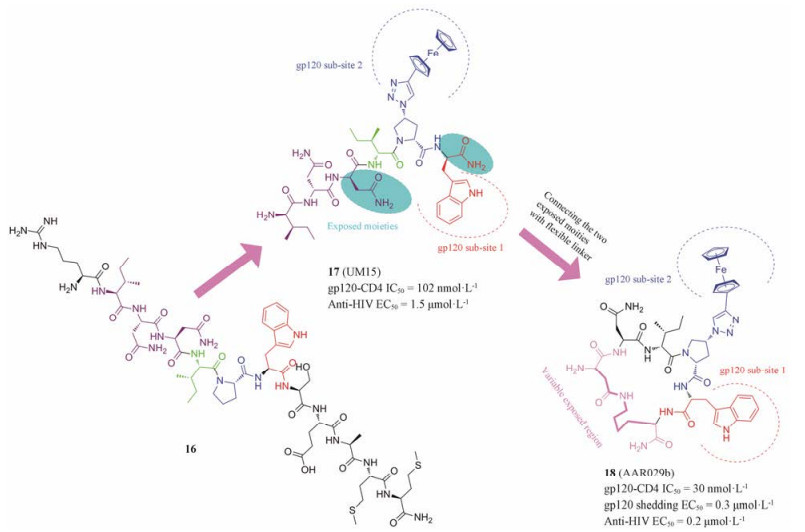
|
Figure 6 The structures of triazole-peptide derivatives |
在HIV-1的复制周期中, 逆转录酶(reverse transcriptase, RT)依靠其RNA/DNA依赖的DNA聚合酶活性和核糖核酸酶H (RNase H)裂解活性, 将原病毒RNA逆转录成双链DNA, 再经整合酶作用, 将病毒DNA整合到宿主细胞的染色体中。由于RT在HIV-1生命周期中的重要作用, 且为病毒所特有以及对其生物结构功能和作用机制的清晰认识, 逆转录酶一直是抗艾滋病药物研究的热门靶点[18]。目前临床应用的HIV-1逆转录酶抑制剂(RTIs)分为核苷(酸)类逆转录酶抑制剂(nucleoside/nucleotide RT inhibitor, NRTIs/NtRTIs)和非核苷类逆转录酶抑制剂(nonnucleoside RT inhibitors, NNRTIs)。由于耐药株的出现, 研发高效、低毒、耐突变的新型RTIs仍然是目前的热点之一。
2.1 核苷(酸)类HIV-1逆转录酶抑制剂NRTIs/NtRTIs作为天然底物的类似物, 通过发挥与酶的竞争性抑制作用和链终止作用而抑制HIV-1复制。目前, 新型NRTIs/NtRTIs的研发思路通常是以上市药物为先导化合物, 通过生物电子等排及前药原理对天然核苷(酸)的碱基或糖基进行广泛的结构修饰, 或者同时对碱基和糖基进行多位点修饰, 以获得高效、低毒、耐突变且具有成药性的核苷(酸)类似物[19]。其中, 非经典的4'-C取代核苷类似物、非磷酸核苷前药和核苷酸前药在最近几年取得了较大的研究进展。
2013年, Sirivolu等[20]通过点击化学得到一系列4'-位三氮唑取代的AZT衍生物, 其中化合物19 (图 7)具有亚微摩尔的抗HIV-1活性。在基于细胞病变效应的抗病毒活性测定中, 抗野生型HIV的EC50为0.067 μmol·L-1, CC50为61 μmol·L-1。在P4R5细胞中, 抗野生型HIV-1的EC50为1.0 μmol·L-1, 抗AZT耐药HIV-1的EC50为9.1 μmol·L-1, 对NNRTI耐药HIV-1的EC50为0.6 μmol·L-1。
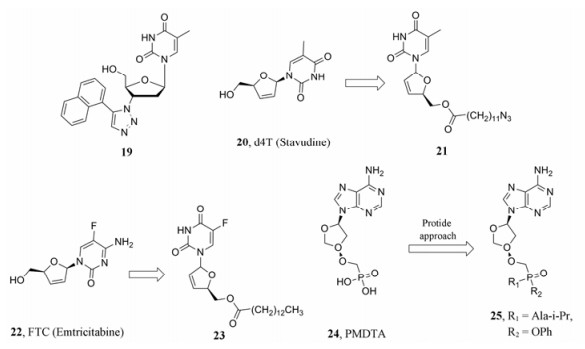
|
Figure 7 The structures of compounds 19-25 |
2011年, Agarwal等[21]报道了20 (d4T, X4 virus: EC50 = 26.8 μmol·L-1; R5 virus: EC50 = 28.1 μmol·L-1)的前药化合物21的抗HIV活性(X4 virus: EC50 = 6.7 μmol·L-1; R5 virus: EC50 = 3.1 μmol·L-1)比20强4~9倍, 且提高了细胞摄入率。2013年, Agarwal等[22]发现22 (FTC)的前药23的抗HIV多耐药株B-NNRTI和B-K65R的活性(IC90 = 15.7~16.1 nmol·L-1)比22 (IC90 = 103~567 nmol·L-1)提高6.6~35.2倍(图 7)。
Herdewijn等[23]利用Protide技术合成了磷酰甲氧基脱氧苏糖基腺嘌呤核苷酸24 (PMDTA)的磷酰胺酯前药, 其代表性化合物25对HIV-1野生株的EC50为22 nmol·L-1, 对HIV-2的细胞活性EC50为3.6 nmol·L-1, CC50为16.9 μmol·L-1。值得指出的是, 该类化合物在低纳摩尔浓度下, 对HBV也有很好的抑制活性(图 7)。
2.2 非核苷(酸)类HIV-1逆转录酶抑制剂在NNRTI研究领域, 计算机辅助药物设计、高品质化合物库的构建及早期成药性评价等药物化学理念逐步应用到NNRTI的修饰中。其中, 以儿茶酚二醚类衍生物和二芳基嘧啶类衍生物的研究进展最为突出。
2.2.1 儿茶酚二醚类衍生物儿茶酚二醚类化合物是由耶鲁大学William L. Jorgensen课题组通过虚拟筛选发现, 后借助自由能微干扰(free energy perturbation, FEP)技术优化得到的一类新型NNRTIs[24]。该类化合物具有良好的抗野生型HIV-1活性和水溶性, 其中化合物26和27 (图 8)抑制野生株的EC50值分别为55和310 pmol·L-1, 且27的水溶性为510 μg·mL-1。但是该类化合物结构中的氰基乙烯基属于Michael受体, 具有潜在的毒性。为了避免该基团, 该课题组设计合成了稠合环类化合物, 其中28和29 (图 8)对野生型HIV-1抑制活性均低于1 nmol·L-1。目前, 多个儿茶酚二醚类化合物与RT的共结晶复合物结构被解析, 为基于结构的合理修饰提供了重要指导。
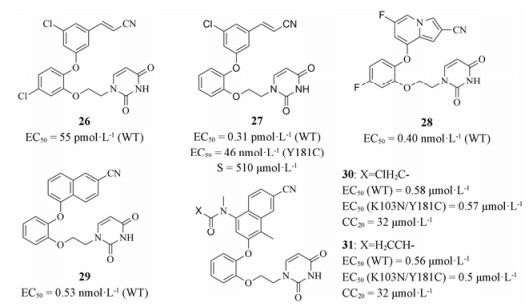
|
Figure 8 The structures of compounds 26-31 |
最近, 该课题组[25]同样以儿茶酚二醚类化合物为骨架, 结合晶体学研究, 首次设计合成了一类共价抑制剂。该类共价抑制剂可以选择性地与HIV RT突变株的Cys181共价结合, 避免了该突变株所引起的药效“失灵”。其中化合物30和31 (图 8)活性最为突出。同时, 作为共价抑制剂, 二者的毒性均低于上市药物依法韦仑和利匹韦林。
2.2.2 二芳基嘧啶(Diarylpyrimidine, DAPY)类衍生物NNRTIs具有活性高、选择性强、毒性低等诸多优点, 是目前治疗艾滋病高效抗逆转录病毒疗法的重要组成部分。目前FDA批准上市的NNRTIs共有5种, 其中第二代NNRTIs依曲韦林和利匹韦林均属于DAPY类衍生物, 该类化合物在临床治疗中出现的耐药性、不良反应及药代动力学性质差等缺点在很大程度上限制了其广泛应用。因此, 对该类化合物的进一步结构修饰一直是近几年该领域的研究热点。
笔者所在课题组以DAPY类化合物为先导, 根据靶标三维空间的适配性要求, 特别是蛋白溶剂界面柔性区域的结构特征, 综合运用基于靶标结构的合理药物设计及抗耐药性药物设计策略(形成主链氢键、精准靶向保守型氨基酸等), 依次对先导化合物右翼、中心杂环和左翼进行了系统的结构修饰, 以探讨未知的化学空间, 并完善该类抑制剂的构效关系; 采用多样性导向的结构修饰, 可克服柔性靶标与配体精准结合模式的不可预知性; 设计合成了多系列噻吩并嘧啶类HIV-1 NNRTIs并进行了细胞及靶点水平的生物活性测试以及早期成药性评价(图 9)[26, 27]。其中化合物32 (K-5a2)和33 (DK5-1)的活性及抗耐药性尤为突出, 32对HIV-1野生株的活性是最新一代上市药物依曲韦林的2.8倍。抑制单突变株L100I、K103N和Y181C的活性与依曲韦林相当; 对于单突变株Y188L、E138K (新一代非核苷类药物常见耐药珠)以及双突变株F227L+V106A的活性均比依曲韦林提高了5倍左右; 且具有极高的选择性指数(> 15 910)、小鼠体内急性毒性低(LD50 > 2 g·kg-1)、药代动力学性质优良, 使之成为具有重要开发前景的药物候选分子。目前已获中国专利授权(ZL201410699294.1), 并进入PCT专利阶段(WO2016197589A1), 正进行规范化的临床前评价。
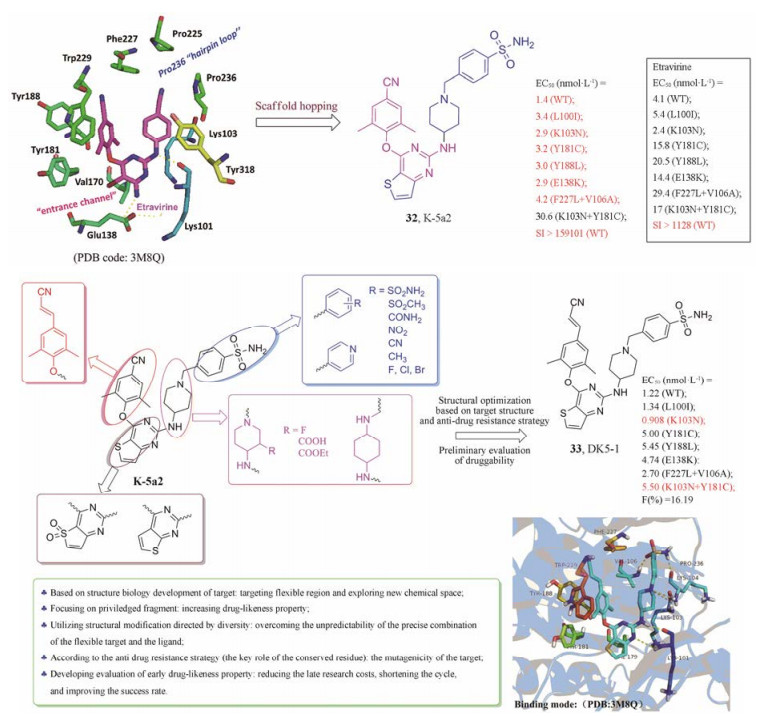
|
Figure 9 Discovery and structural optimization ofthiophene[3, 2-d]pyrimidine HIV-1 inhibitors |
此外化合物33抑制HIV-1野生株和多种临床常见突变株的活性, 较先导化合物32和依曲韦林均有大幅提高。其中, 抑制临床最常见的突变株K103N的活性(EC50 = 0.908 nmol·L-1)是32的3倍; 尤其是抑制临床严重的双突变株RES056 (EC50 = 5.50 nmol·L-1)的活性是32的6倍、依曲韦林的3倍; 抑制单突变株L100I、Y181C、Y188L和E138K的活性远优于依曲韦林。且初步的评价结果显示其成药性显著, 特别是抑制hERG钾离子通道的作用较低。目前正在进行后续的临床前评价。另外, 通过分子模拟分析了该类化合物的作用模式及抗耐药性机制, 对其他易突变型或配体结合位点高度柔性靶标的药物设计具有普遍的参考价值。
2.3 基于RNase H活性的HIV逆转录酶抑制剂HIV-1 RNase H的裂解功能几乎贯穿了逆转录的全过程, 是抗艾滋病药物设计中的一个非常有前景的靶点。目前RNase H抑制剂主要包括RNase H活性位点抑制剂和变构抑制剂[28]。
2.3.1 RNase H活性位点抑制剂目前, RNase H活性位点抑制剂主要是在药效团模型指导下, 通过骨架跃迁或片段杂合所发现的。其中, N-羟基环二酰亚胺类抑制剂和嘧啶醇羧酸类抑制剂就是其中的典型代表。
2.3.1.1 N-羟基环二酰亚胺类抑制剂N-羟基环二酰亚胺(34, 图 10)是最初被报道的流感病毒核酸内切酶抑制剂, 进一步研究发现其能特异性靶向于RNase H活性中心。结合模式研究发现, N-羟基环二酰亚胺的“C=O-(N-OH)-C=O”基团能同时与RNase H活性中心两个相距~4Å (1Å = 1×10-10 m)的二价金属离子发生螯合作用。因此, “C=O-(N-OH)-C=O”三氧原子基团是该类化合物活性所必需, 对化合物34羟基和羰基基团的改造均会使活性降低或丧失[29]。
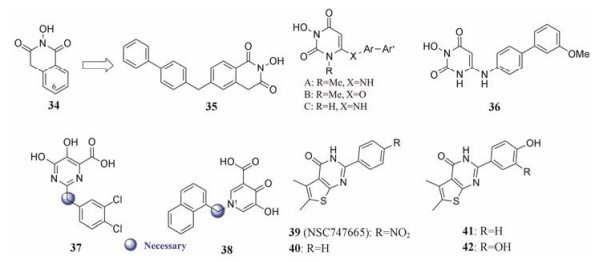
|
Figure 10 The structures of compounds 34-42 |
Vernekar等[29]为验证N-羟基环二酰亚胺化合物6位取代的影响, 对34的6位用苄基或者联苯甲基等取代合成了一系列衍生物, 实验结果表明:其对于HIV-1 RT-RNase H和聚合酶的抑制活性IC50值均低至亚微摩尔水平。该系列中化合物35 (图 10)抑制RNase H的IC50为0.8 μmol·L-1, 且抗病毒活性(EC50 = 3.0 μmol·L-1)。
Tang等[30]合成了一系列新型3-羟基嘧啶-2, 4-二酮(HPD)类衍生物并对其进行了生物活性测试。实验结果表明: N-1位甲基取代的系列衍生物(A和B)能在低微摩尔浓度抑制RNase H活性, 且对于RT-聚合酶活性没有显著的抑制作用(IC50 = 3.3~17 μmol·L-1)。遗憾的是, 这两类化合物表现出了较高的细胞毒性(CC50 = 3.0~10 μmol·L-1); 而N-1位不取代的系列衍生物(C)对于RNase H的抑制活性在亚微摩尔水平(IC50 = 0.15~0.51 μmol·L-1, HTS-1)以及低微摩尔浓度就可以抑制RT-聚合酶活性(IC50 = 0.34~7.3 μmol·L-1), 并且在细胞实验中没有表现出明显的毒性(CC50 > 25 μmol·L-1)。该系列对RNase H抑制活性最好的为化合物36 (IC50 = 0.15 μmol·L-1), 其对RT-聚合酶的抑制活性为7.3 μmol·L-1 (图 10)。
2.3.1.2 嘧啶醇羧酸类抑制剂与N-羟基环二酰亚胺类抑制剂类似, 嘧啶醇羧酸类抑制剂也包含有“三氧原子”的金属螯合药效团。该类抑制剂可以有效地抑制HIV-1 RT-RNase H, 其IC50值低至亚微摩尔, 而且对于人RNase H1的抑制活性极低, 具有良好的选择性。
Kankanala等[31]以37为先导化合物, 将嘧啶环替换为吡啶环, 并在N-1位连接不同的芳香基团, 设计合成了一系列新型的羟基吡啶酮羧酸类衍生物。实验结果表明:多数化合物能以低微摩尔浓度抑制HIV RT-RNase H, 而对RT-聚合酶和整合酶则没有明显的抑制活性, 表明其具有良好的选择性。其中化合物38表现出了较好的抗病毒活性(EC50 = 10 μmol·L-1), 且无明显的细胞毒性(CC50 > 25 μmol·L-1)。后续的构效关系研究表明:金属鳌合药效团与芳基或二芳基之间的一个原子长度的连接链对于发挥RNase H的抑制活性是必需的(图 10)。
2.3.2 RNase H变构抑制剂RNase H变构抑制剂是除活性位点抑制剂之外的另一类重要抑制剂。变构抑制剂不需要含有负电性的“三氧原子”金属鳌合药效团, 因此可能具有更好的细胞透膜性。另外, 这类抑制剂的结合位点拓展到RNase H活性位点区域之外, 有望形成高亲和力的相互作用[32]。
噻吩并嘧啶酮类抑制剂是在变构抑制剂插烯脲类抑制剂环化后得到的。Masaoka等[33]首次探讨了噻吩并嘧啶酮类抑制剂C-2位的苯环上邻位与对位取代的构效关系, 发现化合物40的C-2位上苯环未取代时, 其对于RNaseH抑制活性的IC50值相比39降低了15倍(11.3~0.85 μmol·L-1)。进一步构效关系表明:苯环上有吸电子基团的取代基能够增加抑制剂活性, 而给电子基团则会降低抑制剂活性。比较特殊的是, 羟基虽为给电子基, 但化合物41 (IC50 = 0.79 μmol·L-1)和42 (IC50 = 0.26 μmol·L-1)的活性均有了很大提高。推测可能是羟基与p51-p66接界面的氨基酸残基形成氢键或额外的相互作用, 增强了亲和力(图 10)。
3 HIV-1整合酶抑制剂HIV-1复制周期中的整合过程, 是将逆转录后的病毒DNA整合入宿主DNA的过程。在整合过程中, HIV-1整合酶(integrase, IN)参与并催化整个整合反应, 是HIV-1复制及稳定感染必不可少的酶。目前, 整合酶抑制剂主要可以分为作用于蛋白质催化区域(活性位点)的抑制剂和基于IN-LEDGF/p75相互作用的抑制剂, 这两类也是目前整合酶抑制剂研究的重点。
3.1 作用于IN催化区域(活性位点)的抑制剂二酮酸类(DKA类)整合酶抑制剂通过与底物DNA竞争性地结合到整合酶的活性位点, 进而抑制整合过程中的链转移反应而发挥作用。因其具有高效、高选择性和作用机制明确等特点, 目前已成为整合酶抑制剂研究最为成功的一类。
日本Shionogi公司[34]运用构象限制策略对其发现的先导化合物43 (IC50 = 10 nmol·L-1)进行结构修饰, 使与金属螯合的氧原子可以保持共平面, 并通过后续优化得到化合物44, 44抑制野生型整合酶的IC50 = (3.4 ± 1.1) nmol·L-1, 并对雷特格韦的耐药株均表现出良好的活性, 同时该化合物还具有良好的药代动力学性质(图 11)。
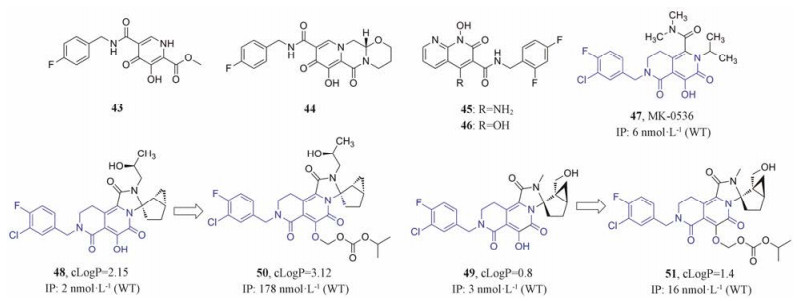
|
Figure 11 The structures of compounds 43-51 |
Terrence R. Burke课题组[35]通过对1-羟基-2-氧-1, 2-二氢-1, 8-萘啶-3-甲酰胺类整合酶抑制剂的结构修饰得到了化合物45, 该化合物表现出较好的抗耐药性、较低的细胞毒性和抑制HIV-1整合酶的活性(IC50 = 1 nmol·L-1)。同年, 该课题组[36]还发现了化合物46 (EC50 = (6.2 ± 2.9) nmol·L-1), 对雷特格韦耐药株Y143R、N155H、G140S/Q148H、G118R和E138K/Q148K等均表现出良好的活性, 开发前景较好(图 11)。
2015年, Raheem课题组[37]基于高效整合酶抑制剂47 (MK-0536, 图 11)的2-吡啶酮核心, 设计合成了一系列衍生物。其中, 化合物48和49 (图 11)表现出更高的活性(inhibitory potency, IP)和抗耐药性。但在进行非啮齿类动物安全性试验过程中, 发现其稳态血药浓度低于10 mg·kg-1。因此, 该课题组应用前药策略设计合成了前药50和51 (图 11), 二者的溶解度和渗透性较其原药均有所提高(表 2)。
| Table 2 In vitro solubility and permeability of compounds 48 and 49 as well as their prodrugs |
HIV-1除利用自身的整合酶外, 还会劫持一些宿主细胞辅助因子(host-cell cofactor)参与合成其整合前病毒DNA。整合过程的主要宿主辅助因子-人晶状体上皮源性生长因子(lens epithelium-derived growth factor, LEDGF), 因与已发现的转录协同激活因子p75为同一种蛋白, 又被称为LEDGF/p75。LEDGF/p75可以将整合酶链合到特定的DNA序列上, 促进链转移反应和整合过程的完成。同时, 还对整合酶具有稳定作用, 在LEDGF/p75缺陷的感染细胞中, 整合酶很快被降解, HIV-1的复制和感染被阻断。由于靶向蛋白-蛋白相互作用药物不易产生抗药性, 因此整合酶与LEDGF/p75的相互作用界面成为抗HIV-1药物设计的理想靶标[38]。目前LEDGF/p75与整合酶的共结晶复合物的三维结构已被成功解析, 人们相继通过高通量筛选也发现了很多靶向于LEDGF/p75-IN相互作用的抑制剂。其中, 2-(喹啉-3-基)乙酸类和8-羟基喹啉类抑制剂是靶向于整合过程中IN-LEDGF/p75相互作用的典型代表。
3.2.1 2-(喹啉-3-基)乙酸类抑制剂Debyser等[39]设计合成了一系列2-(喹啉-3-基)乙酸衍生物, 活性实验证明:该类衍生物能在亚微摩尔浓度阻断HIV-1的整合过程并具有不同于一般整合酶抑制剂的作用机制。同时, 晶体结构进一步证明这类抑制剂可以结合到整合酶上的LEDGF/p75结合口袋。其中, 化合物52的活性最为突出, EC50 = (2.35 ± 0.28) μmol·L-1, CC50 = (59.8 ± 0.5) μmol·L-1, 抑制LEDGF/p75-IN相互作用活性IC50 = (1.37 ± 0.36) μmol·L-1。在过去几年中, 诸多课题组及制药公司纷纷基于该类骨架的药效团特征开展了一系列结构改造, 其中, 化合物53 (BI 224436)目前正在进行临床Ⅰ期试验, 有望成为新一代的抗艾滋病治疗候选药物(图 12)[40]。
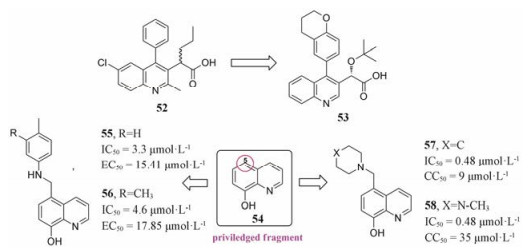
|
Figure 12 The structures of compounds 52-58 |
前期研究发现优势片段54 (8-羟基喹啉, 图 12)能够抑制整合酶与LEDGF/p75的结合, 基于此, Serrao等[41]通过基于片段的药物筛选技术首次发现了在微摩尔浓度即对IN-LEDGF/p75相互作用有抑制作用的8-羟基喹啉衍生物, 但其具有明显的细胞毒性。进而对8-羟基喹啉母环的C-5位进行多样性修饰得到化合物55~58 (图 12), 它们的活性及细胞毒性均得到大幅改善。该类蛋白-蛋白相互作用抑制剂的分子量较小, 因而具有进一步活性及成药性优化的化学空间。
4 HIV-1转录过程及其抑制剂HIV-1的转录是病毒整合之后的重要环节, 可分为三步, 即信号转导、反式激活和核外转运。前病毒DNA的转录是唯一可以使病毒基因组拷贝数急剧增加的步骤, 而对病毒转录的抑制可以使潜伏病毒难以激活。因此, 干预HIV-1转录过程被认为是通过化学治疗来抑制HIV-1复制的有效靶点[42]。针对这一过程的关键步骤, 许多靶点及其抑制剂被相继发现。本文着重概述了HIV-1转录反式激活和核外转运过程涉及的相关重要靶点及其抑制剂。
4.1 HIV-1转录反式激活抑制剂病毒反式激活因子Tat (trans-activator of transcription)调节蛋白在维持HIV-1的高水平复制方面扮演着重要的角色。胞液中的Tat转导进入细胞核, 与病毒新生RNA的反式激活应答区(trans-activator response region, TAR)相互作用, 反式激活病毒RNA的转录, 使转录得以持续进行下去, 生成全长的RNA。理论上, 在反式激活过程中, 包括Tat、TAR以及必需的宿主细胞蛋白包括细胞周期因子T1 (CycT1)、催化亚基细胞周期依赖性激酶9 (cyclindependent kinases 9, CDK9)和组蛋白乙酰基转移酶(histone acetyl transferase, HAT)等在内的所有蛋白质均可作为反式激活过程的作用靶点。下文主要介绍以Tat和CycT1为靶点的HIV-1反式激活抑制剂[43]。
4.1.1 以Tat为靶点的抑制剂Guendel等[44]通过高通量筛选发现了一种Tat依赖性的HIV-1转录抑制剂59 (6BIO), 随后对其衍生物进行了设计和筛选, 发现其第二代衍生物60 (18BIOder)同样能够抑制Tat依赖性的HIV-1转录过程且抑制作用更强, 而它的分子量只有59的一半。同时, 还发现60在纳摩尔浓度可优先抑制仅在HIV-1感染的细胞中存在的新型激酶glycogen synthase kinase(GSK)-3β复合物, 这为后续研发选择性更强的HIV转录过程抑制剂提供了重要方向(图 13)。
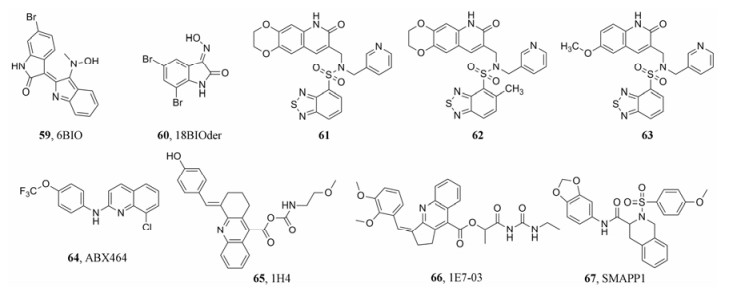
|
Figure 13 The structures of compounds 59-67 |
细胞周期蛋白T1 (CycT1)与HIV-1 Tat和TARRNA相互作用, 导致RNA聚合酶Ⅱ (RNAPⅡ)的过度磷酸化而激活病毒转录。因此, CycT1/Tat/TAR RNA相互作用是抑制HIV-1复制的新靶标。Baba课题组[45]针对CycT1/Tat/TAR RNA复合物, 进行了计算机筛选及体外抗HIV-1试验, 结果发现化合物61和62在肿瘤坏死因子(tumor necrosis factor-α, TNF-α)激活的OM-10.1细胞中能够选择性地抑制HIV-1复制。此外, 衍生物63相较于61和62具有更为强效的抑制作用, 该化合物可通过抑制Tat与CycT1的结合来抑制Tat介导的HIV-1长末端重复驱动的基因表达和RNAPⅡ的磷酸化(图 13)。
4.2 HIV-1转录物核外转运抑制剂Rev蛋白与病毒mRNA的Rev应答元件(Rev response element, RRE)相互作用, 控制病毒mRNA的细胞核输出。如果Rev缺乏或者不能进入细胞核, 未剪接和部分剪接的mRNA将在核内完全降解, 导致HIV-1复制被阻断[46]。因此, 针对辅助蛋白Rev和顺式作用元件RRE均可以设计HIV-1抑制剂并且都取得了重要的研究成果。其中, 以Rev为靶点的抑制剂64 (ABX464, 图 13)的发现最为瞩目。
ABX464是一种新型的抗HIV-1分子, 主要通过阻止Rev介导的未剪接的HIV-1转录物向细胞质的输出, 并与Cap结合复合物相互作用而发挥抗病毒活性。ABX464通过干扰这些Rev介导功能来增强病毒mRNA的剪接, 但ABX464并不干扰正常细胞的mRNA加工。ABX464表现出独特的抗病毒性质, 在人源化小鼠模型中具有长效的抗病毒活性, 并且能够限制感染的免疫细胞(包括贮库)中HIV-1前病毒基因组的表达。2017年7月, ABIVAX公司公布了ABX464正在进行的Phase IIa期最新结果, 数据显示该药能显著降低感染HIV的患者血液中的HIV病毒储库, 表明ABX464可能在治愈HIV或清除HIV感染中有着重要的作用, 研发前景广阔[47, 48]。
4.3 以蛋白磷酸酶1 (protein phosphatase 1, PP1)为靶点的HIV-1转录过程抑制剂和潜伏感染激活剂转录过程被HIV-1反式激活因子Tat激活, Tat蛋白与CycT1依赖性CDK9结合, 磷酸化RNAPⅡ和激活HIV-1基因的转录。在反式激活过程中, 有两步关键的磷酸化作用:一是CDK9自身磷酸化; 二是CDK9磷酸化RNAPⅡ CTD。磷酸化作用同时受控于蛋白激酶和蛋白磷酸酶(protein phosphatase, PP)。最近研究显示, PP1参与HIV-1转录, 脱磷酸化CDK9或RNAPⅡ CTD以增强Tat诱导的转录。
Ammosova等[49]利用PP1γ与RRVSFA肽复合物作为结合模型, 从30万化合物中筛选获得与PP1结合的262个化合物。对这262个化合物进行进一步的细胞水平活性实验, 8个化合物抑制HIV-1转录的IC50低于15 μmol·L-1, 其中化合物65 (1H4)的活性较好, 在CEM-GFP细胞中能较好地抑制HIV-1转录(IC50 = 10 μmol·L-1)且毒性最低, 是第一个被报道的PP1小分子抑制剂。对化合物65进行进一步修饰, 得到化合物66 (1E7-03), 其IC50大幅降低(IC50 = 2 μmol·L-1), 且无明显细胞毒性(图 13)[50]。
尽管现有的抗逆转录病毒治疗非常有效, 但这些药物只能抑制病毒的复制, 却无法根除HIV-1感染。根除潜伏的HIV-1原病毒具有挑战性, 需要新的生物学观点和治疗策略, 因此研发靶向干预HIV-1潜伏期的新型治疗技术, 已成为当前国际上艾滋病治愈研究领域的发展趋势和研究的焦点。
目前有一种先激活再杀死(kick-and-kill)的治疗方法旨在逆转HIV-1的潜伏期从而彻底清除体内的艾滋病病毒。该疗法中先用组蛋白脱乙酰基酶抑制剂(histone deacetylase inhibitors, HDAC)激活病毒, 然后再进行联合抗逆转录病毒治疗(combination antiretroviral therapy, cART)杀死病毒[51]。
最近, Ammosova团队[52]在通过药效团搜索以寻找可替代上述小分子抑制剂1H4的吖啶骨架中芳香部分的化学骨架时, 发现了一类磺胺类似物可以在无明显毒性的浓度下增强HIV-1的感染。将这些化合物在潜在感染的原发性CD4+T细胞中进行测试, 结果显示部分化合物具有激活HIV-1的效应。其中67 (small molecule activating PP1, SMAPP1, 图 13)可以诱导HIV-1转录和重新激活潜在HIV-1原病毒, 增强CDK9残基Ser90和Thr186的磷酸化, 在体外激活PP1, 继而在处理后的T细胞中诱导PP1调节亚基Sds22的表达。67是小分子靶向PP1诱导HIV-1转录的第一例化合物, 为研究与cART药物联合使用以防止病毒反弹开创了新方向。
5 蛋白酶抑制剂HIV编码的天冬氨酰蛋白酶(protease, PR)是HIV基因组复制中的关键酶之一。虽然目前已经上市了10种拟肽和非肽类HIV蛋白酶抑制剂[53], 但是在长期的临床使用中, 耐药病毒株的大量出现和现有药物的不良反应, 已经迫使药物化学家们去寻找新的HIV蛋白酶抑制剂。其中, 对已上市药物骨架的修饰以及寻找新结构骨架、靶向新位点和具有新作用机制的药物研发策略是现阶段HIV蛋白酶抑制剂研发的主要方向, 其研究成果已受到了同行的广泛关注。
5.1 拟肽类HIV-1蛋白酶抑制剂 5.1.1 Darunavir类似物蛋白酶催化蛋白水解过程需要经过蛋白酶单体的二聚化, 而68 (darunavir, 图 14)的作用机制就是其可以有效地抑制蛋白酶单体的二聚化, 是近些年研究最多的拟肽类HIV蛋白酶抑制剂。Darunavir的结构骨架可以分为P1、P2、P1'和P2'四个配体区域, 其与HIV蛋白酶的晶体结构(PDB: 2IEN, 图 14)显示: P1区羰基和P2'区磺酰胺的砜基可以与Ile50和Ile50'通过水桥作用形成氢键作用力, P2区双-四氢呋喃环上的氧原子可以与Asp29和Asp30主链上的氢原子形成氢键作用力, P1'区羟基可以与Asp25以及Asp25'形成氢键作用力, P2'区苯环上氨基也可以与Asp30'形成氢键作用力。为进一步提高darunavir与附近氨基酸残基的结合能力进而提高对耐药株的抑制活性, 国内外不同课题组[54-58]以darunavir为先导化合物, 结合晶体学研究, 对其4个配体部分进行结构修饰, 设计合成的许多衍生物活性超过先导化合物darunavir, 其中代表性化合物(69~73)结构及活性数据见图 14。
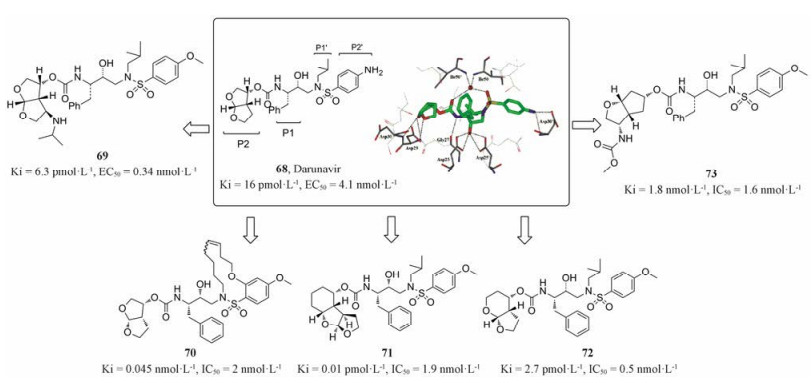
|
Figure 14 The crystal structure of darunavir and HIV protease (PDB: 2IEN)[59]and its derivatives |
HIV蛋白酶是由两条相同的肽链组成的同源二聚体, 两个单体的二聚化对于催化作用位点的形成具有决定性的作用。因此, 抑制单体的二聚化可以阻止蛋白酶的生成。同时, 蛋白酶二聚体的界面在病毒的变异过程中也非常保守[60]。因此, 针对蛋白酶二聚体化开发新的HIV蛋白酶抑制剂已成为当前的研究热点。
Dufau等[61]报道了一类基于羰基酰肼结构的非肽类HIV蛋白酶抑制剂74, 其对蛋白酶的Kid为50 nmol·L-1, 对于多种突变株如ANAM-11, 其抑制活性也达到了80 nmol·L-1。另外, 其对天冬氨酸的蛋白酶肾素和胃蛋白酶均没有抑制活性, 表现出较好的选择性, 是一类非常有前景的蛋白酶单体二聚化抑制剂。苯二氮卓类化合物75 (IC50 = 4.3 μmol·L-1)只表现出低微摩尔的抑制HIV蛋白酶活性, 但是其二聚体化合物76却表现出很强的抑制活性(IC50 = 0.03 μmol·L-1) (图 15)[62]。
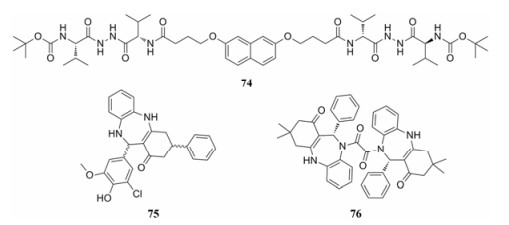
|
Figure 15 The structures of compounds 74-76 |
HIV-1进入人体复制产生大量病毒蛋白和自身RNA, 这是病毒组装的准备阶段。新合成的病毒蛋白和自身RNA在宿主细胞的胞浆区域进行蛋白与基因的互相结合, 并在宿主细胞的内膜表面附着形成待出芽的病毒前体。随后, 病毒前体与各种释放因子在细胞膜上的生物膜脂筏(lipid rafts)聚集引起细胞膜的弯曲变形, 最终释放出新的病毒颗粒[63]。其中, 靶向于HIV-1成熟过程的抑制剂在近几年取得了许多令人瞩目的进展。
6.1 基于HIV-1成熟过程的抑制剂HIV-1成熟抑制剂作用机制新颖, 区别于竞争性的蛋白酶抑制剂, 主要通过干扰蛋白酶介导的衣壳蛋白-间隔肽1 (CA-SP1)裂解过程来阻止HIV的成熟和释放[64]。下文重点介绍靶向于CA-SP1裂解位点的三萜类和吡啶酮类化合物。
6.1.1 三萜类化合物化合物77 (bevirimat, BVM, 图 16)为白桦脂酸衍生物, 通过阻碍CA前体蛋白(p25CA-SP1)向成熟CA (p24CA)的转变, 使病毒产生有缺陷的无感染性颗粒而抑制HIV复制。Bevirimat能够抑制HIV-1复制, 而且对病毒RT和PR有耐药性的病毒株也有抑制活性。Bevirimat目前处于临床Ⅱ期试验, 具有较好的口服生物利用度和药代动力学特征[65]。尽管如此, bevirimat在临床用于治疗HIV-1阳性患者时易产生耐药性。为进一步改善白桦酸的抗HIV活性、理化性质、药动学及生物利用度, 研究者们通过对其结构的修饰改造, 获得了一系列具有不同作用机制的白桦酸类HIV-1抑制剂[66]。
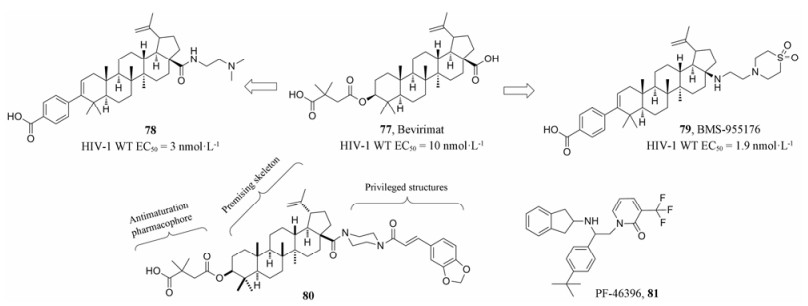
|
Figure 16 The structures of compounds 77-81 |
2016年, Swidorski等[67]报道三萜类化合物苯甲酸部分限制了药效团的拓扑结构, 使其在人血清白蛋白中效力下降。通过对三萜类化合物C-28的修饰可以改善C-3苯甲酸部分的多形态构象, 并对抗病毒效力产生影响。其中, 二甲氨基乙基酰胺衍生物78 (图 16)可以提高抑制bevirimat耐药病毒的效力。79 (BMS-955176, 图 16)是具有口服活性的第二代HIV-1成熟抑制剂, 作用机制主要是抑制HIV-1成熟过程中最后一步切割步骤。与bevirimat相比, 其表现出更好的成药性, 目前处于临床IIb研究阶段[68, 69]。
此外, Zhao等[70]通过将优势结构哌嗪整合到bevirimat上, 得到了抗HIV-1/NL4-3和NL4-3/V370A细胞活性均提高的新一类衍生物, 其中化合物80 [EC50 = 0.019 μmol·L-1 (NL4-3), 0.15 μmol·L-1 (NL4-3/V370A)]与bevirimat [EC50 = 0.065 μmol·L-1 (NL4-3), 7.71 μmol·L-1(NL4-3/V370A)]相比, 抗HIV-1 NL4-3活性提高3倍, 抗HIV-1 NL4-3/V370A活性提高51倍, 同时其代谢稳定性也有所提高。该结果表明将优势结构杂合到天然产物骨架中是发现药物先导化合物的有效策略(图 16)。
6.1.2 吡啶酮类化合物81 (PF-46396, 图 16)是通过高通量筛选获得的作用于CA-SP1的小分子成熟抑制剂[71, 72], 在MT-2细胞中抑制HIV-1 NL4-3和HIV-1 IIIB的EC50值分别为0.36和0.017 μmol·L-1。其结构不同于白桦脂酸, 但作用机制相同。蛋白质印迹技术及突变分析方法(CA: Ile201Val、SP1: Ala1Val)均证明PF-46396能特异性阻断CA-SP1的裂解。与bevirimat较为类似, PF-46396对临床常见变异毒株的抗病毒活性范围波动很大, 这可能与CA末端以及SP1的多态性有关。
7 靶向于其他靶点的HIV抑制剂 7.1 HIV-1 Vif抑制剂Vif蛋白是HIV-1复制过程中不可或缺的病毒感染因子, 对HIV-1的感染性有重要作用, 是目前抗AIDS治疗策略中的理想靶点。Vif蛋白的主要功能是通过介导宿主细胞体内载脂蛋白B mRNA编辑酶催化多肽样蛋白3G (apolipoprotein B mRNA editing enzyme catalytic polypeptide-like 3G, APOBEC3G)的降解, 从而增强病毒的感染性[73]。目前, HIV-1 Vif小分子抑制剂主要通过上调细胞内的APOBEC3G水平而抑制HIV-1的复制。
2016年, Rana课题组[74]为进一步提高82 (RN-18, 图 17)的活性和代谢稳定性, 利用生物电子等排原理, 将RN-18的酰胺键分别用1, 3, 4-噁二唑、1, 2, 4-噁二唑、1, 5-二取代-1, 2, 3-三氮唑和1, 4-二取代-1, 2, 3-三氮唑替换, 得到了RN-18的衍生物83~86 (图 17)。活性结果显示:其抑制HIV-1 H9细胞的EC50值分别为6.8、6.8、15和1.2 μmol·L-1。第二轮修饰中, 他们将五元杂环固定为活性较好的1, 4-二取代-1, 2, 3-三氮唑来进一步探讨A环和C环的构效关系, 最终得到化合物87, 其EC50值为10 nmol·L-1。
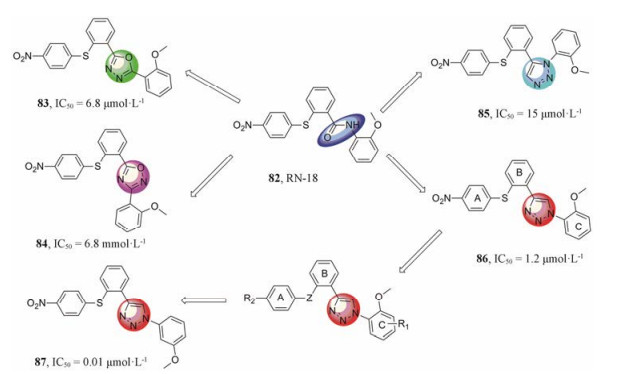
|
Figure 17 The structural optimization of RN-18 |
HIV-1的核壳体蛋白7 (nucleocapsid protein 7, NCp7)在病毒的逆转录过程与整合过程都起到重要作用。基因定点突变结果表明NCp7具有高度的保守性[75]。因此, 针对于此靶点设计合成的药物不易由于NCp7发生基因突变而产生耐药性。近年来NCp7已经成为抗病毒药物研究中备受关注的新作用靶点之一。NCp7锌指受体抑制剂的主要机制分两种: ①通过药物与NCp7作用“逐出”锌指结构里的锌离子, 从而改变NCp7的结构, 并导致其丧失原有的功能, 从而抑制HIV-1的复制; ②通过直接干扰核酸与核壳体蛋白结合而抑制HIV-1的复制[76]。
7.2.1 基于锌离子“逐出”机制的抑制剂2016年, Hartman等[77, 78]利用前药策略设计合成的苯甲酰胺硫酯类化合物MT [NCp7抑制剂88 (SAMT)分子内酰基转移产物89]的前药90表现出了更好的靶向NCp7活性, 实验数据表明: 90抗HIV活性优于其原药MT, 其中90在单核巨噬细胞和PBMC细胞系中的抗HIV活性分别为EC50 = 0.6~20 μmol·L-1和0.87~12.3 μmol·L-1。相较于其原药, 抗HIV活性分别提高了4倍和1.5倍(89: EC50 = 2.5~19 μmol·L-1和1.44~10.7 μmol·L-1) (图 18)。
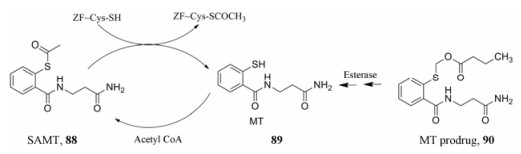
|
Figure 18 HIV NCp7 inhibitors and their prodrugs |
目前, 基于核酸结合的抑制剂主要有两种作用机制: ①与核酸以非共价键竞争性结合核壳体蛋白; ②与核壳体蛋白的核酸伴侣非共价键结合。
Sosic等[79, 80]根据小分子抑制剂与TAR和cTAR的结合会影响NCp7功能, 进而干扰HIV复制的作用机制, 结合蛋白复合物晶体研究发现:化合物91的赖氨酸氨基与TAR RNA链上氨基酸骨架磷酸酯形成的离子键对于化合物保持活性是至关重要的, 而增加赖氨酸与芳香环的距离会减弱与核酸非经典结构的作用。基于此, Sosic等选择了不同长度的阳离子片段并设计了一系列衍生物。活性实验结果表明:调整阳离子的距离确实可以提高与核酸的作用继而竞争性抑制核壳体蛋白NCp7。其中, N-端鸟氨酸衍生物92对核壳体蛋白的抑制作用最强, 其IC50值为(21.9 ± 0.46) μmol·L-1, 是化合物91抑制活性[IC50 = (44.5 ± 0.69) μmol·L-1]的2倍左右(图 19)。
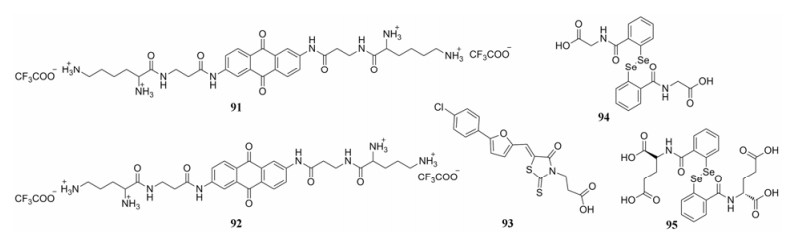
|
Figure 19 The structures of compounds 91-95 |
2015年, Sancineto等[81]通过用硒原子代替二硫代苯甲酰胺类化合物93 (图 19)的硫原子, 设计了一类2, 2'-二硒双苯酰胺(diselenobisbenzamides, DISeBAs) NCp7抑制剂。这类衍生物对于HIV-1 (IIIB)和包括HIV-1RES056、HIV-1IIIB/RIT、HIV-1L6等耐药株以及HIV-2 (ROD)和猴免疫缺陷病毒(SIVMac251)都有一定的抑制活性, 具有广谱的抗病毒作用。其中化合物94和95 (图 19)在MT-4细胞系中对HIV-1、HIV-2的活性和细胞毒性见表 3。
| Table 3 The activity and cytotoxicty of 94 and 95 |
HIV衣壳蛋白(capsid ptotein, CA)在未成熟病毒颗粒和成熟病毒颗粒装配过程中起着非常关键的作用, 已经成为设计新型抗艾滋病药物的热点[82]。
2015年, Machara等[83]研究者通过计算机高通量筛选, 从两个化合物库中的70 000多小分子中筛选出了335个苗头化合物, 采用AlphaScreen法(amplified luminescent proximity assay system)评价它们抑制CA-CAI (capsidassembly inhibitor)的结合活性, 发现2-芳基喹唑啉化合物96的活性最高, IC50为68 μmol·L-1, 抑制病毒复制的IC50约为5 μmol·L-1。为提高其抗病毒活性以及溶解性等理化性质, 以96为先导化合物, 对其C-2位吡啶环和C-4位的氮取代苯环进行修饰, 设计合成了26个目标化合物。活性研究发现97活性最好, 抑制CA-CAI结合活性IC50为9 μmol·L-1, 比先导化合物抑制活性提高了将近8倍, 抑制病毒复制活性IC50为4.6 μmol·L-1, 略优于先导化合物(图 20)。
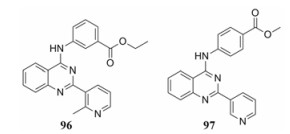
|
Figure 20 The structures of compounds 96 and 97 |
临床上现有的抗艾滋病药物随着长期使用, 面临着诸多亟待解决的问题。通过本文对抗艾滋病药物靶标及其抑制剂新进展的总结, 发现当前抗艾滋病药物研发的途径已呈现“百花齐放”的态势。基于高品质化合物库的高通量筛选(high-throughput screening, HTS)结合如基于片段的筛选、虚拟筛选或对筛选片段的进一步修饰优化等新理论、新方法已经成为发现抗HIV活性先导物的重要途径。同时, 对于已经发现的针对某确定靶点的先导化合物, 通过对其结合模式及构效关系的分析, 根据药物设计的基本原理和策略诸如生物电子等排、骨架跃迁、分子杂合和前药修饰等来设计合成新的衍生物, 并通过系统的药代动力学、药效学和毒理学评价发现候选药物的方法, 依然在当前抗艾滋病药物发现中占据“半壁江山”。除此之外, 大环化合物的引入、抗体偶联、共价抑制剂、早期成药性评价、天然产物与优势片段杂合、Protide前药技术、基于药效团模型的骨架跃迁以及基于生物学机制的药物设计等理念与技术已在HIV抑制剂的开发当中占有“一席之地”, 且方兴未艾。
此外, 一些已经运用到HIV-1某些靶点抑制剂的新药物设计理念和技术应该在其他靶标中普及推广, 并互相借鉴杂糅, 取长补短。例如, 共价抑制剂已成为HIV NCp7抑制剂的主要类型, William L. Jorgensen课题组[25]创造性运用共价结合思路发现了首类非核苷类Cys181共价结合抑制剂; 活性位点抑制剂和变构调节抑制剂(蛋白-蛋白相互作用)已在逆转录酶、蛋白酶、整合酶等一些经典靶标及RNase H、NCp7等新兴靶标中呈现“齐头并进”的趋势。
最后, 药物化学领域一些“小荷才露尖尖角”的新策略与新技术同样值得大力关注, 诸如DNA编码化合物库(DNA encoded compound library, DEL)、蛋白水解靶向嵌合体技术(proteolysis targeting chi merasmethod, Protac)等, 都有望创造性地应用到HIV抑制剂的研发当中, 以提高新一代抗艾滋病药物发现的速度与成功率。
| [1] | World Health Organization. HIV/AIDS[EB/OL]. 2017-06[2017-11]. http://www.who.int/mediacentre/factsheets/fs360/en/. |
| [2] | Arts EJ, Hazuda DJ. HIV-1 antiretroviral drug therapy[J]. Cold Spring Harb Perspect Med, 2012, 2: a007161. |
| [3] | Zhan P, Pannecouque C, De Clercq E, et al. Anti-HIV drug discovery and development:current innovations and future trends[J]. J Med Chem, 2016, 59: 2849–2878. DOI:10.1021/acs.jmedchem.5b00497 |
| [4] | Siegel L, Gulick RM. New antiretroviral agents[J]. Curr Infect Dis Rep, 2007, 9: 243–251. DOI:10.1007/s11908-007-0038-8 |
| [5] | Liu T, Huang B, Zhan P, et al. Discovery of small molecular inhibitors targeting HIV-1 gp120-CD4 interaction drived from BMS-378806[J]. Eur J Med Chem, 2014, 86: 481–490. DOI:10.1016/j.ejmech.2014.09.012 |
| [6] | Lin PF, Blair W, Wang T, et al. A small molecule HIV-1 inhibitor that targets the HIV-1 envelope and inhibits CD4 receptor binding[J]. Proc Natl Acad Sci USA, 2003, 100: 11013–11018. DOI:10.1073/pnas.1832214100 |
| [7] | Wang T, Zhang Z, Wallace OB, et al. Discovery of 4-benzoyl-1-[(4-methoxy-1H-pyrrolo[2, 3-b]pyridin-3-yl)oxoacetyl]-2-(R)-methylpiperazine (BMS-378806):a novel HIV-1 attachment inhibitor that interferes with CD4-gp120 interactions[J]. J Med Chem, 2003, 46: 4236–4239. DOI:10.1021/jm034082o |
| [8] | Regueiro-Ren A, Xue QM, Swidorski JJ, et al. Inhibitors of human immunodeficiency virus type 1(HIV-1) attachment. 12. Structure-activity relationships associated with 4-fluoro-6-azaindole derivatives leading to the identification of 1-(4-benzoylpiperazin-1-yl)-2-(4-fluoro-7-[1, 2, 3] triazol-1-yl-1H-pyrrolo[2, 3-c]pyridin-3-yl)ethane-1, 2-dione (BMS-585248)[J]. J Med Chem, 2013, 56: 166–1669. |
| [9] | Lu L, Yu F, Cai L, et al. Development of small-molecule HIV entry inhibitors specifically targeting gp120 or gp41[J]. Curr Top Med Chem, 2016, 16: 1074–1090. |
| [10] | Pancera M, Lai YT, Bylund T, et al. Crystal structures of trimeric HIV envelope with entry inhibitors BMS-378806 and BMS-626529[J]. Nat Chem Biol, 2017, 13: 1115–1122. DOI:10.1038/nchembio.2460 |
| [11] | Parker CG, Domaoal RA, Anderson KS, et al. An antibody-recruiting small molecule that targets HIV gp120[J]. J Am Chem Soc, 2009, 131: 16392–16394. DOI:10.1021/ja9057647 |
| [12] | Madani N, Schön A, Princiotto AM, et al. Small-molecule CD4 mimics interact with a highly conserved pocket on HIV-1 gp120[J]. Structure, 2008, 16: 1689–1701. DOI:10.1016/j.str.2008.09.005 |
| [13] | Zhao Q, Ma L, Jiang S, et al. Identification of N-phenyl-N'-(2, 2, 6, 6-tetramethyl-piperidin-4-yl)-oxalamides as a new class of HIV-1 entry inhibitors that prevent gp120 binding to CD4[J]. Virology, 2005, 339: 213–215. DOI:10.1016/j.virol.2005.06.008 |
| [14] | Curreli F, Choudhury S, Pyatkin I, et al. Design, synthesis, and antiviral activity of entry inhibitors that target the CD4-binding site of HIV-1[J]. J Med Chem, 2013, 55: 4764–4775. |
| [15] | Curreli F, Kwon YD, Zhang H, et al. Binding mode characterization of NBD series CD4-mimetic HIV-1 entry inhibitors by X-ray structure and resistance study[J]. Antimicrob Agents Chemother, 2014, 58: 5478–5491. DOI:10.1128/AAC.03339-14 |
| [16] | Lalonde JM, Lekhac M, Jones DM, et al. Structure-based design and synthesis of an HIV-1 entry inhibitor exploiting X-ray and thermodynamic characterization[J]. ACS Med Chem Lett, 2013, 4: 338–343. DOI:10.1021/ml300407y |
| [17] | Chaiken I, Rashad AA. Peptide triazole inactivators of HIV-1:how do they work and what is their potential?[J]. Future Med Chem, 2015, 7: 2305–2310. DOI:10.4155/fmc.15.152 |
| [18] | Zhan P, Chen X, Li D, et al. HIV-1 NNRTIs:structural diversity, pharmacophore similarity, and implications for drug design[J]. Med Res Rev, 2013, 33: E1–E72. DOI:10.1002/med.20241 |
| [19] | El AH, Recordonpinson P, Tagajdid R, et al. Drug resistance mutations in HIV type 1 isolates from patients failing antiretroviral therapy in Morocco[J]. AIDS Res Hum Retroviruses, 2012, 28: 944–948. DOI:10.1089/aid.2011.0278 |
| [20] | Sirivolu VR, Vernekar SK, Ilina T, et al. Clicking 3'-azidothymidine into novel potent inhibitors of human immunodeficiency virus[J]. J Med Chem, 2013, 56: 8765–8780. DOI:10.1021/jm401232v |
| [21] | Agarwal HK, Loethan K, Mandal D, et al. Synthesis and biological evaluation of fatty acyl ester derivatives of 2', 3'-didehydro-2', 3'-dideoxythymidine[J]. Bioorg Med Chem Lett, 2011, 21: 1917–1921. DOI:10.1016/j.bmcl.2011.02.070 |
| [22] | Agarwal HK, Chhikara BS, Bhavaraju S, et al. Emtricitabine prodrugs with improved anti-HIV activity and cellular uptake[J]. Mol Pharm, 2013, 10: 467–476. DOI:10.1021/mp300361a |
| [23] | Liu C, Dumbre SG, Pannecouque C, et al. Amidate prodrugs of deoxythreosyl nucleoside phosphonates as dual inhibitors of HIV and HBV replication[J]. J Med Chem, 2016, 59: 9513–9531. DOI:10.1021/acs.jmedchem.6b01260 |
| [24] | Bollini M, Domaoal RA, Thakur VV, et al. Computationally-guided optimization of a docking hit to yield catechol diethers as potent anti-HIV agents[J]. J Med Chem, 2011, 54: 8582–8591. DOI:10.1021/jm201134m |
| [25] | Chan AH, Lee WG, Spasov KA, et al. Covalent inhibitors for eradication of drug-resistant HIV-1 reverse transcriptase:from design to protein crystallography[J]. Proc Natl Acad Sci U S A, 2017, 114: 9725–9730. DOI:10.1073/pnas.1711463114 |
| [26] | Kang D, Fang Z, Li Z, et al. Design, synthesis, and evaluation of thiophene[J]. J Med Chem, 2016, 59: 7991–8007. DOI:10.1021/acs.jmedchem.6b00738 |
| [27] | Kang D, Fang Z, Huang B, et al. Structure-based optimization of thiophene[J]. J Med Chem, 2017, 60: 4424–4443. DOI:10.1021/acs.jmedchem.7b00332 |
| [28] | Wang X, Gao P, Menéndezarias L, et al. Update on recent developments in small molecular HIV-1 RNase H inhibitors (2013-2016):opportunities and challenges[J]. Curr Med Chem, 2017, 24: 1–21. |
| [29] | Vernekar SKV, Liu Z, Nagy E, et al. Design, synthesis, biochemical, and antiviral evaluations of C6 benzyl and C6 biarylmethyl substituted 2-hydroxylisoquinoline-1, 3-diones:dual inhibition against HIV reverse transcriptase-associated RNase H and polymerase with antiviral activities[J]. J Med Chem, 2015, 58: 651–664. DOI:10.1021/jm501132s |
| [30] | Tang J, Liu F, Nagy E, et al. 3-Hydroxypyrimidine-2, 4-diones as selective active site inhibitors of HIV reverse transcriptase-associated RNase H:design, synthesis, and biochemical evaluations[J]. J Med Chem, 2016, 59: 2648–2659. DOI:10.1021/acs.jmedchem.5b01879 |
| [31] | Kankanala J, Kirby KA, Liu F, et al. Design, synthesis and biological evaluations of hydroxypyridone carboxylic acids as inhibitors of HIV reverse transcriptase-associated RNase H[J]. J Med Chem, 2016, 59: 5051–5062. DOI:10.1021/acs.jmedchem.6b00465 |
| [32] | Cao L, Song W, De Clercq E, et al. Recent progress in the research of small molecule HIV-1 RNase H inhibitors[J]. Curr Med Chem, 2014, 21: 1956–1967. DOI:10.2174/0929867321666140120121158 |
| [33] | Masaoka T, Chung S, Caboni P, et al. Exploiting drug-resistant enzymes as tools to identify thienopyrimidinone inhibitors of human immunodeficiency virus reverse transcriptase-associated ribonuclease H[J]. J Med Chem, 2013, 56: 5436–5445. DOI:10.1021/jm400405z |
| [34] | Kawasuji T, Johns BA, Yoshida H, et al. Carbamoyl pyridone HIV-1 integrase inhibitors. 2. Bi-and tricyclic derivatives result in superior antiviral and pharmacokinetic profiles[J]. J Med Chem, 2013, 56: 1124–1135. DOI:10.1021/jm301550c |
| [35] | Xue ZZ, Smith SJ, Métifiot M, et al. 4-Amino-1-hydroxy-2-oxo-1, 8-naphthyridine-containing compounds having high potency against raltegravir-resistant integrase mutants of HIV-1[J]. J Med Chem, 2014, 57: 5190–5202. DOI:10.1021/jm5001908 |
| [36] | Zhao XZ, Smith SJ, Métifiot M, et al. Bicyclic 1-hydroxy-2-oxo-1, 2-dihydropyridine-3-carboxamide-containing HIV-1 integrase inhibitors having high antiviral potency against cells harboring raltegravir-resistant integrase mutants[J]. J Med Chem, 2014, 57: 1573–1582. DOI:10.1021/jm401902n |
| [37] | Raheem IT, Walji AM, Klein D, et al. Discovery of 2-pyridinone aminals:aprodrug strategy to advance a second generation of HIV-1 integrase strand transfer inhibitors[J]. J Med Chem, 2015, 58: 8154–8165. DOI:10.1021/acs.jmedchem.5b01037 |
| [38] | Chen WM, Liu XY. LEDGF/p75:a novel target for anti-HIV therapy and advances in the study of its related inhibitors[J]. Acta Pharm Sin (药学学报), 2009, 44: 953–960. |
| [39] | Christ F, Voet A, Marchand A, et al. Rational design of small-molecule inhibitors of the LEDGF/p75-integrase interaction and HIV replication[J]. Nat Chem Biol, 2010, 6: 442–448. DOI:10.1038/nchembio.370 |
| [40] | Fenwick C, Amad M, Bailey MD, et al. Preclinical profile of BI 224436, a novel HIV-1 non-catalytic-site integrase inhibitor[J]. Antimicrob Agents Chemother, 2014, 58: 3233–3244. DOI:10.1128/AAC.02719-13 |
| [41] | Serrao E, Debnath B, Otake H, et al. Fragment-based discovery of 8-hydroxyquinoline inhibitors of the HIV-1 integrase-lens epithelium-derived growth factor/p75(IN-LEDGF/p75) interaction[J]. J Med Chem, 2013, 56: 2311–2322. DOI:10.1021/jm301632e |
| [42] | Bai RJ, Liu XY. Transactivation of HIV-1 transcription and inhibitors[J]. Acta Pharm Sin (药学学报), 2006, 41: 289–295. |
| [43] | Wang J, Liu XY. Action of protein phosphatase-1 on Tat-dependent HIV-1transcription and its related inhibitors[J]. Acta Pharm Sin (药学学报), 2009, 44: 1343–1347. |
| [44] | Guendel I, Iordanskiy S, Van DR, et al. Novel neuroprotective GSK-3β inhibitor restricts Tat-mediated HIV-1 replication[J]. J Virol, 2014, 88: 1189–1208. DOI:10.1128/JVI.01940-13 |
| [45] | Hamasaki T, Okamoto M, Baba M. Identification of novel inhibitors of human immunodeficiency virus type 1 replication by in silico screening targeting cyclin T1/Tat interaction[J]. Antimicrob Agents Chemother, 2012, 57: 1323–1331. |
| [46] | Cao Y, Liu XY. HIV-1 Rev and related inhibitors[J]. Acta Pharm Sin (药学学报), 2007, 42: 347–351. |
| [47] | Campos N, Myburgh R, Garcel A, et al. Long lasting control of viral rebound with a new drug ABX464 targeting Rev-mediated viral RNA biogenesis[J]. Retrovirology, 2015, 12: 1–15. DOI:10.1186/s12977-014-0129-1 |
| [48] | Berkhout B, van der Velden YU. ABX464:a good drug candidate instead of a magic bullet[J]. Retrovirology, 2015, 12: 1–3. DOI:10.1186/s12977-014-0129-1 |
| [49] | Ammosova T, Platonov M, Ivanov A, et al. 1E7-03, a low MW compound targeting host protein phosphatase-1, inhibits HIV-1 transcription[J]. Br J Pharmacol, 2014, 171: 5059–5075. |
| [50] | Ammosova T, Platonov M, Yedavalli VRK, et al. Small molecules targeted to a non-catalytic "RVxF" binding site of protein phosphatase-1 inhibit HIV-1[J]. PLoS One, 2012, 7: e39481. DOI:10.1371/journal.pone.0039481 |
| [51] | Archin NM, Liberty AL, Kashuba AD, et al. Erratum:administration of vorinostat disrupts HIV-1 latency in patients on antiretroviral therapy[J]. Nature, 2012, 487: 482–485. DOI:10.1038/nature11286 |
| [52] | Tyagi M, Iordanskiy S, Ammosova T, et al. Reactivation of latent HIV-1 provirus via targeting protein phosphatase-1[J]. Retrovirology, 2015, 12: 1–17. DOI:10.1186/s12977-014-0129-1 |
| [53] | Liu JJ, Liu XY. Recent development of HIV protease inhibitor[J]. Chin J New Drug (中国新药杂志), 2006, 15: 247–254. |
| [54] | Ghosh AK, Martyr CD, Osswald HL, et al. Design of HIV-1 protease inhibitors with amino-bis-tetrahydrofuran derivatives as P2-Ligands to enhance backbone-binding interactions:synthesis, biological evaluation, and protein-ligand X-ray studies[J]. J Med Chem, 2015, 58: 6994–7006. DOI:10.1021/acs.jmedchem.5b00900 |
| [55] | Ghosh AK, Chapsal BD, Melinda S, et al. Substituent effects on P2-cyclopentyltetrahydrofuranyl urethanes:design, synthesis, and X-ray studies of potent HIV-1 protease inhibitors[J]. Bioorg Med Chem Lett, 2012, 22: 2308–2311. DOI:10.1016/j.bmcl.2012.01.061 |
| [56] | Ghosh AK, Chapsal BD, Baldridge A, et al. Design and synthesis of potent HIV-1 protease inhibitors incorporating hexahydrofuropyranol-derived high affinity P(2) ligands:structure-activity studies and biological evaluation[J]. J Med Chem, 2011, 54: 622–634. DOI:10.1021/jm1012787 |
| [57] | Ghosh AK, Parham GL, Martyr CD, et al. Highly potent HIV-1 protease inhibitors with novel tricyclic P2 ligands:design, synthesis, and protein-ligand X-ray studies[J]. J Med Chem, 2013, 56: 6792–6802. DOI:10.1021/jm400768f |
| [58] | Ghosh AK, Kulkarni S, Anderson DD, et al. Design, synthesis, protein-ligand X-ray structures and biological evaluation of a series of novel macrocyclic HIV-1 protease inhibitors to combat drug-resistance[J]. J Med Chem, 2011, 52: 7689–7705. |
| [59] | Tie Y, Boross PI, Wang YF, et al. High resolution crystal structures of HIV-1 protease with a potent non-peptide inhibitor (UIC-94017) active against multi-drug-resistant clinical strains[J]. J Mol Biol, 2004, 338: 341–352. DOI:10.1016/j.jmb.2004.02.052 |
| [60] | Bowman MJ, Chmielewski J. Crucial amides for dimerization inhibitors of HIV-1 protease[J]. Bioorg Med Chem Lett, 2004, 14: 1395–1398. DOI:10.1016/j.bmcl.2003.09.099 |
| [61] | Dufau L, Ressurreição ASM, Fanelli R, et al. Carbonylhydrazide-based molecular tongs inhibit wild-type and mutated HIV-1 protease dimerization[J]. J Med Chem, 2012, 55: 6762–6775. DOI:10.1021/jm300181j |
| [62] | Schimer J, Cígler P, Veselý J, et al. Structure-aided design of novel inhibitors of HIV protease based on a benzodiazepine scaffold[J]. J Med Chem, 2012, 55: 10130–10135. DOI:10.1021/jm301249q |
| [63] | Freed EO. HIV-1 assembly, release and maturation[J]. Nat Rev Microbiol, 2015, 13: 484–496. DOI:10.1038/nrmicro3490 |
| [64] | Fontana J, Keller PW, Urano E, et al. Identification of an HIV-1 mutation in spacer peptide 1 that stabilizes the immature CA-SP1 lattice[J]. J Virol, 2016, 90: 972–978. DOI:10.1128/JVI.02204-15 |
| [65] | Li F, Zoumplis D, Matallana C, et al. Determinants of activity of the HIV-1 maturation inhibitor PA-457[J]. Virology, 2006, 356: 217–224. DOI:10.1016/j.virol.2006.07.023 |
| [66] | Li Z, Xu JY, Xie WJ, et al. Advances in research on betulinic acid derivatives as anti-HIV agents[J]. Prog Pharm Sci (药学进展), 2013, 37: 368–375. |
| [67] | Swidorski JJ, Zheng L, Sit SY, et al. Inhibitors of HIV-1 maturation:development of structure-activity relationship for C-28 amides based on C-3 benzoic acid-modified triterpenoids[J]. Bioorg Med Chem Lett, 2016, 26: 1925–1930. DOI:10.1016/j.bmcl.2016.03.019 |
| [68] | Regueiroren A, Zheng L, Yan C, et al. Discovery of BMS-955176, a second generation HIV-1 maturation inhibitor with broad spectrum antiviral activity[J]. ACS Med Chem Lett, 2016, 7: 568–572. DOI:10.1021/acsmedchemlett.6b00010 |
| [69] | Nowicka-Sans BPT, Lin Z, Li Z, et al. BMS-955176:identification and characterization of a second-generation HIV-1 maturation inhibitor with improved potency, anti-viral spectrum and gag polymorphic coverage[J]. Antimicrob Agents Chemother, 2016, 60: 3956–3969. DOI:10.1128/AAC.02560-15 |
| [70] | Zhao Y, Gu Q, Morris-Natschke SL, et al. Incorporation of privileged structures into bevirimat can improve activity against wild-type and bevirimat-resistant HIV-1[J]. J Med Chem, 2016, 59: 9262–9268. DOI:10.1021/acs.jmedchem.6b00461 |
| [71] | Blair WS, Cao J, Fok-Seang J, et al. New small-molecule inhibitor class targeting human immunodeficiency virus type 1 virion maturation[J]. Antimicrob Agents Chemother, 2009, 53: 5080–5087. DOI:10.1128/AAC.00759-09 |
| [72] | Li DY, Zhan P, Liu XY. Recent progress in the development of HIV-1 capsid protein inhibitors[J]. Chin J Med Chem (中国药物化学杂志), 2011, 21: 397–404. |
| [73] | Li ZY, Zhan P, Liu XY. Progress in the study of HIV-1 Vif and related inhibitors[J]. Acta Pharm Sin (药学学报), 2010, 45: 684–693. |
| [74] | Mohammed I, Kummetha IR, Singh G, et al. 1, 2, 3-Triazoles as amide bioisosteres:discovery of a new class of potent HIV-1 vif antagonists[J]. J Med Chem, 2016, 59: 7677–7682. DOI:10.1021/acs.jmedchem.6b00247 |
| [75] | Huang M, Maynard A, Turpin JA, et al. Anti-HIV agents that selectively target retroviral nucleocapsid protein zinc fingers without affecting cellular zinc finger proteins[J]. J Med Chem, 1998, 41: 1371–1381. DOI:10.1021/jm9708543 |
| [76] | Jia YH, Yu Q, Liu XH, et al. Recent progress of inhibitors targeting HIV-1 NCp7[J]. Acta Pharm Sin (药学学报), 2017, 52: 1652–1659. |
| [77] | Garg D, Torbett BE. Advances in targeting nucleocapsid-nucleic acid interactions in HIV-1 therapy[J]. Virus Res, 2014, 193: 135–1343. DOI:10.1016/j.virusres.2014.07.004 |
| [78] | Hartman TL, Yang L, Helfrick AN, et al. Preclinical evaluation of a mercaptobenzamide and its prodrug for NCp7-targeted inhibition of human immunodeficiency virus[J]. Antiviral Res, 2016, 134: 216–225. DOI:10.1016/j.antiviral.2016.08.022 |
| [79] | Sosic A, Frecentese F, Perissutti E, et al. Design, synthesis and biological evaluation of TAR and cTAR binders as HIV-1 nucleocapsid inhibitors[J]. Med Chem Comm, 2013, 4: 1388–1393. DOI:10.1039/c3md00212h |
| [80] | Frecentese F, Sosic A, Saccone I, et al. Synthesis and in vitro screening of new series of 2, 6-dipeptidyl-anthraquinones:influence of side chain length on HIV-1 nucleocapsid inhibitors[J]. J Med Chem, 2016, 59: 1914–1924. DOI:10.1021/acs.jmedchem.5b01494 |
| [81] | Sancineto L, Mariotti A, Bagnoli L, et al. Design and synthesis of diselenobisbenzamides (DISeBAs) as nucleocapsid protein 7(NCp7) inhibitors with anti-HIV activity[J]. J Med Chem, 2015, 58: 9601–9614. DOI:10.1021/acs.jmedchem.5b01183 |
| [82] | Zhang J, Liu X, De Clercq E. Capsid (CA) protein as a novel drug target:recent progress in the research of HIV-1 CA inhibitors[J]. Mini Rev Med Chem, 2009, 9: 510–518. DOI:10.2174/138955709787847958 |
| [83] | Machara A, Lux V, Kozisek M, et al. Specific inhibitors of HIV capsid assembly binding to the C-terminal domain of the capsid protein:evaluation of 2-arylquinazolines as potential antiviral compounds[J]. J Med Chem, 2016, 59: 545–558. DOI:10.1021/acs.jmedchem.5b01089 |
 2018, Vol. 53
2018, Vol. 53


