2. 浙江省食品药品检验研究院, 浙江 杭州 310052
2. Zhejiang Institute for Food and Drug Control, Hangzhou 310052, China
乳腺癌是女性最常见的恶性肿瘤之一, 在女性癌症患者中的病死率位列第二, 且人群有逐步年轻化的趋势[1, 2]。目前化疗仍是治疗乳腺癌并防止其术后复发的主要手段之一, 但肿瘤细胞对化疗药物产生耐药是肿瘤化疗失败的主要原因, 也是影响临床肿瘤患者预后的重要因素[3]。
针对肿瘤多药耐药(multidrug resistance, MDR)的产生过程, 应用MDR逆转剂是解决肿瘤MDR的主要手段。目前肿瘤MDR逆转剂的相关报道较多[4], 环孢菌素A、异搏定等已进入临床研究, 但逆转效果不明显且临床使用禁忌症多, 毒副作用大[5]。而细胞实验、动物实验和临床实践均发现许多中药单味药及复方表现出良好的逆转肿瘤耐药性、增强化疗药物疗效并降低毒性的作用[6-9]。
薏苡仁脂是我国具有自主知识产权的新型广谱抗肿瘤中药有效成分, 对正常组织毒性小, 安全性大; 本身具有一定的抗肿瘤作用, 临床上常与卡铂、多西他赛、吉西他滨等化疗药物合用以增加化疗敏感性及降低毒性[10, 11]。尽管研究薏苡仁脂逆转效果的报道很多[12], 但其逆转耐药的机制尚未明确, 且大部分局限于对肿瘤细胞的蛋白表达量的研究, 如ATP结合盒(ATP-binding cassette, ABC)转运蛋白包括P-糖蛋白(P-glycoprotein, P-gp/ABCB1)、多药耐药相关蛋白1 (multidrug resistance-associated protein 1, MRP1/ ABCC1)以及乳腺癌耐药蛋白(breast cancer resistance protein, BCRP/ABCG2)介导的增强化疗药物外排作用。ABC转运家族蛋白通过ATP结合或水解为各种药物从细胞质转运到细胞外提供能量, ABCG2、ABCC1、ABCB1都是ABC转运蛋白家族成员, 其在肿瘤细胞中的过表达与肿瘤细胞对多种化疗药物的耐药相关。
目前研究ABC蛋白外排功能的方法多是采用ABC蛋白底物罗丹明等荧光物质, 在不同时间点测定罗丹明的流出情况[13], 无法实时动态的进行, 特别是无法应用到体内。因此寻找一种体内外均能特异性地实时分析肿瘤细胞内ABC转运子底物的动力学过程非常重要。
大量研究发现D-荧光素钾是ABC转运子的特异性底物, 其在肿瘤细胞内的动力学(pharmacokinetics, PK)直接和ABC转运子“药泵”活性相关, 且其进出肿瘤细胞的方式与小分子化疗药物也极为相似, 可作为反映肿瘤细胞药物外排的有效探针[14]。同时D-荧光素钾也是萤火虫荧光素酶的特异性底物, 当其进入肿瘤细胞内, 可被事先构建入肿瘤胞内的荧光素酶氧化, 激发相等摩尔量的光子, 由于荧光素酶仅构建于肿瘤细胞内, 因此利用该方法可以实时定量地表征肿瘤细胞内ABC转运子底物的物质量, 可以特异性地体内外实时分析肿瘤细胞内ABC转运子底物的动力学过程[15, 16]。
因此, 本文中采用过表达荧光素酶报告基因的乳腺癌耐药细胞系为研究对象, 采用基于细胞水平的生物发光成像技术(bioluminescence imaging, BLI)研究薏苡仁脂对耐药细胞ABC蛋白外排功能的影响, 并结合常用的q-PCR和Western blot技术同步研究薏苡仁脂对耐药细胞中ABC耐药蛋白表达量的影响, 双管齐下研究薏苡仁脂逆转耐药乳腺癌MDR的机制。
材料与方法材料与试剂 人乳腺癌耐药细胞株MCF-7/DOX, 四川大学高会乐教授赠送; 多柔比星(DOX, 海正辉瑞制药公司); 薏苡仁脂(康莱特注射液, 1412241-2, 浙江康莱特药业有限公司); 0.25%胰蛋白酶、DMEM培养液、青/链霉素(P/S) (Gibco公司); 新生牛血清(FBS, Bioind公司); D-荧光素钾(Science Light公司); MTT (Sigma公司); ABCB1、ABCC1、ABCG2和GAPDH一抗、二抗(Abcam公司); BCA试剂盒(碧云天公司)。
主要仪器 IVIS小动物活体成像系统(美国Xenogen公司); 自动酶标仪(美国Thermo公司); 荧光定量PCR仪(德国Effendorf公司); 数显式稳压稳流电泳仪、凝胶成像仪(美国BIO-RAD公司)。
细胞培养 将MCF-7/DOX细胞用含1% P/S和10% FBS的DMEM培养基在37 ℃、5% CO2培养箱中培养, 每1~2天换液, 当细胞生长至80%~90%丰度时, 用酶消化法进行传代。每月需加入2 μg·mL-1 DOX培养1次以维持其耐药性, 实验检测前1周需撤药。
稳转MCF-7/DOXFluc细胞株构建 取对数生长期的MCF-7/DOX细胞胰酶消化, 用DMEM (10% FBS, 无P/S)培养基制成细胞悬液, 每孔5 000个细胞滴加于96孔板中, 培养过夜。弃去上清液, 每孔按所需的感染复数(multiplicity of infection, MOI)加入已稀释的携带萤火虫荧光素酶报告基因或携带绿色荧光蛋白(green fluorescent protein, GFP)的慢病毒液100 μL。加入polybrene使每孔的终质量浓度为5 μg·mL-1。转染8~12 h后将细胞置于显微镜下观察细胞生长状态和数量, 并更换常规培养基。培养2~3天后, 对于携带GFP慢病毒液感染的细胞置于荧光显微镜下选择蓝色激发光激发观察胞内绿色荧光的表达; 对于携带萤火虫荧光素酶报告基因慢病毒液感染的细胞则加入D-荧光素钾采用酶标仪检测发光响应值。
最佳感染MOI值的筛选 操作同稳转MCF-7/DOXFluc细胞株构建实验, 只需设置成不同的MOI值组, 分别为0、10、20、40、60和80。
非饱和底物浓度和最适细胞数量的选择 ①取对数生长期细胞, 经胰酶消化后制成单细胞悬液, 每孔加入2×104个细胞于96孔板, 常规培养过夜。精密称取D-荧光素钾, 用PBS稀释成0、2.5、5、10、20、50和100 μg·mL-1系列质量浓度的底物工作液。弃上清, 每孔加入底物工作液100 μL, 立即置于酶标仪, 曝光30 s, 检测各孔发光响应值。②将对数生长期的MCF-7/DOXFluc细胞制成不同浓度的细胞悬液, 每孔100 μL均匀滴加于96孔板中, 常规培养过夜。检测前每孔加入100 μg·mL-1 D-荧光素钾溶液, 立即置于酶标仪, 曝光30 s, 检测各孔发光响应值。
活细胞BLI值测定 取对数生长期细胞按每孔1×104个接种于96孔黑色底透板中, 常规培养过夜。药物组各孔加入不同质量浓度薏苡仁脂(1、5、10和20 mg·mL-1), 对照组各孔加入等量培养液, 每组设6个复孔, 转入培养箱中继续培养24和48 h。弃含药培养液, 每孔加入D-荧光素钾(10 μg·mL-1)培养液100 μL。迅速放入IVIS小动物活体成像系统, 每次检测曝光2 min, 每隔5 min检测1次, 记录90 min内BLI信号。采用BCA法测定各组蛋白浓度, 然后将各时间点BLI信号以各组蛋白浓度平均化, 即得各处理组的相对生物发光信号值BLIrel。采用Winnolin5.2药动学软件绘制BLIrel与时间的关系图, 按照非隔室模型方法, 求算不同浓度薏苡仁脂处理不同时间后D-荧光素钾在胞内的动力学参数。
q-PCR 收集经不同质量浓度薏苡仁脂(0、1和10 mg·mL-1)处理48 h的MCF-7/DOXFluc细胞, 加入1 mL Trizol裂解细胞, 再加入0.2 mL三氯甲烷提取RNA, 4 ℃、12 000 ×g离心15 min。小心吸取上清液加入等体积的异丙醇, 剧烈震荡后, 室温静置15 min, 4 ℃、12 000 ×g离心10 min。弃去上清液, 加入1 mL 75%乙醇清洗2次, 4 ℃、7 500 ×g离心10 min。弃上清, 留少量液体于室温下挥干即得RNA。按照反转录和q-PCR试剂盒进行后续实验操作。
Western blot[17] 收集经不同质量浓度薏苡仁脂(0、1和10 mg·mL-1)处理48 h的MCF-7/DOXFluc细胞, 加入细胞裂解液, 置于冰上振摇30 min, 4 ℃、12 000 ×g离心15 min, 取上清液。蛋白定量后各组分别取50 μg蛋白与5× SDS上样缓冲液混匀, 100 ℃煮沸5 min。经8% SDS-PAGE电泳分离, 电转移至PVDF膜上, 5%脱脂奶粉室温封闭1 h, 分别加入ABCB1、ABCC1和ABCG2一抗, 4 ℃孵育过夜, 相应二抗室温孵育2 h, TBST缓冲液洗涤3次, 每次5 min, 显影, 暗室曝光并分析蛋白表达水平。
MTT法检测细胞生长[18] 取对数生长期MCF-7/ DOX细胞, 以每孔1.5×104个细胞接种于96孔板中, 常规培养过夜。DOX设置不同的浓度梯度, 薏苡仁脂的浓度根据DOX的浓度按25:1、50:1、100:1和200:1的比例调整, 对照组各孔加入相同浓度溶剂, 每个浓度设6个复孔, 转入培养箱中继续培养48 h。弃去含药培养液, PBS轻洗2次, 每孔加入MTT (0.5 mg·mL-1)培养液100 μL, 4 h后弃去上清, 每孔加入二甲基亚砜100 μL, 震荡10 min。以空白组调零, 490 nm处测定各孔吸光度(OD值)。计算肿瘤细胞增殖率及IC50。
统计学分析 实验数据以x±s表示, 应用SPSS 17.0统计软件分析, 采用方差分析比较多组间均数, t检验比较两组间均数。以P<0.05表示有显著性差异。
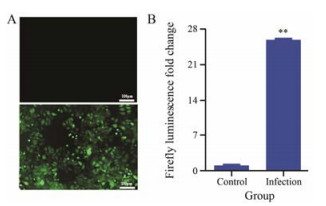
结果 1 稳转MCF-7/DOXFluc细胞株构建病毒感染组在荧光显微镜下可明显观察到细胞内含有绿色荧光(图 1A), BLI响应值结果显示病毒感染组萤火虫荧光素酶表达量是空白组的25.93倍(P<0.01, 图 1B), 说明使用慢病毒感染的方式可以成功转染MCF-7/DOX细胞株。
|
Figure 1 Expression of green fluorescent protein and firefly luciferase in MCF-7/DOXFluc. A: GFP expression; B: Firefly luciferase expression. n = 6, x±s. **P < 0.01 vs control |
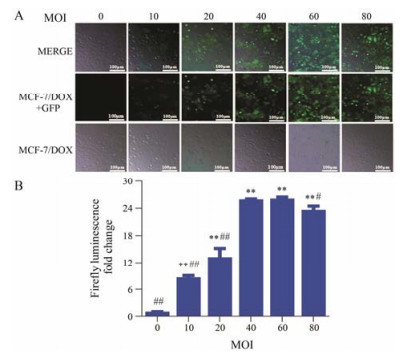
如图 2A所示, 荧光显微镜下观察到细胞内的绿色荧光随着MOI增大明显增加, MOI为40时已有90%以上细胞转染成功。BLI响应值结果基本满足上述规律(图 2B), 由于慢病毒对于细胞有一定的毒性, 随着MOI值的增加, 所加入的慢病毒越多, 对细胞的毒性作用也越强, 故综合考虑选择MOI为40为最佳感染值。
|
Figure 2 Expression of green fluorescent protein (GFP) and firefly luciferase in MCF-7/DOXFlucafter infection with different multiplicity of infection (MOI). A: GFP expression; B: Firefly luciferase expression. n = 6, x±s. **P < 0.01 vs control (MOI 0); #P < 0.05, ##P < 0.01 vs MOI 40 |
在荧光素底物不饱和条件下, D-荧光素钾浓度与发光响应值呈线性相关, y = 2.123x + 5.903 (R2 = 0.947, 0~20 μg·mL-1)。细胞数量与发光响应值呈线性相关, y = 0.002x + 1.081 (R2 = 0.999, 0~2×104个)。说明实验选用10 μg·mL-1 D-荧光素钾和每孔104个细胞数量控制在D-荧光素钾的非饱和浓度范围中。
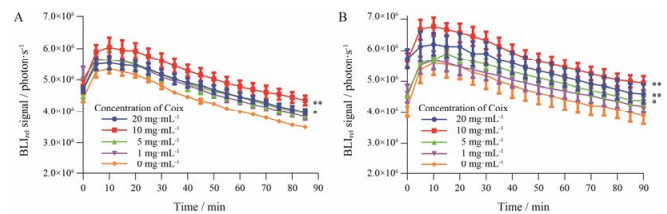
4 活细胞BLI值测定不同浓度薏苡仁脂处理细胞24 h后, 与对照组相比, 10 mg·mL-1薏苡仁脂组能明显延缓胞内D-荧光素钾的消除(P<0.01), 20 mg·mL-1薏苡仁脂组能延缓胞内D-荧光素钾的消除(P<0.05, 图 3A)。不同浓度薏苡仁脂处理细胞48 h后, 与对照组相比, 10和20 mg·mL-1薏苡仁脂组均能明显延缓胞内D-荧光素钾的消除(P<0.01), 5 mg·mL-1薏苡仁脂组能延缓胞内D-荧光素钾的消除(P<0.05, 图 3B)。不同浓度的薏苡仁脂处理24及48 h后, 消除速率常数Kluc随薏苡仁脂浓度升高表现出先降低后升高的趋势, 但均低于对照组, 表明薏苡仁脂处理细胞后, 荧光素从细胞内流出减慢; 药时曲线下面积AUCluc随薏苡仁脂浓度升高表现出先增大后减小, 但均高于对照组, 可见薏苡仁脂促进了细胞对D-荧光素钾的摄取, 使胞内累积量增加(表 1)。
|
Figure 3 Relative bioluminescence imaging (BLIrel) signal photon-time curve of MCF-7/DOXFluc after treatment with different concentration of Coix. A: Treatment with Coix for 24 h; B: Treatment with Coix for 48 h. n = 6, x±s. *P < 0.05, **P < 0.01 vs control (Coix 0 mg·mL-1) |
| Table 1 Fluorescence excretion pharmacokinetic parameters. n = 6, x±s. *P < 0.05, **P < 0.01 vs 0 mg·mL-1 Coix |
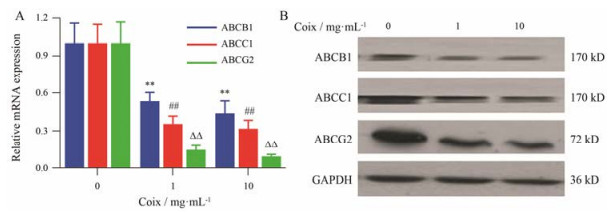
q-PCR检测结果表明, 与对照组相比, 药物组可明显下调ABCG2、ABCC1和ABCB1基因的表达(图 4A)。Western blot检测结果表明, 与对照组相比, 药物组可明显下调ABCG2蛋白表达, 同时下调ABCC1和ABCB1蛋白的表达(图 4B)。提示薏苡仁脂逆转肿瘤细胞耐药性与其影响肿瘤细胞耐药蛋白的活性相关, 各耐药蛋白活性减弱, 与荧光素流出减少的结论相一致。
|
Figure 4 Expression of drug-resistant genes and proteins (P-glycoprotein, multidrug resistance-associated protein 1 and breast cancer resistance protein) in MCF-7/DOXFluc cells after treatment with Coix. A: Drug-resistant genes expression; B: Drug-resistant proteins expression. n = 3, x±s. **P < 0.01 vs control (ABCB1); ##P < 0.01 vs control (ABCC1); △△P < 0.01 vs control (ABCG2) |
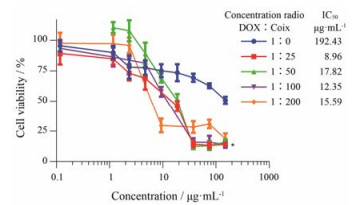
不同药物处理MCF-7/DOX细胞48 h后, 联合用药组DOX的IC50小于单用DOX组(P<0.05), 说明薏苡仁脂可增强DOX抑制耐药乳腺癌细胞增殖的作用, 根据DOX的IC50值, 其较佳联合比例为DOX:薏苡仁脂= 1:25 (图 5)。
|
Figure 5 Cell proliferation of MCF-7/DOXfor 48 h after treatment with different drugs. n = 6, x±s. *P < 0.05 vs control (1:0) |
BLI具有操作简便, 结果直观, 灵敏度高的特点。这种方法在体内同样可以得到运用。作者应用生物发光成像探讨ABC蛋白对D-荧光素钾外排影响, 说明D-荧光素钾作为标志物检测薏苡仁脂对肿瘤细胞耐药相关蛋白活性的影响。荧光素酶的发光不需要激发光, 只需要底物荧光素。荧光素在ATP和氧气的存在下, 氧化成氧化荧光素的同时产生光子, 生成一个信号。Rudin等[19]研究发现荧光素酶的发光强度同标记的细胞的数量呈正比, 当酶浓度有一定范围和底物达到饱和时, 可以认为只与荧光素酶量直接相关, 即发光强度与标记细胞的数目呈线性相关, 而在荧光素钾浓度不饱和时, 生物发光信号光子量与荧光素钾浓度呈正相关。检测的BLI值是在荧光素钾浓度变化的线性范围内, 所以BLI值可以代表胞内荧光素钾的浓度。只有在荧光素钾浓度不饱和时, 生物发光信号光子量与荧光素钾的外排才会呈正相关, 本文中线性范围为0~20 μg·mL-1, 当测定荧光素钾的外排时, 需要采用不饱和浓度即线性范围内的浓度。而当计算到底有多少被转染的细胞时, 需要加入过饱和的荧光素钾, 这样才能确保所有被转染的细胞都被测定到, 即当底物浓度达到过饱和浓度时, 发光值只与细胞数量有关, 而与加入的D-荧光素钾浓度无关。
有研究表明D-荧光素是萤火虫荧光素酶的内源性底物, 是ABCG2转运蛋白的专一性基质。抑制ABCG2转运蛋白活性就能够阻止D-荧光素的流出, 增加胞内D-荧光素浓度从而增强生物发光信号; D-荧光素在过表达ABCG2的肿瘤细胞亚系中累积显著低于亲代肿瘤细胞[20, 21]。本研究中发现薏苡仁脂能明显减少耐药乳腺癌细胞对D-荧光素钾的外排, 增加胞内累积量, 说明薏苡仁脂能够降低耐药蛋白活性。
国内外研究证明薏苡仁脂可以抑制肿瘤多药耐药基因和蛋白的表达, 与化疗药物联合使用可提高肿瘤细胞对化疗药物的敏感性, 逆转多药耐药性[22-24]。q-PCR和Western blot结果显示, 薏苡仁脂处理组MCF-7/DOXFluc细胞中ABCG2、ABCC1和ABCB1的基因水平得以下调, 蛋白量降低。因此, 薏苡仁脂逆转耐药乳腺癌细胞对多柔比星MDR的作用, 可能是通过抑制ABC转运蛋白的外排功能和下调ABC转运蛋白在肿瘤细胞上的表达水平双重作用的结果。
| [1] | Siegel RL, Miller KD, Jemal A, et al. Cancer statistics, 2017[J]. CA Cancer J Clin, 2017, 67: 7–30. DOI:10.3322/caac.21387 |
| [2] | Dong AP, Han LH. Progress in measurement scale of quality of life for patients with breast cancer and its application[J]. Tumor (肿瘤), 2017, 37: 107–116. |
| [3] | Ji H, Wang BG. The research progress on breast cancer resistance protein (BCRP/ABCG2)[J]. Anti-tumor Pharm (肿瘤药学), 2013, 3: 326–330. |
| [4] | Grim J, Jandìk P, Slánská I, et al. Low expression of NQO1 predicts pathological complete response to neoadjuvant chemotherapy in breast cancer patients treated with TAC regimen[J]. Folia Biol, 2012, 58: 185–192. |
| [5] | Baguley BC. Multi-drug resistance in cancer[J]. Meth-ods Mol Biol, 2010, 596: 1–14. DOI:10.1007/978-1-60761-416-6 |
| [6] | Tang T, Dong W, Zhang J, et al. Research progress on Chinese materia medica monomers reversing multidrug resistance of tumor cells[J]. Chin Tradit Herb Drugs (中草药), 2017, 48: 792–797, 846. |
| [7] | He LL, Gu KB. Mechanism of Rhizoma Pinelliae extracts against malignant tumor[J]. China J Tradit Chin Med Pharm (中华中医药杂志), 2017, 32: 685–687. |
| [8] | Li XP, Feng ZQ, Shi XP, et al. Experimental study of evodiamine on reversing multidrug resistance of K562/Adr cells[J]. Chin Tradit Herb Drugs (中草药), 2016, 47: 2123–2129. |
| [9] | Li L, Dong Y, Wang L, et al. Preliminary study of the effects of β-elemene on breast cancer stem cells in cell line MCF-7/ADM[J]. Chin Clinic Oncol (临床肿瘤学杂志), 2013, 18: 683–687. |
| [10] | Huang QD, Zheng L, Chen D, et al. Bioavailability and pharmacokinetics of nanoparticles of Coix seed oil[J]. Chin Pharm J (中国药学杂志), 2016, 51: 40–45. |
| [11] | Yao DJ. Clinical efficacy and safety of Kanglaite combined with gemcitabine and cisplatinum chemotherapy in the treatment of advanced non-small cell lung cancer[J]. Chin J Clin Pharmacol (中国临床药理学杂志), 2015, 31: 1494–1496. |
| [12] | Liu MJ, Qu D, Chen Y, et al. Study on preparation of butyryl galactose ester-modified Coix component microemulsions and their anticancer activity in vitro[J]. Chin Tradit Herb Drugs (中草药), 2015, 46: 2696–2702. |
| [13] | Lara FA, Pohl PC, Gandara AC, et al. ATP binding cassette transporter mediates both heme and pesticide detoxification in tick midgut cells[J]. PLoS One, 2015, 10: e0134779. DOI:10.1371/journal.pone.0134779 |
| [14] | Huang R, Vider J, Serganova I, et al. ATP-binding cassette transporters modulate both coelenterazine-and D-luciferin-based bioluminescence imaging[J]. Mol Imaging, 2011, 10: 215–216. |
| [15] | Zhang Y, Bressler JP, Neal J, et al. ABCG2/ABCG2 expression modulates D-Luciferin based bioluminescence imaging[J]. Cancer Res, 2007, 67: 9389–9397. DOI:10.1158/0008-5472.CAN-07-0944 |
| [16] | Close DM, Hahn RE, Patterson SS, et al. Comparison of human optimized bacterial luciferase, firefly luciferase, and green fluorescent protein for continuous imaging of cell culture and animal models[J]. J Biomed Opt, 2011, 16: 047003. DOI:10.1117/1.3564910 |
| [17] | Wang M, Cui HX, Sun C, et al. Effect of lupeol on mi-gration and invasion of human breast cancer MDA-MB-231 cells and its mechanism[J]. Acta Pharm Sin (药学学报), 2016, 51: 558–562. |
| [18] | Li N, Shan YY, Wu DZ, et al. Antimetastatic effects of cordycepin and its molecular mechanism in human hepatoma MHCC97H cells in vitro and in vivo[J]. Acta Pharm Sin (药学学报), 2017, 52: 1117–1121. |
| [19] | Rudin D, Li L, Niu N, et al. Gemcitabine cytotoxicity:interaction of efflux and deamination[J]. J Drug Metab Toxicol, 2011, 2: 1–10. |
| [20] | Jemal A, Siegel R, Ward E, et al. Cancer statistics, 2009[J]. Ca Cancer J Clinic, 2009, 59: 225–249. DOI:10.3322/caac.20006 |
| [21] | Long J, Zhang Y, Yu X, et al. Overcoming drug resistance in pancreatic cancer[J]. Expert Opin Ther Targets, 2011, 15: 817–828. DOI:10.1517/14728222.2011.566216 |
| [22] | Qu D, Wang L, Liu M, et al. Oral nanomedicine based on multicomponent microemulsions for drug-resistant breast cancer treatment[J]. Biomacromolecules, 2017, 18: 1268–1280. DOI:10.1021/acs.biomac.7b00011 |
| [23] | Lv PT, Zhou K, Wang Y, et al. Effect of Kanglaite injection associated with Cisplatin in lung adnocarcinoma cells A549[J]. Chin Tradit Patent Med (中成药), 2011, 33: 393–396. |
| [24] | Lv PT, Xiao J, Zhou K, et al. Mechanism research on the reversion of multidrug resistance in lung carcinoma cells A549 treated by Coix lacryma-Jobi injection[J]. Chin General Pract (中国全科医学), 2010, 13: 2956–2958. |
 2018, Vol. 53
2018, Vol. 53


