2. 中国医学科学院神经科学中心, 北京协和医学院药物研究所, 天然药物活性物质与功能国家重点实验室, 北京 100050
2. State Key Laboratory of Bioactive Substances and Functions of Natural Medicines, Institute of Materia Medica, Neuroscience Center, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
人参(Panax ginseng C. A. Mey.)来源于五加科多年生草本植物人参的根茎, 其具有广谱的药理活性[1, 2]。人参能滋补强身, 调节中枢神经系统, 改善心脏和肾脏功能, 增强机体的免疫功能, 抗癌抗氧化。人参皂苷Rg1是人参中主要的活性成分之一, 它的甾体皂苷结构与固醇类激素具有相似性, 具有多种药理活性, 涉及消化、神经、内分泌及免疫等多系统。肝病是一种严重的世界性疾病[3], 它可能由许多因素所致, 包括肝炎病毒、化学物质(酒精和药物等)、代谢紊乱和胆汁淤积等。因为肝脏是机体内最重要的代谢性和解毒性器官, 受代谢性毒性损伤较其他组织器官更为严重[4]。如今, 许多肝保护药已被广泛使用, 但其中一些具有潜在的不利影响。从传统的中草药中提取的天然产物作为肝脏疾病的有效和安全的替代疗法, 现已备受关注。人参皂苷Rg1有显著的肝保护作用, 可以作为很好的抗炎剂、抗凋亡剂和抗氧化剂[5]。近年来, 多项研究已经对人参皂苷Rg1在多种肝脏损伤模型和肝纤维化模型中的药理作用进行研究。本文就人参皂苷Rg1在各种肝损伤和肝纤维化模型中的保护作用及分子机制做一综述。
1 人参皂苷Rg1对化学物质诱导的肝损伤和肝纤维化模型的作用 1.1 酒精性肝损伤模型现今社会酗酒现象越来越严重, 由于饮酒导致的各类急慢性酒精中毒、酒精性脂肪肝、酒精性肝炎(alcoholic hepatitis, AH)、肝硬化甚至肝癌等疾病, 严重危害了人类健康[6]。大量饮酒后, 血液中的乙醇浓度明显升高, 肝脏乙醇的氧化代谢异常, 产生大量的活性氧自由基, 引起线粒体和脂质过氧化, 致使肝组织严重受损。另外, 乙醇代谢过程伴有乙醛的产生, 而乙醛是一种毒性物质, 其会引发肝脏能量代谢紊乱等。乙醛等代谢物和肠源性的脂多糖(lipopolysaccharide, LPS)介导的炎症因子“瀑布效应”的释放, 加重肝细胞坏死。目前普遍认为酒精导致的肝损伤最主要机制是氧化应激产生的自由基导致肝损伤[7-9]及炎症反应。
1.1.1 酒精诱导的肝损伤酒精性肝病(alcoholic liver disease, ALD)是一种全球性疾病[10], 而我国ALD仅次于病毒性肝炎, 因而迫切需要一种既可防治ALD又无毒副作用的药物。人参皂苷Rg1是一种皂苷单体, 来源于传统补益药人参。通过HepG2和PC12细胞系检测不同浓度人参皂苷Rg1的毒性作用, 结果显示Rg1无体外毒副作用, 体内实验也显示Rg1能提高酒精诱导的肝损伤小鼠的生存率, 从侧面验证人参皂苷Rg1无毒副作用[11]。因而, 以上研究结果间接说明人参皂苷Rg1是安全有效的。本实验室[12]已证实人参皂苷Rg1抗乙醇加速四氯化碳(CCl4)诱导的大鼠肝纤维化, 增强抗氧化酶的活性以减轻脂质过氧化水平, 还可抑制α平滑肌肌动蛋白(alpha smooth muscle actin, α-SMA)的表达, 这种改善作用与Rg1促进核因子红系2相关因子2 (nuclear factor erythroid 2 related factor 2, Nrf2)核易位和Nrf2下游基因的表达相关。
此外, 人参皂苷Rg1在酒精性肝炎模型中能有效地降低异常升高的血清生化指标, 减轻线粒体嵴断裂膜破坏, 缓解肝脏损伤等病理改变, 显著提高酒精造模小鼠生存率[13]。糖皮质激素与其受体结合通过抑制转录因子-κB (nuclear factor-κB, NF-κB)活性而抵抗炎症作用。而糖皮质激素受体的拮抗剂RU486 (米非司酮)[14, 15]可以竞争性拮抗人参皂苷Rg1或地塞米松的抗炎作用, 这证明Rg1可能是糖皮质激素受体的配体[13]; 并进一步证实人参皂苷Rg1可促进糖皮质激素受体(glucocorticoid receptor, GR)入核来抑制NF-κB信号通路的激活及其下游靶基因肿瘤坏死因子α (tumor necrosis factor-alpha, TNF-α)和白细胞介素(interleukin, IL)-1β等炎性因子转录, 从而发挥抗炎护肝的作用。另外, 人参皂苷Rg1抗酒精性肝炎还与toll样受体4 (toll-like receptor 4, TLR4)信号通路相关。
1.1.2 NIAAA造模法诱导的肝损伤NIAAA造模法是一种新型的造模方式, 用Lieber-DeCarli酒精液体饲料饲养鼠, 很好地模拟了人类每日饮食饮酒的习惯, 诱发的ALD更类似于人类酒精性肝炎的发病机制[16]。该模型可引发较为严重的肝损伤, 主要表现为模型鼠血清生化指标AST、ALT等的异常升高, 肝脂质积聚及活性氧簇(reactive oxygen species, ROS)过度释放。Gao等[11]研究人员发现, 在此模型中, 给予人参皂苷Rg1之后可有效地逆转酒精饲料带来的肝损伤, 并进一步研究发现人参皂苷Rg1可能是潜在的Nrf2信号通路激活剂, 能够阻止酒精诱导的肝损伤; 还可通过调控腺苷单磷酸激活蛋白激酶(adenosine monophosphate activated protein kinase, AMPK)信号通路促进肝能量代谢活动, 包括促进脂质的形成和β氧化降解过程, 发挥护肝作用。在病理情况下, 人参皂苷Rg1主要表现为降低甘油三酯(triglycerides, TG)水平, 并下调与脂肪细胞分化相关的过氧化物酶体增殖物激活受体γ (PPARγ)、胆固醇调节元件结合蛋白1 (SREBP1)和脂肪酸合成酶(FAS)的蛋白表达水平, 提高肝激酶B1 (LKB1)、AMPK的水平[11], 以改善肝功能。
1.2 CCl4诱导的肝损伤和肝纤维化CCl4诱导的肝损伤和肝纤维化模型是一种经典的模型。随着学术的深入探索, 提出肝纤维化是可以逆转的观点[17], 这对于防治肝硬化和肝癌具有重要意义。近年来, 天然产物在肝脏保护的作用越来越备受关注。人参皂苷Rg1可抑制CCl4诱导的急性肝功能衰竭(acute liver failure, ALF)模型中TNF-α、IL-6和IL-1β等炎性因子生产, 从而抑制肝细胞凋亡, 显著减轻ALF病变, 缓减肝纤维化的发展进程, 这些可能与NF-κB p65 DNA结合活性和表达相关[18]。人参皂苷Rg1可增强机体抗氧化和抗炎能力, 抑制过氧化物酶(myeloperoxidase, MPO)、丙二醛(malonaldehyde, MDA)、TNF-α、IL-6和一氧化氮(nitric oxide, NO)的产生, 而缓减CCl4诱导肝毒性; 并且与模型组相比, Rg1治疗组NF-κB p65、AMPK和(silent information regulator 1, Sirt1)的表达受抑制[19]。另外, 人参皂苷Rg1减轻肝组织学异常和线粒体病变[20]; 降低小鼠肝组织金属蛋白酶组织抑制剂-1 (tissue inhibitor of metalloproteinase-1, TIMP-1)和I型胶原的mRNA水平, 抑制TIMP-l表达[21], 显著降低相关胶原蛋白的产生, 减少细胞外基质(extracellular matrix, ECM)过度沉积增加。人参皂苷Rg1可能通过Keap1-Nrf2-ARE信号通路抵抗CCl4诱导的大鼠肝纤维化[12]。
1.3 硫代乙酰胺诱导的肝损伤和肝纤维化人参皂苷Rg1也能改善硫代乙酰胺(thioacetamide, TAA)诱导的大鼠肝损伤的症状, 有效地降低血清中纤维化指标透明质酸(hyaluronic acid, HA)、血清Ⅲ型前胶原(serum precollagen-Ⅲ, pCⅢ)和层粘连蛋白(laminin, LN)及转氨酶水平, 减少鼠肝中硫代巴比妥酸活性底物含量。肝星形细胞(hepatic stellate cells, HSCs)在肝纤维化过程中起重要作用。在培养的肝星形细胞中, 人参皂苷Rg1显著抑制血小板衍生生长因子-BB (platelet-derived growth factor-BB, PDGF-BB)刺激的活性氧形成和细胞增殖与活化。此外, 人参皂苷Rg1通过降低NF-κB活性来下调血小板衍生生长因子受体(platelet-derived growth factor receptor, PDGFR)-β的表达[22]。已有研究证明, 在HSCs的PDGFR-β启动子活性中, NF-κB信号扮演了重要角色[23]。这些结果也表明, 人参皂苷Rg1具有抗氧化和抗肝纤维化作用。总之, 人参皂苷Rg1抗肝纤维化的主要机制: ①增强机体抗氧化和抗炎能力以减轻肝组织学异常和线粒体病变; ②促进核酸及蛋白质的合成以修复肝损伤; ③抑制胶原蛋白大量生成以防止细胞外基质过度沉积。
1.4 药物导致的肝损伤 1.4.1 顺铂诱发的肝损伤顺铂(cisplatin)是目前国内外临床应用于治疗实体瘤的一种首选肿瘤化疗药物。但顺铂对多个器官具有毒副作用, 尤其是消化系统、肝、肾和耳, 这在很大程度上限制了顺铂在临床上的应用。由于顺铂毒副作用造成患者治疗困难、病死率高, 因而急需预防顺铂引起的毒副作用以保证肿瘤化疗的有效治疗[24, 25]。类似于酒精造成的损害, 顺铂在机体内产生大量的自由基, 启动氧化应激损伤, 导致肝脏受损, 肝功能失调, 转氨酶水平升高, 抗氧化酶异常。在顺铂诱发的小鼠肝损伤中, 人参皂苷Rg1能减轻顺铂导致的氧化应激损伤, 使氧化和抗氧化处于动态平衡, 阻断顺铂的氧化损伤[26]。具体机制如下: Rg1有效降低顺铂所致转氨酶水平, 上调抗氧化酶(GSH和GSH-PX)和降低异常升高的MDA和MPO来保护受损肝细胞; Rg1可抑制顺铂诱导的肝组织ROS升高, 清除羟自由基; Rg1还可有效地抑制Nrf2与酪氨酸和泛素蛋白的相互作用, 促进Nrf2入核并抑制Nrf2出核降解, 上调下游基因血色素氧化酶1 (heme oxygenase-1, HO-1)、NAD(P)H醌氧化还原酶1 [NAD(P)H: quinone oxidoreductase 1, NQO1]、GCLC和GCLM的表达; 此外, Rg1护肝作用与p-JNK和p62信号相关[26]。因此, 人参皂苷Rg1能减轻顺铂对肝脏的损伤, 其可能成为一种理想的辅助化疗保肝药物。
1.4.2 对乙酰氨基酚肝损伤对乙酰氨基酚(acetaminophen, APAP), 又称扑热息痛(paracetamol)是临床应用广泛的一种乙酰苯胺类解热镇痛药。现今APAP造成的肝损伤已引起研究人员的广泛关注。APAP中毒时, 肝脏严重受损, 肝小叶坏死和细胞网架的塌陷。电镜结果也显示, 核糖体丢失, 胞浆基质肿胀和内质网水样空泡变性, 线粒体功能的丧失, 血清生化指标大幅度升高[27]。目前临床最常用的解毒剂是N-乙酰半胱氨酸(NAC), 它能缓减APAP肝损伤症状。Gum等[28]研究显示韩国高丽参(Korean red ginseng, KRG)通过调节代谢有效地避免APAP诱导的肝毒性, 并降低死亡率。此外, 人参中主要活性成分人参皂苷Rg1能够较好地降低APAP诱发的肝损害[27]。人参皂苷Rg1能提高APAP处理后的HepG2和HEK293细胞抗氧化能力, 显著提高抗氧化酶GSH-PX、GSH和CAT的活性; 可抑制caspase-3、caspase-8和caspase-9的活性, 降低细胞的凋亡率并主要抑制早期凋亡。另外, 通过用Nrf2的siRNA处理细胞, 再给予APAP造模型, 发现抗氧化蛋白Nrf2、HO-1、NQO1、GCLC和GCLM表达显著下调, 而Rg1能缓减蛋白表达的减少, 但当Nrf2被敲除或敲减后, Rg1的这一保护作用减弱。由此推测人参皂苷Rg1发挥抗氧化应激活性主要通过介导Nrf2信号通路。然后, 通过比较野生型小鼠和Nrf2敲除小鼠肝脏对APAP造模的灵敏度, 结果显示Nrf2敲除后小鼠对APAP的耐受程度减弱。这进一步证实人参皂苷Rg1缓减APAP诱导的肝细胞和肝组织氧化损伤和凋亡, 主要通过介导Keap1-Nrf2-ARE信号通路[27]。
1.4.3 链脲佐菌素引发的2型糖尿病肝损伤链脲佐菌素(streptozotocin, STZ)是一种广谱抗菌素, 具有抗菌和抗肿瘤作用, 临床上STZ用于治疗胰岛细胞瘤(β细胞或非β细胞癌)、肝癌等。人参皂苷Rgl具有显著的抗炎、抗氧化作用。人参皂苷Rg1可显著降低STZ诱发的2型糖尿病肝损伤模型大鼠血清中AST、ALT等水平, 减轻糖脂异常代谢物引发的氧化应激, 改善糖尿病并发肝损伤。人参皂苷Rg1也可降低血清TNF-α和IL-6等炎症因子和血糖水平, 减少胰岛素抵抗。因此, 人参皂苷Rg1能有效降低氧化应激和炎症损伤, 进而对高脂高糖饮食/链脲佐菌素诱发的2型糖尿病(type 2 diabetes mellitus, T2-DM)肝损伤具有明显的保护作用[29]。此外, 人参皂苷Rg1还能降低T2-DM大鼠模型的血脂、血糖水平和改善肝功能[30]。综上, 人参皂苷Rg1主要是通过发挥抗炎、抗氧化作用, 改善血糖脂代谢和胰岛素抵抗来抵抗STZ诱导的T2-DM的病变。
2 人参皂苷Rg1对免疫性肝损伤的作用刀豆蛋白A (concanavalin A, Con A)是植物刀豆中的一种植物凝集素, 能通过T细胞介导肝损伤[31-33]。Con A诱导肝损伤导致小鼠体内转氨酶迅速升高, 同时伴有大量的免疫细胞, 如T细胞、NK细胞、NK细胞和嗜酸性细胞等向肝聚集[31, 34], 还促进炎性细胞因子(如IL-6、IFN-γ、TNF-α)和趋化因子释放, 加速肝损伤。人参皂苷Rg1具有天然抗氧化和调节免疫功能作用。Rg1可降低免疫性肝损伤小鼠血清中IFN-γ和TNF-α炎性因子水平。Rg1还能选择性增强淋巴细胞增殖能力和IL-2的表达和释放, 以介导免疫反应[31]。此外, Rg1明显减轻肝细胞及胞膜变性坏死, 炎性细胞浸润, 明显改善肝组织病变, 并降低小鼠血清中ALT和AST。Rg1可减少CD4+和CD8+ T细胞向Con A诱导的肝损伤浸润, 降低ICAM-1 mRNA的表达以发挥保肝作用[35], 减轻T淋巴细胞毒性作用[36]。总之, 人参皂苷Rg1的抗炎和调节免疫功能可减轻Con A诱导的免疫性肝损伤。
3 人参皂苷Rg1对其他因素导致的肝损伤的作用 3.1 老年化肝衰竭随着社会老年化越来越严重, 老年化肝衰竭相关的疾病也随之增加。老年衰竭肝组织中血流量减少、脂褐素增加和肝胆代谢功能减弱等[37]。人参皂苷Rg1具有抗衰老、抗氧化和提高免疫力作用。Rg1可有效抑制Fe2+-半胱氨酸诱发的肝微粒体脂质过氧化, 并改善快速老化小鼠肝脏中线粒体呼吸功能、膜电位及线粒体膜肿胀程度[38], 显著减少MDA的含量。氧化应激和脂质过氧化反应也是快速老化小鼠SAMP8系老年化鼠肝脏衰竭的重要原因之一。人参皂苷Rg1能提高体内抗氧化酶SOD、CAT和GSH-PX的活性, 抑制脂质过氧化反应, 延缓肝脏衰竭。
3.2 非酒精性脂肪肝非酒精性脂肪肝病(non-alcoholic fatty liver disease, NAFLD)在临床上是一种常见的代谢异常性肝病。最新数据显示, 我国NAFLD发病率已高达25%, 城市地区已超过30%, 仅次于病毒性肝炎的第二大肝病[39-41]。人参皂苷Rg1为人参三醇类皂苷, 能促进机体的能量代谢进程, 包括促进脂质β氧化降解过程[11], 以降低血脂。其降脂作用机制可能与下调羟甲基戊二酸单酰辅酶A还原酶(HMG-CoAR)和固醇调节元件结合蛋白(SREBP-2)表达, 及上调CYP7α水平相关[42], 从而清除大鼠肝脏中聚集的脂滴。而NAFLD的发生会限制β-氧化相关酶的分泌, 加速NAFLD的恶化[43]。人参皂苷Rg1可通过调节大鼠β-氧化相关的酶, 如肝脏脂酰CoA合成酶1 (CoASH1)、肉毒碱脂酰转移酶Ⅰ (CATⅠ)及脂酰CoA氧化酶1 (ACOX1), 改善脂肪代谢, 缓解NAFLD大鼠的肝损伤[44]。另外, 人参皂苷Rg1与氧化苦参碱(OMT)联合使用, 激活PPARα和PPARγ发挥抗氧化功能, 显著降低血清中ALT、AST、TC和TG水平, 发挥协同护肝作用[45]。
3.3 肝缺血再灌注人参皂苷Rg1是人参主要活性成分, 在小鼠肝脏缺血再灌注(ischemia reperfusion, IR)损伤模型中也有潜在的保护作用。人参皂苷Rg1预处理可减轻缺血再灌注小鼠的肝损伤, 抑制NF-κB p65磷酸化水平升高和炎症反应, 减少肝细胞凋亡[46]。在再灌注的早期阶段, 内皮细胞肿胀、血管收缩、肝脏缺血再灌注触发的ROS产生导致内皮细胞和肝细胞的直接损伤, 同时诱导枯否细胞和嗜中性粒细胞被活化, 产生大量的炎性细胞因子和氧自由基, 进一步加剧了肝损伤[47, 48]。而人参皂苷Rg1可提高小鼠肝细胞生存力, 并具有抗凋亡、抗炎和抗氧化的特性。因而, Rg1可能为治疗缺血再灌注诱导的肝损伤提供新的治疗策略。
4 人参皂苷Rg1对病毒性肝炎和肝癌的作用人参具有抗肿瘤作用。人参皂苷Rg1可能抑制癌细胞侵袭和迁移的能力[49], 并有效调节多种致癌基因和肿瘤抑制基因, 以发挥抗癌作用[50]。人参皂苷Rg1可提高癌症患者免疫力, 通过调节淋巴细胞亚群比例、提高外周血淋巴细胞增殖能力等, 并可辅助化疗, 增加化疗药物效应。Rg1对人肝癌细胞(Bel-7402)有较好的抑制活性。但目前人参皂苷Rg1在体内肝癌方面研究甚少, 这有待于研究人员进一步探索。人参皂苷Rg1对乙肝表面抗原(hepatitis B surface antigen, HBsAg)免疫性小鼠发挥免疫佐剂效应。这种佐剂活性增强Th1 (IgG2b和IFN-α)和Th2 (IgG1和IL-4)反应, 并通过TLR4信号途径引发Th1和Th2免疫应答[51]。因此, 这为未来开发新型的乙肝病毒免疫佐剂提供了可行的途径。另外, 人参皂苷Rg1和Rb1可以降低FRhK-4细胞中甲肝病毒浓度[52]。
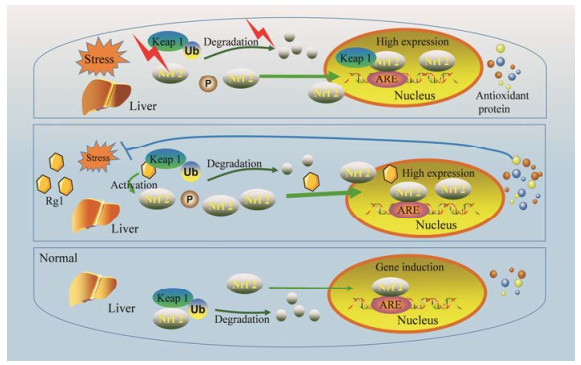
5 结语与展望人参皂苷Rg1是人参三醇类皂苷的重要组成部分, 是一种具有多种靶组织的甾体皂苷, 在机体多个组织器官中发挥药理活性。人参皂苷Rg1在肝病及相关肝损伤模型中发挥护肝作用。人参皂苷Rg1可以逆转肝损伤血清和肝脏中多种生化指标, 抑制脂质过氧化的产生[5, 53]。此外, 人参皂苷Rg1还可通过提高抗氧化酶水平以抵抗过度运动引发的肝内氧化应激[54]。人参皂苷Rg1在肝纤维化、药物或酒精性肝炎及免疫性肝损伤等肝损伤模型中均具有一定的保护作用。正如上述所示, 已将Rg1与模型、模型相关抗肝损伤和抗肝纤维化的药理机制进行整理。其中最主要的机制是人参皂苷Rg1的抗氧化作用, 调节Keap1-Nrf2-ARE信号通路。在正常、应激和应激后给予人参皂苷Rg1条件下Keap1-Nrf2-ARE的动态变化如图 1所示。虽然人参皂苷Rg1在化学剂诱导的肝损伤和肝纤维化已有部分研究, 但是研究的肝病类型较少, 并且其药理机制也未阐述清楚。目前在肝肿瘤、病毒性肝病及胆汁淤积性肝病方面, 人参皂苷Rg1的作用及药理机制研究缺乏。因此, 仍需进一步深入研究, 人参皂苷Rg1有望成为临床治疗肝炎、肝纤维化和肝癌新型的药物。
|
Figure 1 Nrf2 pathway under stressed, normal conditions and ginsenoside Rg1 after stress and mechanisms that regulate Nrf2. Usually, Nrf2 protein is in the cytoplasm with Keap1 and degradation. On this occasion, Nrf2 is ubiquitylated and degraded rapidly. Only few Nrf2 translocates to the nucleus, keeping a basal level of gene expression. When under stress, Nrf2 escapes from Keap1 and gets into the nucleus, binding ARE sequences to transactivate target genes. Ginsenoside Rg1 regulates Keap1 binding to Nrf2 and promotes Nrf2 entry into nucleus to enhance antioxidant gene transcription and protein expression. Rg1 also mediates the degradation of Nrf2, including ubiquitin (Ub) and so on |
| [1] | Unlu A, Nayir E, Kirca O, et al. Ginseng and cancer[J]. J BUON, 2016, 21: 1383–1387. |
| [2] | Yang PF, Song XY, Chen NH. Advances in pharmacological studies of Panax notoginseng saponins on brain ischemia-reperfusion injury[J]. Acta Pharm Sin (药学学报), 2016, 51: 1039–1046. |
| [3] | Bernal W, Wendon J. Acute liver failure[J]. N Engl J Med, 2013, 369: 2525–2534. DOI:10.1056/NEJMra1208937 |
| [4] | Yao H, Qiao YJ, Zhao YL, et al. Herbal medicines and nonalcoholic fatty liver disease[J]. World J Gastroenterol, 2016, 22: 6890–6905. DOI:10.3748/wjg.v22.i30.6890 |
| [5] | Ratno Budiarto B, Chan WH. Oxidative stresses-mediated apoptotic effects of ginsenoside Rb1 on pre-and post-implantation mouse embryos in vitro and in vivo[J]. Environ Toxicol, 2017, 32: 1990–2003. DOI:10.1002/tox.v32.8 |
| [6] | Gao B, Bataller R. Alcoholic liver disease:pathogenesis and new therapeutic targets[J]. Gastroenterology, 2011, 141: 1572–1585. DOI:10.1053/j.gastro.2011.09.002 |
| [7] | Cao YW, Jiang Y, Zhang DY, et al. Protective effects of Penthorum chinense Pursh against chronic ethanol-induced liver injury in mice[J]. J Ethnopharmacol, 2015, 161: 92–98. DOI:10.1016/j.jep.2014.12.013 |
| [8] | Ai Q, Sun G, Luo Y, et al. Ginsenoside Rb1 prevents hy-poxia-reoxygenation induced apoptosis in H9c2 cardiomyocytes via an estrogen receptor-dependent crosstalk among the Akt, JNK, and ERK 1/2 pathways using a label-free quantitative proteomics analysis[J]. RSC Adv, 2015, 5: 26346–26363. DOI:10.1039/C5RA02432C |
| [9] | Palipoch S, Punsawad C, Koomhin P, et al. Hepatoprotective effect of curcumin and alpha-tocopherol against cisplatin-induced oxidative stress[J]. BMC Complement Altern Med, 2014, 14: 1–8. DOI:10.1186/1472-6882-14-1 |
| [10] | Wang FS, Fan JG, Zhang Z, et al. The global burden of liver disease:the major impact of China[J]. Hepatology, 2014, 60: 2099–2108. DOI:10.1002/hep.v60.6 |
| [11] | Gao Y, Chu SF, Xia CY, et al. Rg1 attenuates alcoholic hepatic damage through regulating AMP-activated protein kinase and nuclear factor erythroid 2-related factor 2 signal pathways[J]. J Asian Nat Prod Res, 2016, 18: 765–778. DOI:10.1080/10286020.2016.1162787 |
| [12] | Li JP, Gao Y, Chu SF, et al. Nrf2 pathway activation contributes to anti-fibrosis effects of ginsenoside Rg1 in a rat model of alcohol-and CCl4-induced hepatic fibrosis[J]. Acta Pharmacol Sin, 2014, 35: 1031–1044. DOI:10.1038/aps.2014.41 |
| [13] | Gao Y, Chu SF, Li JW, et al. Anti-inflammatory function of Ginsenoside Rg1 on alcoholic hepatitis through glucocorticoid receptor related nuclear factor-kappa B pathway[J]. J Ethnopharmacol, 2015, 173: 231–240. DOI:10.1016/j.jep.2015.07.020 |
| [14] | Leung KW, Wong AS. Pharmacology of ginsenosides:a literature review[J]. Chin Med, 2010, 5: 20. DOI:10.1186/1749-8546-5-20 |
| [15] | De Bosscher K, Vanden Berghe W, Haegeman G. The interplay between the glucocorticoid receptor and nuclear factor-κB or activator protein-1:molecular mechanisms for gene repression[J]. Endocr Rev, 2003, 24: 488–522. DOI:10.1210/er.2002-0006 |
| [16] | Bertola A, Mathews S, Ki SH, et al. Mouse model of chronic and binge ethanol feeding (the NIAAA model)[J]. Nat Protoc, 2013, 8: 627–637. DOI:10.1038/nprot.2013.032 |
| [17] | Mann DA, Smart DE. Transcriptional regulation of hepatic stellate cell activation[J]. Gut, 2002, 50: 891–896. DOI:10.1136/gut.50.6.891 |
| [18] | Zhao J, Shi Z, Liu S, et al. Ginsenosides Rg1 from Panax ginseng:a potential therapy for acute liver failure patients?[J]. Evid Based Complement Alternat Med, 2014, 2014: 538059. |
| [19] | Yao X, Jiang W, Ma CH, et al. Protective effects of ginse-noside Rg1 against carbon tetrachloride-induced liver injury in mice through suppression of inflammation[J]. Phytomedicine, 2016, 23: 583–588. DOI:10.1016/j.phymed.2016.02.026 |
| [20] | Dong XQ, Duan LP, Liang B, et al. A stereological analysis of ginsenoside Rg1 in inhibiting hepatic fibrosis[J]. Chongqing Med (重庆医学), 2014, 43: 3599–3601, 3616. |
| [21] | Ma LQ, Dong XQ, Liang B, et al. The effect of panaxsaponin Rg1 on the ultra structure of hepatocytes and the express of TIMP-1 in hepatic fibrotic mice[J]. Chin J Hepatol (中国肝脏病杂志), 2010, 18: 304–306. |
| [22] | Geng J, Peng W, Huang Y, et al. Ginsenoside-Rg1 from Panax notoginseng prevents hepatic fibrosis induced by thioacetamide in rats[J]. Eur J Pharmacol, 2010, 634: 162–169. DOI:10.1016/j.ejphar.2010.02.022 |
| [23] | Chen A, Zhang L. The antioxidant (-)-epigallocatechin-3-gallate inhibits rat hepatic stellate cell proliferation in vitro by blocking the tyrosine phosphorylation and reducing the gene expression of platelet-derived growth factor-β receptor[J]. J Biol Chem, 2003, 278: 23381–23389. DOI:10.1074/jbc.M212042200 |
| [24] | Ko JW, Lee IC, Park SH, et al. Protective effects of pine bark extract against cisplatin-induced hepatotoxicity and oxidative stress in rats[J]. Lab Anim Res, 2014, 30: 174. DOI:10.5625/lar.2014.30.4.174 |
| [25] | Abdulrahman LA, Ahmed ARS. Thymoquinone attenuates cisplatin-induced hepatotoxicity via nuclear factor kappa-β[J]. BMC Complement Altern Med, 2014, 14: 282. DOI:10.1186/1472-6882-14-282 |
| [26] | Gao Y, Chu SF, Shao QH, et al. Antioxidant activities of ginsenoside Rg1 against cisplatin-induced hepatic injury through Nrf2 signaling pathway in mice[J]. Free Radic Res, 2017, 51: 1–13. DOI:10.1080/10715762.2016.1234710 |
| [27] | Gao Y, Chu S, Zhang Z, et al. Early stage functions of mitochondrial autophagy and oxidative stress in acetamino-phen-induced liver injury[J]. J Cell Biochem, 2017, 118: 3130–3141. DOI:10.1002/jcb.v118.10 |
| [28] | Gum SI, Cho MK. Korean red ginseng extract prevents APAP-induced hepatotoxicity through metabolic enzyme regulation:the role of ginsenoside Rg3, a protopanaxadiol[J]. Liver Int, 2013, 33: 1071–1084. DOI:10.1111/liv.2013.33.issue-7 |
| [29] | Yao JC. A study on protective effects of ginsenosides Rg1 on pathological liver injury in rats with type 2 diabetes[J]. Clin J Chin Med (中医临床研究), 2016, 8: 13–14. |
| [30] | Tian W, Chen L, Zhang L, et al. Effects of ginsenoside Rg1 on glucose metabolism and liver injury in streptozotocin-induced type 2 diabetic rats[J]. Genet Mol Res, 2017. DOI:10.4238/gmr16019463 |
| [31] | Qin XY, Tang L, Yan L, et al. Tanshinone ⅡA protects against immune-mediated liver injury through activation of T-cell subsets and regulation of cytokines[J]. Immunopharmacol Immunotoxicol, 2010, 32: 51–55. DOI:10.3109/08923970903120997 |
| [32] | Wahl C, Wegenka UM, Leithuser F, et al. IL-22-dependent attenuation of T cell-dependent (Con A) hepatitis in herpes virus entry mediator deficiency[J]. J Immunol, 2009, 182: 4521–4528. DOI:10.4049/jimmunol.0802810 |
| [33] | Tiegs G, Hentschel J, Wendel A. A T cell-dependent ex-perimental liver injury in mice inducible by concanavalin A[J]. J Clin Invest, 1992, 90: 196–203. DOI:10.1172/JCI115836 |
| [34] | Nakaya M, Hashimoto M, Nakagawa R, et al. SOCS3 in T and NKT cells negatively regulates cytokine production and ameliorates Con A-induced hepatitis[J]. J Immunol, 2009, 183: 7047–7053. DOI:10.4049/jimmunol.0900547 |
| [35] | Cao L, Zou Y, Zhu J, et al. Ginsenoside Rg1 attenuates concanavalin A-induced hepatitis in mice through inhibition of cytokine secretion and lymphocyte infiltration[J]. Mol Cell Biochem, 2013, 380: 203–210. DOI:10.1007/s11010-013-1674-y |
| [36] | Yang Y, Qin XY, Guo Z, et al. Protective effect of ginse-noside Rg1 on immune-mediated liver injury in mice[J]. Chin J Public Health (中国公共卫生), 2015, 31: 309–311. |
| [37] | Schmueker DI. Age-related changes in liver structure and function:implications for disease?[J]. Exp Gerontol, 2005, 40: 650–659. DOI:10.1016/j.exger.2005.06.009 |
| [38] | Wang YH, He XL, Li XX, et al. Protections of ginsenoside Rg1 on liver mitochondria in senescence accelerated mice[J]. Chin J Gerontol (中国老年学杂志), 2009, 29: 1897–1900. |
| [39] | Smith BW, Adams LA. Non-alcoholic fatty liver disease[J]. Crit Rev Clin Lab Sci, 2011, 48: 97–113. DOI:10.3109/10408363.2011.596521 |
| [40] | Karrar A, Stepanova M, Alaparthi L, et al. Anti-adipocyte antibody response in patients with non-alcoholic fatty liver disease[J]. J Gastroenterol Hepatol, 2015, 30: 900–908. DOI:10.1111/jgh.2015.30.issue-5 |
| [41] | Lu ZY, Shao Z, Li YL, et al. Prevalence of and risk factors for non-alcoholic fatty liver disease in a Chinese population:an 8-year follow-up study[J]. World J Gastroenterol, 2016, 22: 3663–3669. DOI:10.3748/wjg.v22.i13.3663 |
| [42] | Chen Z, Li C, Yang C, et al. Lipid regulation effects of raw and processed Notoginseng Radix Et Rhizome on steatotic hepatocyte L02 cell[J]. Biomed Res Int, 2016, 2016: 2919034. |
| [43] | Samovski D, Sun J, Pietka T, et al. Regulation of AMPK activation by CD36 links fatty acid uptake to β-oxidation[J]. Diabetes, 2015, 64: 353–359. DOI:10.2337/db14-0582 |
| [44] | Liao WY, Xu D. Study on the improvement effect of ginsenoside Rg1 on nonalcoholic fatty liver phenotype by regulation of β-oxidation[J]. Chongqing Med (重庆医学), 2016, 45: 1179–1182. |
| [45] | Wu T, Wang LM. Synergic liver protection effects of ginsenoside Rg1 and oxymatrine and its mechanism[J]. Int J Trad Chin Med (国际中医中药杂志), 2014, 36: 894–898. |
| [46] | Tao TZ, Chen F, Bo LL, et al. Ginsenoside Rg1 protects mouse liver against ischemia-reperfusion injury through anti-inflammatory and anti-apoptosis properties[J]. J Surg Res, 2014, 191: 231–238. DOI:10.1016/j.jss.2014.03.067 |
| [47] | Mendes-Braz M, Elias-Miro M, Jimenez-Castro MB, et al. The current state of knowledge of hepatic ischemia-reperfusion injury based on its study in experimental models[J]. J Biomed Biotechnol, 2012, 2012: 298657. |
| [48] | Abu-Amara M, Yang SY, Tapuria N, et al. Liver ischemia/reperfusion injury:processes in inflammatory network sea-review[J]. Liver Transpl, 2010, 16: 1016–1032. DOI:10.1002/lt.22117 |
| [49] | Li L, Wang Y, Qi B, et al. Suppression of PMA-induced tumor cell invasion and migration by ginsenoside Rg1via the inhibition of NF-κB-dependent MMP-9 expression[J]. Oncol Rep, 2014, 32: 1779–1786. DOI:10.3892/or.2014.3422 |
| [50] | Li QF, Shi SL, Liu QR, et al. Anticancer effects of ginse-noside Rg1, cinnamic acid, and tanshinone ⅡA in osteosar-coma MG-63 cells:nuclear matrix downregulation and cytoplasmic trafficking of nucleophosmin[J]. Int J Biochem Cell Biol, 2008, 40: 1918–1929. DOI:10.1016/j.biocel.2008.01.031 |
| [51] | Yuan D, Yuan Q, Cui Q. Vaccine adjuvant ginsenoside Rg1 enhances immune responses against hepatitis B surface antigen in mice[J]. Can J Physiol Pharmacol, 2016, 94: 676–681. DOI:10.1139/cjpp-2015-0528 |
| [52] | Lee MH, Lee BH, Lee S, et al. Reduction of hepatitis A virus on FRhK-4 cells treated with Korean red ginseng extract and ginsenosides[J]. J Food Sci, 2013, 78: M1412–M1415. DOI:10.1111/jfds.2013.78.issue-9 |
| [53] | Zhou N, Tang Y, Keep RF, et al. Antioxidative effects of Panax notoginseng saponins in brain cells[J]. Phytomedicine, 2014, 21: 1189–1195. DOI:10.1016/j.phymed.2014.05.004 |
| [54] | Korivi M, Hou CW, Huang CY, et al. Ginsenoside-Rg1 protects the liver against exhaustive exercise-induced oxidative stress in rats[J]. Evid Based Complement Alternat Med, 2012, 2012: 932165. |
 2018, Vol. 53
2018, Vol. 53


