智能、可控和高效的刺激响应性药物传递载体是当今药物传递系统的研究及临床试验的热点。刺激响应性载体不仅可以提高药物在肿瘤部位的蓄积, 而且可以精确控制药物的释放。刺激响应性载体包括pH响应性载体[1]、还原响应性载体[2]、光响应性载体[3]、超声响应性载体、磁场响应性载体、热响应性载体[4]及活性氧自由基(reactive oxygen species, ROS)响应性载体[5]等。其中, ROS响应性载体具有响应速度快、灵敏度高的优势, 主要是针对细胞内过氧化氢(H2O2)[6]、单线态氧(1O2)[7]、羟基自由基(·OH)[8]和超氧化物[6]等响应。本课题组前期综述[9]总结的ROS响应性载体主要包括含硫多聚物ROS响应载体[10]、含硒多聚物ROS响应载体[11]、含碲多聚物ROS响应载体[12]和含不饱和磷脂ROS响应载体。
在众多的ROS响应性载体, 含不饱和磷脂ROS响应载体最具发展潜力, 不饱和磷脂能被1O2快速氧化, 从而实现载体中药物的快速释放。不饱和磷脂主要有蛋黄卵磷脂[13]、二油酰磷脂酰胆碱(1, 2-dioleoyl-sn-glycero-3-phosphocholine, DOPC)[14]及二亚油酰磷脂酰胆碱(1, 2-dilinoleoyl-sn-glycero-3-phosphocholine, DLPC)。
鉴于含不饱和磷脂ROS响应载体需要1O2才能实现ROS响应, 而光敏剂在光照后可以产生1O2。因此, 本课题将含不饱和磷脂ROS响应载体与光敏剂联合使用, 构建光敏活性氧自由基响应脂质体。光敏剂分为第一代光敏剂和第二代光敏剂, 第二代光敏剂较第一代光敏剂具有光毒副作用小、组织渗透能力强、1O2产率高的优点, 因此第二代光敏剂被称为具有前景的光敏剂[15]。第二代光敏剂主要包括卟啉类光敏剂和酞菁(phthalocyanine, PC)类光敏剂, 其中酞菁类光敏剂的吸收波长(660~900 nm)正好在人体组织最佳透射波段范围内, 其对人体组织的相容性较好、对皮肤光毒性远小于卟啉光敏剂, 光与热稳定性也好于卟啉光敏剂, 是第二代光敏剂的典型代表[16]。1, 4, 8, 11, 15, 18, 22, 25-八丁氧基酞菁钯[PdPC(OBu)8]的最大吸收波长在730 nm附近, 具有良好的组织相容性, 1O2产率高, 是有前景的光敏剂。
本研究以PdPC(OBu)8为光敏剂, 盐酸多柔比星(DOX)为化疗药物, DLPC为不饱和磷脂, 构建和评价光敏ROS响应脂质体[liposome loaded with PdPC(OBu)8 and DOX, LPD], 考察LPD在近红外光照射下的ROS响应释放情况, 以期增加肿瘤细胞对化疗药物的敏感性, 精确控制药物的释放, 结合光动力学产生大量1O2可以从不同的机制出发杀死肿瘤细胞, 从而改善光敏ROS响应脂质体的治疗效果。
材料与方法仪器 R206D旋转蒸发仪(上海申生科技有限公司); 678 nm光纤激光器(恩耐激光技术有限公司定制); GG-730-1500MW激光器(长春市亮丽光电有限公司); Agilent 1100系列高效液相色谱-质谱仪(美国安捷伦公司); JY92-IIDN超声波细胞粉碎机(宁波新芝生物科技股份有限公司); 马尔文激光粒度仪(英国Malvern公司); JEM2100F透射电子显微镜(日本JEOL公司); TCS SP5激光共聚焦显微镜(德国Leica公司); FACScan流式细胞仪(美国Beckon Dickson公司); UV1102紫外-可见分光光度计(Techcomp公司); Multiscan MK-3酶标仪(Thermo公司); F-7000荧光分光光度计(日本Hitachi公司); 荧光显微镜(Olympus公司)。
试剂 DOPC、DLPC (Avanti公司); 二硬脂酰磷脂酰胆碱(1, 2-distearoyl-sn-glycero-3-phosphocholine, DSPC, Corden Pharma公司); 氢化大豆卵磷脂(HSPC)、DSPE-mPEG2000 (Lipoid公司); 胆固醇(cholesterol)、H2PC(OBu)8、氯化钯(PdCl2) (Sigma-Aldrich公司); 1, 3-二苯基异苯并呋喃(DPBF, 上海阿拉丁生化科技股份有限公司); N, N-二甲基甲酰胺(DMF)、甲苯、曲拉通X-100、氯仿、乙醇、甲醇、硫酸铵[(NH4)2SO4] (国药集团化学试剂有限公司); PBS (上海双螺旋生物科技有限公司); DOX、LysoTracker Green DND-26、Hoechst 33342 (大连美仑生物技术有限公司); 超氧化物阴离子荧光探针(DHE, 碧云天生物技术有限公司)。
光敏剂的合成与鉴别 按H2PC(OBu)8与PdCl2以1:3摩尔比称取, 置于圆底烧瓶中, 加入无水DMF 3 mL溶解, 氮气缓慢吹打30 min除去空气。将烧瓶置于120 ℃油浴搅拌24 h, 用油泵在65 ℃水浴中旋转蒸发干燥。最后加入甲苯(toluene)溶解固体, 过0.22 μm有机膜, 65 ℃旋干, 真空干燥, 称重, 计算产率。
观察固体颜色, 然后分别用甲苯、DMF和乙醇(ethanol)溶解少量固体, 用H2PC(OBu)8作为对照, 进行紫外扫描。用甲醇溶解PdPC(OBu)8和H2PC(OBu)8, 质谱扫描[M+H]+。
光敏ROS响应脂质体的制备 采用硫酸铵梯度法制备脂质体。精密称取DLPC (DOPC或HSPC)、DSPC、cholesterol及DSPE-mPEG2000两份溶于氯仿中, 其中一份加入PdPC(OBu)8氯仿溶液, 用于制备PdPC(OBu)8脂质体[liposome loaded with PdPC(OBu)8, LP], 另一份不加药物用于制备空白脂质体(blank liposome, BP)。37 ℃减压旋转蒸发形成均匀薄膜。精密吸取125 mmol·L-1 (NH4)2SO4 (PBS, pH 7.4)溶液2 mL水化。将脂质体取出, 200 W探头超声2 min, 400 W探头超声6 min。将LP置于5%蔗糖溶液透析, 每次1.5 h, 透析3次, 加入DOX粉末4 mg, 65 ℃孵育30 min, 取出, 室温冷却, 得到LPD。
光敏ROS响应脂质体的处方筛选 以药物包封率、脂质体药物释放和脂质体在血清中的稳定性为指标, 从磷脂、激光器波长、DLPC用量、cholesterol用量及PdPC(OBu)8投药量对ROS响应脂质体进行优化。
光敏ROS响应脂质体的表征
粒径与zeta电位 将脂质体溶液稀释至适当浓度, 使用马尔文激光粒度仪测定纳米脂质体的粒径、zeta电位。
包封率与载药量 采用紫外分光光度法测定纳米脂质体PdPC(OBu)8的包封率(encapsulation efficiency, EE)和载药量(drug loading, DL), 荧光分光光度法测定纳米脂质体DOX的包封率和载药量, 按以下公式计算: EE=脂质体中药物/投药量×100%; DL=脂质体中药物/载药×脂质体总质量×100%。
脂质体的形态 用透射电子显微镜观察光照及未光照处理的脂质体溶液, 考察脂质体的形态变化。
光敏ROS响应脂质体药物的体外释放[14] 采用730 nm激光以300 mW·cm-2光照强度照射具塞玻璃管中不断搅拌的脂质体溶液, 用荧光分光光度计测量DOX的释放情况。荧光测定条件: Ex = 480 nm, Em = 560 nm; 扫描速度为240 nm·min-1; 电压为400 V; 狭缝宽度为10 nm; 响应值为0.1 s。首先检测脂质体溶液的初始荧光值Finitial, 每隔一段时间测量该时间点的荧光值F, 最后加入0.25%曲拉通X-100超声破乳脂质体后读取荧光值FX-100。利用公式(1)计算DOX释放率。
| $ {\rm{DOX = }}\frac{{F-{F_{{\rm{initial}}}}}}{{{F_{{\rm{X-100}}}}-{F_{{\rm{initial}}}}}} \times 100\% $ | (1) |
光敏ROS响应脂质体在血清中的稳定性[14]采用37 ℃水浴孵育10%血清稀释的脂质体溶液, 用荧光分光光度计测量DOX的泄露情况。利用公式(1)计算DOX泄漏率。
脂质体溶液中1O2的检测 DPBF是一种疏水性的1O2检测探针, 403 nm波长激发下, DPBF在480 nm处有最大荧光发射强度。当DPBF被1O2氧化后, 其发射强度会发生下移。在一定范围内, 其峰值的下降水平与1O2的产生量呈现一定的相关性(1O2产量越高, 峰值下降越低)。将光敏剂脂质体稀释成一定浓度, 然后加入100 μL DPBF乙醇溶液(0.3 mg·mL-1)。以403 nm波长激发, 扫描425~630 nm的荧光发射强度。然后730 nm激光以300 mW·cm-2照射3 min, 再次扫描425~630 nm的荧光发射强度。
光敏ROS响应脂质体的细胞摄取
共聚焦激光显微镜定性观察细胞摄取 配制细胞数为每毫升1×105个的MCF-7细胞悬液, 取1 mL细胞悬液于激光共聚焦皿(圆柱形, 35 mm), 置于细胞培养箱孵育12 h使其贴壁。弃掉培养基, 换为含药[PdPC(OBu)8: 0.5 μg·mL-1; DOX: 5 μg·mL-1]的培养基。4 h后, 光照组进行光照(730 nm、1 200 mW·cm-2, 3 min), 去除培养基, PBS (pH 7.4)洗涤3次, 4%多聚甲醛1 mL固定10 min, PBS洗涤3次, 1 μg·mL-1 DAPI 1 mL避光染色10 min, PBS洗涤3次, 加入PBS 1 mL置于共聚焦激光显微镜进行观察。
流式细胞仪定量观察细胞摄取 配制细胞数为每毫升5×105个的MCF-7细胞悬液, 取细胞悬液1 mL于6孔板中, 置于细胞培养箱孵育12 h使其贴壁。替换培养基为含2 μg·mL-1 DOX的培养基1 mL, 孵育1 h后, 光照组进行光照处理(730 nm、1 200 mW·cm-2, 3 min), 去除培养基, 用PBS (pH 7.4)冲洗3次, 胰酶消化, 再用PBS冲洗3次, 1 000 r·min-1离心5 min, 最后吸取0.5 mL PBS重悬, 避光保存, 通过流式细胞仪检测。
ROS响应脂质体在细胞内的分布 取对数生长期MCF-7细胞, 以每毫升1×105个细胞数取1 mL铺板于玻璃皿中, 12 h细胞贴壁后, 去掉培养基。给药(5 μg·mL-1 DOX), 37 ℃细胞培养箱孵育4 h, 去掉培养基, PBS洗3次, 加入LysoTracker Green DND-26 (100 nmol·L-1) 1 mL染色10 min, 去掉染液, PBS洗3次, 加入4%多聚甲醛1 mL固定10 min, PBS洗3次, 加入Hoechst 33342 (10 μg·mL-1) 1 mL染色15 min。PBS洗3次, 加入PBS 1 mL置于共聚焦激光显微镜进行观察。
ROS响应脂质体的摄取机制配制 细胞数为每毫升5×105个的MCF-7细胞悬液, 各取3 mL于6孔板中, 置于细胞培养箱孵育12 h使其贴壁。抑制剂组每孔分别加入200 μL不同抑制剂溶液阿米洛利(amiloride, 100 μg·mL-1)、非律平(filipin, 5 μg·mL-1)和氯丙嗪(chlorpromazine, 10 μg·mL-1), 对照组和4 ℃组加入培养基200 μL。细胞培养箱孵育30 min, 然后加入1 mL DLPC-PS-DOX (DOX 5 μg·mL-1), 阿米洛利组、非律平组、氯丙嗪组和对照组放入37 ℃细胞培养箱孵育1 h, 4 ℃组放入4 ℃冰箱孵育1 h。去除培养基, PBS洗3次, 胰酶消化, 1 000 r·min-1离心5 min, 去除上清液, 加入PBS 0.4 mL将细胞反复吹打均匀, 利用流式细胞仪测定。
光敏ROS响应脂质体细胞内ROS检测 DHE能与活细胞内ROS发生氧化反应生成氧化乙啶, 氧化乙啶可作用于细胞DNA, 产生红色荧光。根据活细胞内红色荧光的产生和强度, 可以判断ROS的含量有无和多少。取对数生长期MCF-7细胞, 以每毫升3×105个细胞数铺板于24孔板中, 12 h细胞贴壁后, 更换培养基。给药, 继续孵育6 h, 弃掉培养基, 换为PBS, 光照组进行激光照射(730 nm、1 200 mW·cm-2, 3 min), 照射后弃掉培养基, 立即加入0.2 mL DHE溶液(15 μmol·mL-1), 37 ℃孵育5 min, PBS洗涤3次, 用荧光显微镜观察细胞染色情况。
光敏ROS响应脂质体的细胞毒性 取对数期MCF-7细胞通过CCK-8法考察光照强度和ROS脂质体的细胞毒性。
光照强度的细胞毒性 取对数期MCF-7细胞消化计数, 稀释细胞悬液使得细胞数为每毫升5×104个, 在96孔板中每孔加入100 μL细胞悬液, 使得每孔5 000个细胞, 置于细胞培养箱孵育12 h或过夜, 使细胞贴壁。然后用730 nm激光分别以0、50、100、300、500、1 000和1 200 mW·cm-2照射3 min, 接着放入细胞培养箱孵育24 h, 弃掉培养基, 加入含10% CCK-8的培养基, 孵育2 h, 然后将96孔板放于酶标仪上, 在450 nm波长处进行酶标仪读数, 测定光吸收值(A)。按以下公式计算细胞存活率:
| $ {\rm{细胞存活率 = }}\frac{{{A_{{\rm{实验组}}}}-{A_{{\rm{空白组}}}}}}{{{A_{{\rm{未处理组}}}}-{A_{{\rm{空白组}}}}}} \times 100\% $ |
光敏ROS响应脂质体细胞毒性 取对数期MCF-7细胞, 在96孔板中加入细胞数为每毫升5×104个的细胞悬液100 μL, 置于细胞培养箱孵育12 h或过夜。弃掉培养基, 换为含药物的培养基, 接着放入细胞培养箱孵育24 h, 弃掉培养基, 换为无药培养基, 接着光照组用730 nm激光1 200 mW·cm-2照射3 min, 放入细胞培养箱孵育24 h, 弃掉培养基, 加入含10% CCK-8的培养基, 孵育2 h, 然后将96孔板放于酶标仪上, 在450 nm波长处进行酶标仪读数, 测定A。按公式1计算细胞存活率。
统计学方法 采用GraphPad Prism 5.0软件分析数据, 实验数据均以x±s表示。两组样本之间比较采用t检验, 多组间采用单因素方差分析。P < 0.05时有统计学差异。
结果 1 光敏剂的合成与鉴别合成产物为绿色粉末, 易溶于甲苯、DMF及氯仿。反应物光敏剂H2PC(OBu)8和生成物PdPC(OBu)8氢原子环境相似, 核磁共振氢谱并不能很好地鉴别PdPC(OBu)8, 采用最大紫外吸收波长及质谱能很好鉴别。如图 1A所示, PdPC(OBu)8在DMF溶液中的最大紫外吸收在737 nm, 在甲苯中的最大紫外吸收在722 nm, 在乙醇中的最大紫外吸收在729 nm, 与文献[7]结果一致。因此, 鉴定生成物为PdPC(OBu)8, 产率约70%。H2PC(OBu)8在DMF溶液中的最大紫外吸收在766 nm, 在甲苯中的最大紫外吸收在761 nm, 在乙醇中的最大紫外吸收在762 nm (图 1B)。经质谱扫描得到PdPC(OBu)8的[M+H]+ C64H81N8O8106Pd为1 195.6, H2PC(OBu)8的[M+H]+ C64H83N8O8为1 092.3。
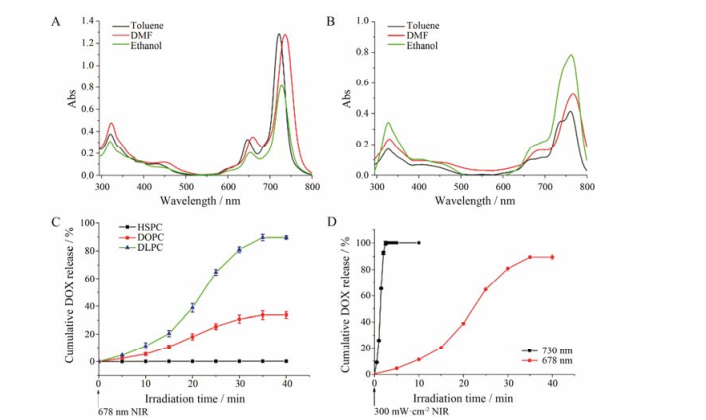
|
Figure 1 UV-Vis absorption (Abs) of PdPC(OBu)8 in different solvent (A). UV-Vis absorption of H2PC(OBu)8in different solvent (B). Cumulative doxorubicin hydrochloride (DOX) release of liposomes contained different unsaturated lipids after irradiation (678 nm, 300 mW·cm-2) (C). Reactive oxygen species (ROS) -responsive DOX release of LPD [liposome loaded with PdPC(OBu)8 and DOX] upon different wavelength light irradiation (300 mW·cm-2) (D) |
如图 1C, HSPC为饱和磷脂, 作为对照组, 由HSPC构成的脂质体在光照下(678 nm、300 mW·cm-2) DOX并没有释放, 由DOPC制备的脂质体在光照35 min后DOX释放约40%, 由DLPC制备的脂质体在光照35 min后DOX释放达到90%, 说明DLPC比DOPC具有更强的ROS响应活性。因此, 选择DLPC作为不饱和磷脂。
2.2 光照波长的选择如图 1D所示, 在相同光照强度下(300 mW·cm-2), 678 nm激光照射40 min后DOX基本释放完全, 而730 nm激光照射不到5 min DOX释放完全, 730 nm波长激光实现了DOX的快速ROS响应释放。因此, 选择730 nm作为光照波长。
2.3 光敏ROS响应脂质体中DLPC用量的筛选DLPC用量越多, PdPC(OBu)8的包封率和载药量逐渐下降, DOX包封率和载药量基本保持不变(表 1)。DOX采用硫酸铵梯度法载入, DLPC的用量不影响DOX包载。在一定范围内, DLPC用量越大, DLPC脂质体药物ROS响应释放越快, 当用量达到5%时, DLPC脂质体药物的ROS响应速率不再加快(图 2A)。DLPC用量低时, DLPC脂质体在血清中稳定, DOX泄露少; DLPC用量高时, DLPC脂质体在血清中不稳定, DOX泄露多(图 2B)。综合以上结果, 考虑脂质体的包封率、ROS响应释放速率及血清中的稳定性, 选择DLPC用量为5%。
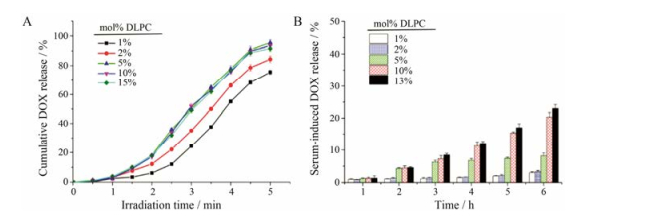
|
Figure 2 Cumulative DOX release of liposomes contained different molar DLPC (A). Serum-induced DOX release of liposomes contained different molar DLPC (B) |
| Table 1 Encapsulation efficiency (EE) and drug loading (DL) of liposomes contained different molar 1, 2-dilinoleoyl-sn-glycero-3-phosphocholine (DLPC) |
胆固醇含量影响药物的包封率和载药量, 同时影响脂质体的稳定性。由表 2可知, 胆固醇用量越高, PdPC(OBu)8包封率越高, DOX包封率也越高, 这是因为脂质体中胆固醇含量越高, 脂质体越稳定, 药物不容易释放, 正如图 3A所示, 胆固醇用量越多, 脂质体越稳定, 这与脂质体在血清中的稳定性结论一致。脂质体在血清中越稳定, DOX泄露越少(图 3B)。因此, 选择胆固醇用量为40%。
| Table 2 Encapsulation efficiency and drug loading of liposomes contained different molar cholesterol (Chol) |
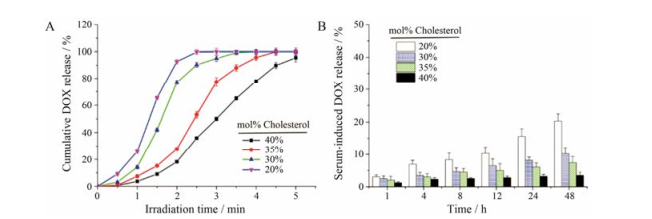
|
Figure 3 Cumulative DOX release of liposomes contained different molar cholesterol (A). Serum-induced DOX release of liposomes contained different molar cholesterol (B) |
PdPC(OBu)8是产生1O2的物质, PdPC(OBu)8越多, 产生1O2越多。然而PdPC(OBu)8越多, 包封率逐渐下降, 只有在低投药量时PdPC(OBu)8包封率能达到制剂要求(表 3)。在一定范围内, PdPC(OBu)8投药量越高, DLPC脂质体药物释放越快, 当PdPC(OBu)8投药量达到质量比为1:200 [PdPC(OBu)8:lipid]后药物释放速率基本维持不变(图 4)。因此, 选择PdPC(OBu)8投药量的质量比为1:200 [PdPC(OBu)8:lipid]。
| Table 3 Encapsulation efficiency and drug loading of liposomes contained PdPC(OBu)8 |
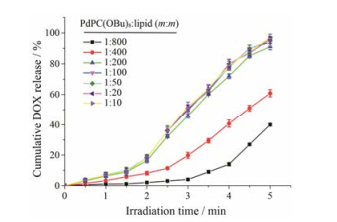
|
Figure 4 Cumulative DOX release of liposomes contained PdPC(OBu)8 |
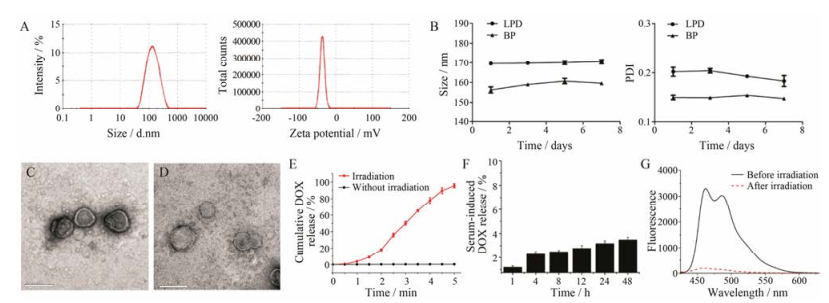
LPD粒径为(169.3 ± 1.2) nm, PDI为0.198 ± 0.003, 粒径均匀, zeta电位为(-39.8 ± 0.8) mV (图 5A)。BP在4 ℃冰箱保存7天粒径基本维持在160 nm, PDI基本维持在0.1; LPD粒径基本维持在170 nm, PDI基本维持在0.2 (图 5B)。说明ROS响应脂质体具有较好的储存稳定性。
|
Figure 5 Particle sizes and zeta potential of ROS-responsive liposome (A). Storage stability of DOX-loaded ROS-responsive liposomes (B). Transmission electron microscopy (TEM) photos of ROS-responsive liposome before irradiation (20 000×) (C). TEM photos of ROS-responsive liposome after irradiation (20 000×) (D). Cumulative DOX release of DOX-loaded ROS-responsive liposomes (E). Serum stability of DOX-loaded ROS-responsive liposomes (F). Fluorescence intensity of 1, 3-diphenylisobenzofuran (DPBF) before or after PdPC(OBu)8 liposome was irradiated (730 nm, 1 200 mW·cm-2, 3 min) (G) |
PdPC(OBu)8的回归方程为A = 0.074 3 C -0.006 3, 相关系数为0.999 7, 线性范围为1~10 μg·mL-1; DOX的回归方程为F = 10.447 C + 1.179, 相关系数为0.999 8, 线性范围为0.1~12.5 μg·mL-1。PdPC(OBu)8的包封率约为(84.43 ± 3.12) %, 载药量为(0.42 ± 0.01) %。在此条件下, DOX包封率为(91.03 ± 3.33) %, 载药量为(9.84 ± 0.40) %。
3.3 脂质体的形态由图 5C可以看出, LPD粒径约150 nm, 光照前有一层透明似膜样的物质, 光照后膜消失(图 5D), 这应该是光照产生1O2破坏了脂质体, 使得脂质体破裂形成。
3.4 光敏ROS响应脂质体药物的体外释放LPD在未光照的情况下, 药物基本不释放; 在光照的情况下, 5 min药物释放率达到95.5% (P < 0.05), 说明LPD具有ROS响应快速释放药物的特性(图 5E)。
3.5 光敏ROS响应脂质体在血清中的稳定性LPD在血清中48 h后DOX泄露率小于5%, 说明LPD具有良好的血清稳定性(图 5F)。综上可知, LPD具有较好的稳定性。
3.6 脂质体溶液中1O2的检测由图 5G可知, DPBF在未光照前荧光强度达到3 000, 光照后荧光强度只有250左右, 说明光照后产生了大量的1O2, 使DPBF的荧光强度显著下降。由此可知, LP光照前不产生1O2, 光照后产生大量1O2, 因此ROS响应脂质体在光照时有可能实现ROS响应。
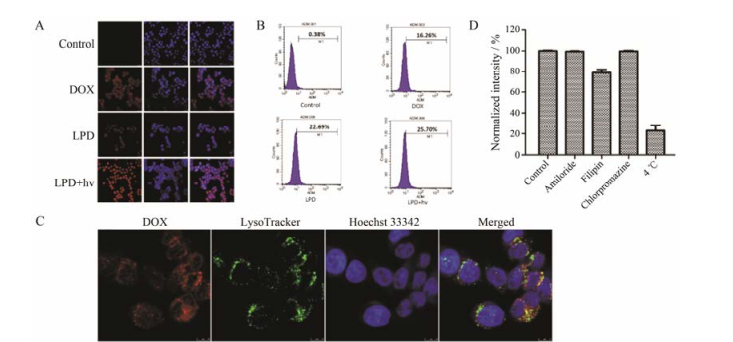
4 光敏ROS响应脂质体的细胞摄取 4.1 共聚焦激光显微镜定性观察细胞摄取DOX作为脂质体中抗肿瘤药物, DOX的摄取情况影响脂质体的药效。由图 6A可知, 游离DOX的荧光最弱, 未光照处理的LPD荧光较强, 光照(730 nm、1 200 mW·cm-2, 3 min)处理的LPD荧光最强。说明与游离DOX摄取情况相比, 未光照处理的LPD摄取情况增强。光照后的LPD荧光最强可能是由于光照后使脂质体中DOX释放, 从而使得荧光增强。
|
Figure 6 DOX uptake of ROS-responsive liposome by confocal microscopy (A). DOX uptake of ROS-responsive liposome by flow cytometry (B). Co-localization of ROS-responsive liposome within the lysosomes (C). Relative intensities of DOX from ROS-responsive liposome internalized by MCF-7 cells (D) |
由流式结果(图 6B)可知, DOX的M1为16.26%, 未光照处理的LPD的M1为22.69%, 光照处理的LPD的M1为25.70%, 未光照处理的LPD与光照处理的LPD的M1值分别是DOX的M1值的1.40倍和1.58倍(P < 0.05)。综上, 光照处理的LPD摄取情况最好。
4.3 ROS响应脂质体在细胞内的分布如图 6C所示, DOX呈现红色荧光, 溶酶体呈现绿色荧光, 细胞核呈现蓝色荧光。图中黄色荧光是DOX的红色荧光与溶酶体的绿色荧光重叠形成的。说明DOX进入细胞后主要分布于溶酶体。
4.4 ROS响应脂质体的摄取机制由图 6D可知, 非律平抑制剂组的DOX相对摄取量为(78 ± 3) %, 相对于对照组下降约20%, 说明非律平抑制剂显著抑制了DOX在MCF-7细胞的摄取(P < 0.05), 从而得出LPD进入细胞是通过小窝蛋白内吞进入。4 ℃组的DOX相对摄取量为(20 ± 5) %, 相对于对照组下降了80%, 说明LPD摄取需要能量。综上, LPD进入细胞的内吞途径是通过小窝蛋白介导的能量依赖型。
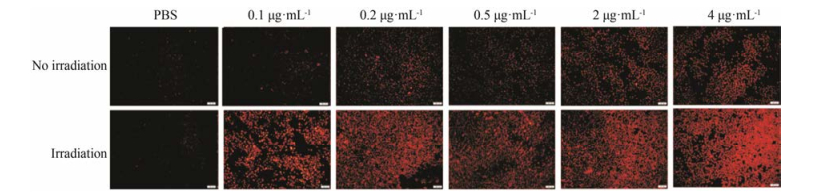
5 光敏ROS响应脂质体细胞内ROS检测由图 7可知, PBS光照前、光照(730 nm、1 200 mW·cm-2, 3 min)均没有红色荧光, 说明PBS在光照前后都不产生ROS。LP在PdPC(OBu)8质量浓度为0.1 μg·mL-1时基本看不到红色荧光, 说明LP在PdPC(OBu)8为0.1 μg·mL-1时不产生ROS, 随着PdPC(OBu)8浓度逐渐升高, LP的红色荧光逐渐增强, 说明即使在不光照时, PdPC(OBu)8浓度越高, 产生的ROS越多。LP在PdPC(OBu)8为0.1 μg·mL-1时光照后具有明显的红色荧光, 说明LP光照后产生大量的ROS, 同理, 在光照的情况下, PdPC(OBu)8浓度越高, 产生的ROS越多。综上说明, PdPC(OBu)8脂质体在活细胞内能产生少量ROS, 光照后产生大量ROS。
|
Figure 7 Dihydroeethidium (DHE) staining of ROS-responsive liposome |
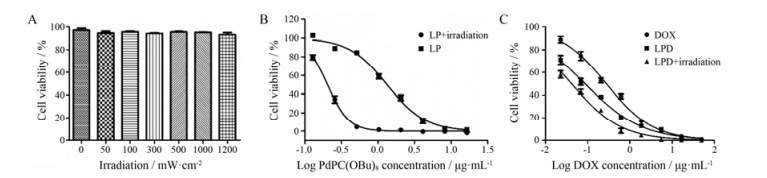
光照强度对MCF-7细胞没有毒性。实验表明, 即使光照强度达到1 200 mW·cm-2, 激光照射3 min, MCF-7细胞存活率大于90%, 说明光照强度达到1 200 mW·cm-2依然对MCF-7细胞没有毒性。因此, 1 200 mW·cm-2可以作为细胞实验激光照射的光照强度(图 8A)。
|
Figure 8 Cytotoxicity of different irradiation intensity (A). Cytotoxicity of liposome loaded with PdPC(OBu)8 (LP) on MCF-7 cells (B). Cytotoxicity of DOX or LPD on MCF-7 cells (C) |
LP在光照前对MCF-7细胞具有毒性, IC50为1.314 μg mL-1; 光照后细胞毒性显著增强, IC50为0.204 μg mL-1 (图 8B), 光照后LP的IC50下降84.5% (P < 0.05)。说明光照能使LP细胞毒性加强, 然而光照本身对细胞没有毒性, 此结果应该是光照与LP发生反应, 从而产生更强的细胞毒性。已有大量文献[17]报道光敏剂在光照后会产生1O2, 产生的1O2具有杀死细胞的作用, 这个作用称为光动力治疗。由此可见, LP在光照后产生1O2, 从而增强细胞毒性。这与体外ROS水平检测一致, LP光照后会产生ROS。
DOX是抗肿瘤药物, 游离DOX的IC50为0.280 μg·mL-1, LPD未光照时的IC50为0.090 μg·mL-1, 光照后IC50为0.040 μg·mL-1 (图 8C)。未光照的LPD与光照的LPD的IC50分别比DOX的IC50下降67.9%和84.7% (P < 0.05)。未光照时LPD比DOX的IC50值低, 说明LPD细胞毒性强于DOX; LPD光照时比未光照时具有更低的IC50值, 说明LPD光照后细胞毒性作用更强。因此LPD光照后具有最强的细胞毒性作用。
讨论本文首先采用硫酸铵梯度法制备了具有光敏剂PdPC(OBu)8与DOX的光敏ROS响应脂质体。以药物包封率、载药量、ROS响应速率和血清中稳定性为指标, 考察了不同磷脂、不同激光波长、DLPC用量、胆固醇用量和PdPC(OBu)8投药量对脂质体的影响, 最终确定了最优处方, 即5% DLPC、40%胆固醇和1:200药脂比的PdPC(OBu)8投药量。LPD在678 nm以300 mW·cm-2光照强度照射40 min后DOX释放率达到90%, 在730 nm以相同光照强度照射5 min后DOX释放率达到95.5%。因此, 选择730 nm作为激光照射波长。然而LPD在不光照的情况下DOX基本不释放, 说明LPD具有光敏性, 光照可以控制药物释放。对LPD的光敏释放机制进行研究发现, LPD在光照后产生大量1O2, 1O2作用于脂质体膜, 不可逆破坏其化学结构, 增强脂质体磷脂双分子层的通透性, 从而释放药物[18]。因此LPD具有ROS响应特性。
LPD的摄取发现, LPD光照后能显著增强DOX的荧光, 说明光照能促进LPD中DOX释放。最后检测细胞内ROS发现, ROS响应脂质体在光照后能产生大量ROS。进一步研究LPD的细胞毒性实验表明未光照LPD的IC50较游离DOX下降67.9%, 光照的LPD的IC50较游离DOX下降85.7%, 说明光照能显著增强LPD的细胞毒性, 这是LPD光照后产生1O2, 1O2具有光动力治疗作用, 因此LPD光照后细胞毒性显著增强[19]。
总之, 本研究初步证明了LPD具有ROS响应特性, 能够增强细胞毒性, 增强细胞摄取, 同时具有光动力治疗、化疗与光敏释药的作用, 具有潜在的抗肿瘤作用。今后尚待进一步考察LPD在动物体内的靶向性、药动学参数、安全性及体内抗肿瘤活性。
| [1] | Lee ES, Na K, Bae YH. Doxorubicin loaded pH-sensitive polymeric micelles for reversal of resistant MCF-7 tumor[J]. J Control Release, 2005, 103: 405–418. DOI:10.1016/j.jconrel.2004.12.018 |
| [2] | Li J, Yin T, Wang L, et al. Biological evaluation of redox-sensitive micelles based on hyaluronic acid-deoxycholic acid conjugates for tumor-specific delivery of paclitaxel[J]. Int J Pharm, 2015, 483: 38–48. DOI:10.1016/j.ijpharm.2015.02.002 |
| [3] | Timko BP, Arruebo M, Shankarappa SA, et al. Near-infrared-actuated devices for remotely controlled drug delivery[J]. Proc Natl Acad Sci U S A, 2014, 111: 1349–1354. DOI:10.1073/pnas.1322651111 |
| [4] | Landon CD, Park JY, Needham D, et al. Nanoscale drug delivery and hyperthermia:the materials design and preclinical and clinical testing of low temperature-sensitive liposomes used in combination with mild hyperthermia in the treatment of local cancer[J]. Open Nanomed J, 2011, 3: 38–64. |
| [5] | Poole KM, Nelson CE, Joshi RV, et al. ROS-responsive microspheres for on demand antioxidant therapy in a model of diabetic peripheral arterial disease[J]. Biomaterials, 2015, 41: 166–175. DOI:10.1016/j.biomaterials.2014.11.016 |
| [6] | Song CC, Du FS, Li ZC. Oxidation-responsive polymers for biomedical applications[J]. J Mater Chem B, 2014, 2: 3413–3426. DOI:10.1039/C3TB21725F |
| [7] | Rwei AY, Lee JJ, Zhan C, et al. Repeatable and adjustable on-demand sciatic nerve block with phototriggerable liposomes[J]. Proc Natl Acad Sci U S A, 2015, 112: 15719–15724. |
| [8] | Lee SH, Gupta MK, Bang JB, et al. Current progress in reactive oxygen species (ROS)-responsive materials for biomedical applications[J]. Adv Healthc Mater, 2013, 2: 908–915. DOI:10.1002/adhm.v2.6 |
| [9] | Lu GZ, Hou C, Zhong YQ, et al. Recent progress of reactive oxygen species-responsive drug delivery systems[J]. Acta Pharm Sin (药学学报), 2017, 52: 206–213. |
| [10] | Shim MS, Xia Y. A reactive oxygen species (ROS)-responsive polymer for safe, efficient, and targeted gene delivery in cancer cells[J]. Angew Chem Int Ed, 2013, 52: 6926–6929. DOI:10.1002/anie.201209633 |
| [11] | Ma N, Li Y, Ren H, et al. Selenium-containing block copolymers and their oxidation-responsive aggregates[J]. Polym Chem, 2010, 1: 1609–1614. DOI:10.1039/c0py00144a |
| [12] | Cao W, Gu Y, Li T, et al. Ultra-sensitive ROS-responsive tellurium-containing polymers[J]. Chem Commun, 2015, 51: 7069–7071. DOI:10.1039/C5CC01779C |
| [13] | Randles EG, Bergethon PR. A photodependent switch of liposome stability and permeability[J]. Langmuir, 2013, 29: 1490–1497. DOI:10.1021/la303526k |
| [14] | Luo D, Li N, Carter KA, et al. Rapid light-triggered drug release in liposomes containing small amounts of unsaturated and porphyrin-phospholipids[J]. Small, 2016, 12: 3039–3047. DOI:10.1002/smll.201503966 |
| [15] | Wei S, Zhou J, Huang D, et al. Synthesis and type Ⅰ/type Ⅱ photosensitizing properties of a novel amphiphilic zinc phthalocyanine[J]. Dyes Pigments, 2006, 71: 61–67. DOI:10.1016/j.dyepig.2005.06.016 |
| [16] | Sharman WM, van Lier JE. Synthesis and photodynamic activity of novel asymmetrically substituted fluorinated phthalocyanines[J]. Bioconjug Chem, 2005, 16: 1166–1175. DOI:10.1021/bc0500241 |
| [17] | Hou Z, Deng K, Li C, et al. 808 nm Light-triggered and hyaluronic acid-targeted dual-photosensitizers nanoplatform by fully utilizing Nd3+-sensitized upconversion emission with enhanced anti-tumor efficacy[J]. Biomaterials, 2016, 101: 32–46. DOI:10.1016/j.biomaterials.2016.05.024 |
| [18] | Meng QS, Zhang PC, Yin Q, et al. Photo-sensitive liposomes loading doxorubicin hydrochloride reverse drug resistance of breast cancer[J]. Acta Pharm Sin (药学学报), 2017, 52: 809–820. |
| [19] | Wang X, Meng G, Zhang S, et al. A reactive 1O2-responsive combined treatment system of photodynamic and chemotherapy for cancer[J]. Sci Rep, 2016, 6: 29911. DOI:10.1038/srep29911 |
 2017, Vol. 52
2017, Vol. 52


