2. 山西大学 化学化工学院, 山西 太原 030006;
3. 中国医学科学院药物研究所, 北京 100050;
4. 美国路易斯维尔大学, 肯塔基州 路易斯维尔 40292
2. College of Chemistry and Chemical Engineering, Shanxi University, Taiyuan 030006, China;
3. Institute of Materia Medica, Chinese Academy of Medical Sciences, Beijing 100050, China;
4. Department of Chemistry in University of Louisville, Louisville 40292, USA
黄芩为唇形科植物Scutellaria baicalensis Georgi的干燥根, 其性寒味苦, 具有清热燥湿、泻火解毒、止血、安胎的功效[1]。黄芩中的化学成分有黄酮类、挥发油类、萜类、甾醇类和一些有机酸类成分, 其中黄酮类是主要成分, 包括黄芩苷、黄芩素、汉黄芩苷、汉黄芩素、千层纸素、黄芩新素等[2-5]。
中药质量的优劣取决于有效成分的含量, 后者会随生长过程发生不同程度的动态变化, 因此适时采收是保证中药材质量的先决因素之一[6]。《中国药典》2015版规定黄芩于春、秋二季采挖[1], 民间也流传这样一句谚语:知母黄芩全年刨, 唯有春秋质量高。可见黄芩的质量与采收期有着密切的关系。目前大多数研究是采用高效液相色谱法, 测定黄芩苷或是几个黄酮类成分的含量变化来确定合适的采收期[7-10]。同时也有采用其他方法, 如刘素丽等[11]采用红外光谱三级鉴定法对春秋两季采收的黄芩化学成分差异进行研究, 张琳等[12]采用HPLC法测定黄芩不同生育期地上和地下部分活性成分的含量变化, 张文岭等[13]采用PAGE法从生理机制探讨黄芩不同器官在不同采收期生长代谢的差异, 为黄芩采收期的确定提供科学依据。
以上对于药材质量控制的研究仅局限于某几个特征成分, 忽略了其他成分的变化。而代谢组学从植物生物体系的整体性和动态性出发, 研究植物次级产物的动态变化, 不仅可以观察到有效成分的积累过程, 还可以发现各成分之间的相互转化规律, 可从整体上科学评价药材的质量。UHPLC-MS技术可将色谱的分离能力与质谱的定性功能相结合, 进行高精密度的目标物和非目标物的筛选。本实验利用基于UHPLC-MS/MS的代谢组学研究方法, 以不同年限不同采收期的黄芩为研究对象, 系统地分析不同采收期黄芩中化学成分的差异, 为确定黄芩最佳采收期提供参考, 也为科学制定黄芩药材质量控制标准提供理论依据。
材料与方法仪器与试剂 黄芩样本为2014年4~10月采集于山西省吕梁市石楼县益民药材种植合作社的不同发育期黄芩药材, 分一年生和两年生两个生长年限, 经本实验室秦雪梅教授鉴定为黄芩Scutellaria baicalensis Georgi的干燥根, 标本现保存于山西大学中医药现代研究中心。
超高效液相色谱与质谱联用仪(Thermo Scientific Q Exactive LC-MS), 美国Thermo公司; 色谱柱: ACQUITY UPLC HSS T3 (2.1 mm × 100 mm, 1.8 μm), 十八烷基键合硅胶为填充剂, 美国Waters公司; 色谱乙腈(美国Fisher Chemistry公司); 水为娃哈哈纯净水。对照品:黄芩苷(MUST-15012813, 质量分数≥98%)、黄芩素(MUST-14406220, 质量分数≥98%)、汉黄芩苷(H0139-20140211, 质量分数≥98%)、汉黄芩素(H0138-20140612, 质量分数≥98%)、千层纸素A (Q0151-20131228, 质量分数≥98%)、千层纸素A-7-O-β-D-葡萄糖醛酸苷(Q6376-20140115, 质量分数≥98%)购自中国科学院成都生物研究所。
样品制备 精密称取黄芩样品粉末各150 mg置于具塞试管中, 加入70%乙醇50 mL, 称重, 80 ℃超声提取1 h, 称重, 用70%乙醇补足减失重量, 静置, 过滤。取续滤液, 用0.22 μL微孔滤膜过滤, 即得。所有检测样品均平行备样8份。QC (quality control)样本由所有待测样品各取等量混合而成。QC样本是具有代表性的平均样本, 每8针样品进样结束后进一次样, 用于检测仪器的稳定性。
色谱条件 流动相: A为乙腈, B为0.1%甲酸水溶液, 梯度洗脱程序: 0~4 min, 15%~23% A; 4~8 min, 23%~25% A; 8~10 min, 25%~27% A; 10~14 min, 27%~50% A; 14~18 min, 50%~52% A; 18~20 min, 52%~90% A; 20~22 min, 90% A; 22~22.5 min, 90%~5% A; 22.5~25 min, 15% A; 流速为0.30 mL·min-1, 柱温为40 ℃, 样品池温度为15 ℃, 进样体积为1 μL。
质谱条件 采用电喷雾正离子检测模式, 雾化气体为高纯度氮气(N2), 碰撞气体为高纯度氦气(He), 采用全扫描质谱和二级质谱, 质量扫描范围: 100~1 500 Da, 锥孔电压: 40 V, 毛细管电压: 3.0 kV, 离子源温度: 120 ℃, 脱溶剂气温度: 300 ℃, 脱溶剂气体流速: 600 L·h-1, 锥孔气体流量50 L·h-1, 碰撞能量(CE) 50~80 V, 采用亮氨酸脑啡肽作为校正溶液, [M+H]+ m/z 556.276 1。
数据处理 运用UHPLC-MS/MS方法对所采集的黄芩样品进行分析测定, 得到所有样品的总离子流图, 并进行数据预处理包括奇异点剔除、去噪、基线校准、重叠峰分析、峰对齐、峰识别、峰特征提取、标准化、归一化等。所得质谱矩阵数据通过Thermo公司自带sieve软件生成并导出。
将UHPLC-MS/MS数据再分别导入SIMCA-P 13.0 (Umetrics, umeå, Sweden)软件, 首先运用PCA进行无监督分析, 从整体上观察各组分离趋势。为了突出组间差异, 便于后续寻找差异代谢物, 采用有监督的偏最小二乘法(PLS-DA)对数据进行分析, 再用PLS-DA的permutation test对模型的可靠性进行验证, 最后用载荷图确定对分类有显著贡献的变量, 规格化方法为Par (VIP > 1)。根据分析结果, 找出差异代谢物, 运用Origin (8.0, OriginLab, USA)软件对不同年限的不同采收期差异代谢物相对含量分别进行分析, 最后再运用Metabo Analyst 3.0 (http://www.metaboanalyst.ca/faces/ModuleView.xhtml)的Statistical Anaiysis功能进行差异代谢物间的含量相关性分析。
结果 1 不同采收期黄芩中的化合物指认对比两个生长年限的不同采收期黄芩UHPLC-MS/MS Base Peak图, 可直观发现不同采收期黄芩中的化学成分种类基本相同, 含量却有所差异。图 1为黄芩总离子流图, 由于黄芩在正离子模式下通过sieve软件导出获得的化合物信号多于负离子模式且正离子模式下空白溶剂的信号较低, 因此本文采用正离子模式检测。结合文献[14-16]以及对照品, 依据UHPLC-MS/MS矩阵中的保留时间、质荷比及碎片离子对黄芩中的代谢产物进行指认, 共推断指认出27个次级代谢产物(表 1)。
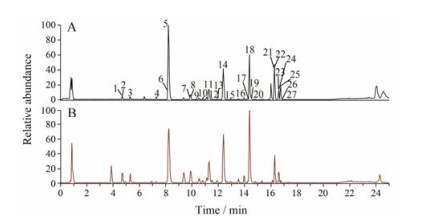
|
Figure 1 Total ion chromatogram of Scutellaria baicalensis Georgi by UHPLC-MS/MS. A: Positive ion mode; B: Negative ion mode; 1-27 in A can be found in Table 1 |
| Table 1 Compounds identified by UHPLC-MS/MS in Scutellaria baicalensis Georgi. *Identification result obtained by comparing with authentic standard |
将预处理后的数据导入SIMCA-P 13.0软件进行PCA分析和PLS-DA分析, 通过载荷图和VIP值(> 1)寻找差异代谢物。
PCA分析的得分散点图能直观地显示不同样品之间的整体差异[17]。图 2A和图 2B分别为一年生和两年生不同采收期黄芩PCA散点图, 由图可见QC样本紧密聚集, 证明了仪器在整个检测分析过程中的稳定性。不同采收期黄芩各聚一类, 具有明显差异, 且呈现一定趋势, 箭头轨迹表明了不同采收期黄芩中化学成分随时间呈现的动态、渐变趋势, 并且一年生与两年生的变化趋势一致, 可相互佐证实验结果的准确性。
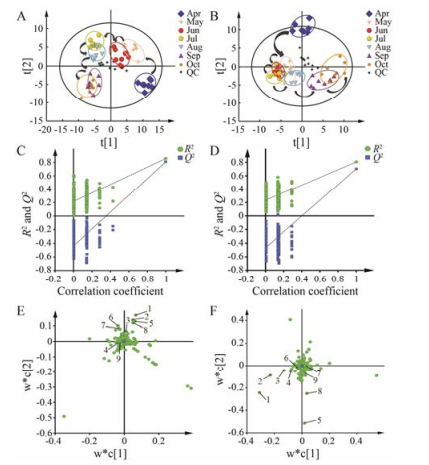
|
Figure 2 Multivariate statistical analysis charts of Scutellaria baicalensis Georgi in different harvest periods. A, C, E: Annual; B, D, F: Biennial; A, B: PCA scores plot; C, D: Permutations plot for PLS-DA model; E, F: PLS-DA loading plot. 1: Baicalein; 2: Wogonin; 3: Oroxylin A; 4: Kullcapflavone Ⅱ; 5: Baicalin; 6: Oroxylin A-5-O-glucopyranoside; 7: Oroxylin A-7-O-glucuronopyranoside; 8: Wogonoside; 9: 5, 6, 7-Trihydroxy-8-methoxyflavone-7-O-glucuronopyranoside |
为进一步研究不同采收期黄芩之间的差异, 并确定潜在的差异代谢物, 采用PLS-DA进行后续分析。PLS-DA分析是有监督的模式识别方法, 着重强调组间的差异, 而将组内的差异降至最低, 更能把握多维数据的整体特征和变异规律。SIMCA软件在Autofit建模时自动进行内部交叉验证, 寻找最优化模型, 应用拟合度(R2Y)和预测度(Q2)对模型有效性进行评价, 一般R2Y值较大, Q2 > 0.5表明该模型良好。本实验的PLS-DA模型, 一年生样本R2Y = 0.791, Q2 = 0.596, 两年生样本R2Y = 0.786, Q2 = 0.512。其后进行置换检验, 排列实验是一种外部验证方法, 主要用于验证PLS-DA模型的拟合程度, PLS-DA模型排列实验(n = 200)中左端任何一次随机排列产生的R2、Q2值均小于右端的原始值, Q2截距值等于或小于0, 则表明模型有效, 可以做后续的差异成分寻找[18-24]。图 2C和图 2D为模型验证图, 由图中可知本研究所用模型有效, 不存在过拟合现象, 可用于进行后续组间差异成分的寻找及分析。图 2E和图 2F分别是一年和两年生不同采收期样本PLS-DA分析对应的载荷图。基于UHPLC-MS/MS数据, 通过载荷图和VIP值(> 1)寻找, 在一年生和两年生样本中分别发现46个和34个差异代谢物, 两个不同生长年限中已指认出的差异代谢物各有9个, 且均为黄芩苷、黄芩素、汉黄芩苷、汉黄芩素、千层纸素A、千层纸素A-7-O-葡萄糖醛酸苷、千层纸素A-5-O-葡萄糖苷、黄芩黄酮Ⅱ和5, 6, 7-三羟基-8-甲氧基黄酮-7-O-葡萄糖醛酸苷。分析差异代谢物的VIP值可以发现, 两个生长年限的样本中, 对组间差异贡献最大的成分均为黄芩苷, 此外也存在黄芩素等其他对组间差异具有较大贡献的成分, 证明了传统黄芩质量评价中以黄芩苷含量作为指标的合理性与不充分性。
3 差异代谢物含量的变化趋势为直观展示各差异代谢物随采收期的动态变化过程, 对9个差异代谢物在不同采收期的相对含量做折线图。图 3可以看出, 两年生样本中各化合物含量整体高于一年生样本, 但二者变化趋势基本一致。黄酮苷类成分含量在5、6月左右达到峰谷后逐渐上升, 在7、8月左右达到峰顶, 之后黄芩苷、汉黄芩苷和5, 6, 7-三羟基-8-甲氧基黄酮-7-O-葡萄糖醛酸苷呈先下降后升高的趋势, 千层纸素A-5-O-葡萄糖苷和一年生千层纸素A-7-O-葡萄糖醛酸苷则逐渐下降, 至10月时接近5、6月峰谷时的含量水平。黄芩素、汉黄芩素和千层纸素A这些苷元类成分在5月时含量达到峰顶, 之后逐渐降低, 10月时含量降低到与4月大致相同, 一年生样本除在7月时略有升高, 其他基本相同。李化等[9]研究发现, 黄芩苷等苷类成分含量在萌发期(5月)和盛花期(8月)达最大值, 黄芩素等苷元类成分含量在萌发期(5月)较高, 之后逐渐降低, 宋国虎等[10]研究发现, 黄芩苷含量在8月达最高值, 本文的研究结果与之相一致。
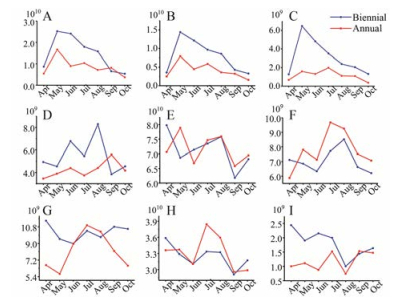
|
Figure 3 The relative contents of biomarkers of different harvest periods of Scutellaria baicalensis Georgi. A: Baicalein; B: Wogonin; C: Oroxylin A; D: Kullcapflavone Ⅱ; E: Baicalin; F: Oroxylin A-5-O-glucopyranoside; G: Oroxylin A-7-O-glucuronopyranoside; H: Wogonoside; I: 5, 6, 7-Trihydroxy-8-methoxyflavone-7-O-glucuronopyranoside |
次生代谢产物通常是中药的主要药效成分, 是植物在长期进化中适应环境的结果, 同种植物在不同生长环境下所产生的次级代谢物不会完全相同:一方面, 物理、化学及生物等因素胁迫会引起植物体内次生代谢产物的增多[25]; 另一方面, 植物往往会因其对环境条件变化的敏感性而诱导某些特定次生代谢产物的合成[26], 郭兰萍等[27]发现各种生态因子对黄芩次生代谢产物积累的影响及强度各不相同。因此, 本实验中不同采收期黄芩的活性成分含量和动态变化的差异, 与黄芩各生育期的生理状态以及外界环境对于黄芩黄酮生物合成的影响有关。
4 差异代谢物的相关分析为了寻找不同采收期黄芩样品的差异代谢物之间的相互关系, 运用Metabo Analyst 3.0进行相关性分析。分别计算同一年限差异代谢物的Pearson相关系数, 并以相关矩阵的形式作聚类相关系数图(图 4), 其中红色表示正相关, 蓝色表示负相关, 颜色越深表示相关性越大, 反之越小。
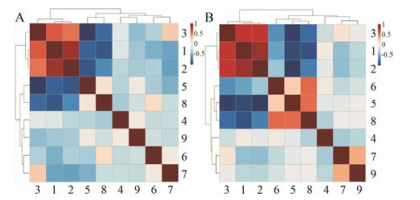
|
Figure 4 Cluster analysis of the correlation coefficient between biomarkers in different harvest periods (A: Annual; B: Biennial). 1: Baicalein; 2: Wogonin; 3: Oroxylin A; 4: Kullcapflavone Ⅱ; 5: Baicalin; 6: Oroxylin A-5-O-glucopyranoside; 7: Oroxylin A-7-O-glucuronopyranoside; 8: Wogonoside; 9: 5, 6, 7-Trihydroxy-8-methoxyflavone-7-O-glucuronopyranoside |
由图 4可见, 一年生与两年生差异代谢物结果与相关关系大体一致, 且两年生黄芩中差异代谢产物间总体相关性较强。从聚类结果看, 图 4A和图 4B均是黄芩素、汉黄芩素和千层纸素A等黄酮苷元类成分聚在一起, 黄芩苷、汉黄芩苷、千层纸素A-5-O-葡萄糖苷、千层纸素A-7-O-葡萄糖醛酸苷等黄酮苷类成分聚在一起, 这说明同类化学结构的化合物在生物体内有较强的相关性。从相关系数看, 图 4A和图 4B均是黄酮苷元之间呈强正相关, 黄酮苷类成分呈弱正相关, 黄酮苷与苷元间呈强负相关, 这与它们的含量变化趋势相吻合, 但对比一年生和两年生黄芩样本, 某些差异代谢物的含量相关性仍具有一定差异。由上述分析可知, 在黄芩植物发育过程中, 同类成分(苷、苷元类成分)变化规律一致, 推断它们可能具有相似的生物合成途径; 而苷和苷元类成分则相反, 推断它们之间可能存在相互转化的途径。
研究认为黄芩类黄酮的生物合成代谢主要是通过苯丙烷途径, 苯丙氨酸解氨酶(PAL)、肉桂酸-4-羟基化酶(C4H)、4-香豆酸辅酶A连接酶(4CL)是将苯丙氨酸转变成活化的香豆酰-CoA的3个关键酶, 从香豆酰-CoA到各种类黄酮的转化也受相应酶的调节, 其中部分代谢酶的基因及其功能已经获得克隆和验证[28]。随着对此过程的深入研究, 最新结果发现黄芩中黄芩素等黄酮类成分还具有区别于标准黄酮的特殊的苯丙烷生物合成途径[29]。但是环境因子具体如何影响生物合成过程中关键酶的表达以及相关基因转录水平尚未完全清楚, 还有待继续进行研究。
讨论本实验成功建立了黄芩药材的UHPLC-MS/MS代谢组学分析方法, 方法稳定可行, 并利用代谢组学技术实现了对不同采收期黄芩化学成分的整体性评价。研究结果表明, 在不同采收季节的黄芩化学成分差异明显, 并呈规律性的变化:以5月为界黄芩素、汉黄芩素和千层纸素A含量整体呈先上升后下降的趋势; 黄芩苷等苷类成分含量在5~6月位于峰谷, 之后逐渐上升, 至7~8月达到峰顶后逐渐下降, 其中黄芩苷和汉黄芩苷在9月时又逐渐上升。综合黄芩中各化学成分随生长过程的含量变化规律, 若以黄芩素等黄酮苷元类成分为目标成分, 则建议采收时间为5月; 若以黄芩苷等黄酮苷类成分为目标成分, 则建议最佳采收时间在7~8月; 另外, 若仅以黄芩苷为目标成分, 则建议最佳采收时间在4月和8月。
本研究借助代谢组学方法对不同采收期黄芩化学成分的动态变化进行了研究, 还对目标成分的含量变化进行了跟踪, 最终规定了几种用于不同用途的黄芩药材采收期, 为深入研究黄芩质量提供参考和借鉴, 同时也为其他中药材的质量评价和控制提供了一种新的模式和手段。
| [1] | Chinese Pharmacopoeia Commission. The Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[M]. 2015 ed. Part Ⅰ. Beijing: China Medical Science Press, 2015: 301-302. |
| [2] | Wang YF, Li T, Tang ZH, et al. Progress on chemical composition and pharmacological activities of Scutellariae Radix[J]. Chin Arch Tradit Chin Med (中华中医药学刊), 2015, 33: 206–211. |
| [3] | Tomimori T, Miyaichi Y, Imoto Y, et al. Studies on the constituents of Scutellaria species. Ⅳ. On the flavonoid constituents of the root of Scutellaria baicalensis Georgi (4)[J]. Yakugaku Zasshi, 1984, 104: 524–528. DOI:10.1248/yakushi1947.104.5_524 |
| [4] | Li HB, Jiang Y, Chen F. Separation methods used for Scutellaria baicalensis active components[J]. J Chromatogr B Anal Technol Biomed Life Sci, 2004, 812: 277. DOI:10.1016/S1570-0232(04)00545-8 |
| [5] | Tomimori T, Jin H, Miyaichi Y, et al. Studies on the constituents of Scutellaria species. Ⅵ. On the flavonoid constituents of the root of Scutellaria baicalensis Georgi (5). Quantitative analysis of flavonoids in Scutellaria roots by high-performance liquid chromatography[J]. Yakugaku Zasshi, 1985, 105: 148–155. DOI:10.1248/yakushi1947.105.2_148 |
| [6] | Duan JA, Yan H, Su SL, et al. Establishment and practice for evaluating model of best harvest time of traditional Chinese medicinal materials[J]. Chin Tradit Herb Drugs (中草药), 2010, 41: 1755–1760. |
| [7] | Zhang YQ, Liu JH, Jia LI, et al. Study on the optimal harvesting period of Scutellariae baicalensis Georgi[J]. Res Pract Chin Med (现代中药研究与实践), 2009, 23: 1–3. |
| [8] | Yu AN, Wang XP, Zhao JJ. Suitable harvest time of cultivating Scutellariae baicalensis in Ningxia Liupan Mountain[J]. Chin J Exp Tradit Med Formulae (中国实验方剂学杂志), 2013, 19: 161–167. |
| [9] | Li H, Huang LQ, Jiang JC, et al. Fingerprint of Scutellaria baicalensis at different growth[J]. Chin Pharm J (中国药学杂志), 2008, 43: 1140–1142. |
| [10] | Song GH, Yan YH, Zhang XW, et al. A study on dynamics of growth and development and active component of biennial Scutellaria baicalensis Georgi[J]. Chin J Exp Tradit Med Formulae (中国实验方剂学杂志), 2013, 19: 121–124. |
| [11] | Liu SL, Chen JB, Zhou Q, et al. Analysis of the harvest seasons of Scutellaria baicalensis Georgi by tri-step identification of infrared spectroscopy and principal component analysis[J]. Spectrosc Spectrom Anal (光谱学与光谱分析), 2012, 32: 2669–2673. |
| [12] | Zhang L, Liu W, Wang X, et al. Dynamic changes of active constituents in different growth stage of Scutellaria baicalensis[J]. Chin J Exp Tradit Med Formulae (中国实验方剂学杂志), 2013, 19: 127–131. |
| [13] | Zhang WL, Jin WR, Shi JY. Studies of peroxidase isozymes at serial harvest time points from different organs of Scutellaria baicalensis Georgi[J]. J Shandong Univ Tradit Chin Med (山东中医药大学学报), 2011, 35: 548–551. |
| [14] | Liu DW, Yan GL, Fang Y, et al. Utility of UPLC-ESI-TOF/MS for rapid analysis of the constituents in Scutellariae Radix[J]. Chin J Inf Tradit Chin Med (中医药信息), 2012, 29: 20–24. |
| [15] | Liu G, Ma J, Chen Y, et al. Investigation of flavonoid profile of Scutellaria bacalensis Georgi by high performance liquid chromatography with diode array detection and electrospray ion trap mass spectrometry[J]. J Chromatogr A, 2009, 1216: 4809–4814. DOI:10.1016/j.chroma.2009.04.021 |
| [16] | Zhao SN, Li SZ. Study on flavonoid in Scutellaria baicalensis Georgi by HPLC-MS[J]. J Chengde Med Coll (承德医学院学报), 2012, 29: 345–347. |
| [17] | JY A. Analysis of metabolomic data:principal component analysis[J]. Chin J Clin Pharmacol Ther (中国临床药理学与治疗学), 2010, 15: 481–489. |
| [18] | Xue Y, Li XW, Li ZY, et al. UPLC/Q-TOF MS and NMR plant metabolomics approach in studying the effect of growth year on the quality of Polygala tenuifolia[J]. Acta Pharm Sin (药学学报), 2015, 50: 340–347. |
| [19] | Liu CF, Yang WZ, Liu KD, et al. Characterization of chemical constituents and in vivo metabolites of Kai-Xin-San prescripttion by HPLC/DAD/ESI-MSn[J]. J Chin Pharm Sci, 2012, 21: 569–579. |
| [20] | Lee JE, Lee BJ, Chung JO, et al. Geographical and climatic dependencies of green tea (Camellia sinensis) metabolites:a 1H NMR-based metabolomics study[J]. J Agric Food Chem, 2010, 58: 10582–10589. DOI:10.1021/jf102415m |
| [21] | Son HS, Hwang GS, Kim KM, et al. Metabolomic studies on geographical grapes and their wines using 1H NMR analysis coupled with multivariate statistics[J]. J Agric Food Chem, 2009, 57: 1481–1490. DOI:10.1021/jf803388w |
| [22] | Tarachiwin L, Katoh A, Ute K, et al. Quality evaluation of Angelica acutiloba Kitagawa roots by 1H NMR-based metabolic fingerprinting[J]. J Pharm Biomed Anal, 2008, 48: 42–48. DOI:10.1016/j.jpba.2008.04.025 |
| [23] | Tian D, Li ZY, Fan SC, et al. NMR-based analysis of water soluble extracts of different Astragali Radix[J]. Acta Pharm Sin (药学学报), 2014, 49: 89–94. |
| [24] | Consonni R, Cagliani LR, Stocchero M, et al. Triple concentrated tomato paste:discrimination between Italian and Chinese products[J]. J Agric Food Chem, 2009, 57: 4506–4513. DOI:10.1021/jf804004z |
| [25] | Huang LQ, Guo LP. Secondary metabolites accumulating and geoherbs formation under enviromental stress[J]. China J Chin Mater Med (中国中药杂志), 2007, 32: 277–280. |
| [26] | Su WH, Zhang GF, Li XH, et al. Relationship between accumulation of secondary metabolism in medicinal plant and environmental condition[J]. Chin Tradit Herb Drugs (中草药), 2005, 36: 1415–1418. |
| [27] | Guo LP, Wang S, Zhang J, et al. Effects of ecological factors on secondary metabolites and inorganic elements of Scutellaria baicalensis and analysis of geoherblism[J]. Sci China Life Sci, 2013, 56: 1047–1056. |
| [28] | Zhao Q, Chen XY, Martin C. Scutellaria baicalensis, the golden herb from the garden of Chinese medicinal plants[J]. Sci Bull, 2016, 61: 1391–1398. DOI:10.1007/s11434-016-1136-5 |
| [29] | Zhao Q, Yang Z, Gang W, et al. A specialized flavone biosynthetic pathway has evolved in the medicinal plant Scutellaria baicalensis[J]. Sci Adv, 2016, 2: e1501780. DOI:10.1126/sciadv.1501780 |
 2017, Vol. 52
2017, Vol. 52


