2. 解放军91837部队卫生队, 浙江 舟山 316291
2. Medical Corps, 91837 Unit, PLA, Zhoushan 316291, China
白念珠菌(Candida albicans)是一种机会性致病真菌, 通常存在于正常人肠道、口腔、上呼吸道和阴道等部位, 也是医院真菌血症的主要发病原因[1]。目前的药物主要有以氟康唑(fluconazole)、伊曲康唑(itraconazole)等为代表的唑类、以两性霉素B (amphotericin B)为代表的多烯类、以特比萘芬为代表的丙烯胺类和以卡泊芬净为代表的棘球白素类抗真菌药物。与此同时, 白念珠菌耐药导致临床上治疗失败的案例不断增加, 促使药物研究人员开发活性更高、毒性更低的新药, 第二军医大学药学院张万年教授课题组研发的艾迪康唑(iodiconazole), 对深部真菌和浅部真菌均显示出较好的抗菌性能, 目前已经完成了3期临床试验[2]。
对于抗白念珠菌候选化合物的活性分析, 主要参考美国临床和实验室标准协会(CLSI)所制定的标准CLSI-M27-A3, 最常用的方法是微量液基稀释法, 即96孔板法。孔板法虽然简单易用, 但存在一个重要的限速环节:它需要将真菌细胞菌落培养到所需浓度才能检测, 孵育时间一般为24 h或48 h。再加上手工步骤多、耗时长、试剂消耗量大、通量低等缺点, 不能满足临床对抗真菌药物日益增长的需求。
近年来, 微流控芯片技术作为最前沿的分析技术之一, 在药物筛选领域中的应用日益增多[3], 其中液滴微流控芯片(droplet microfluidic chip)是微流控芯片的分支, 采用非连续流技术生成高度单分散的纳升级至飞升级液滴, 并能对每个液滴进行平行独立控制和分析; 液滴尺寸与细胞大小相近, 可提供更加接近生理状态的微环境, 生物相容性高, 液滴微流控具有分析速度快、高通量、平行性、自动化、低消耗等优势, 有望进行高通量细胞水平的抗真菌药物筛选[4, 5]。
阿尔玛蓝(Alamar blue)又叫刃天青(resazurin), 是一种安全无毒的氧化还原指示剂[6], 能够透过活细胞的细胞膜, 不影响细胞正常的新陈代谢, 蓝色无荧光, 而在细胞内能被NADPH、NADH等代谢中间体和细胞色素类还原成粉红色或红色的强荧光物质试卤灵(resarufin), 产生亮度变化和荧光信号[7, 8]。阿尔玛蓝只在具有新陈代谢活性的细胞内才能转化, 因此可作活死染色(live/dead staining), 用于最小抑菌浓度(MIC)检测、快速毒性筛选、药物筛选、细胞活性和细胞增殖的定量分析、细胞凋亡、遗传学和免疫表型的研究[9-12]。
本文发展了一种用于筛选抗白念珠菌药物的液滴微流控芯片技术, 利用阿尔玛蓝在活细胞存在下能显示荧光信号的特性, 将其作为指示剂和药物、白念珠菌一起包裹在液滴中, 能快速检测候选化合物的抗真菌活性。选用临床常用的4种抗真菌药物和正在临床试验阶段的新药艾迪康唑分别进行活性分析, 并采用96孔板法来验证所建立方法的适用性。
材料与方法仪器 SC-1B匀胶机、BP-2B型烘胶台(北京创世威纳科技有限公司), JKG-2A光刻机(上海学泽光学机械有限公司), PDC-32G-2型等离子清洗机(美国Harrick公司), 微量精密注射泵(TJ-2A, 保定兰格公司), Olympus Ⅸ-71倒置显微镜(日本Olympus公司), SW-CJ-2D型双人单面净化工作台(苏州净化设备有限公司), Infinite M200多功能酶标仪(Tecan, 瑞士)。
试剂与药品 SU-8 3025光刻胶(美国Microchem公司), 硅单面抛光片和显影液(苏州汶颢芯片科技有限公司), SYLGARD®184 PDMS预聚体和固化剂(美国Dow Corning公司), HFE-7500 (美国3M公司), FC-40 (上海岁合电子科技有限公司), EA-surfactant (苏州工业园区龙兆生物科技研究院有限公司)。
RPMI 1640粉末(美国Gibco公司), 3-(N-吗啉)丙磺酸(3-morpholinopropanesulfonic acid, MOPS, 美国Sigma公司), 蛋白胨、琼脂、酵母浸膏(Bacto, BD, 美国), 葡萄糖购自上海强顺化学试剂有限公司, Na2HPO4、NaOH等无机盐均购自国药集团化学试剂有限公司。所有化学试剂除特殊说明外均为分析纯。阿尔玛蓝(刃天青)购自大连美仑生物技术有限公司, 氟康唑(≥98%)与两性霉素B (80%)购自美国Aladdin公司。卡泊芬净、5-氟胞嘧啶、特比萘芬购自上海陶素生化科技有限公司(Target Molecule), 纯度均>98%。艾迪康唑由第二军医大学药学院药物化学教研室制备, 纯度>98%。
储备液配制 阿尔玛蓝溶于纯水中配制成10 mg·mL-1的储备液, 4 ℃避光保存。两性霉素B、卡泊芬净、5-氟胞嘧啶、特比萘芬和艾迪康唑以DMSO溶解分别配制成0.8、0.8、6.4、3.2和0.2 mg·mL-1的母液, 保存于-20 ℃冰箱。
供试品溶液配制 参考CLSI-M27A3, 两性霉素B、卡泊芬净、5-氟胞嘧啶、特比萘芬的稀释浓度范围分别为0.031 3~16、0.015 7~8、0.125~64、0.062 5~32 μg·mL-1。参照Sun等[13]药理活性实验, 艾迪康唑质量浓度稀释范围设为2~0.003 91 μg·mL-1。阿尔玛蓝终质量浓度为125 μg·mL-1。
RPMI 1640液体培养基配制 取RPMI 1640粉末一包, 再称取NaHCO3 2.0 g、MOPS 34.5 g (0.165 mol·L-1), 加入三蒸水900 mL溶解, 用NaOH调整pH值至7.0, 用三蒸水定容至1 L, 0.22 μm微孔滤膜过滤除菌, 分装后于4 ℃保存备用。
菌株 白念珠菌SC5314菌株由第二军医大学药学院新药研究中心保存并提供。
菌悬液制备 从4 ℃保存的沙堡葡萄糖琼脂(Sabouraud dextrose agar, SDA)固体培养基上挑取单克隆真菌群落, 转移至1 mL酵母浸出粉胨葡萄糖(yeast extract peptone dextrose, YPD)培养基中, 于30 ℃、200 r·min-1振荡培养16 h, 使真菌处于指数生长期后期。取菌液离心去上清, 收集细胞, 用PBS洗涤3次, 去除残余的培养基, 重悬于RPMI 1640液体培养基中。用RPMI 1640液体培养基调整菌液浓度为两倍终浓度(2×103~10×103 CFU·mL-1), 实验时与药物溶液(含指示剂)等比混合得终浓度(1×103~5×103 CFU·mL-1)。
液滴微流控芯片的设计与制作 本实验使用自行设计制作的液滴微流控芯片, 芯片二维设计如图 1。该芯片包含一个油相入口和一个水相入口, 采用标准软光刻技术[14]制作而成。芯片主通道宽为100 μm, 十字形流动聚集处宽为30 μm, 芯片通道高度为45 μm。
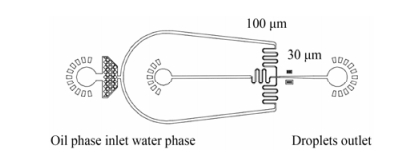
|
Figure 1 Design of droplet microfluidic chip |
液滴微流控芯片的系统考察 在芯片应用前, 分别考察了芯片系统的适用条件和液滴稳定性。比较了FC-40和HFE-7500作为油相, 分别与水相作用生成液滴的效果。并对不同的水相流速和油相流速进行考察, 水相流速为15~100 μL·h-1, 油相流速为30~200 μL·h-1, 以在较短时间内生成大小适中的液滴为佳。生成后的液滴收集到0.2 mL离心管中, 每天涂布于载玻片上观察其形态和尺寸大小, 观察液滴存放0至5天的形态稳定性。
液滴微流控芯片实验 采用RPMI 1640液体培养基配制10个不同药物浓度的混合水相溶液, 包含白念珠菌、药液、阿尔玛蓝。设定生长对照组(无药含菌)和空白对照组(无菌)。油相为HFE-7500 (含1% EA-surfactant)。水相配制完成后立即通入芯片与油相作用生成液滴。液滴收集到0.2 mL离心管孵育, 2 h后取少量中间层液滴涂载玻片于显微镜下观察荧光情况。
96孔板实验 参照CLSI-M27A3推荐的微量液基稀释法, 配制两性霉素B、卡泊芬净、5-氟胞嘧啶(5-FC)、特比萘芬和艾迪康唑的药敏板, 每个浓度设置6行复孔, 分作两组。设立空白对照孔(不含药物和菌液, 只含200 μL RPMI 1640培养液)和无药生长对照孔(为100 μL含2% DMSO的RPMI 1640培养液)。第一组为显色组, 每孔加入菌液(含2.5 μL阿尔玛蓝溶液) 100 μL; 第二组为直接观察组, 每孔加入菌液(不含阿尔玛蓝溶液) 100 μL。阿尔玛蓝的终质量浓度为125 μg·mL-1。参照M27-A3, 35 ℃孵育24 h后观察(5-FC孵育48 h)。
终点时, 显色组无药生长对照孔有白念珠菌生长, 蓝色变为粉红色或红色, 同时空白对照孔保持蓝色, 以刚变粉红色的前一个孔为MIC值。直接观察组是手持孔板对光从下方观察其底部, 生长对照孔出现白色斑点或浑浊, 则表明真菌生长良好, 同时空白对照孔保持透明清澈, 提示无微生物污染, 结果才有意义。
结果 1 芯片系统考察为了生成大小均匀、形状稳定的液滴, 需要选择合适的水油两相体系。实验发现采用FC-40为油相时, 液滴生成过程不稳定, 经常出现乱流, 而且水油流速比大于1时油相难以切断水相; 生成的液滴不稳定, 放置很短时间就发生严重的合并现象, 不能满足实验要求。采用HFE-7500时, 与水相较容易生成液滴, 油水速度比调整范围较大, 可以采用大流速生成液滴, 且液滴可以放置较长时间。最后选择HFE-7500作为油相, 其中含1% EA-surfactant表面活性剂以增加液滴稳定性。
芯片上的两相流速的考察结果表明, 水相流速15 μL·h-1、油相流速30 μL·h-1时, 流经20 cm导管约需要2 h, 耗时太长。水相和油相流速分别为100和200 μL·h-1时, 液滴大小一致性较好, 但液滴较小; 水相和油相流速分别为80和100 μL·h-1时, 液滴大小和时间(9 min)较合适, 此时液滴直径约50 μm, 体积约65 pL, 生成液滴速度约为每秒2.2×104个。
2 生成液滴的稳定性考察液滴生成后收集到0.2 mL离心管中, 保存的液滴每天涂布于载玻片上观察, 液滴总体形态非常稳定, 尺寸大小保持基本一致。个别液滴偏大或偏小, 这可能是因为出口导管收集了前期液流未稳定时生成的液滴。结果发现, 从收集当天(0天)到放置1、2、3天, 液滴保持形态完好, 表明在离心管收集孵育的条件稳定性高, 完全满足实验要求。实际上, 第5天的液滴形态也基本保持完整。
3 液滴中药物与白念珠菌作用的检测终点在单细胞包裹液滴中, 当药物抑制或者杀灭真菌细胞时, 氧化还原指示剂无变化, 液滴不亮, 显示与空液滴一样的背景色。当药物浓度低于MIC时, 真菌细胞生长有活性, 指示剂转化显示荧光, 液滴变亮, 而空液滴保持不变。由此可以判断药物的MIC。终点液滴涂片观察时, 空白对照组(无菌)全部液滴不亮, 有较弱的背景暗光(图 2A); 无药阳性对照组的白念珠菌有生长活动, 荧光检查时可发现少数明显的亮液滴(图 2B)。以不出现亮液滴的最低浓度为MIC。

|
Figure 2 Droplets observed under a fluorescent microscope. A: Control group without Candida albicans; B: Candida albicans group |
单细胞包裹的液滴中, 随着时间推移, 阿尔玛蓝被转化的量越多, 荧光信号越强烈。为使阿尔玛蓝有转化与无转化的液滴的荧光信号差异增大, 可适当增加孵育时间。白念珠菌细胞经过一次传代历时1.5~2 h, 可选定2 h作为终点检测时间。实验发现, 与空白组相比, 2 h后生长阳性组有强烈的荧光信号, 液滴明显变亮。结果说明孵育2 h作为终点观察时间是可行的。
4 液滴微流控芯片药敏实验以4种已知的抗真菌药物为对象, 考察芯片上运行情况, 以两性霉素B实验结果为例, 液滴涂片观察时可见0.5 μg·mL-1及更低浓度都发现有明显的亮液滴, 而在1 μg·mL-1及以上浓度未见, 说明该药对该批次菌株的MIC为1 μg·mL-1, 见图 3。两性霉素B的96孔板结果的最大变色/变浑浊孔为0.5 μg·mL-1, 说明MIC值为1 μg·mL-1。M27-A3标准中关于两性霉素B对白念珠菌的MIC为0.25~1 μg·mL-1, 本结果符合要求。因此, 芯片实验的结果与孔板法的结果符合程度非常好, 说明液滴微流控芯片可以初步应用于抗真菌药物筛选(表 1)。
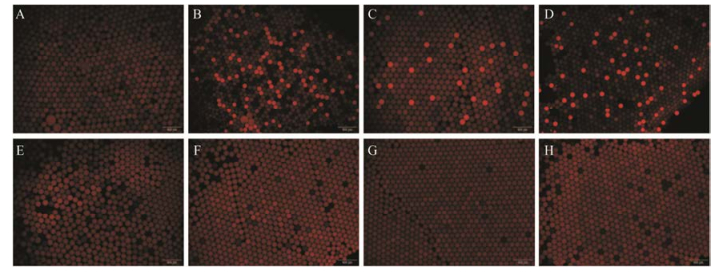
|
Figure 3 Droplets contain amphotericin B at different concentrations (0.25-8 μg·mL-1) and Candida albicans cells after being incubated for 2 h. A: Control group; B: Candida albicans; C: 0.25 μg·mL-1; D: 0.5 μg·mL-1; E: 1 μg·mL-1; F: 2 μg·mL-1; G: 4 μg·mL-1; H: 8 μg·mL-1 |
| Table 1 MIC values of four drugs against Candida albicans SC5314 |
采用所建立的液滴微流控芯片法进行抗真菌药物筛选初步应用, 以新药艾迪康唑为研究对象, 参考Sun等[13]报道的艾迪康唑对白念珠菌MIC<0.062 5 μg·mL-1, 为使该值落于考察范围中间, 本实验设定质量浓度考察范围为2~0.003 91 μg·mL-1。芯片法筛选结果显示, 出现亮液滴的最大浓度为0.062 5 μg·mL-1, 两倍浓度为0.125 μg·mL-1 (MIC)。同时平行进行96孔板法, 所得结果显示两种方法结果一致。
讨论微流控芯片作为一门新兴技术, 其微型化、集成化、高通量的优势在药物筛选领域有广阔的应用前景[15]。液滴微流控作为微流控芯片的一个分支, 通过使用两相互不相容的流体生成单分散的数量众多的微反应器[16]。微米级别的通道在尺寸上与细胞接近, 适用于研究单细胞水平的行为[17], 有望揭示被群体效应掩盖的单个细胞水平上的差异, 从而促进新药开发、疾病诊断等研究。
本文建立了一种基于液滴微流控芯片的抗白念珠菌药物筛选方法, 通过将药物和菌液、指示剂等包裹在约65 pL的液滴中, 每秒可以生成2万多个液滴, 9 min可以收集约27 μL液滴用于观察, 在大量液滴积累的基础上增加了结果的可靠性, 减小了误差引入的可能性, 同时节约了大量的试剂和药品, 对于珍稀药品的药敏试验有绝对优势。每个液滴相互隔离作为独立的微反应器, 其作用结果互不干扰, 也保证了结果的准确性。
本文所用液滴微流控芯片主要用于生成液滴作为微反应器, 包裹药物和白念珠菌细胞, 测定药物的MIC值。在自行设计制作芯片时, 对液滴生成通道结构即T型结构和流动聚集结构, 分别进行了考察。由于流动聚集结构比T型结构在液滴生成过程中更加稳定可控, 因此生成通道选用流动聚集结构。并且在液滴生成处的上游增加蜿蜒的弯曲通道结构, 用来缓冲液流的压力波动, 减少外界震动的影响, 维持系统稳定。液滴生成时, 水相(分散相)的流速越大, 则生成液滴时需要的剪切力越大, 油相(连续相)的流速要求更大。本实验适当增大流速有助于缩短液滴从收集导管流出的时间, 可快速收集液滴。
在液滴内包裹白念珠菌细胞, 以阿尔玛蓝的荧光变化指示细胞代谢活性, 检测方式灵活简便; 白念珠菌传代一次即可转化相当浓度的指示剂, 可在微小的液滴内产生强烈的荧光信号, 传代一次时间(为1.5~2 h)即可作为液滴内孵育时间, 而与CLSI-M27-A3标准建议微量稀释法需要的24 h (甚至48 h或更多)相比, 大大节约时间。在96孔板上常采用三重复的方式以考察重复性, 而液滴微流控芯片短时间内即可产生大量包裹真菌细胞的液滴, 保证液滴活性分析的重现性。
本研究选取了4种临床应用的抗真菌药物两性霉素B、卡泊芬净等, 在液滴内测定了其MIC值与孔板法对照, 结果完全一致; 与M27-A3标准所认定的MIC值相符合, 验证了该方法的可靠性。然后, 用所发展的芯片方法测定新药艾迪康唑的MIC值, 与孔板法对照, 一致性良好。
结论本文发展了基于液滴微流控芯片技术的抗白念珠菌药物筛选方法, 具有检测时间短、试剂消耗少、操作简便的优势, 适合于抗真菌药物活性的快速分析, 为抗真菌药物的研究与开发提供了一种新方法。后续研究可在芯片上实现多种药物同时在线筛选, 发挥液滴微流控芯片的最大优势, 实现高通量, 加快抗真菌药物的筛选进程。
| [1] | Tong YQ, Tang JG. Candida albicans infection and intestinal immunity[J]. Microbiol Res, 2017, 198: 27–35. DOI:10.1016/j.micres.2017.02.002 |
| [2] | Sheng CQ, Zhang WN, Ji HT, et al. Innovative design of novel antifungal agents[J]. Chin J New Drugs (中国新药杂志), 2004, 13: 97–102. |
| [3] | Hou FH, Ye JQ, Chen ZG, et al. Advances on enzymes and enzyme inhibitors research based on microfluidic devices[J]. Acta Pharm Sin (药学学报), 2010, 45: 694–698. |
| [4] | Brouzes E, Medkova M, Savenelli N, et al. Droplet microfluidic technology for single-cell high-throughput screening[J]. Proc Nat Acad Sci U S A, 2009, 106: 14195–14200. DOI:10.1073/pnas.0903542106 |
| [5] | Scanlon TC, Dostal SM, Griswold KE. A High-throughput screen for antibiotic drug discovery[J]. Biotechnol Bioeng, 2014, 111: 232–243. DOI:10.1002/bit.25019 |
| [6] | Ansar Ahmed S, Gogal Robert M, Walsh Jane E. A new rapid and simple non-radioactive assay to monitor and determine the proliferation of lymphocytes:an alternative to[3H]thymidine incorporation assay[J]. J Immunol Methods, 1994, 170: 211–224. DOI:10.1016/0022-1759(94)90396-4 |
| [7] | Alnasiry S. The use of Alamar blue assay for quantitative analysis of viability, migration and invasion of choriocarcinoma cells[J]. Hum Reprod, 2007, 22: 1304. DOI:10.1093/humrep/dem011 |
| [8] | Bonnier F, Keating ME, Wrobel TP, et al. Cell viability assessment using the Alamar blue assay:a comparison of 2D and 3D cell culture models[J]. Toxicol In Vitro, 2015, 29: 124–131. DOI:10.1016/j.tiv.2014.09.014 |
| [9] | Boitard L, Cottinet D, Bremond N, et al. Growing microbes in millifluidic droplets[J]. Eng Life Sci, 2015, 15: 318–326. DOI:10.1002/elsc.201400089 |
| [10] | Zhi JY, Sriranganathan N, Vaught T, et al. A dye-based lymphocyte proliferation assay that permits multiple immunological analyses:mRNA, cytogenetic, apoptosis, and immunophenotyping studies[J]. J Immunol Methods, 1997, 210: 25–39. DOI:10.1016/S0022-1759(97)00171-3 |
| [11] | Mendoza-Aguilar M, Almaguer-Villagrán L, Arce-Paredes P, et al. The use of the microplate alamar blue assay (MABA) to assess the susceptibility of Mycobacterium lepraemurium to anti-leprosy and other drugs[J]. J Infect Chemother, 2012, 18: 652–661. DOI:10.1007/s10156-012-0387-6 |
| [12] | Boedicker JQ, Li L, Kline TR, et al. Detecting bacteria and determining their susceptibility to antibiotics by stochastic confinement in nanoliter droplets using plug-based microfluidics[J]. Lab Chip, 2008, 8: 1265–1272. DOI:10.1039/b804911d |
| [13] | Sun N, Xie Y, Sheng CQ, et al. In vivo pharmacokinetics and in vitro antifungal activity of iodiconazole, a new triazole, determined by microdialysis sampling[J]. Int J Antimicrobial Agents, 2013, 41: 229–235. DOI:10.1016/j.ijantimicag.2012.10.020 |
| [14] | Mcdonald JC, Duffy DC, Anderson JR, et al. Fabrication of microfluidic systems in poly(dimethylsiloxane)[J]. Electrophoresis, 2000, 21: 27–40. DOI:10.1002/(ISSN)1522-2683 |
| [15] | Fan JX, Wang S, Meng XS, et al. Study of cancer cell apoptosis induced by Schizonepeta tenuifolia with microfluidic chip technology[J]. Acta Pharm Sin (药学学报), 2017, 52: 126–131. |
| [16] | Zheng Z, Chen Y, Li WH, et al. Droplet-based microfluidic:technologies and applications in drug screening[J]. Pharm Care Res (药学服务与研究), 2016, 16: 163–169. DOI:10.5428/pcar |
| [17] | Zhu Z, Yang CJ. Hydrogel droplet microfluidics for high-throughput single molecule/cell analysis[J]. Acc Chem Res, 2017, 50: 22–31. DOI:10.1021/acs.accounts.6b00370 |
 2017, Vol. 52
2017, Vol. 52


