2. 中山大学药学院, 广东 广州 510006
2. School of Pharmaceutical Sciences, Sun Yat-Sen University, Guangzhou 510006, China
肝脏是药物毒性的重要靶器官, 在大多数药物的代谢过程中发挥重要作用。药物肝损伤(drug-induced liver injury, DILI)是急性、慢性肝病的重要致因, 是新药研发的重要安全问题[1]。因此, 进行药物肝毒评价是药物研发中毒性评价的关键步骤。
目前用于药物安全性评价的模型包括在体实验动物模型和体外模型。体内评价模型常用各种实验动物, 不仅实验周期长、耗费财力、存在伦理问题, 并且与人类存在种属差异; 而体外评价模型常使用的人类肝细胞单层培养模型源自人类, 检测迅速, 但由于二维(two-dimension, 2D)培养的细胞缺乏细胞-细胞接触和细胞-胞外基质间的联系, 不具有三维结构, 培养几天后即产生生长抑制, 其CYP酶表达低, 药物代谢能力低下, 丧失了肝脏的异质性, 局限于急性药物毒性的检测, 不适合用于长期重复给药的研究[2-5]。因此, 建立既能保留体内细胞微环境的物质结构基础、模拟体内肝脏组织各项功能、实现长期重复给药, 在进行药物安全性评价时又能达到高效、准确、直观、可控的肝毒评价体系是目前药物肝毒性研究的热衷方向[6]。相对于2D培养模型, 三维(three-dimension, 3D)培养已被证实能够进行更长时间的培养, 并且能够保持较好的肝细胞功能[7-9], 由原代肝细胞、肝实质/非实质细胞构建起来的部分体外肝脏3D模型已被用于组织工程学研究和药物研发过程中的药物评估[10, 11]。对体外3D模型长期培养下肝细胞功能的研究和寻找更合适的材料用于构建模型研究日渐优化, 但体外肝脏3D模型在药物重复给药毒性评价方面的应用验证和机制探索仍不太明朗, 有待进行更多的验证和探索。
研究表明, 人体肝前体细胞系终端分化肝细胞HepaRG细胞株是一个有效的探究药物肝毒性的细胞模型[12, 13]。3D多细胞聚球体培养可精确控制细胞的数量和球体的大小, 操作简便, 又可进行高通量研究[14], 保持肝状类似结构和组织代谢活动[15, 16]。本研究首先利用悬滴技术构建了HepaRG细胞的3D多细胞聚球体模型, 并对该模型进行两周的肝功能检测, 然后利用该模型进行肝毒阳性药的肝毒性评价, 深入研究该体外3D肝脏模型在药物安全性评价中的特点和优势。
材料与方法 材料HepaRG人源肝细胞系购自ATCC Thermo-Fisher Scientific (广州吉尼欧生物有限公司代购); 异烟肼对照品(isoniazid, INH, 100578-200401, 99.2%)、盐酸胺碘酮对照品(amiodarone hydrochloride, 100065-201207, 99.7%)、苯妥因对照品(phenytoin, PT, 100210-201303, 99.0%)和酮康唑对照品(ketoconazole, KN, 100294201203, 99.4%)均购自中国食品药品检定研究院; 胎牛血清(FBS, 10099-141)和0.25% Trypsin-EDTA购自Gibco公司; 二甲基亚砜(DMSO, Sigma-Aldrich公司); 3D细胞活力检测试剂CellTiter-Glo® 2.0、CYP2C9和CYP3A4检测试剂均购自Promega公司; 白蛋白和尿素检测试剂盒均购自BioAssay Systems公司。
仪器悬滴GravityPlusTM和GravityTRAPTM板(Insphero公司), 全自动生化分析仪(日立Hitachi 7180型), VICTOR X5多功能酶标仪(PerkinElmer公司)。
细胞培养将HepaRG细胞置于常规培养瓶内, 以RPMI 1640完全培养基(含10% FBS), 在37 ℃、5% CO2和相对湿度90%的培养箱内培养, 培养基隔天更换, 2~3天细胞贴壁生长覆盖瓶底80%~90%后传代培养。本实验所用HepaRG为第13代、第14代细胞。
体外肝脏3D模型的建立HepaRG细胞诱导分化 HepaRG细胞在含10% FBS的1640完全培养基中正常贴壁生长至覆盖瓶底80%~90%后, 加入2% DMSO高密度诱导培养14天成内皮细胞或肝脏细胞[17]。
3D悬滴培养模型的构建 HepaRG细胞经2% DMSO诱导培养14天成内皮细胞或肝脏细胞后, 用含0.25% EDTA的胰酶消化, 并用含10% FBS的新鲜1640培养基制备密度为每毫升1.25×107个的细胞悬液并接种于GravityPlusTM板上, 每孔40 μL, 每孔接种细胞总数为5×105个。悬滴培养4天, 形成肝细胞微球后加入培养液70 μL将其转移至底径为1 mm的GravityTRAPTM板中, 隔天换液, 连续培养10天。
肝功能评价将细胞分别进行单层平面培养和3D悬滴培养。平面培养模型于接种后第1、2、3天, 悬滴模型在接种后第1、2、3、5、7、10天分别收集细胞培养上清液, 利用白蛋白试剂盒和尿素试剂盒来检测白蛋白表达量和尿素分泌水平。
抑制剂/诱导剂对2D/3D模型CYP 3A4的影响将CYP 3A4诱导剂PT和抑制剂KN溶于DMSO制备成母液。在2D模型接种后第3天, 3D模型培养第3、5、7和10天分别给予PT (100 μmol·L-1)和KN (25 μmol·L-1), 并各设溶剂(0.1% DMSO)对照组。在含10% FBS的培养基中孵育24 h后, 用PBS洗细胞3遍, 并用非细胞裂解型CYP3A4检测试剂检测各孔化学发光强度, 计算CYP3A4活性% = (Luce给药组/ Luce对照组) ×100%。结果均除以肝细胞数进行归一化处理。
2D肝脏模型评价药物毒性在96孔培养板中每孔接种5 000个HepaRG细胞, 孵育24 h。分设对照组和异烟肼、盐酸胺碘酮给药组。其中异烟肼组给药浓度分别为100、200、400、600、800和1 000 μmol·L-1, 盐酸胺碘酮给药浓度分别为10、20、40、100、150、200和250 μmol·L-1。给药后, 在37 ℃、5% CO2 (孵育条件下同)条件下孵育24 h后, 每孔加入等体积的ATP检测试剂, 轻轻晃动, 室温平衡10 min。取反应液于96孔荧光检测板, 用酶标仪检测各孔的ATP发光强度, 并计算细胞存活率(%) = (Luce给药组/Luce对照组) ×100%。
3D肝脏模型评价药物重复给药毒性悬滴培养模型在接种后第4天将微组织转移到GravityTRAPTM板培养7天, 给予异烟肼和盐酸胺碘酮, 并设对照组, 连续给药3次, 每次24 h。给药浓度与“2D肝脏模型评价药物毒性”中所列给药浓度一致。每次给药24 h后取上清液, 生化检测仪测定LDH的释放量。重复给药3次后按照“2D肝脏模型评价药物毒性”中所描述的方法测定细胞ATP发光强度, 得出药物对细胞增殖抑制的影响。
数据处理实验数据均以x ± s表示。采用Graph-Pad Prism 6软件, 对两组数据进行比较时采用t检验, 对3组及以上数据采用单因素方差分析, P < 0.05时认为差异有统计学意义。
结果 1 3D培养模型的建立和评价 1.1 微组织体的形成未经诱导的HepaRG细胞形态饱满, 折光率好, 胞浆清晰可见, 细胞-细胞间分辨明显(图 1A)。在含2% DMSO的培养液中培养5天后, 细胞逐渐分化成扁平状和颗粒状两种形态(图 1B)。经过14天2% DMSO诱导成扁平状、胞质透明的内皮细胞或颗粒肝脏样细胞(图 1C)。在悬滴培养模型中, 于GravityPlusTM板上悬滴4天后, 细胞聚集生长形成微组织, 将其转移至底径为1 mm的GravityTRAPTM板(图 1D)。继续培养, 微组织体生长迅速, 培养至第5天已长满底孔(图 1E), 之后紧密生长, 透光性低(图 1F)。
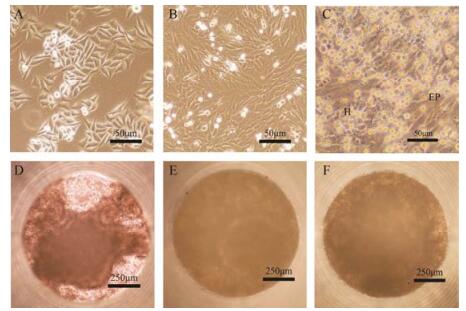
|
Figure 1 Phase-contrast micrographs of HepaRG cells. Cells were seeded at high density for 2 days without dimethyl sulfoxide (DMSO) (A), and maintained in culture for 5 days (B) or 14 days (C) in a medium deprived of 2% DMSO. H: Hepatocyte-like cells; EP: Epithelial like cells. Light microscopy pictures of three dimensional (3D) HepaRG spheroids after incubation for 1 day (D), 5 days (E), 9 days (F) |
在细胞培养的不同时间点, 收集细胞培养上清液, 分别对白蛋白(图 2A)和尿素(图 2B)含量进行评价。结果显示, 3D培养3天后, 白蛋白分泌达到较高的水平; 在3D培养5天后尿素分泌达到较高水平, 且都显著性高于2D培养水平, 且该水平一直维持到培养10天后。结果表明3D模型可以长时间保持高水平白蛋白和尿素分泌, 维持其肝脏功能。
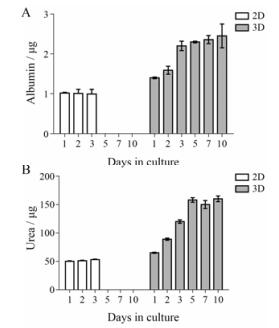
|
Figure 2 Albumin expression (A) and urea secretion (B) per day per 106 cells in two dimensional (2D) and 3D culture models. n = 4, x ± s |
肝药酶活性是影响药物肝毒性的重要因素。为检测3D模型培养下细胞的代谢能力, 实验通过CYP3A4诱导剂PT和抑制剂KN检测细胞在2D培养和3D模型中肝药酶表达的强弱。
培养不同时间后, HepaRG细胞经PT处理24 h, 3D培养细胞的CYP3A4活性诱导水平均明显高于2D培养的诱导水平。HepaRG细胞经KN处理24 h后, CYP3A4活性均受抑制(图 3)。
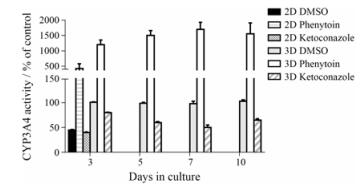
|
Figure 3 Cytochrome P 3A4 (CYP3A4) activity in 2D and 3D HepaRG cultures. Basal, induced and inhibited activities of CYP3A4 for up to 10 days of 3D liver culture and 3 days of 2D liver culture. Cells were treated in serum-containing media with vehicle (0.1% DMSO), CYP3A4 inducer (100 μmol·L-1 phenytoin) or CYP3A4 inhibitor (25 μmol·L-1 ketoconazole) for 24 h. The results were presented normalized to the activity of the vehicle treated cells, set to 100%. n = 4, x ± s |
本实验首先在2D培养中分别给予两种肝毒阳性药异烟肼和盐酸胺碘酮, 孵育24 h, 检测其对HepaRG细胞的毒性。实验结果表明, 盐酸胺碘酮能明显抑制HepaRG的增殖, 并且呈现明显的剂量依赖性, 其IC50为50 μmol·L-1 (图 4A)。然而, 会引起肝细胞坏死性损伤的抗结核药异烟肼进行同样的检测却并未显示出明显的细胞毒性(图 4B)。结果显示2D培养对于异烟肼的肝脏毒性评价存在较大局限。

|
Figure 4 2D liver culture for detection of drugs-induced acute toxicity. Cells were treated for 24 h. The viabilities were measured in the cell lysates at the end of drug treatment period. Viability is given as percentage of untreated control. A: Amio-darone hydrochloride; B: Isoniazid. n = 4, x ± s |
LDH是重要的代谢酶, 其释放量是判断肝损伤的重要指标。每次给药24 h后检测在3D模型培养下LDH的释放量。给予盐酸胺碘酮后, 悬滴技术培养下LDH的释放存在明显的剂量依赖关系, 并且经重复给药后呈现明显的时间/次数依赖性, 在给药剂量100~250 μmol·L-1间, 第二次给药后LDH的释放量达对照组的2~3倍, 第三次高达3~4倍(图 5A)。检测盐酸胺碘酮对细胞的增殖抑制作用, 悬滴培养时IC50为100 μmol·L-1 (图 5B), 高于2D培养的50 μmol·L-1。
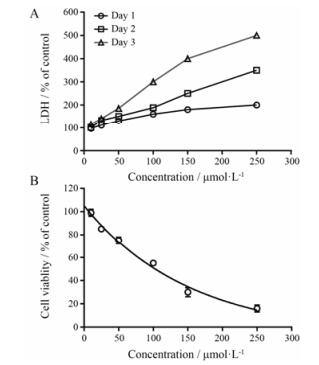
|
Figure 5 3D liver culture for detection of amiodarone hydro-chloride-induced chronic toxicity. Cells were treated for 3 days, medium was changed every 24 h. A: Lactate dehydrogenase (LDH) release: the media of the treated 3D liver cells was collected daily and LDH release was measured. B: The viabilities were measured in the cell lysates at the end of drug treatment period. All datas were expressed as percentage of untreated control. n = 4, x ± s |
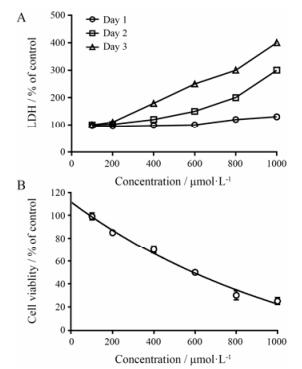
在2D培养中给药浓度高达1 mmol·L-1时却未被检出毒性的异烟肼, 悬滴培养检测出其IC50为700 μmol·L-1, LDH的释放量也存在明显的剂量依赖关系和时间依赖性(图 6)。对比2D培养模型而言, 运用肝细胞的3D培养模型用于药物肝毒性评价一定程度上能够更加接近机体对药物毒性的反应。
|
Figure 6 3D liver culture for detection of isoniazid-induced chronic toxicity. Cells were treated for 3 days, medium was changed every 24 h. A: LDH release, the media of the treated 3D liver cells was collected daily and LDH release was measured. B: The viabilities were measured in the cell lysates at the end of drug treatment period. All datas were expressed as percentage of untreated control. n = 4, x ± s |
目前, 迫切需要建立更准确的体外肝细胞模型预测药物对人体的肝毒性。本研究的主要目的是采用悬滴法建立可以长期培养的3D HepaRG球体模型并进一步对该体外模型的肝功能进行评价, 并探究其在药物肝毒性评价中的特点和优势。有研究显示, 体外细胞球体的大小对缺氧型核坏死有重要影响[18], 在细胞球大小为200 μmol·L-1左右时活性较高且不会出现大量的核坏死。本研究采用悬滴法建模, 能精确控制细胞数量, 保持球体的大小在 < 1 mm, 细胞迅速增殖增强了细胞与细胞之间的联系。同时, 结果显示, 3D肝微组织形成后再培养10天, 其代谢酶水平、白蛋白表达水平以及尿素分泌水平均明显高于2D培养的细胞, 说明其肝细胞功能状态保持良好。
此外, 本实验用肝毒性阳性药评价了所建立起来的体外肝脏3D悬滴培养模型检测药物重复给药毒性的能力。盐酸胺碘酮是著名的抗心绞痛药, 临床用药易引起急性肝炎和长期给药引起严重肝损伤[19, 20]。在2D/3D模型中对其肝毒性进行比较, 结果表明, 体外肝脏3D悬滴培养模型下, 盐酸胺碘酮所显示的毒性具有时间/给药次数依赖性和剂量正相关性, IC50高于2D模型检测结果, 这可能与3D培养模型药物的代谢酶活性较高而对药物代谢较快有关, 也可能是因为3D培养细胞形成细胞球, 模拟体内生理结果, 减缓了药物直接渗透, 该结果显示该模型仍具有更多次重复给药的潜力。异烟肼作为典型的临床抗结核药, 常引起肝细胞性坏死型药源性肝损伤[21]。然而, 在2D培养中给药浓度高达1 mmol·L-1却未被检出细胞毒性的异烟肼[13], 通过本研究建立的3D模型却能检测出其毒性(IC50 = 700 μmol·L-1), 并呈现时间依赖性和剂量正相关性。有研究报道, 异烟肼原型药并不会引起肝损伤, 而是容易被肝药酶CYP2E1和N-乙酰基转移酶2 (NAT2)代谢成毒性产物联胺等而引起肝损伤[22, 23]。印证了本实验中由于3D模型代谢酶活性明显高于2D模型, 从而在测定异烟肼毒性时更具优势。类似地, Gunness等[24]通过了体外肝脏2D/3D悬滴培养模型评价肝毒性阳性药对乙酰氨基酚(APAP)时发现3D悬滴培养模型能够检测出APAP的细胞毒性并且毒性的产生与CYP2E1水平有关, 3D模型所得结果与药物在体内反应的结果相似。因此, 运用肝细胞的3D培养模型用于药物肝毒性评价一定程度上能够更加接近复杂的机体对药物毒性的反应, 与Li等[25]关于肝细胞3D培养的研究结果相似, 然而更多的体外肝脏3D培养模型的肝功能特异性指标以及可靠的药源性肝毒指标的筛选仍需进一步验证和探究。
综上所述, 本研究初步成功建立可进行相对长时间培养的HepaRG细胞体外3D培养模型, 并且可用于药物重复给药实验以预测药物肝毒性, 其评价功能更接近于机体对药物的反应。该体外肝脏3D模型在药物肝毒性评价, 特别是体外长期多次给药毒性评价中具有特别的优势。该模型的建立为体外高通量筛选药物肝脏毒性提供了可能。
| [1] | Bjornsson ES, Bergmann OM, Bjornsson HK, et al. Incidence, presentation, and outcomes inpatients with drug-induced liver injury in the general population of Iceland[J]. Gastroenterology, 2013, 144: 1419–1425. DOI:10.1053/j.gastro.2013.02.006 |
| [2] | Hewitt NJ, Lechon MJ, Houston JB, et al. Primary hepatocytes:current understanding of the regulation of metabolic enzymes and transporter proteins, and pharmaceutical practice for the use of hepatocytes in metabolism, enzyme induction, transporter, clearance, and hepatotoxicity studies[J]. Drug Metab Rev, 2007, 39: 159–234. DOI:10.1080/03602530601093489 |
| [3] | Wilkening S, Stahl F, Bader A, et al. Comparison of primary human hepatocytes and hepatoma cell line HepG2 with regard to their biotransformation properties[J]. Drug Metab Dispos, 2003, 31: 1035–1042. DOI:10.1124/dmd.31.8.1035 |
| [4] | Guguen-Guillouzo C, Guillouzo A. General review on in vitro hepatocyte models and their applications[J]. Methods Mol Biol, 2010, 640: 1–40. DOI:10.1007/978-1-60761-688-7 |
| [5] | Wikswo JP. The relevance and potential roles of microphysiological systems in biology and medicine[J]. Exp Biol Med, 2014, 239: 1061–1072. DOI:10.1177/1535370214542068 |
| [6] | Hartung T. Toxicology for the twenty-first century[J]. Nature, 2009, 460: 208–212. DOI:10.1038/460208a |
| [7] | LeCluyse EL, Witek RP, Andersen ME, et al. Organotypic liver culture model:meeting current challenges in toxicity testing[J]. Crit Rev Toxicol, 2012, 42: 501–548. DOI:10.3109/10408444.2012.682115 |
| [8] | Chang SY, Voellinger JL, Van Ness KP, et al. Characterization of rat or human hepatocytes cultured in microphysiological systems (MPS) to identify hepatotoxicity[J]. Toxicol In Vitro, 2017, 40: 170–183. DOI:10.1016/j.tiv.2017.01.007 |
| [9] | Li PY, Li CY, Lu XH, et al. The three dimensional organoids-based high content imaging model for hepatotoxicity assessment[J]. Acta Pharm Sin (药学学报), 2017, 52: 1055–1062. |
| [10] | Godoy P, Hewitt NJ, Albrecht U, et al. Recent advance in 2D and 3D in vitro systems using primary hepatocytes, alternative hepatocyte sources and non-parenchymal liver cells and their use in investigating mechanisms of hepatoxicity, cell signaling and ADME[J]. Arch Toxicol, 2013, 87: 1315–1530. DOI:10.1007/s00204-013-1078-5 |
| [11] | Yu CB, Pan XP, Yu L, et al. Evaluation of a novel choanoid fluidized bed bioreactor for future bioartificial livers[J]. World J Gastroenterol, 2014, 20: 6869–6877. DOI:10.3748/wjg.v20.i22.6869 |
| [12] | Gripon P, Rumin S, Urban S, et al. Infection of a human hepatoma cell line by hepatitis B virus[J]. Proc Natl Acad Sci U S A, 2002, 99: 15655–15660. DOI:10.1073/pnas.232137699 |
| [13] | Wu Y. Screening of in vitro Model in Drug-induced Liver Injury and Preliminary Investigation of Polygonum multiflorum Induced Liver Injury (药物性肝损伤体外筛选模型和何首乌致肝损伤的初步研究)[D]. Beijing: Chinese Academy of Medical Science & Peking Union Medical College, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10023-1016236177.htm |
| [14] | Drewitz M, Helbling M, Fried N, et al. Towards automated production and drug sensitivity testing using scaffold-free spherical tumor microtissues[J]. Biotechnology, 2011, 6: 1488–1496. |
| [15] | Abu-Absi SF, Friend JR, Hansen LK, et al. Structural polarity and functional bile canaliculi in rat hepatocyte spheroids[J]. Exp Cell Res, 2002, 274: 56–67. DOI:10.1006/excr.2001.5467 |
| [16] | Miranda JP, Rodrigues A, Tost es RM, et al. Extending hepatocyte functionality for drug-testing applications using high-viscosity alginate-encapsulated three-dimensional cultures in bioreactors[J]. Tissue Eng Part C Methods, 2010, 16: 1223–1232. DOI:10.1089/ten.tec.2009.0784 |
| [17] | Aninat C, Piton A, Glaise D, et al. Expression of cytochromes P450, conjugating enzymes and nuclear receptors in human hepatoma HepaRG cells[J]. Drug Metab Dispos, 2006, 34: 75–83. |
| [18] | Lin RZ, Chang HY. Recent advances in three-dimensional multicellular spheroid culture for biomedical research[J]. Biotechnol, 2008, 3: 1172–1184. |
| [19] | Huang XF, Yang YM, Zhu J. Intravenous amiodarone and severe liver injury[J]. Chin J Card Pacing Electrophysiol (中国心脏起搏与心电生理杂志), 2009, 23: 477–479. |
| [20] | Sun YC, Wang JW, Yang Y, et al. Analysis of a short-term acute hepatotoxicity induced by intravenous amiodarone in 4 cases[J]. Clin Med J (临床药物治疗杂志), 2012, 10: 60–62. |
| [21] | Jin WD, Wang ZL, Ma XM, et al. Side effect of anti-tuberculosis drugs in 156 spinal tuberculosis patients[J]. J Third Mil Med Univ (第三军医大学学报), 2009, 31: 1932–1935. |
| [22] | Preziosi P. Isoniazid:metabolic aspects and toxicological correlates[J]. Curr Drug Metab, 2007, 8: 839–851. DOI:10.2174/138920007782798216 |
| [23] | Ramachandran G, Swaminathan S. Role of pharmacogenomics in the treatment of tuberculosis:a review[J]. Pharmgenomics Pers Med, 2012, 5: 89–98. |
| [24] | Gunness P, Mueller D, Shevchenko V, et al. 3D organotypic cultures of human HepaRG cells:a tool for in vitro toxicity studies[J]. Toxicol Sci, 2013, 133: 67–78. DOI:10.1093/toxsci/kft021 |
| [25] | Li TT, Li RH, Liu ZX, et al. Three dimensional organoids-based evaluation for hepatotoxicity of the susceptible compound in Polygonum multiflorum Thunb[J]. Acta Pharm Sin (药学学报), 2017, 52: 1048–1054. |
 2017, Vol. 52
2017, Vol. 52


