2. 上海中医药大学, 上海 201203
2. Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China
瑞格非尼(regorafenib, REG, 图 1)是一种新型的口服小分子多靶点磷酸激酶抑制剂, 可有效阻断促进肿瘤血管生成和肿瘤细胞增殖的多种酶系[1, 2], 包括血管内皮生长因子受体-1 (vascular endothelial growth factor receptor-1, VEGFR-1)、VEGFR-2、VEGFR-3、酪氨酸蛋白激酶受体-2 (TIE-2)、血小板衍生生长因子受体-β (platelet derived growth factor receptor-β, PDGFR-β)、原癌基因c-Kit、酪氨酸蛋白激酶受体RET等[3], 临床上对治疗转移性结直肠癌和胃肠间质瘤中具有非常理想的疗效[4, 5]。
|
Figure 1 Chemical structure of regorafenib (REG) |
尿苷二磷酸葡糖醛酸转移酶(UGTs)是人体重要的Ⅱ相代谢酶[6], 其中尿苷二磷酸葡糖醛酸转移酶1A1 (UGT1A1)在维系内源物代谢平衡和外源物代谢清除中均扮演着非常重要的角色[7, 8], 是机体负责代谢内源性毒物胆红素的唯一代谢酶, 同时还参与众多外源物的代谢清除, 包括抗癌药物依托泊甙、抗艾滋病药物雷特格韦等临床药物[9], 对UGT1A1的强效抑制作用会导致上述药物药代动力学行为的改变, 进而增大临床发生DDI的风险。UGT1A1表达/功能的异常偏低可导致胆红素代谢障碍进而引发高胆红素血症, 严重者会致死[8]。药物对UGT1A1的抑制作用是引发胆红素代谢障碍和DDI的一个重要原因, 在多药联合使用时需密切关注。
目前已发现多种药物, 如HIV治疗药物阿扎那韦等、抗真菌药酮康唑等, 可通过强效抑制UGT1A1进而影响UGT1A1底物药物的代谢清除, 同时还可引发高胆红素血症及肝功能异常等症状[10-12]。众所周知, UGT1A1抑制剂的筛选与评价需借助相应的探针底物来实现。但由于UGT1A1与其他UGT1A酶的底物谱高度交叉, 其特异性探针底物严重匮乏。新近发表的文献仅初步考察了REG对UGTs的抑制作用, 并采用传统的内源性底物胆红素和β-雌二醇共同作为UGT1A1的探针底物, 借助复杂繁琐的HPLC构建了UGT1A1的酶活检测方法, 分别在单酶(胆红素)和微粒体(β-雌二醇)的层面测定了REG对UGT1A1的抑制动力学参数, 并根据体外孵育体系所获得的抑制动力学参数(Ki)预测了REG对人体中UGT1A1抑制所引发DDI的潜在可能性, 尝试从药代水平探讨REG在临床引发高胆红素血症的机制[13-15], 此外, REG对个别UGT酶亚型的抑制动力学也未见报道。本文应用体外人肝微粒体和重组人源代谢酶孵育体系研究了REG对12种人UGTs的抑制作用, 并通过体外-体内外推(IV-IVE)预测其与经过UGT1A1代谢消除药物共服引发DDI的风险, 为深入了解REG对UGTs的抑制特征及指导临床上科学合理高效用药, 尤其是可有效避免肿瘤治疗中多药联用引发的DDI等潜在安全隐患, 提高REG使用的安全性。
材料与方法 药品与试剂瑞格非尼(批号F1502104, 纯度≥98%)购于Sigma-Aldrich公司; N-(3-羧丙基)-4-羟基-1, 8-萘酰亚胺(NCHN, 纯度≥98%)和N-(正丁基)-4-(4-羟苯基)-1, 8-萘酰亚胺(NPHN, 纯度≥98%)是由大连理工大学冯磊博士合成; NCHN-4-O-葡糖醛酸苷(NCHNG, 纯度≥95%)是由中国科学院大连化学物理研究所药用资源研发组吕侠博士使用混合人肝微粒和猴肝微粒体生物合成获得; NPHN-O-葡糖醛酸苷(NPHNG, 纯度≥95%)是由中国科学院大连化学物理研究所药用资源研发组吕侠博士使用混合豚鼠肝微粒生物合成方法获得; 4-甲基伞形酮(4-MU, 批号90-33-5)和4-甲基伞形酮-β-D-葡糖醛酸苷(4-MUG, 批号6160-80-1)购于东京化成工业株式会社, 纯度均为98%;三氟拉嗪(TFP, 纯度为98%)、尿苷-5'-二磷酸三钠盐(UDPGA)、三羟甲基氨基甲烷(Tris)、聚氧乙烯十六烷基醚(Brij 58), 氯化镁(MgCl2)、尼罗替尼、厚朴酚和雄酮均购于Sigma-Aldrich公司; 混合人肝微粒体(HLM, n = 50)购于上海瑞德肝脏疾病研究有限公司(批号YAO); 12种商业化的重组人源UGTs包括UGT1A1 (批号456411)、1A3 (批号456413)、1A4 (批号456414)、1A6 (批号456416)、1A7 (批号456407)、1A8 (批号456418)、1A9 (批号456419)、1A10 (批号456410)、2B4 (批号456424)、2B7 (批号456427)、2B15 (批号456435)和2B17 (批号456437)均购于美国BD生物科学有限公司; 甲醇、乙腈、二甲基亚砜(DMSO, 纯度大于99.5%)、甲酸购自Sigma-Aldrich且均为色谱纯, 实验用水为Millipore纯化水, 其余试剂为分析纯。
仪器多功能微孔板检测酶标仪(Synergy H1)购于美国伯腾仪器有限公司; LC-30AT超快速液相色谱仪(UFLC)购自日本岛津公司, 配备有一个系统控制器CBM-20A、两个LC-30AD泵、一个DGU-20A真空脱气机、一个SIL-30AC自动进样器、一个CTO-30A柱温箱、一个SPD-M 30A DAD检测器, 一个RF-20A荧光检测器和岛津色谱工作站; 振荡恒温金属浴和低温高速离心机购于美国热电; KH-250SP超声清洗器购于昆山禾创超声仪器有限公司; 精密分析天平和pH计购于北京赛多利斯科学仪器有限公司; XW-80A涡旋混合器购于上海精科实业有限公司; Milli-Q超纯水机购于美国Millipore公司; XB70制冰机购于宁波格兰特制冷设备制造有限公司; XR-ODS C18色谱柱(2.1 mm × 150.0 mm, 2.0 μm)购于日本岛津公司。
检测条件在参考已发表文献的基础上稍作调整[16, 17], 4-MUG的色谱检测条件:色谱柱为XR-ODS C18色谱柱(2.1 mm × 150.0 mm, 2.0 μm); 流动相为乙腈(A)~0.2%甲酸水(B), 梯度洗脱条件: 0~2 min, 90% B; 2~9 min, 90%~25% B; 9~9.01 min, 25%~5% B; 9.01~12 min, 5% B; 12.01~15 min, 5%~90% B; 流速为0.4 mL·min-1; 柱温40 ℃; 检测波长317 nm; 进样量6 μL; TFPG的色谱检测条件:色谱柱为XR-ODS C18色谱柱(2.1 mm × 150.0 mm, 2.0 μm); 流动相为乙腈(A)~0.1%三氟乙酸水溶液(B), 梯度洗脱条件: 0~9 min, 70%~50% B; 9~9.01 min, 50%~25% B; 9.01~10 min, 25%~5% B; 10~13 min, 5% B; 13.01~16 min, 5%~70% B; 流速为0.3 mL·min-1; 柱温40 ℃; 检测波长254 nm; 进样量6 μL; NCHNG检测条件:多功能微孔板检测酶标仪测定NCHN及其代谢产物NCHNG的荧光强度, NCHN的激发波长450 nm, 发射波长564 nm; NCHNG的激发波长为362 nm, 发射波长450 nm, 能量均设置为80; NPHNG检测条件:多功能微孔板检测酶标仪测定NPHN及其代谢产物NPHNG的荧光强度, NPHN的激发波长450 nm, 发射波长564 nm; NPHNG的激发波长为370 nm, 发射波长520 nm, 能量均设置为100。
瑞格非尼对UGTs抑制作用的筛选REG作为UGT各亚型的抑制剂, 4-MU作为UGT1A1、1A3、1A6、1A7、1A8、1A9、1A10、2B4、2B7、2B15和2B17的广谱探针底物, TFP作为UGT1A4的特异性探针底物, 通过三点法初筛实验(即REG终浓度设置为1、10和100 µmol·L-1), 考察REG对UGTs活性的抑制作用, 阴性对照组抑制剂用等量的DMSO替代, 孵育体系总体积200 μL, 包括REG、Tris-HCl缓冲液(pH 7.4, 50 mmol·L-1)、MgCl2 (5 mmol·L-1)、不同浓度的4-MU、重组单酶和UDPGA (2 mmol·L-1), DMSO终浓度1%。各样品涡旋混匀并置于恒温金属浴, 37 ℃预孵3 min, 反应体系中每间隔10 s加入10 μL UDPGA起始反应, 孵育条件参考文献[18], 详见表 1, 孵育结束后, 各加200 μL乙腈(含20 μmol·L-1的7-羟基香豆素作为内参)终止反应, 在4 ℃、20 000×g的条件下离心20 min, 吸取6 μL用于UFLC分析。
| Table 1 The incubation conditions of twelve recombinant UGT isoforms |
基于上述初筛实验结果, 选取REG浓度为10 µmol·L-1时、酶的残余活性小于50%的重组单酶(UGT1A1、UGT1A7、UGT1A9和UGT2B7)为酶源, 进一步评价REG分别对4种单酶催化的4-MU-O-葡糖醛酸化反应的抑制动力学行为。整个孵育体系包括系列不同浓度的REG, 其余操作同上, 阳性对照组选择各亚型相应的抑制剂作为对比。本实验参考已报道的文献, 选择尼罗替尼作为UGT1A1的阳性抑制剂, 厚朴酚作为UGT1A7和UGT1A9的特异性抑制剂, 雄酮作为UGT2B7的特异性抑制剂[19-22]。结果采用GraphPad Prism 6.0进行非线性回归并拟合曲线, 绘制REG在4种重组单酶条件下的剂量-依赖性抑制曲线, 酶的残余活性为50%时所对应的横坐标(即抑制剂的浓度)为IC50值。通过测定的IC50值, 选择使酶的残余活性为20%~80%之间所对应的抑制剂浓度作为测定抑制作用常数(Ki)时所用抑制剂浓度的参考, 通过前期的动力学实验及参考已发表文献所得的Km[16, 17], 底物浓度的选择范围为1/3~3 Km之间。采用多个底物浓度和不同的抑制剂浓度测定Ki, 由Lineweaver-Burk图和Dixon图判断其抑制作用类型。
瑞格非尼对NCHN-4-O-葡糖醛酸化反应的抑制作用鉴于目前缺乏UGT1A7和UGT2B7的特异性探针底物, 且UGT1A9的特异性底物异丙酚[23]需要借助复杂的质谱检测, 考虑到UGT1A1的重要性, 本实验旨在评估REG在HLM和UGT1A1两种酶源条件下对UGT1A1的抑制作用, 测定其对UGT1A1的IC50和Ki, 并确定了抑制类型。选择比率型荧光探针NCHN作为UGT1A1的特异性荧光探针底物[24], 该探针具有特异性高、代谢产物单一、检测灵敏、可高通量筛选等优势, 孵育体系中NCHN的浓度参考前期的动力学条件, 设置在自身Km附近(40 μmol·L-1), 以确保反应中代谢产物NCHNG的形成在所选择的孵育时间和蛋白浓度范围中处于线性。HLM孵育体系中, 加入等体积Brij 58 (0.1 mg·mg-1 protein)作为酶打孔剂, 并置于冰上打孔20 min, HLM和UGT1A1的蛋白浓度分别为0.2和0.05 mg·mL-1, 孵育时间分别为30和60 min, 最后加入等体积乙腈终止反应, 样品在4 ℃, 20 000×g的条件下离心20 min, 吸取200 μL上清液于至96孔板中, 并放置多功能酶标仪中检测。
瑞格非尼对NPHN-O-葡糖醛酸化反应的抑制作用UGT1A1具有多个配体结合位点[16, 17], 且UGT1A1的抑制呈现底物依赖性, 以4-MU为底物难以准确反映REG对胆红素(或其他UGT1A1底物)代谢的抑制能力。为避免假阳性结果, 选用off-on型荧光探针NPHN作为UGT1A1的另一个特异性荧光探针底物[25], 该底物与NCHN可分别结合在UGT1A1的两个主要配体结合位点, 且NPHN与胆红素的结合位点一致, 故NPHN与NCHN可作为位点特异性的探针底物, 表征REG与UGT1A1的结合位点及相互作用机制, 进而实现对REG的高内涵表征。孵育体系中NPHN的浓度参考前期的动力学条件, 设置在自身Km附近(5 μmol·L-1), 以确保反应中代谢产物NPHNG的形成在线性范围内。孵育体系中, HLM和UGT1A1的蛋白浓度分别为0.2和0.1 mg·mL-1, 孵育时间均为60 min, 其余操作同上, 并按上述NPHN的检测条件进行检测。
体内药物相互作用风险预测为了进一步评估REG对人体中UGT1A1抑制所引发DDI的潜在可能性。本实验采用人肝微粒体体外孵育体系所获得的抑制动力学参数(Ki), 最大血浆浓度(Cmax)用于模拟抑制剂在体内的浓度, 参考文献报道的DDI预测方法[26], 预测结果以有无REG的条件下, 药物在体内的暴露量即药-时曲线下面积(AUC)的比值来表示:
| ${\rm{AUC\;ratio}} = \frac{1}{{{f_{{\rm{hep}}}} \cdot \left( {\frac{{1/{E_{\rm{h}}}}}{{(1/{E_{\rm{h}}} - 1) \cdot (1 + I/{K_{\rm{i}}}) + 1}}} \right) + (1 - {f_{{\rm{hep}}}})}}$ | (1) |
公式(1)中, AUC ratio表示代谢酶经抑制后, 药物暴露量的增加; fhep是肝脏清除率; Eh是肝提取率; I是人血浆中抑制剂的最大浓度; Ki (μmol·L-1)是抑制动力学常数。
数据处理所有样品平行制备两份, 结果以均值±标准差表示。REG对UGTs的抑制作用通过酶的残余活性表示, 即加与不加抑制剂至孵育体系中所产生的4-MUG、NCHNG、NPHNG或TFPG代谢产物的峰面积/荧光强度比值。对反应速率V和底物浓度进行双倒数作图, 线性回归拟合, 最终得到以底物浓度倒数1/[S]为横坐标, 1/[V]为纵坐标的Lineweaver-Burk图。以系列不同的抑制剂浓度为横坐标, Lineweaver-Burk图中回归直线的斜率为纵坐标, 进行二次线性回归, 得到直线的横截距即为-Ki。使用GraphPad Prism 6.0软件中的非线性回归中的酶动力学-抑制模块获得IC50和Ki。
结果 1 瑞格非尼对UGTs抑制作用的筛选单酶筛选实验如图 2所示。结果表明, REG的浓度为10 μmol·L-1时, 仅对UGT1A1、UGT1A7、UGT1A9和UGT2B7呈现较强的抑制作用, 酶的残余活性百分比分别为阴性对照的16.2% ± 2.01% (UGT1A1)、36.8% ± 4.03% (UGT1A7)、12.3% ± 0.89% (UGT1A9)和36.1% ± 4.55% (UGT2B7), 均小于50%, 同等条件下, 对其他酶亚型几乎无抑制或抑制能力小于50%。
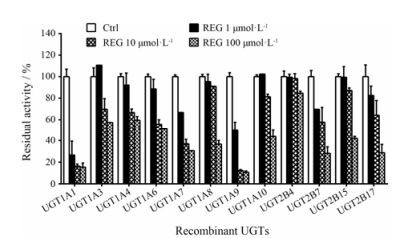
|
Figure 2 The inhibitory effects of REG (0, 1, 10, and 100 µmol·L-1) on the catalytic activities of 4-methylumbelliferone (4-MU)-O-glucuronidation by UGT1A1, 1A3, 1A6, 1A7, 1A8, 1A9, 1A10, 2B4, 2B7, 2B15, 2B17, and trifluoperazine (TFP)-N-glucuronidation by UGT1A4. Ctrl: Negative control |
此外, REG的浓度为1 μmol·L-1时, 仅对肝、肠中存在的UGT1A1呈现出非常强烈的抑制作用, 对肝中存在的UGT1A9呈现出较强的抑制作用, 而对其余酶亚型包括仅存于肠道中的3个主要酶亚型(UGT1A7、UGT1A8和UGT1A10)均呈现微弱或可以忽略的抑制作用, 以上结果表明, REG在一定的浓度条件下, 对UGT1A1的抑制作用具有较好的选择性, 抑制谱较窄。
如图 3所示, UGT1A1的残余活性仅为阴性对照的(18.5 ± 0.53) %, UGT1A7、UGT1A9、UGT1A10和UGT2B7的残余活性分别为阴性对照的(72.3 ± 3.10) %、(43.2 ± 8.12) %、(93.2 ± 5.15) %和(97.6 ± 3.50) %。结果表明, 2 μmol·L-1的REG对仅在肠道或肝外组织中表达的UGT1A7和UGT1A10也呈现出可以忽略的抑制作用, 且对肝脏中含量最高的UGT2B7呈现微弱的抑制作用。
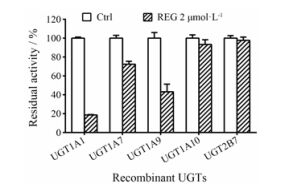
|
Figure 3 The inhibitory effects of REG (2 μmol·L-1) on the catalytic activities of 4-MU-O-glucuronidation by UGT1A1, 1A7, 1A9, and 2B7 |
综上所述, 图 2和图 3的结果表明, REG对UGT1A1的抑制作用选择性最好, 抑制谱窄, 对仅在肠中存在的3种UGTs (UGT1A7、UGT1A8和UGT1A10)无抑制作用, 其余8种在肝中存在的主要酶亚型抑制较弱或可忽略(UGT1A9除外)。
2 瑞格非尼对UGT1A1、UGT1A7、UGT1A9UGT2B7催化的4-MU-O-葡糖醛酸化反应的抑制作用通过非线性拟合得到REG对4-MU-O-葡糖醛酸化反应的IC50值分别为0.15 ± 0.01 (UGT1A1)、3.55 ± 0.49 (UGT1A7)、1.03 ± 0.15 (UGT1A9)和6.6 ± 3.07 (UGT2B7) μmol·L-1; 4种特异性抑制剂对4-MU-O-葡糖醛酸化反应的IC50值分别为0.26 ± 0.02 (尼罗替尼, UG1TA1)、0.73 ± 0.04 (厚朴酚, UGT1A7)、0.057 ± 0.01 (厚朴酚, UGT1A9)和14.83 ± 2.95 (雄酮, UGT2B7) μmol·L-1。结果显示, REG对UGT1A1、UGT1A7、UGT1A9和UGT2B7催化的4-MU-O-葡糖醛酸化呈现较强的抑制作用, 对UGT1A1和UGT1A9的抑制作用非常强烈, IC50值小于1 μmol·L-1; 对UGT1A1的抑制作用大于UGT1A1阳性抑制剂尼罗替尼。
由Lineweaver-Burk图和Dixon图(图 4)可知, REG对UGT1A1催化的4-MU-O-葡糖醛酸化反应呈现竞争性的抑制, 其Ki值为0.48 ± 0.06 μmol·L-1, 对UGT1A7、UGT1A9和UGT2B7所催化的4-MU-O-葡糖醛酸化反应呈现混合型的抑制类型, 其Ki值分别为2.13 ± 0.11、0.34 ± 0.18和14.0 ± 1.25μmol·L-1。
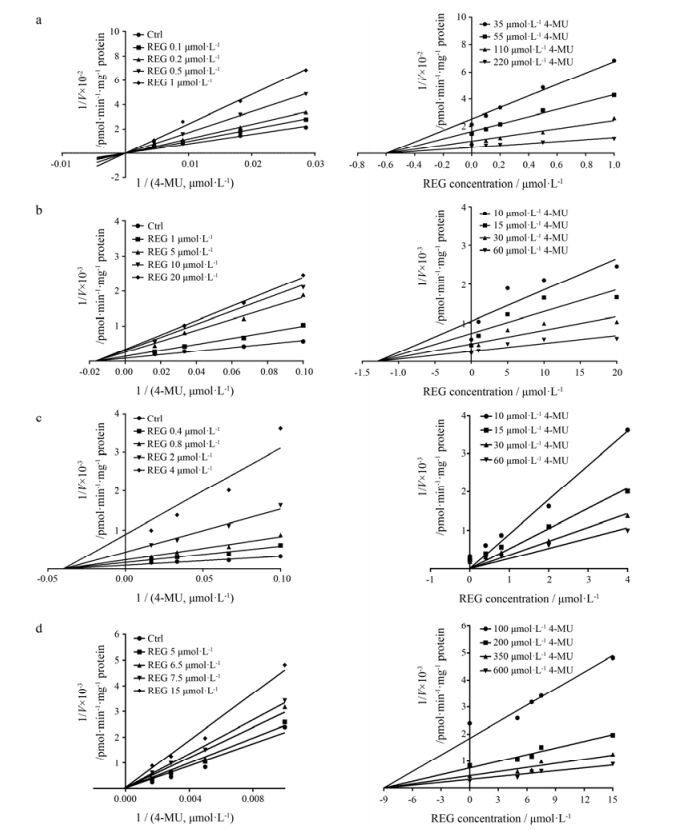
|
Figure 4 Lineweaver-Burk plots and Dixon plots of REG against 4-MU-O-glucuronidation in recombinant UGT1A1 (a), UGT1A7 (b), UGT1A9 (c) and UGT2B7 (d). Left: Lineweaver-Burk plots; Right: Dixon plots |
结果表明, REG对HLM和UGT1A1所催化的NCHN-4-O-葡糖醛酸化反应的抑制作用很强(IC50和Ki值均小于1 μmol·L-1), IC50值如表 2所示。由Lineweaver-Burk图和Dixon图(图 5)可知抑制类型, Ki值见表 2。此外, REG对HLM和UGT1A1催化的NCHN-4-O-葡糖醛酸化的Ki值小于2倍的差异, REG对UGT1A1中NCHN-4-O-葡糖醛酸化和4-MU-O-葡糖醛酸化的Ki值也小于2倍的差异。由表 2可知, REG对UGT1A1两个代表性底物(NCHN与4-MU)展现出相似的抑制作用强度和不同的抑制作用类型。
| Table 2 The inhibitory effects of REG on UGT1A1 activities determined by three representative probe substrates |
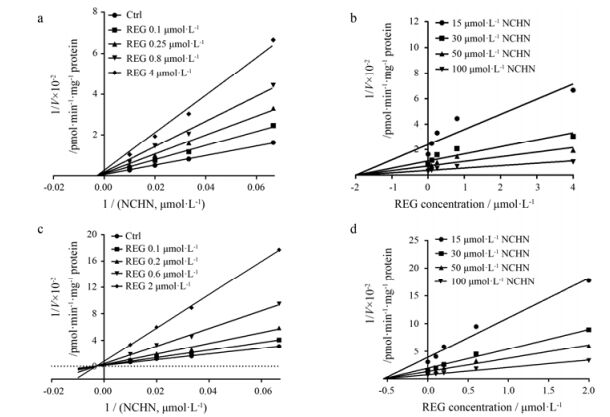
|
Figure 5 Lineweaver-Burk plots and Dixon plots of REG against N-(3-carboxy propyl)-4-hydroxy-1, 8-naphthalimide (NCHN)-4-O-glucuronidation in both HLM (a and b) and recombinant UGT1A1 (c and d). Left: Lineweaver-Burk plots; Right: Dixon plots |
结果表明, REG对HLM和UGT1A1所催化的NPHN-O-葡糖醛酸化反应的抑制作用很强(IC50值小于1μmol·L-1, Ki值小于0.1 μmol·L-1), IC50值见表 2。且由Lineweaver-Burk图和Dixon图(图 6)可知抑制类型, Ki值见表 2。此外, REG对HLM和UGT1A1催化的NPHN-O-葡糖醛酸化的Ki值小于2倍的差异, REG对UGT1A1中NPHN-O-葡糖醛酸化和4-MU-O-葡糖醛酸化的Ki值大于2倍的差异。综上所述, 由表 2可知, REG对UGT1A1的3个代表性底物(NCHN、NPHN和4-MU)展现出不同的抑制作用强度和不同的抑制作用类型。
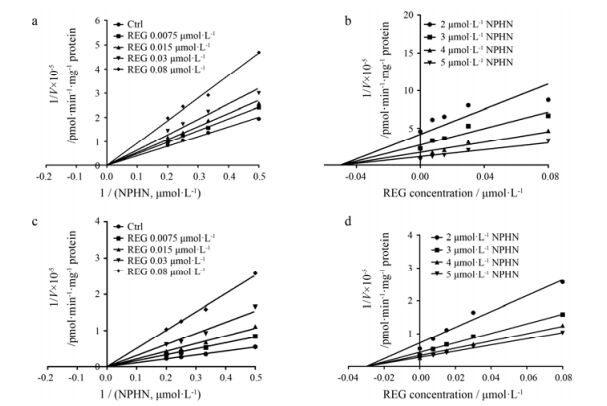
|
Figure 6 Lineweaver-Burk plots and Dixon plots of REG against N-butyl-4-(4-hydroxyphenyl)-1, 8-naphthalimide (NPHN)-O-glucuronidation in both HLM (a and b) and recombinant UGT1A1 (c and d). Left: Lineweaver-Burk plots; Right: Dixon plots |
由表 3可知, 参考文献报道的口服治疗剂量的REG (160 mg·d-1)后[15, 27], 其在人血浆中的Cmax高达3.9 μg·mL-1 (8.08 μmol·L-1), 由于I = Cmax×fu, fu = 0.1[15, 17], I为0.81 μmol·L-1。以NPHN (高亲和力底物)作为UGT1A1的特异性探针底物, REG对HLM中NPHN-O-葡糖醛酸化的抑制作用非常强烈, 0.1 < [I]/Ki < 1, AUC增加了101%~302%;同时, 以NCHN (低亲和力底物)作为UGT1A1的另一个特异性底物, REG对HLM中NCHN-4-O-葡糖醛酸化也呈现较强的抑制作用, 0.1 < [I]/Ki < 1, AUC增加了13%~109%。
| Table 3 Prediction of the potential DDI risks in vivo based on the AUC ratios. a: Eh is the hepatic extraction ratio ranging from 0.1 to 0.9. b: fhep is the percentage of hepatic clearance mediated by UGT1A1; The fhep was set to the mean value of each UGT substrates. c: The maximum concentration of inhibitor (I) in human plasma was calculated as fu×Cmax; The Cmax of REG in humans was obtained from literature; fuwas 0.1. d: AUC ratios were calculated using Eq.(1) in materials and methods |
综上所述, DDI预测结果表明, 当REG与一些主要经UGT1A1代谢的底物联合应用时, 其在机体内的清除很可能会被抑制, 且前期实验基础已证明NPHN和胆红素的结合位点相同, 进一步提示当服用高剂量的REG后, 可通过强效抑制UGT1A1进而影响机体内胆红素的代谢清除, 同时还可引发急性肝损伤及肝功能异常等症状, 在临床使用过程中需要密切关注。
讨论本研究证明了REG对UGT1A1、UGT1A7、UGT1A9和UGT2B7催化的4-MU-O-葡糖醛酸化反应呈现出较强的抑制作用(IC50 < 10 μmol·L-1), 且对UGT1A1的抑制作用最强(IC50 < 1 μmol·L-1); 通过对比REG对UGT1A1催化的3种代表性底物葡糖醛酸化反应的抑制动力学参数可知, UGT1A1至少具有两个配体结合位点, 与之前文献报道的结果相吻合[16, 17]; 对于UGT1A1、UGT1A7和UGT1A9, 其[I]/Ki值大于1, 提示有可能发生严重的DDI, REG与上述提到的几种酶的底物药物联合用药时, 临床使用过程中应密切监测患者的肝肾功能。
新近文献报道将胆红素和β-雌二醇共同作为UGT1A1的特异性底物[15], 预测体内因REG对UGT1A1的抑制而引发DDI的潜在可能性。而胆红素作为UGT1A1探针底物并不是十分理想, 它不仅化学稳定性差(见光易分解), 而且与表达UGTs的肝微粒体、细胞、细胞浆广泛结合, 其代谢动力学参数Km值会随着孵育体系中微粒体含量的改变而改变, 导致其检测误差大、准确度难以保证。其次, 单酶筛选体系无法真实的模拟复杂生物体系中的传质过程以及生物基质/非靶蛋白与配体间的相互作用, 为避免胆红素的非特异性结合, 用单酶体系获得的抑制动力学参数去预测引发体内DDI的可能性尚不充分。再者, β-雌二醇还存在特异性不足、检测灵敏度低及无法实现高通量筛选等缺陷。综上所述, 迫切需要构建UGT1A1快速、高效、实用的抑制作用评价和风险预测体系, 其对多药联用的风险评控、揭示药物/草药的安全隐患和致毒物质基础以及减少DDI的发生率等具有重要意义。
本研究借助前期的实验基础, 采用兼具高选择性、高灵敏度的NCHN和NPHN作为UGT1A1的特异性荧光探针, 与传统的非特异性探针4-MU共同作为UGT1A1的特异性底物, 对REG的抑制作用进行综合评价。因4-MU与胆红素的结合位点并不吻合[16], 若仅以4-MU为底物将难以准确反映REG对胆红素(或其他UGT1A1底物)代谢的抑制能力。更重要的是, 本方法克服了UGT1A1非荧光探针底物代谢产物多、选择性、测试通量低及灵敏性不佳等缺陷, 最终实现对REG的高内涵表征。在DDI预测中, 以NPHN (高亲和力底物)作为UGT1A1的特异性探针底物, REG对HLM中NPHN-O-葡糖醛酸化具有强烈抑制作用, 提示该药物存在潜在的抑制胆红素解毒的途径, 与文献所报道的REG会引起胆红素水平升高的现象正好吻合[1-5], 以上结果再次证实了本实验选用与胆红素结合位点一致的特异性荧光探针底物NPHN, 实现快速定量定性检测, 更具有实用性及推广性。
上述结果用于解释临床DDI及指导临床合理用药时, 将DDI的决定因素确定为药代属性中机体体系因素时, 应注意使用正确的药物与酶的比例量, 才能模拟真实体内情形。其次, UGT1A1具有高度的基因多态性(如UGT1A1*28, 通常诊断为吉尔伯特综合征), 其会导致UGT1A1的低表达或者降低该酶的活性, 且活性具有明显的个体差异[28, 29]。换言之, 上述携带UGT1A1*28的个体会显现出受损的胆红素结合能力, 而高胆红素血症在肝脏胆红素结合能力降低的情况下更加显著, 因此, REG对体内UGT1A1介导的胆红素代谢通路的抑制, 对于携带UGT1A1*28的个体可能会更容易呈现出高胆红素血症的易感性以及肝损伤等不良反应。同理, UGT1A7、UGT1A9存在基因多态性, 特别是UGT1A7*3和UGT1A9*3也会向上述情况一样, 以上情形均使REG在体内形成抑制的可能性变得复杂。
综上所述, 本文系统研究了REG对人尿苷二磷酸葡糖醛酸转移酶体外活性抑制作用, 从药代的因素揭示了服用REG相关制剂后, 血中胆红素浓度急剧上升并引发急性肝损伤现象的机制。所采用的UGT1A1特异性荧光探针NCHN的相关检测方法已被推广至国内及欧美多个实验室, 使得UGT1A1-小分子相互作用的研究进入到了高通量时代。上述研究中发现的UGT1A1强抑制剂等信息还可用于指导REG的临床科学合理用药, 尤其可有效避免肿瘤治疗中多药联用引发的DDI等潜在安全隐患。
| [1] | Strumberg D, Scheulen ME, Schultheis B, et al. Regorafenib (BAY 73-4506) in advanced colorectal cancer:a phase I study[J]. Br J Cancer, 2012, 106: 1722–1727. DOI:10.1038/bjc.2012.153 |
| [2] | D'Alessandro R, Refolo MG, Lippolis C, et al. Reversibility of regorafenib effects in hepatocellular carcinoma cells[J]. Cancer Chemother Pharmacol, 2013, 72: 869–877. DOI:10.1007/s00280-013-2269-8 |
| [3] | Li J. Research progress of new oral multikinase inhibitor regorafenib in the treatment of cancer[J]. Chin Clin Oncol (临床肿瘤学杂志), 2014, 19: 385–390. |
| [4] | Wang Z, Xu J, Nie W, et al. Risk of hypertension with regorafenib in cancer patients:a systematic review and meta-analysis[J]. Eur J Clin Pharmacol, 2014, 70: 225–231. DOI:10.1007/s00228-013-1598-1 |
| [5] | Carr BI, D'Alessandro R, Refolo MG, et al. Effects of low concentrations of regorafenib and sorafenib on human HCC cell AFP, migration, invasion, and growth in vitro[J]. J Cell Physiol, 2013, 228: 1344–1350. DOI:10.1002/jcp.v228.6 |
| [6] | Rowland A, Miners JO, Mackenzie PI. The UDP-glucuronosyltransferases:their role in drug metabolism and detoxification[J]. Int J Biochem Cell Biol, 2013, 45: 1121–1132. DOI:10.1016/j.biocel.2013.02.019 |
| [7] | Wang XX, Hou J, Ning J, et al. Inhibition of sciadopitysin against UDP-glucuronosyltransferases[J]. Acta Pharm Sin (药学学报), 2016, 51: 749–755. |
| [8] | Fujiwara R, Nguyen N, Chen S, et al. Developmental hyperbilirubinemia and CNS toxicity in mice humanized with the UDP glucuronosyltransferase 1(UGT1) locus[J]. Proc Natl Acad Sci USA, 2010, 107: 5024–5029. DOI:10.1073/pnas.0913290107 |
| [9] | Wen Z, Tallman MN, Ali SY, et al. UDP-glucuronosyltransferase 1A1 is the principal enzyme responsible for etoposide glucuronidation in human liver and intestinal microsomes:structural characterization of phenolic and alcoholic glucuronides of etoposide and estimation of enzyme kinetics[J]. Drug Metab Dispos, 2007, 35: 371–380. |
| [10] | Goon CP, Wang LZ, Wong FC, et al. UGT1A1 mediated drug interactions and its clinical relevance[J]. Curr Drug Metab, 2016, 17: 100–106. DOI:10.2174/1389200216666151103121253 |
| [11] | Krishna R, East L, Larson P, et al. Atazanavir increases the plasma concentrations of 1200 mg raltegravir dose[J]. Biopharm Drug Dispos, 2016, 37: 533–541. DOI:10.1002/bdd.v37.9 |
| [12] | Zhang N, Liu Y, Jeong H. Drug-drug interaction potentials of tyrosine kinase inhibitors via inhibition of UDP-glucuronosyltransferases[J]. Sci Rep, 2015, 5: 177–178. |
| [13] | Iacovelli R, Palazzo A, Procopio G, et al. Incidence and relative risk of hepatic toxicity in patients treated with anti-angiogenic tyrosine kinase inhibitors for malignancy[J]. Br J Clin Pharmacol, 2014, 77: 929–938. DOI:10.1111/bcp.2014.77.issue-6 |
| [14] | Tlemsani C, Huillard O, Arrondeau J, et al. Effect of glu-curonidation on transport and tissue accumulation of tyrosine kinase inhibitors:consequences for the clinical management of sorafenib and regorafenib[J]. Expert Opin Drug Metab Toxicol, 2015, 11: 1–10. DOI:10.1517/17425255.2015.1074355 |
| [15] | Miners J O, Chau N, Rowland A, et al. Inhibition of human UDP-glucuronosyltransferase enzymes by lapatinib, pazopanib, regorafenib and sorafenib:implications for hyperbilirubinemia[J]. Biochem Pharmacol. DOI:10.1016/j.bcp.2017.01.002 |
| [16] | Lü X, Wang XX, Hou J, et al. Comparison of the inhibitory effects of tolcapone and entacapone against human UDP-glucuronosyltransferases[J]. Toxicol Appl Pharmacol, 2016, 301: 42–49. DOI:10.1016/j.taap.2016.04.009 |
| [17] | Xin H, Qi XY, Wu JJ, et al. Assessment of the inhibition potential of licochalcone A against human UDP-glucuronosyltransferases[J]. Food Chem Toxicol, 2016, 90: 112–122. DOI:10.1016/j.fct.2016.02.007 |
| [18] | Uchaipichat V, Mackenzie PI, Guo XH, et al. Human UDP-glucuronosyltransferases:isoform selectivity and kinetics of 4-methylumbelliferone and 1-naphthol glucuronidation, effects of organic solvents, and inhibition by diclofenac and probenecid[J]. Drug Metab Dispos, 2004, 32: 413–423. DOI:10.1124/dmd.32.4.413 |
| [19] | Kim D, Zheng YF, Min JS, et al. In vitro stereoselective inhibition of ginsenosides toward UDP-glucuronosyltrans-ferase (UGT) isoforms[J]. Toxicol Lett, 2016, 259: 1–10. DOI:10.1016/j.toxlet.2016.07.108 |
| [20] | Uchaipichat V, Mackenzie PI, Elliot DJ, et al. Selectivity of substrate (trifluoperazine) and inhibitor (amitriptyline, androsterone, canrenoic acid, hecogenin, phenylbutazone, quinidine, quinine, and sulfinpyrazone) "probes" for human UDP-glucuronosyltransferases[J]. Drug Metab Dispos, 2006a, 34: 449–456. |
| [21] | Ai LM, Zhu LL, Yang L, et al. Selectivity for inhibition of nilotinib on the catalytic activity of human UDP-glucurono-syltransferases[J]. Xenobiotica, 2014, 44: 320–325. DOI:10.3109/00498254.2013.840750 |
| [22] | Zhu LL, Ge GB, Liu Y, et al. Potent and selective inhi-bition of magnolol on catalytic activities of UGT1A7 and 1A9[J]. Xenobiotica, 2012, 42: 1001–1008. DOI:10.3109/00498254.2012.681814 |
| [23] | Rowland A, Knights KM, Mackenzie PI, et al. The "albumin effect" and drug glucuronidation:bovine serum albumin and fatty acid-free human serum albumin enhance the glucuronidation of UDP-glururonosyltransferase (UGT) 1A9 substrates but not UGT1A1 and UGT1A6 activities[J]. Drug Metab Dispos, 2008, 36: 1056–1062. DOI:10.1124/dmd.108.021105 |
| [24] | Lü X, Ge GB, Feng L, et al. An optimized ratiometric fluo-rescent probe for sensing human UDP-glucuronosyltransferase 1A1 and its biological applications[J]. Biosens Bioelectron, 2015, 72: 261–267. DOI:10.1016/j.bios.2015.05.003 |
| [25] | Lü X. Screening, Characterization and Application of UGT1A1 Specific Fluorescent Probes (UGT1A1特异性荧光探针的设计筛选、性能表征及应用研究)[D]. Dalian:Dalian University of Technology, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10141-1016204383.htm |
| [26] | Kirby BJ, Unadkat JD. Impact of ignoring extraction ratio when predicting drug-drug interactions, fraction metabolized, and intestinal first-pass contribution[J]. Drug Metab Dispos, 2010, 38: 1926–1933. DOI:10.1124/dmd.110.034736 |
| [27] | Mross K, Frost A, Steinbild S, et al. A phase I dose-escalation study of regorafenib (BAY 73-4506), an in-hibitor of oncogenic, angiogenic, and stromal kinases, in patients with advanced solid tumors[J]. J Clin Cancer Res, 2012, 18: 26–58. |
| [28] | Sim SC, Kacevska M, Ingelman-Sundberg M. Pharmacogenomics of drug-metabolizing enzymes:a recent update on clinical implications and endogenous effects[J]. Pharmacogenomics J, 2013, 13: 1–11. DOI:10.1038/tpj.2012.45 |
| [29] | Udomuksorn W, Elliot DJ, Lewis BC, et al. Influence of mutations associated with Gilbert and Crigler-Najjar type Ⅱ syndromes on the glucuronidation kinetics of bilirubin and other UDP-glucuronosyltransferase 1A substrates[J]. Pharmacogenet Genom, 2007, 17: 1017–1029. DOI:10.1097/FPC.0b013e328256b1b6 |
 2017, Vol. 52
2017, Vol. 52


