2. 江苏恩华药物研究院, 江苏 徐州 221100
2. Jiang Su Enhwa Drug Research Institution, Xuzhou 221100, China
钙激活氯通道(calcium-activated chloride channel, CaCC)作为人体阴离子通道, 广泛分布于呼吸道、消化道等具有分泌功能的腺上皮细胞中, 也存在于视网膜、背根神经节及平滑肌细胞中, 参与多种细胞生理活动, 例如分泌蛋白及盐的跨上皮转运、神经信号传导、动作电位复极、平滑肌收缩等[1-5]。迄今为止, 发现的CaCC分子基础主要有CLCA (chloride channel accessory)[6]、tweety (hTTHY1 and hTTYH3)[7]、bestrophins[8]和anoctamins[9]。
Anoctamin 1 (ANO1), 也被称为TMEM16A (transmembrane protein 16A), 是一类具有8次跨膜结构的膜蛋白。ANO1最初被发现在部分肿瘤组织中特异性高表达, 如胃肠道间质瘤[10]、口腔鳞状细胞癌[11]、头颈部鳞状细胞癌[12]等, 而在相同起源的正常组织低表达或不表达。ANO1抗体能够作为检测胃肠道间质瘤的一种敏感的特异性标志物[13]。2008年, ANO1蛋白首次被确认为CaCC的分子基础, 在体外可表现完整的钙激活氯电流特征[14-17]。
理论上, 如果对ANO1蛋白进行调控, 可能产生一系列与离子通道功能相关的药效作用, 例如Lee等[18]在小鼠中使用干扰RNA将ANO1敲低后, 小鼠对针刺和热刺激产生明显痛觉钝化现象; Namkung等[19]使用离体肠平滑肌组织进行肠蠕动力监测, 发现ANO1抑制剂TMEM16Ainh-A01可以显著降低肠蠕动舒张力和收缩力, 但不改变蠕动节律。此外, ANO1也具有肿瘤相关的调控功能, 具有明显的抑制肿瘤增殖和迁移的作用[20], 例如Liu等[21]在前列腺癌细胞中使用shRNA对ANO1进行沉默, 显著抑制了肿瘤的增殖和迁移。
针对ANO1蛋白的小分子调节剂研究还处于起步阶段, 数量少、活性低是当前存在的主要问题。文献报道较强的ANO1特异性抑制剂IC50值在1 μmol·L-1以上, 较低的活性一定程度上制约了ANO1蛋白的基础研究工作。
ANO1特异性抑制剂主要有CaCCinh系列[22], TMEM16Ainh-A系列[23]、MONNA系列[24]、Ani9系列[25]和部分天然化合物[26], 以上化合物普遍对ANO1稳转细胞系中的CaCC电流具有明显抑制作用, 但是对具有CaCC电生理特征的正常人体组织细胞抑制作用存在明显差异; 此外, 以上抑制剂对于ANO1相关的肿瘤增殖抑制效果也存在差异, CaCCinh-A01和tannic acid具有明显抑制作用, 而其余抑制剂则无效。目前ANO1激动剂只有Eact系列[27], 其可在无Ca2+环境下直接激动ANO1蛋白, 产生离子通道功能。
本文将从以ANO1为靶点的钙激活氯通道调节剂的测活方法、结构及构效关系和潜在应用方向进行论述。
1 钙激活氯通道调节剂的生物活性测试方法目前对于ANO1蛋白调节剂的测活方法, 主要围绕ANO1蛋白的钙激活氯通道特性, 即转运阴离子, 且通道开闭受到细胞内Ca2+浓度和细胞膜电位的双重影响。当通道开放时, 细胞膜电阻显著下降, 并出现跨细胞膜的阴离子流, 这种电流可以被电极检测到, 不同的开放程度产生的跨细胞膜电流不同。因此, 通过调整细胞内Ca2+浓度或改变膜电位来控制通道开放程度, 检测调节剂对跨膜电流的影响, 是大多数ANO1蛋白调节剂测活方法的基本原理; 与此同时, 也可通过使用对阴离子敏感的荧光指示蛋白, 检测阴离子浓度变化的方式来进行间接检测。ANO1蛋白调节剂的测活方法主要有黄色荧光蛋白-碘离子荧光淬灭法、短路电流法、全细胞膜片钳法和电压钳法, 以下分别阐述。
1.1 黄色荧光蛋白-碘离子荧光淬灭法该方法使用ANO1和黄色荧光蛋白(yellow fluoresence protein, YFP)共转染的FRT细胞, 或YFP转染的内源性表达CaCC的人体组织细胞。YFP的黄色荧光可以被碘离子淬灭。当细胞外液加入卡巴胆碱(CCh)或ATP时, 细胞内钙库会释放钙离子, 使钙离子浓度升高, 从而激活CaCC通道。而CaCC通道可以将细胞外碘离子转运进入细胞内部, 因而在不加入调节剂时细胞内的YFP荧光会被淬灭, 在酶标仪检测下, 荧光值会显著降低。如图 1所示, 当加入CaCC抑制剂时, 荧光值降低的速度会减慢; 反之, 当加入激动剂时, 荧光值降低速度会加快, 通过比较荧光值的下降速率, 可间接评价调节剂的活性。
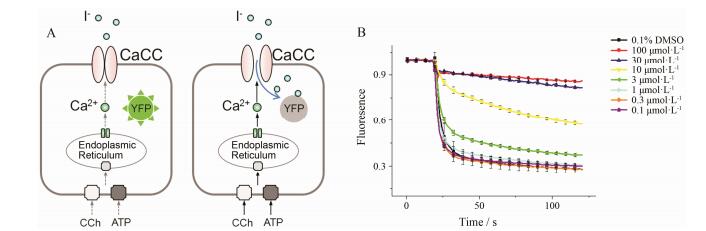
|
Figure 1 Yellow fluoresence protein (YFP) florescence quenching assay. (A) Experiment method of YFP florescence quenching assay; (B) Changes of yellow fluorescence in response to different CaCCinh-A01 concentration[22] |
短路电流法(short circle current)使用经典的尤斯室装置, 如图 2所示, 上皮组织或单层细胞接种在基底上, 形成具有极性的紧密连接, 将两个小室完全隔离开。在基底上下两侧通过电极连接一个电压表, 用于测量细胞外侧和基底侧之间的电压。两个小室内装有不同盐溶液, 通过盐桥串联一个外接电源和电流表。在离子通道开放状态下, 基底细胞会自发在两个小室之间转运离子, 产生转运电流和转运电压, 转运电压会被基底层两侧连接的电压表记录下来。此时外接电源给予一个与转运电流大小相同、方向相反的电流, 将转运电压抵消至0 mV, 电流表记录此时给予的外接电流的大小, 即为转运电流的大小。当加入ATP时, 促进细胞内钙库释放钙离子, 进一步激活ANO1通道, 转运电流上升。若再向其中加入ANO1抑制剂, 通道关闭, 此时转运电流会急剧下降。不同强度的抑制剂, 电流的下降幅度不一, 因此可判断抑制剂强弱。
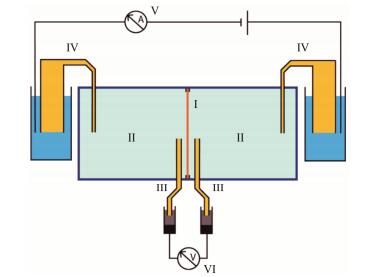
|
Figure 2 Ussing chamber. (Ⅰ) Epithelial tissue or cells; (Ⅱ) The two half chambers with ringer solution; (Ⅲ) (Ⅳ) Agar-Ringer bridges; (Ⅴ) Amperemeter; (Ⅵ) Voltmeter |
膜片钳实验被称为离子通道研究领域的“金标准”。全细胞膜片钳使用特制的中空玻璃电极吸住并吸破细胞表面, 使细胞膜和电极之间形成封闭回路, 电极可检测全细胞膜的离子转运电流。通过中空电极向细胞内液中加入钙离子, 激活ANO1通道。此时电极上外加梯度电压, 检测电流变化情况。当细胞外液加入抑制剂后, 通道闭合, 电阻升高, 在相同的梯度电压下, 相比不加药的空白组离子转运电流降低; 激动剂反之。由此可评估调节剂对离子通道的影响。
1.4 电压钳法本方法在CaCC通道检测方面的应用是由Oh等于2008年提出[28]。电压钳与膜片钳的基本原理相似, 但装置有所区别。电压钳更有利于间接测定在某一特定膜电位下, 细胞膜电阻值, 即离子通道开放程度。装置由两根电极刺入细胞, 其中一根电极连接电压计和指令电压装置, 设定好某一指令电压后, 判断电路会判断膜电压和指令电压值之间的差距, 而后命令外接电源通过另一根电极向细胞内输入一定电流, 使膜电位和指令电压大小相等, 方向相反, 此输入电流会被电流计记录下来。在一定指令电压和钙离子浓度下, 抑制剂活性越强, ANO1通道开放程度越小, 膜电阻越大, 意味着要使膜电位和指令电压相等, 需要输出的电流越小。因此通过比较输入电流, 可间接反映抑制剂活性强弱。
2 ANO1调节剂CaCC抑制剂根据作用选择性可分为非特异性和特异性两类。最初发现的CaCC抑制剂都属于非特异性类, 其选择性较差, 抑制活性弱, 例如niflumic acid (NFA)[29], 能在非洲爪蟾卵母细胞中以10 μmol·L-1的剂量阻断CaCC[30]。曾经人们一度认为NFA是一种特异性阻断剂, 甚至将其用于在不同组织的阴离子电流中识别CaCC电流。然而, NFA有时也能提高钙激活氯电流[31]。NFA除阻滞CaCC外, 还能对许多离子通道进行抑制, 例如电压门控阴离子通道(VRAC)[32]和钾离子通道[33, 34]。此外, NFA对Ca2+电流也有影响[34, 35]。
以下分别详述以ANO1为靶点的CaCC特异性抑制剂。
2.1 天然产物该系列化合物由Namkung等[26]于2010年发表, 代表结构主要有digallic acid (1, IC50 3.6 μmol·L-1)、dichlorophene (2, IC50 4.5 μmol·L-1)、tannic acid (3, IC50 6.1 μmol·L-1)、candesartan (4, IC50 3.7 μmol·L-1)、gossypol (5, IC50 6.1 μmol·L-1)和gambogic acid (6, IC50 3.7 μmol·L-1) (图 3)。在ANO1稳转的FRT细胞上对3 200种天然产物进行基于黄色荧光蛋白-碘离子荧光淬灭模型测试后筛选出以上化合物。其中, tannic acid (3)对ANO1稳转FRT细胞、内源性高表达ANO1的肠T84细胞、支气管上皮细胞均具有良好的CaCC抑制作用。同时其对囊性纤维化跨膜转导因子相关氯通道(cystic fibrosis transmembrane conductance regulator, CFTR)、上皮细胞钾通道(epithelial sodium channel, EnaC)等离子通道均无抑制作用, 亦不影响细胞内钙离子浓度。
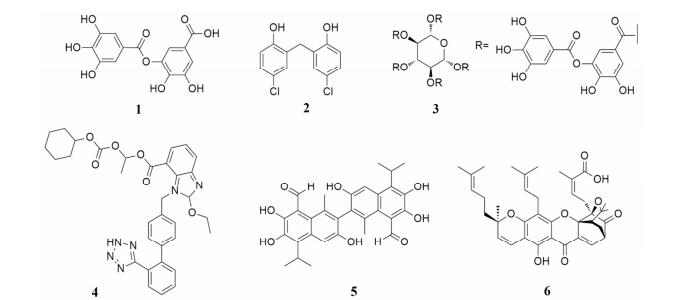
|
Figure 3 Calcium-activated chloride channel (CaCC) inhibitor natural products |
CaCCinh-A01 (7)是第一个特异性CaCC抑制剂, 其起效迅速, 抑制能力较强。该系列化合物由Namkung等[22]于2008年发表并申请专利。由于ANO1蛋白作为CaCC的分子基础直到2008年才被揭示, 因此Namkung等进行CaCCinh-A01系列研究时并未使用ANO1蛋白稳转细胞系, 而使用人结肠癌细胞HT-29 (内源性CaCC高表达)构建黄色荧光蛋白-碘离子荧光淬灭模型。对50 000种类药化合物进行高通量筛选获得了CaCCinh-A (7)、CaCCinh-B (8)两类化合物。二者在抑制CaCC通道同时, 不影响细胞内钙浓度, 同时对CFTR无抑制作用。
如图 4所示, 对CaCCinh-A (7a)系列18个类似物分子进行构效关系研究发现, n为1 (即噻吩并环己烷母核)活性最高, n为2 (即噻吩并环庚烷母核)次之, 而n为0 (即噻吩并叔丁基环戊烷母核)活性消失; R1部分为叔丁基有利于活性提升; R2部分为OH (即噻吩甲酸)时活性最高, 为甲氧基(即噻吩甲酸甲酯)或乙氧基(噻吩甲酸乙酯)时活性次之, 为取代氨基时(即噻吩酸酰胺)活性消失; R3部分对活性影响较弱, 为2-呋喃甲酰基或(trans)-C=OC=CCO2H时活性最高, 为取代苯基或-C=O(CH2)2CO2H时活性次之。
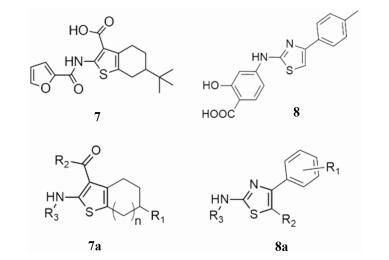
|
Figure 4 The series of CaCCinh inhibitors |
对CaCCinh-B (8a)系列14个类似物进行构效关系研究发现, R1部分为4位取代甲基或乙基活性最好, 3位取代活性消失; R2部分为正丙基、乙酸基或氢时活性最高, 为苯基时活性消失; R3分别为2, 3, 4位取代苯基活性均可。
由于ANO1蛋白在肿瘤组织中高度表达, 使用siRNA对ANO1进行沉默会导致相应ANO1高表达肿瘤细胞增殖抑制, 因此使用ANO1抑制剂进行肿瘤相关研究也是学界的研究热点之一。2014年诺华生物医学研究中心的Hall等[36]发表文章, 发现CaCCinh-A01系列分子在抑制肿瘤增殖方面具有一定活性, 同时此种活性是通过促进ANO1蛋白降解而产生的。分别在ANO1内源性高表达癌细胞(Te11和Fadu)和ANO1低表达的癌细胞上测试, ANO1特异性抑制剂CaCCinh-A01 (7)、TMEM16Ainh-A01 (9)、ANO1天然抑制剂tannic acid (3)和digallic acid (1) 4种化合物的作用并不一致。只有CaCCinh-A01和tannic acid在ANO1高表达癌细胞上具有增殖抑制活性, 并且对ANO1低表达细胞增殖抑制活性较低; 其余两种抑制剂对ANO1高、低表达的细胞均无增殖抑制活性。对CaCCinh-A01衍生物进行测试发现, 此种增殖抑制效果与化学结构密切相关, 如图 4所示n = 1时, R1叔丁基和R2羟基对增殖抑制活性为必需基团, 当R1变为氢原子或R2部分成酯后, 增殖抑制活性消失, 但仍具有CaCC通道抑制活性。Hall等又将CaCCinh-A01羧酸形态和钙离子共孵育结晶, 进行X-射线晶体衍射发现, 6个CaCCinh-A01分子的羧酸部分与3个钙离子形成稳定的配位, 而R2部分成酯的CaCCinh-A01衍生物则无法形成稳定配位, 猜想肿瘤增殖抑制活性可能是由抑制剂与ANO1钙结合区的钙离子配位引起的。进而使用10种钙配位剂进行增殖抑制测试, 均无活性, 而后使用EGTA-AM (即EGTA的可透膜形式)进行增殖抑制测试, 发现其具有的增殖抑制活性与ANO1的表达量无关。因此提出与钙离子的配位能力可能是肿瘤增殖抑制活性的必要条件, 但不是充分条件。
2.3 TMEM16Ainh-A01该系列化合物由Namkung和Verkman等[23]于2011年通过高通量筛选发现。对商业化合物库10万个分子进行基于黄色荧光蛋白-碘离子黄色荧光淬灭实验发现, TMEM16Ainh-A01 (9, IC50 1.8 μmol·L-1)、B01 (10, IC50 4.4 μmol·L-1)、C01 (11, IC50 8.4 μmol·L-1)、D01 (12, IC50 4.4 μmol·L-1) (图 5) 4个分子在ANO1稳转的FRT细胞中表现出良好的抑制活性, 同时不影响细胞内钙浓度。随后在短路电流实验中发现, TMEM16Ainh系列分子以及ANO1天然抑制剂digallic acid (1)仅对唾液分泌腺上皮细胞中的CaCC通道有抑制作用, 而对支气管和肠上皮细胞中的CaCC通道抑制作用微弱; 与此相比, CaCC经典抑制剂CaCCinh-A01 (7)和天然抑制剂tannic acid (3)则对上述唾液腺细胞、肠上皮细胞、支气管上皮细胞均有良好的抑制作用。在对唾液腺上皮细胞和支气管上皮细胞进行Western blot检测后发现, 唾液腺细胞ANO1蛋白表达量远高于支气管上皮细胞。白细胞介素4 (interleukin-4, IL-4) 可以显著提高ANO1蛋白含量, 在对支气管上皮细胞进行IL-4孵育后, Western blot结果表明其ANO1蛋白含量也并未出现显著增加。以上实验表明:在支气管上皮细胞中, ANO1介导的CaCC电流只占小部分; CaCCinh-A01和tannic acid除抑制ANO1蛋白外, 还能够抑制其他CaCC的分子基础。
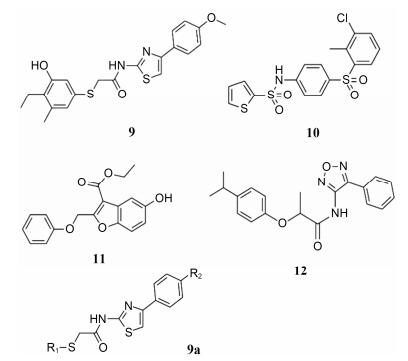
|
Figure 5 The series of TMEMinh inhibitors |
Namkung等[23]还进行了ANO家族另一亚型ANO2通道的相关抑制试验(此前有报道表明其也是CaCC的分子基础之一, 主要分布于中枢神经系统), 结果表明上述CaCCinh-A01 (7)、TMEM16Ainh-A01 (9)、digallic acid (1)和tannic acid (3)均同时抑制ANO1及ANO2通道。
在对TMEM16Ainh-A系列18个衍生物进行的构效关系分析表明, R1部分对活性影响显著, R1为小疏水基团取代的苯基时活性最好, 例如3, 4, 5位甲基或乙基取代的苯基; R1为亲水基团取代的苯基时活性较差, 例如多氨基、多羟基取代苯基; 连接芳基取代的苯基时活性消失。R2部分对活性影响较小, 氢、甲氧基、氟、氯取代时活性相差不大。
2.4 MONNAMONNA系列分子是Oh和Lee于2013年发表[24], 该系列使用Oh等[28]在2008年建立的非洲蟾蜍卵母细胞电压钳模型进行生物活性测试, 通过合成优化的手段获得MONNA (13, IC50 0.08 μmol·L-1, 电压钳) (图 6) 分子。该研究中未将MONNA和其他ANO1特异性抑制剂进行比较, 只与非特异性CaCC抑制剂NFA等进行比较。MONNA (13)在全细胞膜片钳实验中IC50为1.27 μmol·L-1, 在数据上与ANO1抑制剂TMEM16Ainh-A01 (9)相近。MONNA系列分子对bestrophin-1和CFTR等通道均无明显抑制作用。
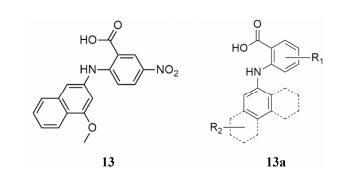
|
Figure 6 The series of MONNA inhibitors |
在对MONNA系列72个类似物分子进行构效关系研究后表明(13a) (图 6), R1为5取代硝基时活性最强, 吸电子基团有利于活性提高。R2为2-萘环有助于活性提升, 其中4-甲氧基-2-萘基时活性最强。
2.5 Ani9该系列由Seo和Namkung在2016年发表[25], 是目前抑制能力最强的选择性ANO1蛋白抑制剂。Namkung等在ANO1稳转FRT细胞上使用黄色荧光蛋白-碘离子荧光淬灭法对54 000个分子进行高通量筛选, 使用短路电流实验进行验证, 筛选出Ani9 (14, IC50 0.107 μmol·L-1) (图 7) 系列分子。该系列化合物对ANO1具有很强的选择性, 在短路电流实验中, 该分子对ANO2、CFTR、VRAC等均无明显抑制作用, 在ANO1高表达的FRT细胞、PC-3细胞、Capan-1细胞及IL-4孵育的NHNE (normal human nasal epithelial)细胞中, Ani9 (14)均具有良好抑制作用。
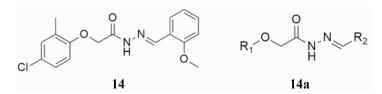
|
Figure 7 The series of Ani9 inhibitors |
Ani9系列分子没有进行衍生合成, 对其现有9个类似物进行测试表明(14a) (图 7), R1为2-甲基-4-氯苯基时活性最强, 特别是2位甲基取代对活性提升帮助较大。R2部分进行了甲氧基取代苯基和羟基取代苯基类似物的测活, 其中2-甲氧基苯基取代时活性最强。
2.6 激动剂: Eact和Fact该系列分子由Namkung在2011年发表[19], 通过黄色荧光蛋白-碘离子荧光淬灭实验筛选和短路电流实验验证, 对Chemdiv和Asinex商业化合物库10万个合成分子以及7 500个天然分子进行测试, 获得了Eact (15, EC50 3 μmol·L-1)和Fact (16, EC50 37 μmol·L-1) (图 8) 两个代表分子。其二者在ANO1稳转的FRT细胞中, 激动CaCC通道的同时不影响细胞内钙浓度。二者激动的CaCC电流可被ANO1抑制剂TMEM16Ainh-A01 (9)抑制。
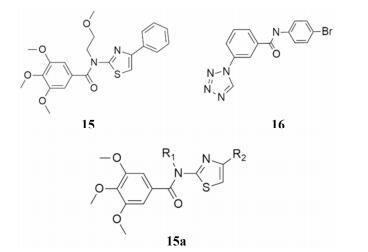
|
Figure 8 The series of Eact agonists |
在全细胞膜片钳实验中, Eact (15)可在细胞内、外钙离子浓度极低的情况下, 轻度激活ANO1通道, 但Fact (16)则不具有此种功能; 在Eact和Fact联合给药试验中, 二者呈现明显的协同作用: 1 μmol·L-1 Eact激动能力小于20%, 1 μmol·L-1 Fact激动能力小于5%, 而各1 μmol·L-1的二者联用, 激动能力超过40%; 1 μmol·L-1 Eact和3 μmol·L-1 Fact联用, 激动能力则高达80%。
Namkung等[19]合成了17种Eact类似物(15a) (图 8), R1为芳环或醚链, R2部分则替代为不同取代位置的苯环。其中, R1部分的取代基对活性影响较小, 芳烃或环状烷烃利于活性提升; R2为无取代苯基或卤代苯基、甲氧基取代苯基、4-哌啶基活性相近; 仅当R1为2-甲氧基乙基, 且R2为3, 6-二甲氧基苯基或4-哌啶基时无活性, 但是当R1为其他芳烃或环烷烃时, R2为上述两种取代基时有活性。
3 ANO1调节剂构效关系比较以ANO1为靶点的特异性钙激活氯通道抑制剂结构差异较大, 但可能具有相似的药效团特征。如图 9 (A), 以CaCCinh-A01模板, 比较分析TMEM16Ainh-A01、MONNA、Ani9、dalligic acid、Eact、Fact等调控分子, 可见分子基本骨架由芳环-连接链-芳环体系组成, 连接链两侧芳环中心距离6.2Å 左右, 在TMEM16Ainh-A01和Ani9中, 硫醚的硫原子或醚链的氧原子到左侧芳环中心的距离在7Å 左右。在MONNA中, 右侧萘环与1-硝基苯环中心距离7.5Å 左右, 与TMEM16Ainh-A01中硫苯和噻唑中心距离7.8Å 相近。
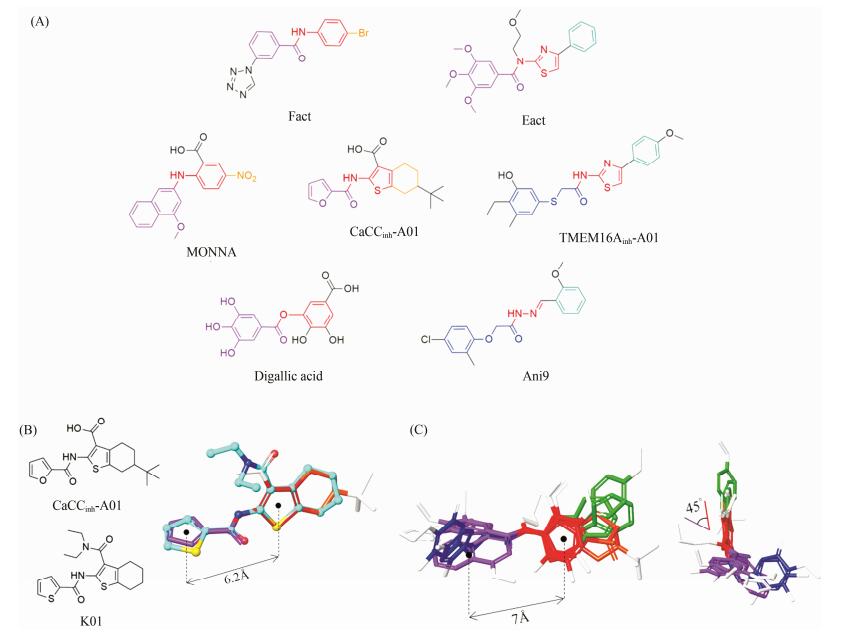
|
Figure 9 SAR of ANO1 modulators. (A) Comparing with ANO1 modulators, different colours means different structural features; such as CaCCinh-A01, red means aromatic rings (Ar) or conjugated functional group bonding to amide nitrogen, purple means Ar which attaching to amide carbonyl, orange means hydrophobic functional group bonding to thiophene; And in TMEM16Ainh-A01, blue means aromatic ether attaching to amide carbonyl, green means Ar bonding to 4 position of thiophene; (B) left: CaCCinh-A01 and K01, right: alignment CaCCinh-A01 to K01 conformation from KSP-K01 complex crystal structure, and the distance between two Ar centrals which bonding to amide carbonyl and amide nitrogen is 6.2Å ; (C) Alignment many ANO1 inhibitors in (A) method, the angle between Ar plate and amide plate is approximately 45°; the distance of S or O, in TMEM16Ainh-A01 and Ani9, to the Ar central which bonding to amide nitrogen is approximately 7Å |
在上述分子中, 连接链与两侧芳环可能并不处于平面共轭状态。如图 9 (B)左图, 观察CaCCinh-A01的类似物——K01, 其是纺锤体驱动蛋白(kinesin spindle protein, KSP)的非共价抑制剂分子(kinesin-like蛋白与ANO1蛋白完全不相关, 仅其抑制剂分子K01和ANO1抑制剂分子CaCCinh-A01结构相近)。选取K01共晶结构(PDB ID:2PG2) 中的活性构象, 将CaCCinh-A01与之叠合, 如图 9 (B)右图所示, 酰胺键N侧的芳环平面与酰胺键平面呈约45度夹角。而将CaCCinh-A01与K01进行叠合, 而后将所有调节剂分子与CaCCinh-A01进行叠合, 如图 9 (C), 可发现图 9 (A)中相同的结构特征部分叠合较好, 说明ANO1系列调节剂具有一定的相似性。
结合文献[19, 22-26, 36]报道的调节剂构效关系, 可以猜想: ANO1调节剂可能结合于一狭长口袋之中, 长度在16Å 范围内, 口袋内部较为疏水。以TMEM16Ainh-A01分子为例, 4-取代苯基噻唑结合于口袋右侧, 而芳香硫醚基团结合于口袋左侧。口袋内部右侧为弱的氢键给体, 与TMEM16Ainh-A01苯环上的甲氧基形成弱氢键; 结合口袋中部可能有含正电荷的氨基酸残基与CaCCinh-A01的羧基形成静电相互作用或氢键, 而口袋左侧则较为疏水, 是否存在氢键还不得而知。在CaCCinh-A01中存在的叔丁基可能暴露在口袋外侧, 以疏水作用将分子推入口袋内部; 而TMEM16Ainh-A01芳香硫醚和Ani9中芳香醚一般与主链形成弯折, 可能固定于口袋外部较为疏水的区域。以上猜想是基于构效关系的综合分析, 对于TMEM16Ainh-A01和Ani9等分子, 口袋左侧芳香醚部分的改变对于活性影响不大; 而几乎所有调节剂分子, 右侧芳环改变或芳环取代基改变可以显著影响活性。
4 以ANO1为靶点的CaCC调节剂潜在应用ANO1在包括气管和肠上皮细胞、平滑肌细胞、肠起搏细胞、感觉神经元和许多肿瘤细胞在内的多种细胞中具有重要作用[16, 37], 并参与到多种病理过程中[12, 38-40]。抑制ANO1蛋白将有助于多种疾病的治疗, 例如肿瘤、痢疾、哮喘、高血压、疼痛等。ANO1高度表达于多种人类肿瘤细胞中, 包括头颈部鳞状细胞癌、胃肠道恶性间质细胞瘤、乳腺癌和前列腺癌细胞等[39-41], 抑制ANO1蛋白可以显著降低上述肿瘤细胞的生存能力[12, 39, 42, 43]。在轮状病毒引起的痢疾中, 通常认为轮状非结构蛋白4 (rotavirus nonstructure protein 4, NSP4) 作为一种肠毒素, 是通过激活CaCC而引起痢疾[44], 使用小分子对CaCC进行抑制可以减少轮状病毒介导的肠液流失。在卵清蛋白(oval albumin, OVA)介导的小鼠哮喘模型中, ANO1高度表达于气管黏蛋白分泌细胞和气管平滑肌细胞中。抑制ANO1导致气管上皮细胞黏液分泌抑制, 同时也会导致平滑肌收缩抑制[45]。最近, ANO1蛋白在血压调节中的作用逐渐被揭示出来, ANO1在原发性高血压患者的动脉中高度表达, 使用ANO1抑制剂TMEM16Ainh-A01可以明显降低血压(动物实验), 并且使用siRNA对ANO1进行敲低可以预防原发性高血压的出现[46]。此外, 在使用野百合碱(monocrotaline, MCT)介导的肺高压大鼠模型中ANO1 mRNA和蛋白水平均出现上调; 在五羟色胺相关肺高压中, 抑制ANO1可以明显降低肺动脉收缩[47]。ANO1还在痛觉传导中扮演重要角色, 例如, ANO1高度表达于痛觉相关的背根神经节(DRG)细胞中, 在DRG中阻断或敲低ANO1蛋白可显著降低小鼠在疼痛模型中的痛觉反应[37]。此外, 辣椒素引起的痛觉相关模型中, 痛觉行为可以被ANO1抑制剂TMEM16Ainh-A01降低[48]。
5 总结和展望ANO1特异性调节剂的发展自2008年开始已经走过9个年头, 包括CaCCinh-A01、TMEM16Ainh-A01、MONNA、tannic acid、Eact、Ani9在内的众多分子已经为ANO1基础研究提供了极大帮助。
但是ANO1蛋白作为CaCC通道的分子基础之一, 与其他分子基础之间的关系并没有得到阐明。特别是在ANO1抑制剂研究中, 各型ANO1抑制剂对支气管上皮细胞、肠上皮细胞中的CaCC通道抑制作用并不一致, 鉴于各种上皮细胞中的ANO1表达量不尽相同, 现无法确定抑制作用差异现象是由ANO1蛋白表达量引起, 还是由抑制剂在各CaCC通道分子基础之间选择性引起。与此同时, CaCCinh-A01抑制活性可能与ANO1的Ca2+激活特性有关, 其对其他钙激活离子通道也具有一定作用, 目前难以确定ANO1调节剂的各种药理作用是否只与ANO1蛋白有关。
此外, ANO1蛋白与其他蛋白的相互作用机制也未得到阐明, 在ANO1参与的多种生理功能中, 可能存在多种调控通路。使用ANO1调节剂治疗某种疾病时, 是否会因此产生其他不良反应, 目前仍缺少证据。
虽然ANO1研究中存在许多问题亟待解决, 但在疾病的治疗中ANO1调节剂存在的巨大应用潜力仍然极具“诱惑”[18, 48-56]。特别是对于疼痛治疗, 目前还未出现任何一种针对阴离子通道的镇痛药物或麻醉药物, 以ANO1为靶点的药物, 有望开启新的镇痛治疗模式。未来, 相信在结构生物学、化学生物学研究的帮助下, 人们对于ANO1蛋白的研究会越发明朗, 也会有更多高选择性的抑制剂出现, 为众多疾病的治疗带来曙光。
| [1] | Manoury B, Tamuleviciute A, Tammaro P. TMEM16A/ anoctamin 1 protein mediates calcium-activated chloride currents in pulmonary arterial smooth muscle cells[J]. J Physiol, 2010, 588: 2305–2314. DOI:10.1113/jphysiol.2010.189506 |
| [2] | Ousingsawat J, Martins JR, Schreiber R, et al. Loss of TMEM16A causes a defect in epithelial Ca2+-dependent chloride transport[J]. J Biol Chem, 2009, 284: 28698–28703. DOI:10.1074/jbc.M109.012120 |
| [3] | Rock JR, O'Neal WK, Gabriel SE, et al. Transmembrane protein 16A (TMEM16A) is a Ca2+-regulated Cl- secretory channel in mouse airways[J]. J Biol Chem, 2009, 284: 14875–14880. DOI:10.1074/jbc.C109.000869 |
| [4] | Davis AJ, Forrest AS, Jepps TA, et al. Expression profile and protein translation of TMEM16A in murine smooth muscle[J]. Am J Physiol Cell Physiol, 2010, 299: C948–C959. DOI:10.1152/ajpcell.00018.2010 |
| [5] | Gomez-Pinilla PJ, Gibbons SJ, Bardsley MR, et al. Ano1 is a selective marker of interstitial cells of Cajal in the human and mouse gastrointestinal tract[J]. Am J Physiol Gastrointest Liver Physiol, 2009, 296: G1370–G1381. DOI:10.1152/ajpgi.00074.2009 |
| [6] | Loewen ME, Forsyth GW. Structure and function of CLCA proteins[J]. Physiol Rev, 2005, 85: 1061–1092. DOI:10.1152/physrev.00016.2004 |
| [7] | Suzuki M. The Drosophila tweety family: molecular candi dates for large-conductance Ca2+-activated Cl- channels[J]. Exp Physiol, 2006, 91: 141–147. DOI:10.1113/expphysiol.2005.031773 |
| [8] | Kane D, Pedi VL, Long SB. Structure and insights into the function of a Ca2+-activated Cl- channel[J]. Nature, 2014, 516: 213–218. DOI:10.1038/nature13913 |
| [9] | Hartzell C, Putzier I, Arreola J. Calcium-activated chloride channels[J]. Annu Rev Physiol, 2005, 67: 719–758. DOI:10.1146/annurev.physiol.67.032003.154341 |
| [10] | Espinosa I, Lee CH, Kim MK, et al. A novel monoclonal antibody against DOG1 is a sensitive and specific marker for gastrointestinal stromal tumors[J]. Am J Surg Pathol, 2008, 32: 210–218. DOI:10.1097/PAS.0b013e3181238cec |
| [11] | Huang X, Godfrey TE, Gooding WE, et al. Comprehensive genome and transcriptome analysis of the 11q13 amplicon in human oral cancer and synteny to the 7F5 amplicon in murine oral carcinoma[J]. Genes Chromosomes Cancer, 2006, 45: 1058–1069. DOI:10.1002/gcc.v45:11 |
| [12] | Duvvuri U, Shiwarski DJ, Xiao D, et al. TMEM16A induces MAPK and contributes directly to tumorigenesis and cancer progression[J]. Cancer Res, 2012, 72: 3270–3281. DOI:10.1158/0008-5472.CAN-12-0475-T |
| [13] | Lee CH, Liang CW, Espinosa I. The utility of discovered on gastrointestinal stromal tumor 1 (DOG1) antibody in surgical pathology-the GIST of it[J]. Adv Anat Pathol, 2010, 17: 222–232. DOI:10.1097/PAP.0b013e3181d973c2 |
| [14] | Caputo A, Caci E, Ferrera L, et al. TMEM16A, a membrane protein associated with calcium-dependent chloride channel activity[J]. Science, 2008, 322: 590–594. DOI:10.1126/science.1163518 |
| [15] | Schroeder BC, Cheng T, Jan YN, et al. Expression cloning of TMEM16A as a calcium-activated chloride channel subunit[J]. Cell, 2008, 134: 1019–1029. DOI:10.1016/j.cell.2008.09.003 |
| [16] | Yang YD, Cho H, Koo JY, et al. TMEM16A confers receptor-activated calcium-dependent chloride conductance[J]. Nature, 2008, 455: 1210–1215. DOI:10.1038/nature07313 |
| [17] | Ferrera L, Caputo A, Galietta LJ. TMEM16A protein: a new identity for Ca2+-dependent Cl- channels[J]. Physiology (Bethesda), 2010, 25: 357–363. DOI:10.1152/physiol.00030.2010 |
| [18] | Lee B, Cho H, Jung J, et al. Anoctamin 1 contributes to inflammatory and nerve-injury induced hypersensitivity[J]. Mol Pain, 2014, 10: 5. |
| [19] | Namkung W, Yao Z, Finkbeiner WE, et al. Small-molecule activators of TMEM16A, a calcium-activated chloride channel, stimulate epithelial chloride secretion and intestinal contrac tion[J]. FASEB J, 2011, 25: 4048–4062. DOI:10.1096/fj.11-191627 |
| [20] | Jia L, Liu W, Guan L, et al. Inhibition of calcium-activated chloride channel ANO1/TMEM16A suppresses tumor growth and invasion in human lung cancer[J]. PLoS One, 2015, 10: e0136584. DOI:10.1371/journal.pone.0136584 |
| [21] | Liu W, Lu M, Liu B, et al. Inhibition of Ca2+-activated Cl- channel ANO1/TMEM16A expression suppresses tumor growth and invasiveness in human prostate carcinoma[J]. Cancer Lett, 2012, 326: 41–51. DOI:10.1016/j.canlet.2012.07.015 |
| [22] | De La Fuente R, Namkung W, Mills A, et al. Small-molecule screen identifies inhibitors of a human intestinal calcium-activated chloride channel[J]. Mol Pharmacol, 2008, 73: 758–768. |
| [23] | Namkung W, Phuan PW, Verkman AS. TMEM16A inhibitors reveal TMEM16A as a minor component of calcium-activated chloride channel conductance in airway and intestinal epithelial cells[J]. J Biol Chem, 2011, 286: 2365–2374. DOI:10.1074/jbc.M110.175109 |
| [24] | Oh SJ, Hwang SJ, Jung J, et al. MONNA, a potent and selective blocker for transmembrane protein with unknown function 16/anoctamin-1[J]. Mol Pharmacol, 2013, 84: 726–735. DOI:10.1124/mol.113.087502 |
| [25] | Seo Y, Lee HK, Park J, et al. Ani9, A novel potent small-molecule ANO1 inhibitor with negligible effect on ANO2[J]. PLoS One, 2016, 11: e0155771. DOI:10.1371/journal.pone.0155771 |
| [26] | Namkung W, Thiagarajah JR, Phuan PW, et al. Inhibition of Ca2+-activated Cl- channels by gallotannins as a possible molecular basis for health benefits of red wine and green tea[J]. FASEB J, 2010, 24: 4178–4186. DOI:10.1096/fj.10-160648 |
| [27] | Liu SB, Feng J, Luo JL, et al. Eact, a small molecule activator of TMEM16A, activates TRPV1 and elicits pain-and itch-related behaviours[J]. Br J Pharmacol, 2016, 173: 1208–1218. DOI:10.1111/bph.v173.7 |
| [28] | Oh SJ, Park JH, Han S, et al. Development of selective blockers for Ca2+-activated Cl- channel using Xenopus laevis oocytes with an improved drug screening strategy[J]. Mol Brain, 2008, 1: 14. DOI:10.1186/1756-6606-1-14 |
| [29] | White MM, Aylwin M. Niflumic and flufenamic acids are potent reversible blockers of Ca2+-activated Cl- channels in Xenopus oocytes[J]. Mol Pharmacol, 1990, 37: 720–724. |
| [30] | Qu Z, Hartzell HC. Functional geometry of the permeation pathway of Ca2+-activated Cl- channels inferred from analysis of voltage-dependent block[J]. J Biol Chem, 2001, 276: 18423–18429. DOI:10.1074/jbc.M101264200 |
| [31] | Piper AS, Greenwood IA, Large WA. Dual effect of blocking agents on Ca2+-activated Cl- currents in rabbit pulmonary artery smooth muscle cells[J]. J Physiol, 2002, 539: 119–131. DOI:10.1113/jphysiol.2001.013270 |
| [32] | Xu WX, Kim SJ, So I, et al. Volume-sensitive chloride current activated by hyposmotic swelling in antral gastric myocytes of the guinea-pig[J]. Pflugers Arch, 1997, 435: 9–19. DOI:10.1007/s004240050478 |
| [33] | Wang HS, Dixon JE, McKinnon D. Unexpected and differential effects of Cl- channel blockers on the Kv4.2 K+ channels. Implications for the study of the Ⅰ(to2) current[J]. Circ Res, 1997, 81: 711–718. DOI:10.1161/01.RES.81.5.711 |
| [34] | Doughty JM, Miller AL, Langton PD. Non-specificity of chloride channel blockers in rat cerebral arteries: block of the L-type calcium channel[J]. J Physiol, 1998, 507: 433–439. DOI:10.1111/tjp.1998.507.issue-2 |
| [35] | Reinsprecht M, Rohn MH, Spadinger RJ, et al. Blockade of capacitive Ca2+ influx by Cl- channel blockers inhibits secretion from rat mucosal-type mast cells[J]. Mol Pharmacol, 1995, 47: 1014–1020. |
| [36] | Bill A, Hall ML, Borawski J, et al. Small molecule-facilitated degradation of ANO1 protein[J]. J Biol Chem, 2014, 289: 11029–11041. DOI:10.1074/jbc.M114.549188 |
| [37] | Cho H, Yang YD, Lee J, et al. The calcium-activated chloride channel anoctamin 1 acts as a heat sensor in nociceptive neurons[J]. Nat Neurosci, 2012, 15: 1015–1021. DOI:10.1038/nn.3111 |
| [38] | Mazzone A, Eisenman ST, Strege PR, et al. Inhibition of cell proliferation by a selective inhibitor of the Ca2+-activated Cl- channel, Ano1[J]. Biochem Biophys Res Commun, 2012, 427: 248–253. DOI:10.1016/j.bbrc.2012.09.022 |
| [39] | Shiwarski DJ, Shao C, Bill A, et al. To " grow" or " go" : TMEM16A expression as a switch between tumor growth and metastasis in SCCHN[J]. Clin Cancer Res, 2014, 20: 4673–4688. DOI:10.1158/1078-0432.CCR-14-0363 |
| [40] | Bill A, Gutierrez A, Kulkarni S, et al. ANO1/TMEM16A interacts with EGFR and correlates with sensitivity to EGFR-targeting therapy in head and neck cancer[J]. Oncotarget, 2015, 6: 9173–9188. DOI:10.18632/oncotarget.v6i11 |
| [41] | Matsuba S, Niwa S, Muraki K, et al. Downregulation of Ca2+-activated Cl- channel TMEM16A by the inhibition of histone deacetylase in TMEM16A-expressing cancer cells[J]. J Pharmacol Exp Ther, 2014, 351: 510–518. DOI:10.1124/jpet.114.217315 |
| [42] | Britschgi A, Bill A, Brinkhaus H, et al. Calcium-activated chloride channel ANO1 promotes breast cancer progression by activating EGFR and CAMK signaling[J]. Proc Natl Acad Sci U S A, 2013, 110: E1026–E1034. DOI:10.1073/pnas.1217072110 |
| [43] | Seo Y, Park J, Kim M, et al. Inhibition of ANO1/TMEM16A chloride channel by idebenone and its cytotoxicity to cancer cell lines[J]. PLoS One, 2015, 10: e0133656. DOI:10.1371/journal.pone.0133656 |
| [44] | Ousingsawat J, Mirza M, Tian Y, et al. Rotavirus toxin NSP4 induces diarrhea by activation of TMEM16A and inhibition of Na+ absorption[J]. Pflugers Arch, 2011, 461: 579–589. DOI:10.1007/s00424-011-0947-0 |
| [45] | Huang F, Zhang H, Wu M, et al. Calcium-activated chloride channel TMEM16A modulates mucin secretion and airway smooth muscle contraction[J]. Proc Natl Acad Sci U S A, 2012, 109: 16354–16359. DOI:10.1073/pnas.1214596109 |
| [46] | Wang B, Li C, Huai R, et al. Overexpression of ANO1/ TMEM16A, an arterial Ca2+-activated Cl- channel, contributes to spontaneous hypertension[J]. J Mol Cell Cardiol, 2015, 82: 22–32. DOI:10.1016/j.yjmcc.2015.02.020 |
| [47] | Forrest AS, Joyce TC, Huebner ML, et al. Increased TMEM16A-encoded calcium-activated chloride channel activity is associ ated with pulmonary hypertension[J]. Am J Physiol Cell Physiol, 2012, 303: C1229–C1243. DOI:10.1152/ajpcell.00044.2012 |
| [48] | Takayama Y, Uta D, Furue H, et al. Pain-enhancing mecha nism through interaction between TRPV1 and anoctamin 1 in sensory neurons[J]. Proc Natl Acad Sci U S A, 2015, 112: 5213–5218. DOI:10.1073/pnas.1421507112 |
| [49] | Liu B, Linley JE, Du X, et al. The acute nociceptive signals induced by bradykinin in rat sensory neurons are mediated by inhibition of M-type K+ channels and activation of Ca2+-activated Cl- channels[J]. J Clin Invest, 2010, 120: 1240–1252. DOI:10.1172/JCI41084 |
| [50] | Iqbal J, Tonta MA, Mitsui R, et al. Potassium and ANO1/ TMEM16A chloride channel profiles distinguish atypical and typical smooth muscle cells from interstitial cells in the mouse renal pelvis[J]. Br J Pharmacol, 2012, 165: 2389–2408. DOI:10.1111/j.1476-5381.2011.01730.x |
| [51] | Cho H, Oh U. Anoctamin 1 mediates thermal pain as a heat sensor[J]. Curr Neuropharmacol, 2013, 11: 641–651. DOI:10.2174/1570159X113119990038 |
| [52] | Jin X, Shah S, Liu YN, et al. Activation of the Cl- channel ANO1 by localized calcium signals in nociceptive sensory neurons requires coupling with the IP3 receptor[J]. Sci Sig naling, 2013, 6: 290. DOI:10.1126/scisignal.2004944 |
| [53] | Deba F, Bessac BF. Anoctamin-1 Cl- channels in nociception: activation by an N-aroylaminothiazole and capsaicin and inhibition by T16A[J]. Mol Pain, 2015, 11: 55. |
| [54] | Pineda-Farias JB, Barragan-Iglesias P, Loeza-Alcocer E, et al. Role of anoctamin-1 and bestrophin-1 in spinal nerve ligation-induced neuropathic pain in rats[J]. Mol Pain, 2015, 11: 1–14. |
| [55] | Hwang SJ, Basma N, Sanders KM, et al. Effects of new-generation inhibitors of the calcium-activated chloride channel anoctamin 1 on slow waves in the gastrointestinal tract[J]. Br J Pharmacol, 2016, 173: 1339–1349. DOI:10.1111/bph.v173.8 |
| [56] | Ta CM, Adomaviciene A, Rorsman NJG, et al. Mechanism of allosteric activation of TMEM16A/ANO1 channels by a commonly used chloride channel blocker[J]. Br J Pharmacol, 2016, 173: 511–528. DOI:10.1111/bph.13381 |
 2017, Vol. 52
2017, Vol. 52


