2. 长沙方圆咨询有限公司, 湖南 长沙 410000;
3. 韩国高丽大学生物医药工程系, 首尔 136701;
4. 澳大利亚悉尼科技大学工程学院, 悉尼 2007
2. Changsha Fangyuan Consultation Ltd., Changsha 410000, China;
3. Department of Biomedical Engineering, Korea University, Seoul 136701, South Korea;
4. College of Engineering, University of Technology Sydney, Sydney 2007, Australia
药物递释系统是运用可食用载体将药物运载到目标位置的给药方式, 对提高药物的功效、降低药物对人体的损伤有较好的作用, 而对于药物载体的设计直接影响了药物递释系统的功能[1]。近年来, 通过联合应用材料科学与生物技术, 多种新型的载体被发明并应用到临床药学中[2]。如乳糖、甘露醇、果糖、葡萄糖和海藻糖等糖类物质, 被广泛用作可溶性药用载体, 以运载非水溶性的药物分子, 同时采用化工技术将药物分子均匀分布在载体材料中, 达到提高药物的整体水溶性、吸收效率和临床疗效[3]; 而合成的生物可降解的多糖颗粒, 通过纳米限制技术, 能对药物分子起到可控释放效果[4]; 通过在不同溶剂中的胶束作用和分子作用力制备两亲物胶束微粒, 可将药物分子包裹在胶束内部, 也能起到药物运载递释效果[5]。除上述有机材料外, 金属有机框架材料[6]和二氧化硅纳米颗粒[7]等材料也被用作药物载体广泛运用在研究领域。
在众多需要运用药物载体的应用中, 干粉吸入剂是肺部用药的常用给药形式, 由药物分子和载体颗粒组成, 其中药物分子作用于肺部, 载体材料用于承载药物分子达到传输药物的作用。而用作干粉吸入剂的载体有严格的尺寸要求, 必须是可被呼吸道、肺部细胞吸收或对其无影响的材料, 如乳糖(美国药食品监督局推荐载体[8])、甘露醇等。且考虑到肺部气管通道的尺寸, 直接药物或载体材料的形态以1~5 μm大小的颗粒为宜[9]。常用的以乳糖为材料的干粉吸入剂是将药物分子吸附在球形或研磨(无形态)的乳糖颗粒上, 通过分子吸附作用将药物分子固定。而随着纳米技术的不断发展, 花形材料以其优秀的美学外貌和材料性能(比表面积大), 受到越来越多的报道和关注, Ge等[10]报道的花形蛋白质制备技术、Liu等[11]及Yang等[12]报道的花形胶束微粒制备技术, 均将载体材料制备成花形外貌, 用于构建药物递释系统。故将作为干粉吸入剂的糖类微粒载体也制作成花形材料, 运用到实际药物递释系统中, 可能是药物载体纳米制备技术上的一个突破。
本研究制备了含纳米孔结构的药用花形载体乳糖微粒, 作为一种新型的干粉吸入剂载体, 并探索了其对噻托溴铵的吸附和脱附能力。噻托溴铵是慢性阻塞性肺疾病的吸入型长效抗胆碱药物, 通过选择性作用于M1和M3受体起到扩张支气管的作用[13], 其能溶于醇类有机溶液, 但在水中的溶解度不好, 故在本实验中选用噻托溴铵作为新型干粉吸入剂的运载药物, 以提高其水溶性和人体利用效果。
材料与方法试剂与仪器 一水乳糖(C12H22O11·H2O)、硼酸(H3BO3)、噻托溴铵(C19H22BrNO4S2)和乙醇(C2H5OH)购自澳大利亚Chem-Supply公司, 为分析纯(AR)。花形乳糖(C12H22O11)由太仓澳新生物医药科技有限公司加工生产, 为分析纯(AR)。Quantachrome Autosorb-1气体吸附仪(美国Quantachrome Instru ments公司); Raman inVia Reflex共聚焦拉曼扫描显微镜(英国Renishaw公司); Zeiss Auriga共聚焦离子切割-扫描电子显微镜(德国Zeiss公司); Nicolet 6700红外光谱仪, Sorvall ST 8R离心分离机(澳大利亚Thermo Fisher Scientific公司); Büchi-290喷雾干燥器(瑞士Büchi公司)。
花形载体乳糖微粒的制备 称取水100 g, 加入一水乳糖10 g和硼酸1 g, 溶解得到样品混合物。将得到的混合物用Büchi-290喷雾干燥器进行喷雾干燥, 再用乙醇洗涤30 min, 在600 r·min-1下离心1 min后去除上清液, 在50 ℃下进行恒温干燥至质量恒定, 即得花形载体乳糖微粒[14,15]。
花形载体乳糖微粒运载噻托溴铵的制备 ① 溶液吸附法:将0.1 mol·L-1噻托溴铵乙醇溶液20 mL与上述制得的花形载体乳糖微粒1 g混合, 静置吸附1 h; ② 结晶吸附法:将1 mol·L-1噻托溴铵乙醇溶液0.2 mL逐滴加到1 g花形载体乳糖微粒上, 边滴加边用干燥气体风干, 直到所有的噻托溴铵乙醇溶液都滴加到并完全风干在花形载体乳糖微粒上。
花形载体乳糖微粒的表征
气体吸附仪 采用低温(液氮保护)氮气吸附, 样品质量为1.5 g, 表征前脱气处理为80 ℃下保持12 h, 表征取点数为吸附、脱附各20个点, 微孔分析采用Horvath-Kawazoe (HK)模型, 介孔分析采用Barrett-Joyner-Halenda (BJH)模型。
共聚焦拉曼扫描显微镜 通过共聚焦拉曼扫描显微镜获取噻托溴铵成分在颗粒中的分布图, x轴、y轴的扫描间隔尺寸为0.1 μm, z轴手动聚焦调节至待测颗粒的中间面上。
共聚焦离子切割-扫描电子显微镜 采用共聚焦离子切割组件在30 kV电压、1 nA电流下进行粗切割, 之后在30 kV电压、100 pA电流下进行精细切割, 扫描电子显微镜在15 kV电压、1 Pa气压下进行扫描。
红外光谱仪 采用红外光谱仪通过对样品粉末(乳糖、硼酸、喷雾干燥微粒和药用花形载体乳糖微粒)在800~2 000 nm-1波长下进行32次扫描, 得出光谱图。
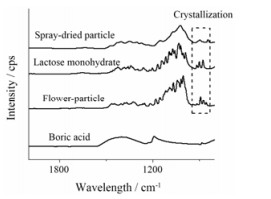
结果 1 电镜扫描及红外光谱表征通过喷雾干燥制备的颗粒, 在电镜扫描图下显示为球形微粒(图 1a), 乳糖和硼酸均匀地分布在微粒中。采用乙醇除去硼酸(作为模板物质)后, 通过电镜扫描图(图 1b)显示, 合成的乳糖微粒呈花形外貌。在红外光谱图上(图 2), 喷雾干燥微粒的光谱峰平缓, 而花形乳糖和一水乳糖的光谱图相似, 在1 100 cm-1附近有明显结晶峰。

|
Figure 1 Scanning electron microscope (SEM) images of spraydried particles (a) and the engineered particles (b) |
|
Figure 2 Fourier transform infrared spectroscopy of spray-dried particles, lactose monohydrate, flower-particles and boric acid (from upper to bottom) |
为测量花形载体乳糖微粒的孔隙率, 采用气体吸附仪对氮气进行吸附表征, 并运用HK模型生成了微孔(直径小于2 nm)分布图, 运用BJH模型生成了介孔(直径2~50 nm)分布图。如图 3a所示, 氮气的延缓脱附主要发生在0.5~1.0气压比(P/P0)下。Brunauer-Emmett-Teller (BET)计算该花形载体乳糖微粒的孔表面积为40 m2·L-1, 且进一步HK模型显示微孔尺寸主要为1.7 nm (图 3b), BJH模型显示介孔尺寸主要为3.8、6.5和29.9 nm (图 3c)。

|
Figure 3 Nitrogen adsorption isotherms (a) with the HorvathKawazoe model (b) and Barrett-Joyner-Halenda model (c) |
聚焦离子切割后的花形载体乳糖微粒可通过扫描直接观察微粒内部结构, 如图 4所示。所述花形载体乳糖微粒内部的孔结构分布较为均匀, 大孔(直径大于50 nm)和部分介孔可以直接看到。

|
Figure 4 SEM images of ion-beam cut particles |
花形载体乳糖微粒在采用溶液吸附法结合噻托溴铵分子后, 形貌未发生较大改变(图 5a), 测得的药物吸附量为5% (w/w固体质量比)。相比之下, 采用结晶吸附法结合噻托溴铵分子后的花形载体乳糖微粒, 其表面形貌发生较大变化, 微粒表面的花形外貌被沉淀的噻托溴铵分子结晶体所取代(图 5b), 且测得药物吸附量为49% (w/w固体质量比)。通过共聚焦拉曼扫描仪对噻托溴铵分子的分布测量显示, 采用溶液吸附法(图 5c)结合的噻托溴铵分子集中分布在花形微粒的内部, 随花形微粒的几何结构的密度变化, 而采用结晶吸附法(图 5d)结合的噻托溴铵分子集中分布在花形微粒的外部, 虽然不少噻托溴铵分子在吸附过程中随着毛细吸附作用进入微粒内部, 但较多的噻托溴铵分子仍结晶在微粒表面。

|
Figure 5 Scanning electron microscope images of the drug-loaded particles using solution-based method (a) and evaporation-based method (b). The confocal Raman microscope images showing the drug distribution in the drug-loaded particles using solution-based method (c) and evaporation-based method (d) |
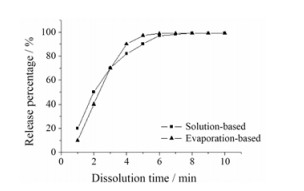
采用溶液吸附结合的噻托溴铵分子在前3 min的药物释放速率较快, 但随后药物释放速率逐渐减慢, 在7 min时达到99%以上(微粒和药物基本上全部溶解在水中), 而采用结晶吸附结合的噻托溴铵分子在3 min后的药物释放速率较快, 在5 min时即达到99%以上。结果见图 6。
|
Figure 6 The drug release rate over the dissolution time for solution-based method and evaporation-based method |
喷雾干燥微粒在红外光谱上不显示结晶峰, 说明其呈非结晶型[16]; 而制得的乳糖微粒呈花形外貌, 且在红外扫描图上重新出现结晶峰, 这意味着乳糖从非结晶型态重新转变成结晶态。如同其他花形材料[10-12], 本研究合成的花形载体乳糖微粒也具有比表面积大带来的一系列优点, 包括高孔隙率、高载药量和高药物释放效率。
氮气的延缓脱附主要发生在0.5~1.0 P/P0条件下, 代表部分微-介孔的存在[17]。由于所述花形载体乳糖微粒具有微-介孔的纳米多孔结构, 其对药物的吸附固定作用非常有利。同时, 在聚焦离子切割后的花形载体乳糖微粒的电镜扫描图中, 大孔和部分介孔可以直接看到, 故此新型药物载体具有孔结构均匀的微-介-大孔花形结构。因此, 合成的药用花形载体乳糖微粒具有较好的纳米孔分子结合能力和大孔通道分子运输能力[18,19], 同时药用花形载体乳糖微粒的尺寸在1~5 μm, 满足肺部给药尺寸要求[9], 故将吸附噻托溴铵分子的花形乳糖微粒作为新型的干粉吸入剂。
在药物吸附测试中, 花形载体乳糖微粒采用溶液吸附法结合噻托溴铵分子后形貌未发生较大改变, 这是由于花形载体乳糖微粒在溶液中主要通过微、介孔吸附作用来结合药物分子。而相比之下, 采用结晶吸附法结合噻托溴铵分子后的花形载体乳糖微粒表面形貌发生较大变化, 微粒表面的花形外貌被沉淀的噻托溴铵分子结晶体所取代, 这是由于在吸附过程中除发生了微、介孔的毛细吸附作用, 还在风干溶剂时, 噻托溴铵分子结晶在花形微粒的表面, 且药物结合量较大(根据滴加药物的量控制)。
药物释放速率是药物递释系统的另一个主要参数[20,21], 由于花形载体乳糖微粒在溶液吸附或结晶吸附噻托溴铵分子后在水中药物释放速率主要受材料特性的两个因素控制: ① 花形载体乳糖微粒载药后的几何结构(形貌); ② 被吸附的噻托溴铵分子在乳糖微粒中的分布位置。测量的结果表明, 由于不同的吸附方法造成药物在花形微粒中的分布位置不同, 在载体的几何形貌影响下, 载体的药物释放速率也不同。
Ge等[10]制备的花形蛋白质、Liu等[11]及Yang等[12]制备的花形胶束微粒, 均凸显了花形外貌给结构带来的理化稳定性和药物递释能力的增强。本研究制备了一种新型的干粉喷雾剂载体, 并用于噻托溴铵的吸附和脱附应用, 合成的花形载体乳糖微粒呈结晶态, 含微-介-孔均匀分布的孔结构, 且具有高孔隙率、高载药量和高药物释放效率的优点。同时, 含纳米孔结构的药用花形载体乳糖微粒受喷雾干燥造粒控制, 由于喷雾干燥技术能较简单地调控造粒尺寸、主材料、模板物质和溶剂等实验参数[22], 因此该技术能运用到多种多孔花形载体的生产中, 如蔗糖、葡萄糖、甘露醇、海藻糖、山梨糖醇、赤藻糖醇和蜜三糖(棉子糖)等, 可制备成花形糖类微粒载体, 也许成为未来化学精工在医药载体领域的发展方向。
| [1] | Gao H, Jiang X. The progress of novel drug delivery systems[J]. Acta Pharm Sin (药学学报), 2017, 52: 181–188. |
| [2] | Such GK, Yan Y, Johnston APR, et al. Interfacing materials science and biology for drug carrier design[J]. Adv Mater, 2015, 27: 2278–2297. DOI:10.1002/adma.v27.14 |
| [3] | Madgulkar A, Bandivadekar M, Shid T, et al. Sugars as solid dispersion carrier to improve solubility and dissolution of the BCS class Ⅱ drug:clotrimazole[J]. Drug Dev Ind Pharm, 2016, 42: 28–38. DOI:10.3109/03639045.2015.1024683 |
| [4] | Pushpamalar J, Veeramachineni AK, Owh C, et al. Biodegradable polysaccharides for controlled drug delivery[J]. Chempluschem, 2016, 81: 504–514. DOI:10.1002/cplu.201600112 |
| [5] | Rosler A, Vandermeulen GWM, Klok HA. Advanced drug delivery devices via self-assembly of amphiphilic block copolymers[J]. Adv Drug Deliv Rev, 2012, 64: 270–279. DOI:10.1016/j.addr.2012.09.026 |
| [6] | Horcajada P, Chalati T, Serre C, et al. Porous metal-organicframework nanoscale carriers as a potential platform for drug delivery and imaging[J]. Nat Mater, 2010, 9: 172–178. DOI:10.1038/nmat2608 |
| [7] | Ge K, Ren HH, Sun WT, et al. Walnut kernel-like mesoporous silica nanoparticles as effective drug carrier for cancer therapy in vitro[J]. J Nanoparticle Res, 2016, 18: 81. DOI:10.1007/s11051-016-3380-7 |
| [8] | Wu L, Miao X, Shan Z, el al. Studies on the spray dried lactose as carrier for dry powder inhalation[J]. Asian J Pharm Sci, 2014, 9: 336–341. DOI:10.1016/j.ajps.2014.07.006 |
| [9] | Cao W, Chen Y, Zhang ZH. Application of lactose in dry powder inhaler[J]. Chin J Mod Appl Pharm (中国现代应用药学), 2012, 29: 591–596. |
| [10] | Ge J, Lei J, Zare RN. Protein-inorganic hybrid nanoflowers[J]. Nat Nanotechnol, 2012, 7: 428–432. DOI:10.1038/nnano.2012.80 |
| [11] | Liu B, Chen H, Li X, et al. pH-responsive flower-like micelles constructed via oxime linkage for anticancer drug delivery[J]. RSC Adv, 2014, 4: 48943–48951. DOI:10.1039/C4RA08719D |
| [12] | Yang Q, He C, Zhang Z, et al. Redox-responsive flower-like micelles of poly(L-lactic acid)-b-poly(ethylene glycol)-b-poly (L-lactic acid) for intracellular drug delivery[J]. Polymer, 2016, 90: 351–362. DOI:10.1016/j.polymer.2016.03.030 |
| [13] | Fan Z, Gao H, Zhang B, et al. Evaluation of efficacy and safety of once-daily inhaled tiotropium in chronic obstructive pulmonary disease[J]. J Clin Pulm Med, 2011, 16: 1157–1160. |
| [14] | Tan S, Chen X. Saccharide micro-particle carrier, preparation method, use method, and application:CN 201610720875[P]. 2016-08-02. |
| [15] | Tan S, Chen X, Zhai S. System's device of preparation porous material:CN 201621104530[P]. 2016-10-09. |
| [16] | Ebrahimi A, Saffari M, Langrish T. Developing a new production process for high-porosity lactose particles with high degrees of crystallinity[J]. Powder Technol, 2015, 272: 45–53. DOI:10.1016/j.powtec.2014.11.033 |
| [17] | Shen J, Liu A, Tu Y, et al. How carboxylic groups improve the performance of single-walled carbon nanotube electrochemical capacitors?[J]. Energy Environment Sci, 2011, 4: 4220–4229. DOI:10.1039/c1ee01479j |
| [18] | Zhan G, Zeng HC. An alternative synthetic approach for macro-meso-microporous metal-organic frameworks via a "domain growth" mechanism[J]. Chem Commun, 2016, 52: 8432–8435. DOI:10.1039/C6CC03555H |
| [19] | Vantomme A, Leonard A, Yuan ZY, et al. Self-formation of hierarchical micro-meso-macroporous structures:generation of the new concept "Hierarchical Catalysis"[J]. Colloid Surface A, 2007, 300: 70–78. DOI:10.1016/j.colsurfa.2007.01.010 |
| [20] | Tang ZK, Xiong XQ, Cai L, et al. Recent progress in the study of reduction-sensitive drug carriers[J]. Acta Pharm Sin (药学学报), 2011, 46: 1032–1038. |
| [21] | Wang QF, Li SM, Zhang YY, et al. Modulating drug loading and release profile of β-cyclodextrin polymers by means of cross-linked degree[J]. Acta Pharm Sin (药学学报), 2011, 46: 221–226. |
| [22] | Patel BB, Patel JK, Chakraborty S. Review of patents and application of spray drying in pharmaceutical, food and flavor industry[J]. Recent Pat Drug Deliv Formu, 2014, 8: 63–78. DOI:10.2174/1872211308666140211122012 |
 2017, Vol. 52
2017, Vol. 52


