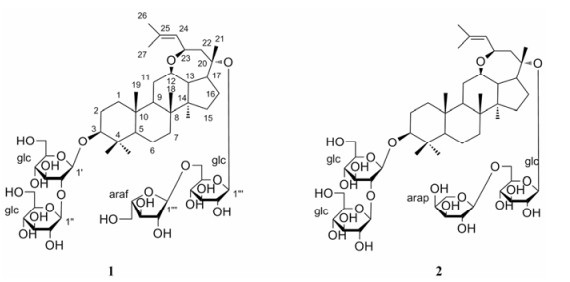
三七[Panax notoginseng (Burk.) F.H.Chen]为五加科(Araliaceae)人参属多年生草本植物, 其根部经炮制后即为我国传统名贵中药“三七”, 具有散瘀止血、消肿定痛的功效, 药用历史悠久。近现代研究表明, 三七中的主要生物活性成分为达玛烷型三萜皂苷, 三七总皂苷在多种体内实验中显示出保护心肌细胞[1]、降血脂[2]、抗抑郁[3]等生物活性。由于三七植物的传统用药部位是根茎, 为了更好地开发我国珍贵中药材资源, 进一步寻找活性成分, 本课题组对采自云南省文山州的三七茎叶进行了化学成分研究, 从中分离得到5个化合物, 并鉴定为3-O-β-D-glucopyranosyl-(1→2)-β-D-glucopyranosyl-12β, 23(R)-epoxydammara-24-ene-3β, 6α, 20(S)-triol 20-O-α-L-arabinofuranosyl-(1→6)-β-D-glucopyranoside (1)、3-O-β-D-glucopyranosyl-(1→2)-β-D-glucopyranosyl-12β, 23(R)-epoxydammara-24-ene-3β, 6α, 20(S)-triol 20-O-α-L-arabinopyranosyl-(1→6)-β-D-glucopyranoside (2)、notoginsenoside FP2 (3)、gypenoside Ⅸ (4)和ginsenoside Rg1 (5)。其中化合物1、2为新化合物, 结构见图 1。
|
Figure 1 Structures of compounds 1 and 2 |
化合物1 白色无定形粉末。HR-ESI-MS m/z: 1 075.571 3 [M-H]- (计算值: 1 075.569 4), 确定分子式为C53H88O22, 不饱和度为10。红外光谱显示其结构中存在羟基(3 375 cm-1)、双键(1 648 cm-1)、醚键(1 080 cm-1)等特征信号峰。
1H NMR (600 MHz, C5D5N)的高场区显示8个角甲基信号δH 0.93 (3H, s, H-18)、0.82 (3H, s, H-19)、1.48 (3H, s, H-21)、1.66 (3H, s, H-26)、1.83 (3H, s, H-27)、1.28 (3H, s, H-28)、1.11 (3H, s, H-29) 和1.15 (3H, s, H-30), 低场区显示4个糖端基氢信号δH 4.95 (1H, d, J = 7.7 Hz, H-1')、5.39 (1H, d, J = 7.7 Hz, H-1'')、5.13 (1H, d, J = 7.7 Hz, H-1''')、5.70 (1H, br s, H-1''''), 提示其为含有4个糖的三萜皂苷; 1H NMR显示1个烯氢信号δH 5.53 (1H, d, J = 7.6 Hz, H-24), 提示其结构含有一个双键。结合化合物1的10个不饱和度, 说明苷元结构含有5个环。
结合HSQC谱图, 完成对碳氢信号的归属(表 1), 可以得知13C NMR (150 MHz, C5D5N)显示的53个碳信号中, 其中30个是苷元碳信号, 包括8个甲基信号δC 15.5 (C-18)、16.5 (C-19)、24.9 (C-21)、25.7 (C-26)、19.0 (C-27)、28.1 (C-28)、16.6 (C-29)、17.1 (C-30), 4个连氧碳δC 88.8 (C-3)、79.8 (C-12)、82.0 (C-20)、72.8 (C-23), 1对双键碳δC 129.2 (C-24)、131.2 (C-25)。通过与文献[4]对比, C-1~20与原人参二醇型的核磁谱数据类似, 可推断苷元是达玛烷型三萜, 但17位上的侧链不同。HMBC谱图显示, H-23和C-12有远程相关, 由于这两个碳都是连氧碳, 可推断它们之间有醚键相连, 形成一个含氧七元环, 符合不饱和度给出的线索。NOESY谱图显示H-23与H-12有相关, 确定H-23与H-12顺式。通过与文献[5, 6]数据对比, 化合物1的苷元与人参皂苷La、人参皂苷Rh18相同, 为12β, 23(R)-epoxydammara-24-ene-3β, 6α, 20(S)-triol。
| Table 1 1H NMR (600 MHz) and 13C NMR (150 MHz) data in pyridine-d5 for compounds 1 and 2. *Overlapped |
通过1H-1H COSY和TOCSY谱图分析, 完成对4个糖的核磁信号的准确归属(表 1), 表明结构中含有3个六碳糖和1个五碳糖。化合物1用盐酸水解, 得到糖部分, 制备三甲基硅烷化衍生物, 进行气相色谱检测, 与D-葡萄糖、L-阿拉伯糖的三甲基硅烷化衍生物的气相色谱保留时间一致, 确定糖为D-葡萄糖、L-阿拉伯糖。H-1'、H-1''和H-1'''的氢谱偶合常数提示它们为β构型, H-1''''是宽单峰, 说明为α构型。
HMBC谱显示H-1'和C-3、H-1''和C-2'、H-1'''和C-20、H-1''''和C-6'''之间有远程相关, 说明C-1'连在苷元的3位上, C-1''连在Glc'的2位上, C-1'''连在苷元的20位上, C-1''''连在Glc'''的6位上。通过以上分析最终可确定化合物1的结构是3-O-β-D-glucopyranosyl-(1→2)-β-D-glucopyranosyl-12β, 23(R)-epoxydammara-24-ene-3β, 6α, 20(S)-triol 20-O-α-L-arabinofuranosyl-(1→6)-β-D-glucopyranoside (图 1), 命名为notoginsenoside Fh8。
化合物2 白色无定形粉末。HR-ESI-MS m/z: 1 075.571 6 [M-H]- (计算值: 1 075.569 4), 确定分子式为C53H88O22, 不饱和度为10。红外光谱显示其结构中存在羟基(3 392 cm-1)、双键(1 647 cm-1)、醚键(1 081 cm-1)等特征信号峰。13C NMR (150 MHz, C5D5N)显示53个碳信号, 由HSQC谱图, 完成对碳氢信号的归属(表 1), 结合核磁数据和高分辨质谱可推断, 化合物2的苷元和化合物1的苷元相同, 且同样含有4个糖, 其中3个葡萄糖的核磁数据非常相似, 仅连接在C-6'上的五碳糖不同。通过与文献[7]数据的对比, C-20上的糖链与Floraginsenoside Tc的C-20糖链相同, 可确定末端的五碳糖是α-L-阿拉伯吡喃糖。由以上的分析最终可确定化合物2的结构是3-O-β-D-glucopyranosyl-(1→2)-β-D-glucopyranosyl-12β, 23(R)-epoxydammara-24-ene-3β, 6α, 20(S)-triol 20-O-α- L-arabinopyranosyl-(1→6)-β-D-glucopyranoside (图 1), 命名为notoginsenoside Fh9。
实验部分紫外可见分光光度仪(JASCO V-650型); 旋光测定仪(JASCO P-2000型, 日本); 红外光谱仪(Nicolet impact 5700型傅里叶变换红外光谱仪); 核磁共振仪(VNS-600核磁共振仪, 以TMS信号作为参照); 质谱仪(Agilent 1100 series LC/MSD型); 高效液相色谱仪(Agilent 1100型高效液相色谱仪; Shimadzu LC-6AD高效液相色谱仪); 中压液相色谱仪(Büchi Gradient Former B-687, Rp C18); 制备/半制备色谱柱(YMC-pack, ODS-A, 250 mm × 20 mm, 250 mm × 10 mm); 100~200目硅胶(青岛海洋化工厂); 薄层硅胶板GF254 (青岛海洋化工厂); 分析纯试剂(北京化工厂); 色谱纯试剂(Dikma为美国Tedia公司生产; Fisher为美国Fisher公司生产)。
药材于2015年5月采自云南省文山州。经中国医学科学院药物研究所马林研究员鉴定为五加科(Araliaceae)人参属植物三七Panax notoginseng (Burk) F.H.Chen的地上部分。
1 提取分离干燥的三七叶25 kg, 粉碎后用95%乙醇(100 L)回流提取2次, 每次2 h; 乙醇提取后的茎叶再用水(100 L)提取2次, 每次2 h。得到的水溶液通过HPD100大孔树脂色谱分离, 依次用水、25%乙醇、50%乙醇、95%乙醇洗脱, 弃去水部分, 另外三个部分减压浓缩, 得25%乙醇部分(298.5 g)、50%乙醇部分(365.4 g)和95%乙醇部分(93.4 g)。50%乙醇部分(365.4 g)用硅藻土柱色谱分离, 依次用乙酸乙酯、丙酮、乙醇-丙酮(1:1)、70%乙醇、50%乙醇洗脱, 得到5个部分:乙酸乙酯部分(Fr1, 3 g)、丙酮部分(Fr2, 2 g)、乙醇-丙酮(1:1) 部分(Fr3, 146.7g)、70%乙醇部分(Fr4, 130.6 g)、50%乙醇部分(Fr5, 9.1 g)。Fr3经硅胶柱色谱分离, 氯仿-甲醇-水(6:4:0.5, 28 L)等度洗脱, 1 L为一份, 得到27个组分(Fr3.1~Fr3.27)。经薄层色谱法检测分析, 合并Fr3.6~Fr3.8 (命名为FrA, 12.73 g), FrA用中压液相色谱(ODS柱)分离, 以甲醇-水(40:60→75:25) 梯度洗脱, 分为23个部分(FrA.1~FrA.23)。FrA.15通过制备液相色谱(ODS柱)分离, 以甲醇-水(22:78) 溶液制备, 得化合物1 (15 mg, tR = 13.6 min)、2 (10 mg, tR = 15.1 min)、3 (15 mg, tR = 23.2 min)、5 (25 mg, tR = 12.6 min); 以甲醇-水(30:70) 为流动相制备, 得化合物4 (25 mg, tR = 22.7 min)。
2 结构鉴定化合物1 白色无定形粉末(MeOH)。
化合物2 白色无定形粉末(MeOH)。
化合物3 白色粉末。ESI-MS m/z: 1 209 [M-H]-, 推测其分子量为1 210, 分子式C58H98O26, 不饱和度为10。13C NMR (150 MHz, C5D5N) δ: 38.9 (C-1), 26.3 (C-2), 88.6 (C-3), 39.4 (C-4), 56.1 (C-5), 18.1 (C-6), 34.8 (C-7), 39.7 (C-8), 49.9 (C-9), 36.6 (C-10), 30.5 (C-11), 70.4 (C-12), 49.1 (C-13), 51.1 (C-14), 30.4 (C-15), 26.5 (C-16), 51.3 (C-17), 15.7 (C-18), 16.0 (C-19), 83.1 (C-20), 22.1 (C-21), 35.9 (C-22), 22.9 (C-23), 125.7 (C-24), 130.7 (C-25), 25.5 (C-26), 17.6 (C-27), 27.8 (C-28), 16.4 (C-29), 17.1 (C-30), 104.5 (C-1'), 82.8 (C-2'), 77.5 (C-3'), 70.9 (C-4'), 78.0 (C-5'), 62.3 (C-6'), 102.9 (C-1''), 84.2 (C-2''), 77.7 (C-3''), 71.5 (C-4''), 79.0 (C-5''), 62.7 (C-6''), 106.1 (C-1'''), 75.7 (C-2'''), 78.4 (C-3'''), 69.9 (C-4'''), 67.1 (C-5'''), 97.8 (C-1''''), 74.8 (C-2''''), 76.3 (C-3''''), 71.8 (C-4''''), 77.4 (C-5''''), 68.2 (C-6''''), 109.8 (C-1'''''), 83.1 (C-2'''''), 78.5 (C-3'''''), 85.7 (C-4'''''), 62.5 (C-5''''')。以上数据与文献[8]报道基本一致, 故鉴定化合物3为notoginsenoside FP2。
化合物4 白色粉末。ESI-MS m/z: 914 [M-H]-, 推测其分子量为915, 分子式为C47H80O17, 不饱和度为8。13C NMR (150 MHz, C5D5N) δ: 39.5 (C-1), 27.1 (C-2), 89.1 (C-3), 40.0 (C-4), 56.7 (C-5), 18.7 (C-6), 35.4 (C-7), 40.3 (C-8), 50.5 (C-9), 36.9 (C-10), 31.2 (C-11), 70.4 (C-12), 49.8 (C-13), 51.7 (C-14), 31.0 (C-15), 26.9 (C-16), 51.9 (C-17), 16.3 (C-18), 16.6 (C-19), 83.8 (C-20), 22.6 (C-21), 36.5 (C-22), 23.4 (C-23), 126.3 (C-24), 131.3 (C-25), 26.1 (C-26), 18.2 (C-27), 17.7 (C-28), 17.1 (C-29), 28.4 (C-30), 107.3 (C-1'), 76.1 (C-2'), 79.6 (C-3'), 71.9 (C-4'), 78.7 (C-5'), 63.4 (C-6'), 98.4 (C-1''), 75.1 (C-2''), 79.0 (C-3''), 72.2 (C-4''), 77.2 (C-5''), 70.3 (C-6''), 106.1 (C-1'''), 75.1 (C-2'''), 78.3 (C-3'''), 71.4 (C-4'''), 67.3 (C-5''')。以上数据与文献[9]报道基本一致, 故鉴定化合物4为gypenoside Ⅸ。
化合物5 白色粉末。ESI-MS m/z: 784 [M-H]-, 推测其分子量为785, 分子式为C42H72O13, 不饱和度为7。13C NMR (150 MHz, C5D5N) δ: 39.4 (C-1), 28.0 (C-2), 78.6 (C-3), 40.4 (C-4), 61.4 (C-5), 80.2 (C-6), 45.1 (C-7), 41.1 (C-8), 50.0 (C-9), 39.7 (C-10), 30.7 (C-11), 70.2 (C-12), 49.2 (C-13), 51.4 (C-14), 31.0 (C-15), 26.6 (C-16), 51.5 (C-17), 17.6 (C-18), 17.8 (C-19), 83.3 (C-20), 22.3 (C-21), 36.2 (C-22), 23.2 (C-23), 126.0 (C-24), 130.9 (C-25), 25.8 (C-26), 17.6 (C-27), 31.8 (C-28), 16.4 (C-29), 17.2 (C-30), 106.0 (C-1'), 75.5 (C-2'), 79.7 (C-3'), 71.9 (C-4'), 79.4 (C-5'), 63.1 (C-6'), 98.3 (C-1''), 75.1 (C-2''), 78.2 (C-3''), 71.69 (C-4''), 78.3 (C-5''), 62.9 (C-6'')。以上数据与文献[10]对照基本一致, 故鉴定化合物5为ginsenoside Rg1。
3 酸水解和糖的绝对构型的确定将新化合物1、2 (各3 mg)溶于2.5 mol·L-1 HCl-H2O (2 mL)溶液中, 90 ℃加热搅拌12 h, 反应液用乙酸乙酯萃取3次。水层减压蒸干, 加水反复蒸至中性(无盐酸味), 得化合物1、2的糖部分。于其中加入L-半胱氨酸甲酯盐酸盐(2 mg)和无水吡啶(2 mL), 60 ℃搅拌反应2 h, 反应产物回收至干燥, 再加入0.2 mL三甲基硅烷咪唑, 60 ℃搅拌反应2 h后, 将反应液加至2 mL冰水中淬灭, 用等体积的正己烷萃取3次, 合并萃取液回收至干燥, 即制成糖噻唑三甲基硅醚化衍生物, 加入1 mL正己烷溶解, 即可用于气相分析。D-葡萄糖、L-阿拉伯糖(各3 mg)的单糖对照品按照以上步骤进行衍生化反应, 得到可用于气相分析的对照品。D-葡萄糖的衍生物保留时间29.8 min, L-阿拉伯糖保留时间19.6 min, D-阿拉伯糖保留时间20.5 min[气相条件:初始温度200 ℃, 然后升温至260 ℃ (升温速度: 10 ℃·min-1), 260 ℃保持24 min, 载气为氮气]。化合物1、2的糖部分衍生物都观察到保留时间为29 min、19 min的两个峰, 由此判定糖的绝对构型。
| [1] | Han SY, Li HX, Ma X, et al. Evaluation of the anti-myocardial ischemia effect of individual and combined extracts of Panax notoginseng and Carthamus tinctorius in rats[J]. J Ethnopharmacol, 2013, 145: 722. DOI:10.1016/j.jep.2012.11.036 |
| [2] | Li LZ, Lv GY, Chen SH, et al. Effect of the total saponins of Panax notoginseng leaves on blood lipid levels, liver function and lipid peroxidation in hyperlipidemia rats by fat emulsion[J]. Chin J Mod Appl Pharm (中国现代应用药学), 2014, 31: 662–666. |
| [3] | Xiang H, Liu Y, Zhang B, et al. The antidepressant effects and mechanism of action of total saponins from the caudexes and leaves of Panax notoginseng in animal models of depression[J]. Phytomed Int J Phytother Phytopharmacol, 2011, 18: 731. |
| [4] | Besso H, Kasai R, Saruwatari Y, et al. Ginsenoside-Ra1 and ginsenoside-Ra2, new dammarane-saponins of ginseng roots[J]. Chem Pharm Bull, 1982, 30: 2380–2385. DOI:10.1248/cpb.30.2380 |
| [5] | Zhang S, Yao X, Chen Y, et al. Ginsenoside La, a novel saponin from the leaves of Panax ginseng[J]. Chem Pharm Bull, 1989, 37: 1966–1968. DOI:10.1248/cpb.37.1966 |
| [6] | Li KK, Yang XB, Yang XW, et al. New triterpenoids from the stems and leaves of Panax ginseng[J]. Fitoterapia, 2012, 83: 1030. DOI:10.1016/j.fitote.2012.05.013 |
| [7] | Nguyen HT, Song GY, Kim JA, et al. Dammarane-type saponins from the flower buds of Panax ginseng and their effects on human leukemia cells[J]. Bioorg Med Chem Lett, 2010, 20: 309–314. DOI:10.1016/j.bmcl.2009.10.110 |
| [8] | Wang XY, Wang D, Ma XX, et al. Two new dammarane-type bisdesmosides from the fruit pedicels of Panax notoginseng[J]. Helv Chim Acta, 2008, 91: 60–66. DOI:10.1002/(ISSN)1522-2675 |
| [9] | Takemoto T, Arihara S, Nakajima T, et al. Studies on the constituents of Gynostemma pentaphyllum MAKINO. I. Structures of gypenoside Ⅰ-ⅩⅣ[J]. J Pharm Soc Jpn, 1983, 103: 173–185. DOI:10.1248/yakushi1947.103.2_173 |
| [10] | Kim DS, Chang YU, Zhao P, et al. Dammarane saponins from Panax ginseng[J]. Phytochemistry, 1995, 40: 1493–1497. DOI:10.1016/0031-9422(95)00218-V |
 2017, Vol. 52
2017, Vol. 52


