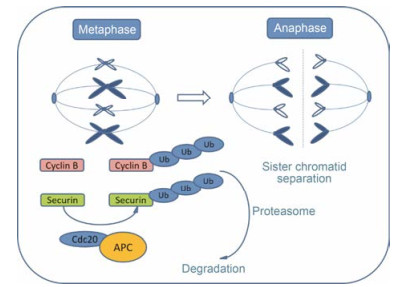
泛素化在细胞生长、繁殖、凋亡, DNA的损伤、迁移、入侵中发挥至关重要的作用。泛素化是由泛素蛋白酶系统(UPS)介导的一种翻译后修饰, 它能够调节蛋白降解过程[1]。多亚基E3泛素连接酶参与细胞分裂过程, 其中, 细胞分裂后期促进复合物(anaphase promoting complex, APC)是最大的E3泛素连接酶, 由至少14个亚基和1个共活化因子组成, 经细胞分裂周期蛋白20 (Cdc20) 或Cdc20同系物1 (Cdh1) 活化后形成两种不同的E3泛素连接酶复合物APCCdc20或APCCdh1, APCCdc20在有丝分裂中期至后期的过渡期破坏关键细胞周期调控子来调节细胞周期进程(图 1)[2], 而APCCdh1在M期和G1期发挥重要作用[3]。
|
Figure 1 A schematic illustration of cell division cycle protein 20 (Cdc20) participates in the cell division process |
Cdc20通常被认为是致癌因子, 促进肿瘤的发生及发展, 抑制Cdc20的活性可调节细胞分裂周期、加速细胞凋亡。同时, 在多种肿瘤细胞甚至肿瘤干细胞中都存在Cdc20的高表达, 为Cdc20作为一个新型抗肿瘤药物研发靶点提供了依据。因此, 本文总结了Cdc20与肿瘤的关系及现有的Cdc20抑制剂。
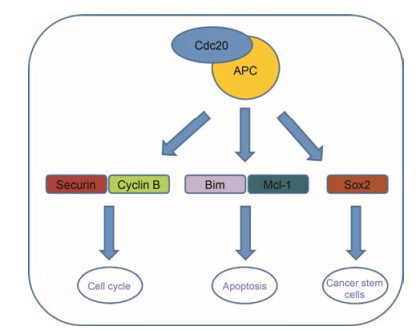
1 Cdc20与肿瘤 1.1 Cdc20的生物学功能Cdc20的发现早在40年前, 最初有研究者发现, Cdc20突变可引起有丝分裂异常停止, 使分裂后期染色体分离异常[4]。随后, 有研究表明, Cdc20能调节蛋白−蛋白相互作用[5]。目前, 研究认为Cdc20主要通过活化APC形成一种E3泛素连接酶复合物APCCdc20, 参与其下游底物的降解过程, 调节细胞有丝分裂周期进程、促进细胞凋亡等(图 2)。
|
Figure 2 A schematic illustration of the pharmacological functions of Cdc20 |
APC经Cdc20活化后形成APCCdc20复合物, 破坏其下游细胞周期调控子securin、cyclin B的泛素化[6], 在有丝分裂中期至后期的过渡期发挥至关重要的作用(图 1)。随着对Cdc20的研究不断深入, 越来越多的APCCdc20底物被发现(表 1)[7-17], 有些底物直接或间接参与细胞分裂过程, Cdc20能调节这些底物的泛素化或降解过程, 从而调节细胞周期进程。因此, 发现更多的APCCdc20底物有助于了解APCCdc20在调节细胞周期进展的分子机制。
| Table 1 The functions of the identified substrates for APCCdc20 |
除了调节细胞周期进程, Cdc20也被发现参与细胞凋亡过程。细胞凋亡过程与抗凋亡因子和促凋亡因子关系密切, Cdc20通过靶向作用于Mcl-1和Bim调节细胞凋亡。抗有丝分裂药物可以活化纺锤体组装检查点从而抑制APCCdc20的活性[18], 如taxol和nocodazole通过Mad2依赖的途径抑制APCCdc20的活性, 长期使用可促进癌细胞凋亡, 这一策略已经应用于肿瘤治疗方面[19]。也有报道表明, Cdc20通过抑制细胞凋亡引起癌细胞对化学治疗和放射治疗的抗性[20]。随着对Cdc20的不断研究, 其在调节细胞凋亡中的作用将会越来越明确。
1.1.3 Cdc20与肿瘤干细胞肿瘤干细胞具有高度增殖和分化能力, 具有发展成肿瘤的特性。在越来越多的肿瘤组织中发现了肿瘤干细胞的存在, 有研究认为, 现有的抗肿瘤药物只针对普通肿瘤细胞, 不能杀死肿瘤干细胞, 导致肿瘤化疗耐药和肿瘤治疗失败[21]。因此, 肿瘤干细胞靶向药物研究成为热点。有研究者发现, Cdc20活化APC形成APCCdc20复合物后, 调节其下游多能性相关转录因子Sox2的活性, 促进胶质瘤干细胞的侵袭及更新[17]。
1.2 Cdc20在肿瘤中表达情况Cdc20促进肿瘤的发生及发展, 在很多肿瘤中都发现了Cdc20高表达的现象(表 2), 且Cdc20的表达程度与肿瘤的病理程度相关, Cdc20表达越高, 肿瘤患者的病理分级越高, 预后越差, 5年总体生存率越低。
| Table 2 Cdc20 expressions in normal tissues/ tumor tissues from multiple organs. a: The expression levels are shown as number of high expression cases/total number of cases/percentage. ADC: Adenocarcinoma; HCC: Hepatocellular carcinoma; IDC: Invasive duct carcinoma; ILC: Invasive lobular carcinoma; MCADC: Mucinous cystadenocarcinoma; SCADC: Serous cystadenocarcinoma; SCC: Squamous cell carcinoma; TCC: Transitional cell carcinoma |
降低Cdc20水平是一条潜在的肿瘤治疗策略。例如, 在胰腺癌患者中, 降低Cdc20的表达水平能有效改善射线对胰腺癌细胞的效果[22, 23]; 在非小细胞肺癌中, 随着Cdc20表达水平增高, 癌细胞胸膜浸润越明显[24], 而下调Cdc20表达水平后, 肺癌细胞生长减缓, 肺癌细胞集落的形成速率减慢[25]。此外, 在乳腺癌[26]、大肠癌[27]、肝癌[28]、前列腺癌[29]、胶质瘤[30]、胃癌[31]、膀胱癌[32]和宫颈癌[33]等肿瘤中也存在Cdc20的高表达, 且其表达程度与肿瘤患者的病理程度、预后关系密切, Cdc20表达水平越高, 风险越大。总而言之, Cdc20的表达水平是一个有效的肿瘤患者预后指标, 并有望成为肿瘤治疗药物研发的新型靶点。
2 Cdc20抑制剂Cdc20促进肿瘤的发生及发展, 在很多肿瘤中都存在Cdc20的高表达, 因此, 使用小分子抑制剂降低Cdc20水平是治疗肿瘤的一条策略。尽管有些蛋白酶抑制剂可以限制APC的活性, 但往往是以一种非特异性的方式, 作用于多种蛋白, 破坏下游许多抑癌因子, 引起发热、贫血、腹泻和恶心等不良反应, 而靶向作用于Cdc20的特异性抑制剂可以避免直接抑制APC的活性, 从而减轻毒副作用[34]。遗憾的是, 目前特异性Cdc20抑制剂研究非常少。以下将总结一些特异性和非特异性Cdc20抑制剂(表 3)[35-39], 为特异性Cdc20抑制剂的研发提供思路。
| Table 3 The structures and functions of Cdc20 inhibitors |
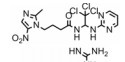
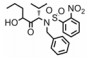
目前, 特异性Cdc20抑制剂的研究尚处于起步阶段。有研究组在蟾蜍卵提取物中构建APCCdc20−底物模型来筛选Cdc20抑制剂:依照文献[40]方法制备处于分裂间期的蟾蜍卵提取物(不加入钙离子载体A23187活化), 保存于−80 ℃条件下, 加入难降解性cyclin蛋白(MBP-△90) 诱导处于分裂间期的蟾蜍卵提取物进入有丝分裂分裂期, MBP-△90由麦芽糖结合蛋白MBP与缺失N端90位氨基酸的cyclin蛋白融合而成。为消除分裂间期残留蛋白的影响, 加入Cdh1蛋白和细胞周期依赖性蛋白激酶抑制剂roscovitine促进其降解, roscovitine能减缓Cdk1对Cdh1蛋白去磷酸化的抑制作用。用待筛选化合物处理蟾蜍卵提取物后加入同位素标记的cyclin蛋白N端碎片(cyc B1-NT), 根据cyc B1-NT的剩余量可以计算所筛选化合物的活性[35]。
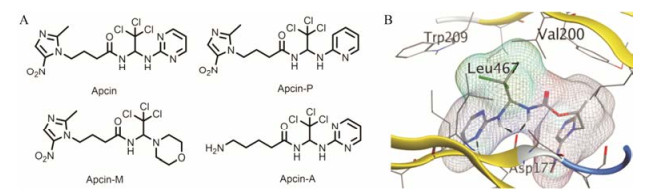
对所筛选化合物构效关系研究(图 3)发现, 用吡啶环替换apcin中嘧啶环时活性降低(apcin-P); 而用吗啉环替换(apcin-M)活性消失; 但用氨基替换apcin中的硝基咪唑基团时, 活性影响很小(apcin-A)[35]。在实验过程中, 用apcin处理的蟾蜍卵提取物实验组中Cdc20的含量减少, 而加入体外制备的Cdc20后, cyclin蛋白水解受到的抑制作用解除, 这说明apcin通过靶向作用于Cdc20, 从而抑制cyclin蛋白水解。随后, Cdc20的晶体结构也被发现(图 3), apcin与Cdc20的对接结果显示, apcin嘧啶环中的氮原子、链上的2个氮氢与Cdc20中的177位天冬氨酸有3个氢键结合作用, apcin中的三氯甲基埋入由200位缬氨酸、209位酪氨酸和467位亮氨酸组成的疏水口袋中, 而apcin中的硝基咪唑基团则暴露在溶剂中。这些研究都表明, apcin是通过靶向作用于Cdc20, 阻断Cdc20与APC之间的连接, 从而调节其下游底物的活性, 进而发挥其生物功能。
|
Figure 3 The structures of apcin derivatives (A) and crystal structure of the apcin Cdc20 complex (B) |
目前, 本课题组也在进行Cdc20特异性抑制剂的研究。对Cdc20晶体结构分析后, 以apcin为先导化合物, 保留已有的氢键作用, 对apcin中的嘧啶环、三氯甲基和甲硝唑基团进行改造, 并使用计算机辅助药物设计进行验证, 以期发现活性更好的Cdc20特异性抑制剂。
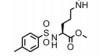
2.2 非特异性Cdc20抑制剂 2.2.1 TAME和pro-TAME研究组[36]发现另外一个小分子化合物TAME也能抑制蟾蜍卵提取物中cyclin蛋白水解, 然而, TAME是通过与APC结合, 阻断Cdc20或Cdh1活化APC, 从而抑制APC的活性。尽管TAME可以阻断Cdc20活化APC, 对APCCdc20的底物进行调节, 但它同时也可以阻断Cdh1活化APC, 而Cdh1是一个抑癌因子, APC经Cdh1活化后形成APCCdh1复合物, 抑制肿瘤的形成及发展(图 4)。由于TAME的渗透性不佳, Zeng等[36]发现pro-TAME能水解生成TAME, pro-TAME也能阻断Cdc20或Cdh1与APC的结合, 抑制APC的活性, 而且pro-TAME能诱导细胞凋亡, 与其他抑制剂联合使用时能大大提高细胞死亡率。
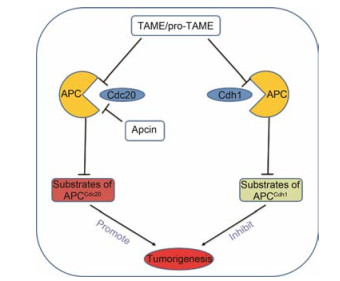
|
Figure 4 The difference between specific Cdc20 inhibitors and non-specific Cdc20 inhibitors |
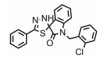
在乳腺癌小鼠模型中, NAHA能减小肿瘤的体积, 减轻肿瘤的重量, 降低Cdc20水平, 减缓细胞生长速率, 抑制癌细胞集落的形成。有研究者报道, NAHA能通过抑制尿激酶型纤溶酶原激活物减缓癌细胞的入侵和迁移[37]。这些都表明, NAHA以一种不明机制的方式抑制乳腺癌细胞中Cdc20的表达。CARP-1能把Cdc20或Cdh1与APC2结合起来, 调节细胞的生长和凋亡, 而化合物CFM-4能阻断这种结合, 延长细胞周期并诱导凋亡[38]。Nasr等[39]发现在产生耐药性的胰腺癌细胞中, 化合物BCHHD 7c能抑制Cdc20的表达。
2.2.3 天然产物成分金雀异黄素是一种异黄酮类植物雌激素, 对恶性肿瘤具有多效作用, 它能抑制酪氨酸激酶活性, 作用于多种信号通路抑制细胞生长、迁移和入侵, 诱导凋亡。在胶质瘤、横纹肌肉瘤、肝癌和乳腺癌等肿瘤细胞中, 金雀异黄素能下调包括Cdc20在内的很多关键调控因子的表达, 表现出抗肿瘤性[41]。从药用真菌中提取的一种灵芝醇ganodermanontriol (GDNT), 能下调Cdc20水平, 抑制乳腺癌细胞的生长及癌细胞集落形成[42]。从茄科植物中提取出的withaferin A对胰腺癌、乳腺癌和大肠癌等多种肿瘤细胞都有抗肿瘤活性, 而近期有研究者发现withaferin A是通过促进Cdc20和Mad2的降解和抑制纺锤体组装检查点功能来发挥抗肿瘤活性[43]。
3 结语越来越多的研究表明, Cdc20作为一个促癌因子, 参与很多肿瘤的发生和发展过程, Cdc20抑制剂是肿瘤治疗的一种新策略。Apcin是一种特异性Cdc20抑制剂, 与Cdc20靶向结合, 抑制APC的活性, 而其他抑制剂为非特异性抑制剂, 选择性较低。金雀异黄素、GDNT和withaferin A等植物成分具有无毒的特点, 是一种安全的肿瘤治疗途径。对Cdc20在肿瘤中作用的不断研究, 将为特异性Cdc20抑制剂的研发提供新的思路, 一方面, 研究者要不断发现APCCdc20的下游蛋白, 更深入、全面地了解Cdc20在肿瘤中的作用; 另一方面, 也要探索Cdc20在肿瘤的发生及发展中除了调节细胞周期和细胞凋亡以外的药理作用。为满足进一步的研发及临床需要, 应致力于特异性更高、活性更好的Cdc20抑制剂研究。
| [1] | Bassermann F, Eichner R, Pagano M. The ubiquitin proteasome system -implications for cell cycle control and the targeted treatment of cancer[J]. Biochim Biophys Acta, 2014, 1843: 150–162. DOI:10.1016/j.bbamcr.2013.02.028 |
| [2] | Kim S, Yu H. Mutual regulation between the spindle checkpoint and APC/C[J]. Semin Cell Dev Biol, 2011, 22: 551–558. DOI:10.1016/j.semcdb.2011.03.008 |
| [3] | Hu D, Qiao X, Wu G, et al. The emerging role of APC/CCdh1 in development[J]. Semin Cell Dev Biol, 2011, 22: 579–585. DOI:10.1016/j.semcdb.2011.03.012 |
| [4] | Hartwell LH, Culotti J, Reid B. Genetic control of the celldivision cycle in yeast. Ⅰ. Detection of mutants[J]. Proc Natl Acad Sci U S A, 1970, 66: 352–359. DOI:10.1073/pnas.66.2.352 |
| [5] | Hartwell LH, Mortimer RK, Culotti J, et al. Genetic control of the cell division cycle in yeast:Ⅴ. Genetic analysis of Cdc mutants[J]. Genetics, 21973, 74: 267–286. |
| [6] | Holland AJ, Cleveland DW. Boveri revisited:chromosomal instability, aneuploidy and tumorigenesis[J]. Nat Rev Mol Cell Biol, 2009, 10: 478–487. DOI:10.1038/nrm2718 |
| [7] | Zur A, Brandeis M. Securin degradation is mediated by fzy and fzr, and is required for complete chromatid separation but not for cytokinesis[J]. EMBO J, 2001, 20: 792–801. DOI:10.1093/emboj/20.4.792 |
| [8] | Clute P, Pines J. Temporal and spatial control of cyclin B1 destruction in metaphase[J]. Nat Cell Biol, 1999, 1: 82–87. DOI:10.1038/10049 |
| [9] | Amador V, Ge S, Santamaria PG, et al. APC/CCdc20 controls the ubiquitin-mediated degradation of p21 in prometaphase[J]. Mol Cell, 2007, 27: 462–473. DOI:10.1016/j.molcel.2007.06.013 |
| [10] | Sedgwick GG, Hayward DG, Di Fiore B, et al. Mechanisms controlling the temporal degradation of Nek2A and Kif18A by the APC/C-Cdc20 complex[J]. EMBO J, 2013, 32: 303–314. DOI:10.1038/emboj.2012.335 |
| [11] | Lim HJ, Dimova NV, Tan MK, et al. The G2/M regulator histone demethylase PHF8 is targeted for degradation by the anaphase-promoting complex containing CDC20[J]. Mol Cell Biol, 2013, 33: 4166–4180. DOI:10.1128/MCB.00689-13 |
| [12] | Song L, Rape M. Regulated degradation of spindle assembly factors by the anaphase-promoting complex[J]. Mol Cell, 2010, 38: 369–382. DOI:10.1016/j.molcel.2010.02.038 |
| [13] | Cho HJ, Lee EH, Han SH, et al. Degradation of human RAP80 is cell cycle regulated by Cdc20 and Cdh1 ubiquitin ligases[J]. Mol Cancer Res, 2012, 10: 615–625. DOI:10.1158/1541-7786.MCR-11-0481 |
| [14] | Ichim G, Mola M, Finkbeiner MG, et al. The histone acetyltransferase component TRRAP is targeted for destruction during the cell cycle[J]. Oncogene, 2014, 33: 181–192. DOI:10.1038/onc.2012.570 |
| [15] | Cragg MS, Harris C, Strasser A, et al. Unleashing the power of inhibitors of oncogenic kinases through BH3 mimetics[J]. Nat Rev Cancer, 2009, 9: 321–326. DOI:10.1038/nrc2615 |
| [16] | Harley ME, Allan LA, Sanderson HS, et al. Phosphorylation of Mcl-1 by CDK1-cyclin B1 initiates its Cdc20-dependent destruction during mitotic arrest[J]. EMBO J, 2010, 29: 2407–2420. DOI:10.1038/emboj.2010.112 |
| [17] | Mao DD, Gujar AD, Mahlokozera T, et al. A CDC20-APC/SOX2 signaling axis regulates human glioblastoma stem-like cells[J]. Cell Rep, 2015, 11: 1809–1821. DOI:10.1016/j.celrep.2015.05.027 |
| [18] | Izawa D, Pines J. The mitotic checkpoint complex binds a second CDC20 to inhibit active APC/C[J]. Nature, 2015, 517: 631–634. |
| [19] | Janssen A, Medema RH. Mitosis as an anti-cancer target[J]. Oncogene, 2011, 30: 2799–2809. DOI:10.1038/onc.2011.30 |
| [20] | Wan L, Tan M, Yang J, et al. APCCdc20 suppresses apoptosis through targeting Bim for ubiquitination and destruction[J]. Dev Cell, 2014, 29: 377–391. DOI:10.1016/j.devcel.2014.04.022 |
| [21] | Ma HY, He M, Wei MJ. Research progress on targeting effect and regulating mechanisms of the stemness of cancer stem cells[J]. Acta Pharm Sin (药学学报), 2016, 51: 189–196. |
| [22] | Xu QQ, Zhou ZS, Xiang M. Progress in the study of signal pathways for chronic inflammation-associated pancreatic carcinogenesis[J]. Acta Pharm Sin (药学学报), 2016, 51: 174–181. |
| [23] | Taniguchi K, Momiyama N, Ueda M, et al. Targeting of CDC20 via small interfering RNA causes enhancement of the cytotoxicity of chemoradiation[J]. Anticancer Res, 2008, 28: 1559–1563. |
| [24] | Kato T, Daigo Y, Aragaki M, et al. Overexpression of CDC20 predicts poor prognosis in primary non-small cell lung cancer patients[J]. J Surg Oncol, 2012, 106: 423–430. DOI:10.1002/jso.v106.4 |
| [25] | Kidokoro T, Tanikawa C, Furukawa Y, et al. CDC20, a potential cancer therapeutic target, is negatively regulated by p53[J]. Oncogene, 2008, 27: 1562–1571. DOI:10.1038/sj.onc.1210799 |
| [26] | Yuan B, Xu Y, Woo JH, et al. Increased expression of mitotic checkpoint genes in breast cancer cells with chromosomal instability[J]. Clin Cancer Res, 2006, 12: 405–410. DOI:10.1158/1078-0432.CCR-05-0903 |
| [27] | Wu WJ, Hu KS, Wang DS, et al. CDC20 overexpression predicts a poor prognosis for patients with colorectal cancer[J]. J Transl Med, 2013, 11: 142. DOI:10.1186/1479-5876-11-142 |
| [28] | Li J, Gao J, Du J, et al. Increased CDC20 expression is associated with development and progression of hepatocellular carcinoma[J]. Int J Oncol, 2014, 45: 1547–1555. DOI:10.3892/ijo.2014.2559 |
| [29] | Kwan PS, Lau CC, Chiu YT, et al. Daxx regulates mitotic progression and prostate cancer predisposition[J]. Carcinogenesis, 2013, 34: 750–759. DOI:10.1093/carcin/bgs391 |
| [30] | Dai B, Gong A, Jing Z, et al. Forkhead box M1 is regulated by heat shock factor 1 and promotes glioma cells survival under heat shock stress[J]. J Biol Chem, 2013, 288: 1634–1642. DOI:10.1074/jbc.M112.379362 |
| [31] | Ding Z, Wu H, Zhang J, et al. Expression characteristics of CDC20 in gastric cancer and its correlation with poor prognosis[J]. Int J Clin Exp Pathol, 2014, 7: 722–727. |
| [32] | Choi J, Kim Y, Lee J, et al. High expression of spindle assembly checkpoint proteins CDC20 and MAD2 is associated with poor prognosis in urothelial bladder cancer[J]. Virchows Arch, 2013, 463: 681–687. DOI:10.1007/s00428-013-1473-6 |
| [33] | Kim Y, Choi J, Lee J, et al. MAD2 and CDC20 are upregulated in high-grade squamous intraepithelial lesions and squamous cell carcinomas of the uterine cervix[J]. Int J Gynecol Pathol, 2014, 33: 517–523. DOI:10.1097/PGP.0000000000000082 |
| [34] | Dou QP, Zonder JA. Overview of proteasome inhibitorbased anti-cancer therapies:perspective on bortezomib and second generation proteasome inhibitors versus future generation inhibitors of ubiquitin-proteasome system[J]. Curr Cancer Drug Targets, 2014, 14: 517–536. DOI:10.2174/1568009614666140804154511 |
| [35] | Sackton KL, Dimova N, Zeng X, et al. Synergistic blockade of mitotic exit by two chemical inhibitors of the APC/C[J]. Nature, 2014, 514: 646. DOI:10.1038/nature13660 |
| [36] | Zeng X, Sigoillot F, Gaur S, et al. Pharmacologic inhibition of the anaphase-promoting complex induces a spindle checkpoint-dependent mitotic arrest in the absence of spindle damage[J]. Cancer Cell, 2010, 18: 382–395. DOI:10.1016/j.ccr.2010.08.010 |
| [37] | Jiang J, Thyagarajan-Sahu A, Krchnak V, et al. NAHA, a novel hydroxamic acid-derivative, inhibits growth and angiogenesis of breast cancer in vitro and in vivo[J]. PLoS One, 2012, 7: e34283. DOI:10.1371/journal.pone.0034283 |
| [38] | Puliyappadamba VT, Wu W, Bevis D, et al. Antagonists of anaphase-promoting complex (APC)-2-cell cycle and apoptosis regulatory protein (CARP)-1 interaction are novel regulators of cell growth and apoptosis[J]. J Biol Chem, 2011, 286: 38000–38017. DOI:10.1074/jbc.M111.222398 |
| [39] | Nasr T, Bondock S, Youns M. Anticancer activity of new coumarin substituted hydrazide-hydrazone derivatives[J]. Eur J Med Chem, 2014, 76: 539–548. DOI:10.1016/j.ejmech.2014.02.026 |
| [40] | Murray AW. Cell cycle extracts[J]. Method Cell Biol, 1991, 36: 581–605. DOI:10.1016/S0091-679X(08)60298-8 |
| [41] | Zhang L, Yang B, Zhou K, et al. Potential therapeutic mechanism of genistein in breast cancer involves inhibition of cell cycle regulation[J]. Mol Med Rep, 2015, 11: 1820–1826. |
| [42] | Jiang J, Jedinak A, Sliva D. Ganodermanontriol (GDNT) exerts its effect on growth and invasiveness of breast cancer cells through the down-regulation of CDC20 and uPA[J]. Biochem Biophys Res Commun, 2011, 415: 325–329. DOI:10.1016/j.bbrc.2011.10.055 |
| [43] | Das T, Roy KS, Chakrabarti T, et al. Withaferin A modulates the spindle assembly checkpoint by degradation of Mad2-Cdc20 complex in colorectal cancer cell lines[J]. Biochem Pharmacol, 2014, 91: 31–39. DOI:10.1016/j.bcp.2014.06.022 |
 2017, Vol. 52
2017, Vol. 52