2. 澳门大学中华医药研究院, 中药质量研究国家重点实验室, 澳门 999078
2. State Key Laboratory of Quality Research in Chinese Medicine, Institute of Chinese Medical Sciences, University of Macau, Macau 999078, China
纳米给药系统作为一种新型药物递送系统, 因其能增加难溶性药物的生物利用度已经得到了广泛关注。常见的纳米给药系统主要包括纳米乳、纳米粒、胶束、脂质体和碳纳米管等[1]。为了进一步优化纳米给药系统的性质, 研究者们经常对纳米载体进行各种修饰, 其中主动靶向修饰是研究热点之一。主动靶向修饰是指用特定的配体修饰纳米载体, 通过配体和受体的特异性结合, 使载体可以靶向特定部位达到提高治疗效果的目的。
新生儿Fc受体(neonatal Fc receptor, FcRn)是一种肠道上高表达的受体, 主要功能是介导自然被动免疫使新生儿从母乳中获得抗体[2]。免疫球蛋白G (immunoglobulin G, IgG)在pH 7.4时与FcRn结合能力差, 而在pH 6左右时和FcRn结合较强。与FcRn结合的IgG可以跟随FcRn受体转运进入循环途径或跨膜转运, 逃离溶酶体的降解, 而未与FcRn结合的IgG则会进入溶酶体降解途径[3, 4]。这一特点极大地延长了IgG的血浆半衰期[5], 为药物的长循环提供了一种新的思路。
利用小肠两侧pH的差异和FcRn与IgG结合的特性, 可以增加物质从小肠上皮顶侧向基底侧的转运, 促进物质的口服吸收。在十二指肠和空肠等肠段, 肠腔中pH呈弱酸性, 靶向FcRn的纳米载体可以与FcRn结合, 引发受体介导的内吞[6], 在胞内的酸性转运囊泡中, 配体与FcRn保持结合, 进入穿细胞途径, 在小肠上皮的基底侧外排出胞, 在pH中性的固有层, 配体与FcRn解离[7], 纳米载体可以进入体循环, 完成递送。Pridgen等[8]曾构建了一种靶向FcRn的纳米粒来促进胰岛素的口服递送, 其跨膜效率是被动纳米粒的10倍。
由于IgG蛋白结构复杂, 分子质量太大, 作者选用短肽FcBP来代替IgG。FcBP是根据噬菌体展示技术发现的IgG与FcRn的关键结合位点的氨基酸序列筛选出来的短肽[9]。本研究中选用的短肽是一个13个氨基酸组成的环肽, 编号为SYN1327, 是Syntonix Pharmaceuticals公司由噬菌体筛选肽SYN722优化而来。FcBP都含有一个包含高度相似的七肽序列Gly-His-Phe-Gly-Gly-X-Tyr (X代表一个疏水的氨基酸)的十一元环, 由不同位置的半胱氨酸上的巯基形成二硫键成环[10]。该序列与IgG的Fc段并无同源性, 但在pH 6.0下可以与IgG产生竞争抑制。通过对SYN722的优化, 在pH 6.0下SYN1327与FcRn的结合常数为31 nmol·L-1, 与IgG的Fc段相似, 而在pH 7.4下结合较少, 结合常数为170 nmol·L-1。
由于FcBP和FcRn在不同的pH条件下结合不同, 并且靶头密度也是载体靶向修饰效率的一个重要影响因素[11, 12]。为了进一步优化载体, 在本研究中, 以香豆素6 (C6) 为疏水性药物模型, 构建了FcBP修饰的不同靶头密度的PEG-PCL主动胶束和被动胶束, 以Caco-2细胞模拟肠道细胞, 考察胶束在pH 7.4和pH 6.0条件下的摄取和外排的区别, 初步考察FcRn在胶束摄取中的作用, 为纳米载体的设计提供了一定的参考。
材料与方法药品与试剂 mPEG3000-PCL2500 (PEG-PCL, Mw 5 500), HOOC-PEG4000-b-PCL2500 (HOOC-PEG-PCL, Mw 6 500, 加拿大Advanced Polymer Materials公司); N-羟基琥珀酰亚胺(N-hydroxysuccinimide, NHS)、无水DMF、无水CH2Cl2、N, N-二环己基碳二亚胺(N, N-dicyclohexycarbodiimide, DCC) (北京百灵威科技有限公司); 香豆素-6 (coumarin-6, C6, Mw 350.43, 美国Sigma-aldrich公司); FcBP (序列为RF-Pen-TGHFG-Sar-NMeLeu-YPC, Mw 1 510.76, 上海强耀生物科技有限公司); N-甲基吗啉(美国Fluka公司); 无水乙腈(美国Thermo Fisher Scientific公司); 透析袋(MWCO 3500, 上海捷瑞生物工程有限公司); 胎牛血清(fetal bovine serum, FBS, 美国Gibco公司); Minimum essential medium (MEM, pH 7.4) 无血清培养液、细胞培养瓶、12孔细胞培养板(美国Corning公司)、非必需氨基酸、100 u·mL-1青霉素、100 μg·mL-1链霉素、0.1 mol·L-1丙酮酸钠、0.25%胰蛋白酶/0.02% EDTA (北京迈晨生物科技有限公司); Hoechst 33258 (美国Molecular Probes公司); HCl (北京市通广精细化工公司)。
主要仪器 Nano ZS激光粒度测定仪(英国Malvern Instruments公司); 流式细胞仪(美国BD公司); F-7000荧光分光光度计(日本Hitachi公司); JEM-200CX型透射电子显微镜(日本电子株式会社)。
细胞株 Caco-2细胞购于中国典型培养物保藏中心。将Caco-2细胞培养于25 cm2的培养瓶中。培养液为含10% FBS、1%非必需氨基酸、1%青霉素和链霉素的MEM培养液。培养环境为95%相对湿度、5% CO2的37 ℃细胞培养箱。隔天更换细胞培养液。培养细胞至细胞汇合度达80%~90%时用0.25%胰酶/0.02% EDTA消化传代。
FcBP-PEG-PCL的合成 将HOOC-PEG4000-b-PCL2500、NHS和DCC以物质的量1: 1.5: 1.5的比例溶解于无水CH2Cl2中, 在冰浴, N2保护条件下搅拌12 h后过滤, 滤液蒸干, 产物重新溶解于DMF中。将与脂材物质的量相同的FcBP溶解于DMF中缓慢滴加到反应液中, N-甲基吗啉调节pH值至8~9, 室温, N2保护下搅拌反应约36 h[13]。反应进程通过高效液相色谱法监测FcBP的量进行, 并计算连接率。反应产物经50%乙醇透析24 h、纯水透析24 h, 冷冻干燥。
不同靶头密度的胶束的制备 本研究以香豆素6 (C6) 为疏水性模型药物, 采用薄膜水化法制备胶束。按表 1标识的量, 分别取PEG-PCL和FcBP-PEG-PCL储备液(1 mg·mL-1)于25 mL茄形瓶中, 加入乙腈4 mL完全溶解后, 加入C6储备液(100 μg·mL-1) 20 μL, 避光, 40 ℃减压旋转蒸发至溶剂挥尽, 得到均匀的C6与聚合物的混合薄膜。迅速加入预热的PBS 2 mL, 剧烈涡旋5 min, 使薄膜完全水化, 再超声分散至溶液澄清。12 000 r·min-1离心5 min, 除去未包载的C6, 上层溶液即为不同靶头修饰密度的载C6胶束[14]。分别标示为0%-M、0.5%-M、1%-M、1.5%-M、2%-M、2.5%-M、5%-M、10%-M和15%-M。
| Table 1 The amount of PEG-PCL and FcBP-PEG-PCL in micelles with different FcBP content. FcBP: IgG Fc domain-binding peptide |
胶束的粒径测定与形态观察 用动态光散射法测定各种胶束的粒径及粒度分布。设定粒度测定仪的激光波长为633 nm, 入射光与散射光束的夹角为90°, 测定温度为25 ℃。采用醋酸双氧铀负染法, 用透射电子显微镜观察胶束的形态, 加速电压为160 kV。
pH对细胞活性及胶束稳定性的影响 pH对细胞活性的影响采用磺酰罗丹明B (sulforhodamine B, SRB)方法测定。pH对胶束稳定性的影响采用HPLC测定[13]。将包载香豆素6的被动胶束0%-M和最大靶头密度修饰的主动胶束15%-M分别用pH 7.4和pH 6.0的MEM稀释后置于截留分子质量12 000~ 14 000的透析袋中, 分别置于pH 7.4和pH 6.0的释放介质中, 于37 ℃在摇床中振摇, 在0.5、1、2和4 h取样并用HPLC法测定释放介质中的香豆素含量, 计算香豆素释放的比例。
pH对不同靶头密度修饰的胶束摄取的影响 将Caco-2细胞接种于12孔板, 待细胞汇合度达80%左右, 吸尽培养液, 用PBS洗3次。加入用无血清MEM (pH 7.4) 稀释的胶束溶液(C6的终质量浓度均为100 ng·mL-1), 37 ℃孵育1 h。然后用冰冷PBS清洗终止摄取, 细胞消化后离心洗去黏附在细胞上的胶束。用流式细胞仪检测细胞内摄取C6的荧光强度。空白培养液作为空白对照。在pH 6.0组中, 预先用HCl将稀释胶束的无血清MEM调节pH至6.0, C6的终质量浓度也为100 ng·mL-1。其余操作步骤同pH 7.4。
胶束的外排 设摄取组、外排组和对照组。将Caco-2细胞接种于12孔板中, 待细胞汇合度达80%左右, 吸尽培养液, 用PBS洗3次。摄取组各孔加入pH 6.0的胶束溶液(C6的终质量浓度均为100 ng·mL-1), 37 ℃孵育1 h。用冰冷PBS清洗终止摄取, 用流式细胞术进行检测, 步骤同上。外排组在37 ℃下与胶束(pH 6.0, C6的终质量浓度均为100 ng·mL-1)孵育1 h后, 再加入完全培养液(pH 7.4), 37 ℃孵育1 h。之后弃去培养液, 用PBS洗3次, 用流式细胞术进行检测。对照组仅加无血清MEM培养液。外排组测得的荧光值为胞内剩余量(remain), 摄取组测得的荧光值减去外排组测得的荧光值得到外排量(exocytosis)。各组以0%-M为参照, 归一化后得到相对胞内剩余量和相对外排量。
FcRn在胶束摄取中的作用 将Caco-2细胞接种于12孔板中, 待细胞汇合度达80%左右, 吸尽培养液, 用PBS洗3次。共设4组:空白对照组、0%-M组、10%-M组和FcRn预饱和的10%-M组。0%-M组和10%-M组分别直接加入0%-M或10%-M溶液(pH 7.4, C6的终质量浓度均为100 ng·mL-1), 于37 ℃下孵育0.5 h。FcRn受体预饱和组先与80 μg·mL-1 FcBP溶液(大于胶束中含有FcBP浓度的500倍) 37 ℃下预孵育0.5 h, 吸出后加入含有相同浓度FcBP的10%-M溶液(pH 7.4, C6的终质量浓度均为100 ng·mL-1), 再孵育0.5 h。空白对照组仅加无血清MEM。孵育完成后弃去培养液, 用PBS洗3次, 用流式细胞术进行检测。
统计学分析 应用GraphPad Prism 6.0软件包进行统计学处理, 实验结果以x±s表示, 多样本均数间比较采用单因素方差分析, 当P < 0.05时认为差别有统计学意义。
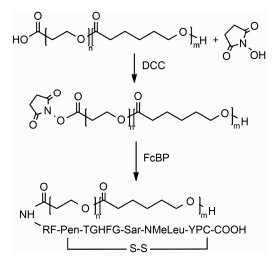
结果与讨论 1 FcBP-PEG-PCL的合成FcBP-PEG-PCL合成见合成路线1所示, 反应进程用高效液相色谱法进行监测。36 h时反应结束。通过计算FcBP连接率为70.1%。未参与反应的NHS-PEG-PCL在后续透析过程中, 可以被水解形成PEG-PCL而参与胶束的自组装, 所以产物无需进一步纯化。
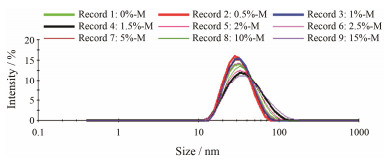
2 胶束的粒径与形态按照表 1的处方量制备不同靶头密度FcBP修饰的PEG-PCL胶束, 其粒径及粒径分布结果见图 1。结果显示胶束的粒径均在30~40 nm左右, PDI均小于0.25, 粒径分布均匀, 即FcBP的修饰不影响粒径分布, 主动胶束组和被动胶束组对照良好。选择0%-M和10%-M进行透射电镜拍摄, 如图 2所示, 主、被动胶束均呈圆形, 粒径大小与动态光散射测定结果相符。
|
Scheme1 Synthetic route for FcBP-PEG-PCL. One-letter code is used for the amino acids except for Pen (L-penicillamine), NmeLeu (L-N-methylleucine), Sar (sarcosine). Pen and Cys are connected by a disulfide bridge |
|
Figure 1 Particle size distribution of micelles measured by dynamic light scattering (DLS) |

|
Figure 2 Transmission electron microscopy (TEM) image of 0%-M (A) and 10%-M (B) stained with 1% uranyl acetate and examined by electron microscopy |
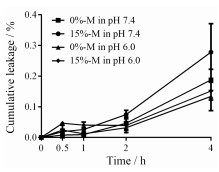
首先考察了pH对细胞活性以及胶束稳定性的影响。结果表明, 在pH 6.0条件下孵育4 h, 细胞的活性与pH 7.4条件下无明显改变(文中未显示), 说明在不同pH条件下摄取的差异不是由细胞状态的不同引起的, 即实验的可比性良好。主被动胶束在不同pH条件下的稳定性如图 3所示, 胶束在4 h内释放量小于0.4%, 在2 h内释放量小于0.1%, 可见胶束在两个pH条件下都稳定, 并且荧光染料的包载情况较好, 荧光染料的强度可以代表细胞中胶束的量。
|
Figure 3 Cumulative leakage of 0%-M and 15%-M in pH 7.4 and pH 6.0. n= 3, x±s |
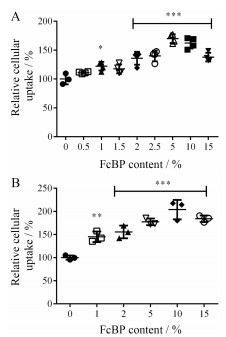
在pH 7.4环境中胶束摄取的结果如图 4A所示。结果表明, 各主动组的摄取量较被动组均有提升, 且摄取量随着FcBP修饰密度的增大呈现先增大后减小的趋势, 其中5%-M组相对摄取量最大, 为被动组的171%。
|
Figure 4 Flow cytometry result of micelles uptaken by Caco-2 cells at pH 7.4 (A) and pH 6.0 (B). n = 3, x±s. *P < 0.05, **P < 0.01, ***P < 0.001 vs 0%-M group |
由文献[10]报道可知, FcRn介导的内吞与pH相关, 当pH为6.0~6.5时, 受体与配体的亲和力增强, 当pH≥7时, 受体与配体容易发生解离。本研究进一步考察了在pH 6.0条件下的主、被动胶束的摄取差异。pH 7.4时的摄取结果可知, 在FcBP修饰密度达到5%前摄取量与修饰密度的关系呈正相关。为了简化实验, 在pH 6.0条件下实验低于5%的FcBP修饰密度的胶束仅选择了2%, 即pH 6.0条件下的摄取实验仅选用了0%-M、2%-M、5%-M、10%-M和15%-M。
胶束在pH 6.0环境中的摄取结果如图 4B所示。与pH 7.4条件下结果相同, 各主动组的摄取量均有提升, 且摄取量随着FcBP修饰密度变化的趋势为先增大后减小。类似的结果在其他研究中也有报道, 如Yu等[15]发现转铁蛋白修饰的金纳米粒的入脑量也有随着靶头密度的增大先增大后减少的现象。结合文献[12]报道推测可能是过多的FcBP修饰, 造成空间位阻, 影响了胶束上的配体与受体的结合, 或产生多个配体同时竞争1个受体的情况。
在pH 6.0条件下胶束的摄取与pH 7.4条件下的摄取也有不同: ① 前者相对摄取量最大的为10%-M, 而后者为5%-M。推测FcBP在不同pH条件下与FcRn的亲和力不同是引起胶束最佳靶头密度不同的主要原因[16]; ② pH 6.0下的主动摄取量提升幅度更大, 推测这可能与FcRn的作用机制有关。在pH 6.0环境下, FcBP与FcRn结合力强, 可能会引起更多的内吞, 而在胶束通过循环途径出胞时, FcBP在胞外不能像在pH 7.4条件下一样与FcRn解离使胶束外排, 可能会引起更高的胞内滞留。
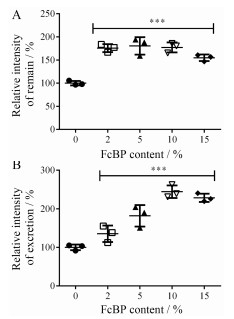
5 胶束的外排采用流式细胞术对主、被动胶束经Caco-2细胞摄取后的外排情况进行分析。在本实验中, Caco-2细胞是pH 6.0条件下摄取胶束, 在pH 7.4条件下外排。图 5A为外排结束后胞内胶束剩余量, 图 5B为计算得到的外排量。结果显示, 在pH 7.4条件下外排1 h后细胞内的滞留量有明显下降。说明胶束可以在pH 6.0环境下被摄取后, 在pH 7.4下被释放。这符合胃肠道的转运规律, 胶束可以在胃肠道一侧被摄取(pH 6.0)[17, 18]并在血液中释放(pH 7.4), 可见FcBP修饰的PEG-PCL胶束有口服药物递送的潜力。
|
Figure 5 Relative intensity of remain (A) and excretion (B) in excretion experiment. n = 3, x±s. ***P < 0.001 vs 0%-M group |
但是胶束在pH 6.0下摄取最多的靶头密度为10%, 而经过外排后2%-M、5%-M和10%-M的滞留量没有差异, 可见不同靶头密度修饰的胶束之间的外排也有一定的差异。其中10%-M的外排量是最大的, 最有利于跨膜递送。
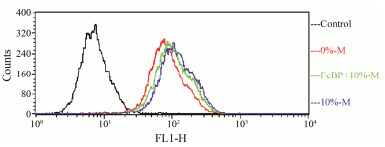
6 FcRn在胶束摄取中的作用上述结果已经表明Caco-2细胞对主动胶束的摄取是pH依赖型的, 符合FcRn介导的摄取的特点, 也提示该摄取过程是FcRn依赖性的。进一步采用竞争性抑制实验验证FcBP与受体的作用是否是FcBP修饰的胶束摄取量提升的原因。结果如图 6所示, 经FcBP预孵育的10%-M荧光强度较未经孵育的降低了23.4%。验证了FcBP修饰的主动靶向胶束在Caco-2细胞上摄取的提升主要与配体和FcRn的作用有关。
|
Figure 6 Competition experiment conducted using flow cytometry. Prior to uptake experiment, the competitive group (green line) was incubated with FcBP for 0.5 h. Then cells were incubated with 0%-M (red line) or 10%-M (green line and blue line) for 1 h |
本研究构建了FcBP修饰的PEG-PCL胶束, 通过物理包载C6, 用流式细胞术研究了pH和靶头密度对各胶束的摄取与外排的影响。结果表明FcBP修饰的PEG-PCL胶束的摄取量与pH和靶头密度都有关。摄取量随靶头密度的增大先增加后减少, 最优靶头密度与pH有关。同时胶束可以高效率地在pH 6.0进行摄取并在pH 7.4环境中外排, 表现出跨膜转运递送的潜力。竞争性抑制研究也表明FcBP修饰的PEG-PCL胶束的摄取与胶束和受体的结合有关。本研究为应用FcBP修饰的PEG-PCL胶束进行跨膜转运药物打下了一定的基础, 跨膜部分的机制还需进一步研究。
| [1] | Koo OM, Rubinstein I, Onyuksel H. Role of nanotechnology in targeted drug delivery and imaging:a concise review[J]. Nanomedicine, 2005, 1: 193–212. DOI:10.1016/j.nano.2005.06.004 |
| [2] | Brambell FWR. The transmission of immunity from mother to young and the catabolism of immunoglobulins[J]. Lancet, 1966, 288: 1087–1093. DOI:10.1016/S0140-6736(66)92190-8 |
| [3] | Martins JP, Kennedy PJ, Santos HA, et al. A comprehensive review of the neonatal Fc receptor and its application in drug delivery[J]. Pharmacol Ther, 2016, 161: 22–39. DOI:10.1016/j.pharmthera.2016.03.007 |
| [4] | Sockolosky JT, Szoka FC. The neonatal Fc receptor, FcRn, as a target for drug delivery and therapy[J]. Adv Drug Deliv Rev, 2015, 91: 109–124. DOI:10.1016/j.addr.2015.02.005 |
| [5] | Kontermann RE. Strategies for extended serum half-life of protein therapeutics[J]. Curr Opin Biotechnol, 2011, 22: 868–876. DOI:10.1016/j.copbio.2011.06.012 |
| [6] | Roopenian DC, Akilesh S. FcRn:the neonatal Fc receptor comes of age[J]. Nat Rev Immunol, 2007, 7: 715–725. DOI:10.1038/nri2155 |
| [7] | Ober RJ, Martinez C, Vaccaro C, et al. Visualizing the site and dynamics of IgG salvage by the MHC Class I-related receptor, FcRn[J]. J Immunol, 2004, 172: 2021–2029. DOI:10.4049/jimmunol.172.4.2021 |
| [8] | Pridgen EM, Alexis F, Kuo TT, et al. Transepithelial transport of Fc-targeted nanoparticles by the neonatal Fc receptor for oral delivery[J]. Sci Transl Med, 2013, 5: 213ra167. DOI:10.1126/scitranslmed.3007049 |
| [9] | Mezo AR, McDonnell KA, Castro A, et al. Structure-activity relationships of a peptide inhibitor of the human FcRn:human IgG interaction[J]. Bioorganic Med Chem, 2008, 16: 6394–6405. DOI:10.1016/j.bmc.2008.05.004 |
| [10] | Mezo AR, McDonnell KA, Hehir CA, et al. Reduction of IgG in nonhuman primates by a peptide antagonist of the neonatal Fc receptor FcRn[J]. Proc Natl Acad Sci U S A, 2008, 105: 2337–2342. DOI:10.1073/pnas.0708960105 |
| [11] | Saul JM, Annapragada A, Natarajan JV, et al. Controlled targeting of liposomal doxorubicin via the folate receptor in vitro[J]. J Control Release, 2003, 92: 49–67. DOI:10.1016/S0168-3659(03)00295-5 |
| [12] | Elias DR, Poloukhtine A, Popik V, et al. Effect of ligand density, receptor density, and nanoparticle size on cell targeting[J]. Nanomedicine, 2013, 9: 194–201. DOI:10.1016/j.nano.2012.05.015 |
| [13] | Du W, Fan Y, Zheng N, et al. Transferrin receptor specific nanocarriers conjugated with functional 7 peptide for oral drug delivery[J]. Biomaterials, 2013, 34: 794–806. DOI:10.1016/j.biomaterials.2012.10.003 |
| [14] | Li R, Song XN, Zhang H, et al. The integrity study on PEG-PCL micelles transcellular transported across MDCK epithelial cell monolayer using FRET technology[J]. Acta Pharm Sin (药学学报), 2016, 51: 1316–1324. |
| [15] | Yu YJ, Zhang Y, Kenrick M, et al. Boosting brain uptake of a therapeutic antibody by reducing its affinity for a transcytosis target[J]. Sci Transl Med, 2011, 3: 84ra44. |
| [16] | Bien-Ly N, Yu YJ, Bumbaca D, et al. Transferrin receptor (TfR) trafficking determines brain uptake of TfR antibody affinity variants[J]. J Exp Med, 2014, 211: 233–244. DOI:10.1084/jem.20131660 |
| [17] | Lalezari D. Gastrointestinal pH profile in subjects with irritable bowel syndrome[J]. Ann Gastroenterol, 2012, 25: 333–337. |
| [18] | Abuhelwa AY, Foster DJR, Upton RN. A quantitative review and meta-models of the variability and factors affecting oral drug absorption-Part Ⅱ:gastrointestinal transit time[J]. AAPS J, 2016, 18: 1322–1333. DOI:10.1208/s12248-016-9953-7 |
 2017, Vol. 52
2017, Vol. 52


