乳腺癌是女性常见恶性肿瘤, 据统计我国每年女性乳腺癌发生率16.9万, 是死亡率位居第二位的常见恶性肿瘤[1-3]。肿瘤的发生和转移与肿瘤细胞所处的微环境密切相关, 细胞外基质蛋白(ECM)的大量沉积及交联可导致肿瘤组织的基质硬度和弹性力学逐渐升高, 而基质硬度变化可影响细胞的多种生物学特征和行为如形态、迁移、增殖和凋亡等[4-7]。以高分子聚合物为基础的纳米制剂作为一种有前景的疾病诊疗手段和药物递送系统, 在抗肿瘤新药研发方面的应用越来越广泛[8-10]。如何提高纳米制剂在体内的有效递送和对肿瘤细胞的靶向性一直是靶向药物递送领域的研究热点和重点。然而, 关于肿瘤微环境的力学因素如基质硬度是如何影响纳米制剂在肿瘤部位被肿瘤细胞所摄取的研究鲜有报道。Huang等[11]选择血管内皮细胞为研究对象, 初步探索了基质硬度和聚苯乙烯纳米粒细胞摄取行为之间的联系, 并通过构建数学模型进一步解释机械力信号对细胞摄取纳米粒行为的影响。
体外细胞培养技术被广泛用于新药及其制剂的活性筛选、药理和毒理机制的研究。目前, 常用的体外细胞培养均在以聚苯乙烯为主要材质的组织细胞培养板(TCPS)上进行, 而其硬度接近于1 GPa[12]。TCPS硬度与细胞在体内的生长组织环境硬度相差很大, 故可能导致研究结果与细胞在体内实际生长的生物学行为发生较大偏差。因此, 选择力学性能和生物相容性良好的基质模拟体内力学环境建立硬度可控的体外细胞生长基质模型是进行上述研究的重要环节。综合国内外研究发现, 用于二维细胞体外培养的基质主要有硅胶、聚苯乙烯、聚丙烯酰胺、胶原和琼脂糖等[13, 14]。作为应用最广的聚丙烯酰胺凝胶因具有一定的亲水性、理化性质稳定并且可通过调节单体的浓度而获得较大的硬度范围, 故可将聚丙烯酰胺凝胶作为体外模拟体内细胞培养的理想基质[15, 16]。然而, 2D细胞培养不能完全反映细胞在体内的生长环境, 忽略了肿瘤细胞间的相互作用和它们所处特殊微环境的整体特性, 很多研究发现正常组织细胞及肿瘤细胞在传统的2D培养模型中细胞的一些特定表型消失, 进而可影响肿瘤的发生发展及肿瘤细胞的相关功能[17-19]。随着对肿瘤微环境了解的深入, 研究者发现3D细胞培养模型能够在体外构建与体内相近的细胞发育结构系统, 能更好地模拟细胞生长的微环境, 体现肿瘤细胞间的相互作用, 还能重现人体肿瘤细胞局部黏附、侵袭及转移的过程[18, 19]。在肿瘤发生发展的研究方面, 3D培养比2D培养有着更大的优势, 肿瘤细胞在3D模型中恶性表型更突出, 致瘤性更强[20]。常用的3D细胞培养模型中的细胞外基质蛋白包括: Ⅰ型胶原蛋白(collagen Ⅰ)、Ⅲ型胶原蛋白(collagen Ⅲ)、Ⅳ型胶原蛋白(collagen Ⅳ)、层粘连蛋白(laminin)及Matrigel等。商品化Matrigel作为3D细胞培养基质, 可形成具有生物学活性的三维基质模拟体内细胞基质的结构、组成、物理特性和功能, 有利于体外细胞的培养和分化, 可用于对细胞形态、生化功能、迁移、侵染和基因表达等研究。然而, Matrigel来源于EHS小鼠肉瘤细胞分泌的细胞外基质, 其组成成分复杂, 难以通过改变成胶处方获得不同基质硬度的凝胶[21]。本研究拟考察基质硬度这个单一变量, 为避免其他因素对实验结果产生干扰, 需选择成分单一的细胞外基质进行3D细胞培养。胶原凝胶可以通过调节胶原浓度获得不同硬度的基质, 其组成单一, 同时结合2D聚丙烯酰胺凝胶(PAA gel)的制备, 故本研究选择Ⅰ型鼠尾胶原构建胶原凝胶(collagen gel)建立3D细胞培养模型。
为更好地研究2D和3D细胞培养模型中基质硬度和纳米制剂细胞摄取行为之间的联系, 本研究通过构建硬度可控的2D和3D体外细胞培养基质, 模拟肿瘤组织硬度, 以粒径大小为20 nm和50 nm的聚苯乙烯纳米球作为模型纳米制剂, 研究乳腺癌细胞对不同硬度基质的响应性, 进一步研究在不同细胞培养模型中基质硬度对乳腺癌细胞形态和摄取功能的影响, 从而揭示癌变过程中力学因素变化对乳腺癌细胞摄取纳米制剂行为的影响。
材料与方法试剂与药品 聚苯乙烯荧光纳米球(美国Phosphorex公司); 丙烯酰胺、N, N-亚甲基双丙烯酰、3-氨丙基三甲氧硅烷、Irgacure 2959 (I-2959)、罗丹明标记的鬼笔环肽(TRITC-phalloidin) (美国Sigma-Aldrich公司); Sulfo-SANPAH (美国ThermoFisher Scientific公司); Ⅰ型鼠尾胶原(美国Advanced Biomatrix公司); 磷酸盐缓冲液(PBS)、RPMI-1640培养基(美国Hyclone公司); 胰蛋白酶溶液、注射用青霉素钠、注射用硫酸链霉素(北京索莱宝生物科技有限公司); 标准胎牛血清(fetal bovine serum, FBS, 上海复蒙生物制品有限责任公司); 4', 6-diamidino-2-pheylindole (DAPI, 江苏碧云天生物有限公司); 实验用水为灭菌超纯水; 其余试剂均为分析纯。
仪器 LED式紫外光固化仪(Uvata, 上海和沁光电有限公司); 动态热机械分析仪(DMA) (Q800, 美国TA instrument公司); Zetasizer Nano ZS90激光粒度分析仪(英国Malvern公司); Varioskan Flash全波长多功能酶标仪(美国Thermo Scientific公司); LSM510型激光共聚焦显微镜(德国Carl Zeiss公司)。
细胞 人乳腺癌细胞MCF-7 (中国科学院上海细胞生物研究所), 用含10%胎牛血清的RPMI-1640培养基于37 ℃、5% CO2及饱和湿度条件下连续培养, 隔天换液。
活化盖玻片 将盖玻片置于装有稀酸的烧杯中, 浸泡过夜后用自来水冲洗残余酸液, 然后浸入95%乙醇溶液, 超声清洗10 min, 再用蒸馏水冲洗干净, 于37 ℃烘箱中烘干。将盖玻片小心缓慢加入含2% 3-氨丙基三甲氧硅烷溶液中, 避免相互黏连, 轻轻搅拌10 min。用超纯水冲洗盖玻片4次, 每次浸泡10 min, 并轻轻搅拌, 于30 ℃烘箱中烘干10 min。冷却至室温, 于通风橱中, 将盖玻片浸入1%戊二醛水溶液中, 并轻轻搅拌30 min。用超纯水冲洗盖玻片3次, 每次浸泡10 min, 并轻轻搅拌。室温下晾干, 并盖上锡箔纸以防落尘, 干燥环境下保存。
2D细胞培养基质的制备 根据表 1处方向EP管中各加入一定量的丙烯酰胺溶液、双丙烯酰胺溶液和I-2959溶液, 涡旋3 min, 充分混匀, 取PAA溶液180 μL滴于铺有封口胶的载玻片上并轻轻盖上活化过的盖玻片, 在紫外光催化下聚合(功率80 W, 波长365 nm, 时间6 min)。将制备好的PAA gel转移至无菌细胞培养皿内, 加超纯水浸泡过夜, 移至超净台中, 75%乙醇浸泡清洗2 min, 无菌HEPES溶液洗2次, 在PAA gel上滴加0.5 mg·mL-1 Sulfo-SANPAH试液250 μL, 紫外照射(功率80 W, 波长365 nm, 时间5 min), 用HEPES溶液洗去残余反应液, 再重复上一步操作。将PAA gel转移至24孔板中, 加0.1 mg·mL-1鼠尾胶原300 μL, 4 ℃避光过夜反应, 反应结束后用无菌PBS清洗3遍, 加适量双抗溶液, 紫外照射灭菌1 h, 保存于4 ℃。接种细胞前用紫外灭菌30 min, PBS清洗3次, 加细胞完全培养基于37 ℃孵育30 min后, 取对数生长期的MCF-7细胞, 通过常规方法消化, 制成单细胞悬液, 以8×104个/孔的细胞数接种于PAA gel上, 待细胞贴壁生长24 h后可进行后续实验操作。
| Table 1 The formula of polyacrylamide (PAA) gel |
PAA gel的硬度表征 通过动态热机械分析仪(DMA)测定所制备的PAA gel的硬度。首先, 按照上述处方于24孔板中加入2 mL聚丙烯酰胺溶液制备PAA gel, 将其浸泡于超纯水中, 使其充分溶胀24 h, 进行DMA测试。测试频率: 1 Hz; 试样尺寸:直径20 mm (夹持系统:平行板); 应变范围: 0.01%~20% (初始应变扫描); 测量杨氏模量应力-应变曲线应力范围: 0.01%~10%;温度:室温。最后根据测得的应力-应变曲线的斜率, 获得不同处方PAA gel的杨氏模量(E′)大小。
PAA gel表面蛋白含量的测定 PAA gel表面不具有细胞黏附位点, 细胞无法正常黏附。因此, 需在其表面引入胶原蛋白, 为细胞黏附提供必要的位点。由于胞外基质蛋白量会影响细胞的生物学行为如黏附和增殖, 需对不同硬度PAA gel上结合的蛋白进行定量测定, 以确保在不同硬度PAA gel上共价连接的蛋白量一致, 以避免由于表面蛋白含量不一致对后续实验结果产生干扰。本研究采用BCA法进行表面蛋白含量测定, 具体操作如下:在96孔板中, 每孔加入20 μL标准曲线样品, 各孔加入160 μL BCA工作液, 在装有PAA gel的24孔板中每孔加入PBS 80 μL和工作液640 μL, 37 ℃孵育2 h。冷却至室温, 用酶标仪测定吸光值(λmax 562 nm), 根据标准曲线计算蛋白含量。
3D细胞培养基质的制备 通过改变I型鼠尾胶原浓度制备不同硬度的3D细胞培养基质。在冰浴条件下, 依次按表 2所述溶液量, 加入各组分溶液于1.5 mL EP管中, 涡旋3 min, 使溶液混合均匀。取对数生长期的MCF-7细胞, 通过常规方法消化, 制成单细胞悬液, 调整细胞数每毫升为1×106个。取细胞悬液83.5 μL加入上述混合溶液中混合均匀, 然后分别取150 μL混合液加入共聚焦小皿中, 于37 ℃细胞培养箱中孵育30 min, 待成胶后, 加入1 mL细胞完全培养液于培养箱中继续培养, 隔天换液。
| Table 2 The formula of collagen gel |
聚苯乙烯荧光纳米球的理化性质表征 通过激光粒度分析仪测定两种聚苯乙烯荧光纳米球溶液的粒径和ζ电位。
细胞纤维状肌动蛋白(F-actin)染色 待细胞生长完全贴附于PAA gel上和collagen gel中时移除培养基, 用预温的PBS清洗细胞2次, 4%多聚甲醛溶液固定细胞20 min后加入100 μL 0.5% Triton X-100对细胞膜打孔穿透10 min, 以便染料进入。然后用含1% BSA的PBS室温封闭细胞30 min, 以避免背景荧光对实验造成的干扰, 吸干封闭液, 用PBS溶液洗3次。加入5 μg·mL-1 TRITC-phalloidin进行染色, 室温下30 min, 为防止染色过程中染液蒸发, 将PAA gel和collagen gel置于密闭的湿润环境中。染色完成后, 用PBS溶液清洗3次。1 μg·mL-1 DAPI避光染色10 min, 待PBS溶液清洗3次后甘油封片, 在激光共聚焦显微镜下观察形态。
细胞对聚苯乙烯荧光纳米球的摄取 采用激光共聚焦显微镜定性和半定量考察聚苯乙烯荧光纳米球在不同硬度PAA gel上和collagen gel中细胞的摄取效率。先在内置无菌PAA gel的24孔板中加入细胞培养液预先孵育30 min, 取对数生长期的MCF-7细胞, 通过常规方法消化, 制成单细胞悬液, 以8×104个/孔的细胞数接种于PAA gel上。待PAA gel上细胞贴壁生长24 h, collagen gel中细胞生长72 h后, 弃去原细胞培养液, 加入含0.2 g·L-1的20 nm和50 nm聚苯乙烯荧光纳米球培养液, 孵育2 h后, 用预冷PBS洗涤3次, 后续实验步骤与“细胞纤维状肌动蛋白染色”方法一致, 对细胞核和细胞骨架进行染色, 通过激光共聚焦显微镜对实验结果进行定性考察和用Image-J软件对实验结果进行半定量分析。
数据分析 采用Prism 5.0软件进行统计学分析。计量数据用x±s表示。组间均数差异采用Student’s t-test进行检验。
结果和讨论 1 2D和3D培养基质的硬度表征对离体的乳腺组织样本进行杨氏模量测定得到其癌症初期和晚期的硬度大小在3~42 kPa[22]。通过DMA测试, 获得不同处方PAA gel的E′大小, 结果如图 1所示, 软基质的杨氏模量大小为1 kPa, 硬基质的杨氏模量大小为25 kPa。由于3D培养基质collagen gel材料硬度范围超出DMA测试限度, 未对其进行DMA测试硬度表征。根据文献[23, 24]方法, 通过调整胶原浓度可以获得不同硬度大小的胶原凝胶进行3D细胞培养, 通过原子力显微镜测得1 g·L-1胶原凝胶的弹性模量约为1 kPa, 而0.5 g·L-1胶原凝胶的弹性模量大小为100 Pa[23], 接近于正常乳腺组织的硬度[25]。相对于PAA gel, 胶原凝胶的硬度大小更接近于乳腺癌细胞在癌变过程中在体生长的组织硬度。
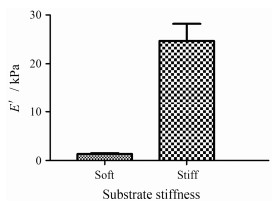
|
Figure 1 The Young's moduli (E′) of polyacrylamide (PAA) gel substrates. n = 3, x±s |
如图 2所示, 两种硬度大小的PAA gel表面共价连接的胶原蛋白量并无显著性的差异(P > 0.05), 可以避免由于表面蛋白含量差异对后续实验结果产生影响。
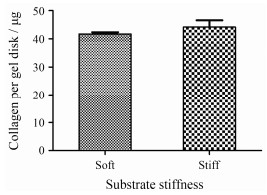
|
Figure 2 Quantification of rat tail collagen Ⅰ covalently conjugated on PAA gel substrates. n = 3, x±s |
两种荧光纳米球的平均粒径分别为19.82 ± 0.05 nm和51.83 ± 0.64 nm, PDI分别为0.257 ± 0.006和0.133 ± 0.005, ζ电位分别为-22.6 ± 0.012 mV和-42.5 ± 0.026 mV。见图 3。结果表明两种荧光纳米球的平均粒径如商品标示(20 nm和50 nm), 分布均一, 结构稳定性良好。
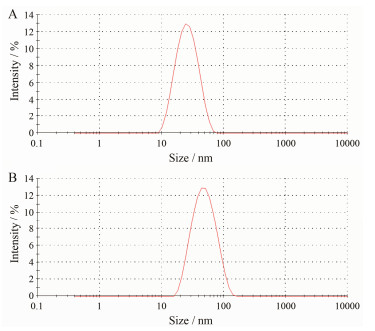
|
Figure 3 Size distributions of polystyrene nanospheres. DLS measurement shows average size distributions of about 20 nm and 50 nm polystyrene nanospheres (A and B) |
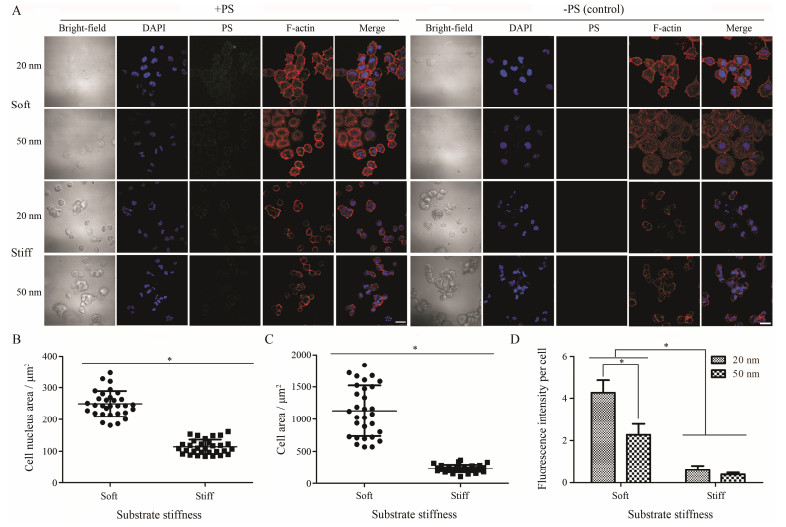
2D培养条件下, 不同硬度PAA gel上黏附的MCF-7细胞形态呈现较明显差异(图 4A)。在硬基质上(25 kPa), 细胞呈马蹄形展开, 有明显的肌动蛋白纤维束形成, 细胞面积和细胞核面积较大; 而在软基质上(1 kPa), 细胞呈类球形且肌动蛋白主要是以环状形式分布在细胞膜周围, 细胞核面积和细胞面积较小(图 4B, C)。结果说明, 2D培养条件下细胞更倾向于在硬基质上生长和铺展。以collagen gel为基质的3D细胞培养条件下, 基质硬度对细胞形态变化的影响趋势与PAA gel相反, 细胞更易于在软基质中(~100 Pa)生长, 且细胞铺展程度较高, 呈马蹄形, 形成细胞和细胞之间的连接, 而在相对硬基质中(1 kPa)细胞呈类球形, 成簇生长(图 5A), 细胞核面积和细胞面积较小(图 5B, C), 说明3D培养条件下, 较软的胶原凝胶基质更接近于细胞在体生长的组织力学环境。此外, 研究表明2D培养模型中的细胞与细胞间的相互作用力较弱, 在体内形成的肿瘤较3D培养模型中的细胞小、致瘤率较低, 且有关肿瘤细胞侵袭表型的信号分子转录水平也显著性低于3D培养模型中的细胞[20, 26]。因此, 3D细胞培养模型相比于2D细胞培养模型能更好地模拟乳腺癌干细胞的特性并能够较好地进行药物体内外评价。
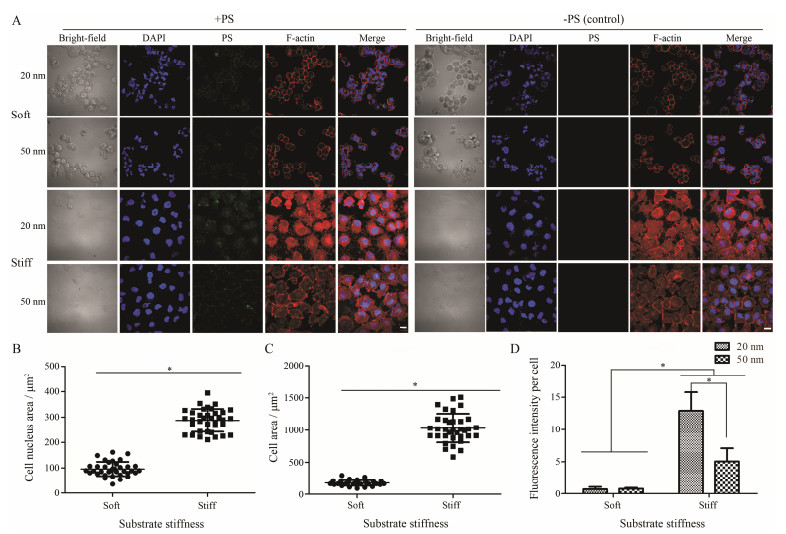
|
Figure 4 Morphological characterizations and cell uptake efficiency of MCF-7 on PAA gel substrates of varying stiffness (1 kPa and 25 kPa). A: Cell cytoskeleton: F-actin (red). Nuclei: DAPI (blue). Polystyrene nanospheres (PS, green). B: Scale bar is 20 μm (n = 5). Spreading area of the cell nuclei (n ≥ 30). C: Spreading area of cells on PAA gel substrates of varying stiffness (n ≥ 30). D: Normalized fluorescence intensity to cell number. Fluorescence intensity was determined using semi-quantitative analysis using Image J software. Control was without PS treatment. *P < 0.05 |
|
Figure 5 Morphological characterizations and cell uptake efficiency of MCF-7 in collagen gel substrates of varying stiffness (100 Pa and 1 kPa). A: Cell cytoskeleton: F-actin (red). Nuclei: DAPI (blue). Polystyrene nanospheres (PS, green). Scale bar is 20 μm (n = 5). B: Spreading area of the cell nuclei (n ≥ 30). C: Spreading area of cells in collagen gel substrates of varying stiffness (n ≥ 30). D: Normalized fluorescence intensity to cell number. Fluorescence intensity was determined using semi-quantitative analysis using Image J software. Control was without PS treatment. *P < 0.05 |
本研究中选用聚苯乙烯荧光纳米球作为模型纳米制剂, 因其具有发光效率高、稳定性良好等优点可以更好地用于评价细胞对纳米制剂的摄取[27, 28]。实验结果表明, 在PAA gel上, 生长在硬基质上的细胞对两种粒径大小聚苯乙烯荧光纳米球的摄取量都显著高于在软基质上生长的细胞(P < 0.05)。在硬基质上(25 kPa), 细胞对粒径大小为20 nm的聚苯乙烯荧光纳米球的摄取量显著高于粒径为50 nm的聚苯乙烯荧光纳米球(P < 0.05), 这与文献[29]报道一致, 即粒径较小的纳米药物越容易被细胞所摄取, 而在软基质上(1 kPa)的细胞对两种不同大小的聚苯乙烯荧光纳米球的摄取量没有显著性差异(P > 0.05), 这可能与细胞对基质硬度的响应性下调有关, 使细胞的摄取量显著减少, 导致两种荧光纳米球的摄取量差异不明显(图 4A, D)。
在3D培养的细胞中, 细胞摄取纳米粒的结果与PAA gel呈相反趋势, 即生长在软基质中的细胞对两种粒径大小的聚苯乙烯荧光纳米球的摄取量均显著高于生长在硬基质中的细胞(P < 0.05), 并且在软基质中(~100 Pa), 细胞对粒径大小为20 nm的聚苯乙烯荧光纳米球的摄取量显著高于粒径为50 nm的聚苯乙烯荧光纳米球(P < 0.05), 而在相对硬基质中(1 kPa)的细胞对两种不同大小的聚苯乙烯荧光纳米球的摄取量没有显著性差异(P > 0.05) (图 5A, D)。这可能与胶原凝胶的结构有关, 硬度大的collagen gel其交联化程度高, 结构致密, 内部孔隙较小, 两种粒径大小的荧光纳米球通过孔隙渗透入collagen gel内部的量很少, 因此生长在collagen gel内部的细胞摄取量就相对较低, 导致两种荧光纳米球的摄取量差异不明显(图 5A, D)。关于不同细胞培养模型中基质硬度对细胞摄取的调控机制还有待于进一步深入研究。
结论本研究构建了2D和3D细胞培养模型, 在研究中发现无论是2D还是3D细胞培养基质, 在同一硬度基质上, 细胞对粒径大小为20 nm的荧光纳米球的摄取量高于50 nm。在2D细胞培养基质上, 细胞更倾向于在硬的基质上生长, 细胞核和细胞面积都大于软基质上的细胞且在硬基质上的细胞对聚苯乙烯荧光纳米球的摄取量高于软基质上的细胞。相反, 在3D培养条件下, 细胞在较软的基质中更易铺展, 细胞核和细胞面积都大于硬基质上的细胞, 且细胞对聚苯乙烯荧光纳米球的摄取量相对于硬的基质高, 表明细胞生长的力学环境对细胞的形态和功能产生了一定的影响。研究还表明3D细胞培养模型相比于2D细胞培养模型能更好地进行药物体内外评价。综上, 本文为研究物理力学因素如何调节细胞对纳米制剂摄取的行为提供了重要参考依据, 同时也为纳米制剂在体内的有效递送提供了新的研究思路和研究方法。关于不同细胞培养模型中基质硬度对细胞摄取的调控机制还有待于进一步深入研究。
| [1] | Lin CY, Chen SH, Huang CC, et al. Risk of secondary cancers in women with breast cancer and the influence of radiotherapy a national cohort study in Taiwan[J]. Medicine, 2016, 95: e5556. DOI:10.1097/MD.0000000000005556 |
| [2] | Ma Y, Liu H, Zhang H, et al. The TGF-β signaling pathway induced EMT in breast cancer[J]. Acta Pharm Sin (药学学报), 2015, 50: 385–392. |
| [3] | Qiu SP, Li HL, Shi HL, et al. Notoginsenoside Ft1 downregulates HIF-1α, inhibits cell proliferation, decreases migration and promotes apoptosis in breast cancer cells[J]. Acta Pharm Sin (药学学报), 2016, 51: 1091–1097. |
| [4] | Davis ME, Chen Z, Shin DM. Nanoparticle therapeutics:an emerging treatment modality for cancer[J]. Nat Rev Drug Discov, 2008, 7: 771–782. DOI:10.1038/nrd2614 |
| [5] | Engler AJ, Sen S, Sweeney HL, et al. Matrix elasticity directs stem cell lineage specification[J]. Cell, 2006, 126: 677–689. DOI:10.1016/j.cell.2006.06.044 |
| [6] | Zhang YH, Zhao CQ, Jiang LS, et al. Substrate stiffness regulates apoptosis and the mRNA expression of extracellular matrix regulatory genes in the rat annular cells[J]. Matrix Biol, 2011, 30: 135–144. DOI:10.1016/j.matbio.2010.10.008 |
| [7] | Chen WC, Lin HH, Tang MJ. Regulation of proximal tubular cell differentiation and proliferation in primary culture by matrix stiffness and ECM components[J]. Am J Physiol Renal Physiol, 2014, 307: F695–F707. DOI:10.1152/ajprenal.00684.2013 |
| [8] | Kemp JA, Shim MS, Heo CY, et al. "Combo" nanomedicine:co-delivery of multi-modal therapeutics for efficient, targeted, and safe cancer therapy[J]. Adv Drug Deliv Rev, 2016, 98: 3–18. DOI:10.1016/j.addr.2015.10.019 |
| [9] | Li Y, Xiao K, Zhu W, et al. Stimuli-responsive cross-linked micelles for on-demand drug delivery against cancers[J]. Adv Drug Deliv Rev, 2014, 66: 58–73. DOI:10.1016/j.addr.2013.09.008 |
| [10] | Gao HL, Jiang XG. The progress of novel drug delivery systems[J]. Acta Pharm Sin (药学学报), 2016, 51: 272–280. |
| [11] | Huang C, Butler PJ, Tong S, et al. Substrate stiffness regulates cellular uptake of nanoparticles[J]. Nano Lett, 2013, 13: 1611–1615. DOI:10.1021/nl400033h |
| [12] | da Cunha CB, Klumpers DD, Koshy ST, et al. CD44 alternative splicing in gastric cancer cells is regulated by culture dimensionality and matrix stiffness[J]. Biomaterials, 2016, 98: 152–162. DOI:10.1016/j.biomaterials.2016.04.016 |
| [13] | Gaudet C, Marganski WA, Kim S, et al. Influence of type Ⅰ collagen surface density on fibroblast spreading, motility, and contractility[J]. Biophy J, 2003, 85: 3329–3335. DOI:10.1016/S0006-3495(03)74752-3 |
| [14] | Bhana B, Iyer RK, Chen WL, et al. Influence of substrate stiffness on the phenotype of heart cells[J]. Biotechnol Bioengineer, 2010, 105: 1148–1160. |
| [15] | Discher DE, Janmey P, Wang YL. Tissue cells feel and respond to the stiffness of their substrate[J]. Science, 2005, 310: 1139–1143. DOI:10.1126/science.1116995 |
| [16] | Yeung T, Georges PC, Flanagan LA, et al. Effects of substrate stiffness on cell morphology, cytoskeletal structure, and adhesion[J]. Cell Motil Cytoskel, 2005, 60: 24–34. DOI:10.1002/(ISSN)1097-0169 |
| [17] | Weaver VM, Howlett AR, Langtonwebster B, et al. The development of a functionally relevant cell-culture model of progressive human breast-cancer[J]. Semi Cancer Biol, 1995, 6: 175–184. DOI:10.1006/scbi.1995.0021 |
| [18] | Hickman JA, Graeser R, de Hoogt R, et al. Three-dimensional models of cancer for pharmacology and cancer cell biology:capturing tumor complexity in vitro/ex vivo[J]. Biotechnol J, 2014, 9: 1115–1128. DOI:10.1002/biot.201300492 |
| [19] | Kim JB, Stein R, O'Hare MJ. Three-dimensional in vitro tissue culture models of breast cancer -a review[J]. Breast Cancer Res Treatment, 2004, 85: 281–291. DOI:10.1023/B:BREA.0000025418.88785.2b |
| [20] | Chen L, Xiao Z, Meng Y, et al. The enhancement of cancer stem cell properties of MCF-7 cells in 3D collagen scaffolds for modeling of cancer and anti-cancer drugs[J]. Biomaterials, 2012, 33: 1437–1444. DOI:10.1016/j.biomaterials.2011.10.056 |
| [21] | Booth BW, Park JP, Burg KJL. Evaluation of normal and metastatic mammary cells grown in different biomaterial matrices:establishing potential tissue test systems[J]. J Biomater Sci Polym Ed, 2013, 24: 758–768. DOI:10.1080/09205063.2012.708189 |
| [22] | Samani A, Zubovits J, Plewes D. Elastic moduli of normal and pathological human breast tissues:an inversion-techniquebased investigation of 169 samples[J]. Physics Med Biol, 2007, 52: 1565–1576. DOI:10.1088/0031-9155/52/6/002 |
| [23] | Cassereau L, Miroshnikova YA, Ou G, et al. A 3D tension bioreactor platform to study the interplay between ECM stiffness and tumor phenotype[J]. J Biotechnol, 2015, 193: 66–69. DOI:10.1016/j.jbiotec.2014.11.008 |
| [24] | Rijal G, Li W. 3D scaffolds in breast cancer research[J]. Biomaterials, 2016, 81: 135–156. DOI:10.1016/j.biomaterials.2015.12.016 |
| [25] | Wei SC, Fattet L, Tsai JH, et al. Matrix stiffness drives epithelial mesenchymal transition and tumour metastasis through a TWIST1-G3BP2 mechanotransduction pathway[J]. Nat Cell Biol, 2015, 17: 678–688. DOI:10.1038/ncb3157 |
| [26] | Sung KE, Su X, Berthier E, et al. Understanding the impact of 2D and 3D fibroblast cultures on in vitro breast cancer models[J]. PLoS One, 2013, 8: e76373. DOI:10.1371/journal.pone.0076373 |
| [27] | Bradley M, Alexander L, Sanchez-Martin RM. Cellular uptake of fluorescent labelled biotin-streptavidin microspheres[J]. J Fluoresce, 2008, 18: 733–739. DOI:10.1007/s10895-008-0334-1 |
| [28] | Nie W, Wang Y, Zhang H, et al. Preparation and performance of polystyrene fluorescent microspheres[J]. J Shenyang Pharm Uni (沈阳药科大学学报), 2013, 30: 329–334, 341. |
| [29] | Cao X, Zhou X, Wang Y, et al. Diblock-and triblockcopolymer based mixed micelles with high tumor penetration in vitro and in vivo[J]. J Mater Chem B, 2016, 4: 3216–3224. DOI:10.1039/C6TB00508J |
 2017, Vol. 52
2017, Vol. 52


