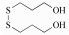
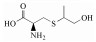
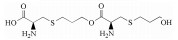
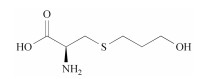
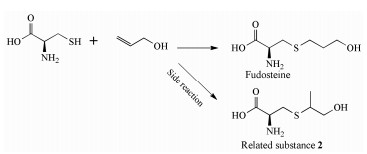
福多司坦[S-(3-羟基丙基)-L-半胱氨酸, 图 1]是一种祛痰药, 属于半胱氨酸衍生物, 基本作用是杯状细胞增生抑制作用及对呼吸道的黏液、黏膜正常状态的调节作用[1]。福多司坦原料药的合成方法有两种, 均以L-半胱氨酸为起始原料, 分别与3-卤代-1-丙醇(方法1)[2]或丙烯醇(方法2, 图 2)[3]反应制备。目前福多司坦及其制剂的质量标准仅收载于日本药典[4]中, 其中包括L-胱氨酸和有关物质检查项, 有关物质项下并未列出特殊杂质。国内市售制剂包括片剂与胶囊剂, 国内文献[5-7]均采用传统C18色谱柱对福多司坦制剂进行有关物质检查, 但未见系统鉴定研究报告。国外文献[8]采用特殊键合的C18柱, 对方法1制备的福多司坦原料药中4种工艺杂质和2种降解产物做了结构鉴定。由于福多司坦极性较大, 不利于在反相色谱上保留, 药典和文献报道的液相方法均采用100%纯水相[4, 5, 8]或90%以上离子对试剂[6, 7]作为流动相。亲水作用色谱法(HILIC)是一种适用于极性化合物分析的方法, 在高比例有机相的情况下可以对极性化合物有较好的保留, 并且可以直接与质谱检测器联用。由于福多司坦可能存在反相色谱法难以分离的极性杂质, 本研究采用亲水作用色谱-四级杆串联飞行时间质谱(HILIC-Q-TOF)法, 对方法2制备的福多司坦原料药的有关物质做了研究, 共分离出6个有关物质(1个工艺杂质与5个强制降解杂质), 并对其中5个做了鉴定, 有3个尚未见文献报道, 可为福多司坦的生产工艺和质量控制提供参考依据。
|
Figure 1 Chemical structure of fudosteine |
|
Figure 2 Fudosteine synthesis technology |
仪器 LC-20AD高效液相色谱仪(日本岛津公司); 1290 Infinity液相色谱-6538Q TOF四级杆飞行时间质谱仪(美国安捷伦公司)。
试药与试剂 福多司坦原料药(批号140613-1) 由企业A提供, 乙腈为色谱纯, 乙酸铵、盐酸、氢氧化钠、30%双氧水均为分析纯, 自制纯化水。
色谱条件 采用Waters Xbridge HILIC色谱柱(250 mm × 4.6 mm, 5 μm), 以乙腈-20 mmol·L-1乙酸铵(89:11) 为流动相等度洗脱, 流速1.5 mL·min-1, 柱温35 ℃, 检测波长为210 nm, 进样20 μL。
质谱条件 电喷雾正离子化, 喷雾电压4 kV, 雾化气压力35 psi (1 psi ≈ 6.9 kPa), 干燥气流量10 L·min-1, 去溶剂温度350 ℃, 碎片电压75 V。质量数扫描范围m/z 100~500。
供试品溶液 取福多司坦原料药约10 mg, 精密称定, 置20 mL量瓶中, 加流动相适量溶解并稀释至刻度, 摇匀, 作为供试品溶液。
强制降解实验溶液 取福多司坦原料药约10 mg, 分别经1 mol·L-1盐酸溶液(或1 mol·L-1氢氧化钠溶液) 0.1 mL 80 ℃水浴2 h, 酸碱中和后用流动相稀释至20 mL, 作为酸碱破坏溶液。另取福多司坦原料药约10 mg, 加30%双氧水0.1 mL溶解, 用流动相稀释至20 mL, 室温下放置12 h, 作为氧化破坏溶液。取福多司坦原料药粉末, 置105 ℃烘箱24 h或置强光下照射24 h后, 加流动相溶解并稀释制成0.5 mg·mL-1的溶液, 作为高温破坏或光照破坏溶液。同时进行空白溶剂实验。
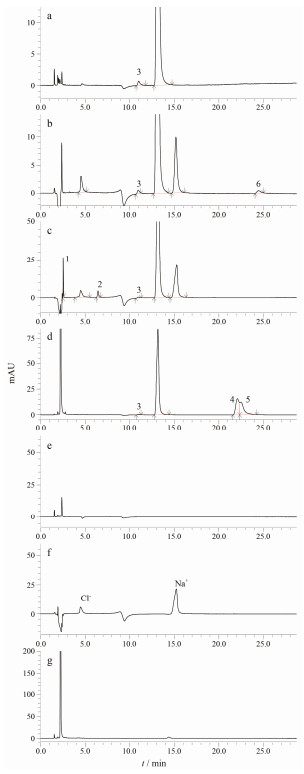
结果 1 有关物质检查采用上述方法对于福多司坦原料药(图 3a)进行有关物质分析, 发现1个主要有关物质(有关物质3), 采用面积归一化法计算含量约为0.7%。强制降解实验结果表明, 本品在强酸(图 3b)、强碱(图 3c)和氧化(图 3d)条件下分别产生1个(有关物质6)、2个(有关物质1和2)和2个(有关物质4和5)强制降解产物, 对应空白实验结果见图 3e、3f和3g。在高温和光照破坏后未检测到杂质生成。
|
Figure 3 HPLC-UV chromatograms of the related substances in fudosteine from stress tests. a: Normal; b: Acid; c: Base; d: Oxidation; e: Blank solvent; f: NaCl + blank solvent; g: H2O2 + blank solvent |
采用HPLC-Q/TOF做一级与二级质谱分析, 测得各有关物质母离子与子离子的准确分子质量并推测离子组成, 通过与福多司坦裂解规律对照, 鉴定了除有关物质2外其他有关物质结构, 结果见表 1。有关物质2未扫描到[M+H]+离子, 可能其结构不利于离子化。一级与二级质谱中推测离子式理论质量与测得质量偏差均分别小于5 ppm与15 ppm。
| Table 1 Related substances identified in fudosteine by HPLC-Q/TOF |
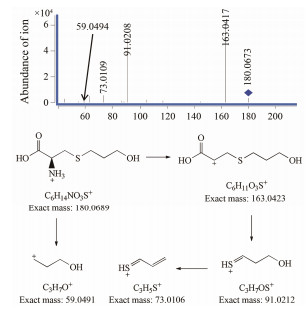
ESI+-TOF测得福多司坦[M+H]+的准确相对分子质量为180.068 9, 与离子式C6H14NO3S+相应。其[M+H]+离子主要碎片m/z 163、91、73和59, 与福多司坦的结构相应。m/z 163为福多司坦中性丢失一个氨分子产生, 之后靠羧基侧碳硫键断裂形成m/z 91离子, 接着中性丢失一个水分子形成m/z 73。m/z 59为正丙醇离子。福多司坦的二级质谱分析对于解析其有关物质具有参考意义。福多司坦二级质谱图与可能的裂解途径见图 4。
|
Figure 4 MS/MS spectra of fudosteine [M+H]+ (m/z 180) ion and its fragmentation pathways |
ESI+-TOF测得有关物质1的[M+H]+的准确相对分子质量为183.050 1, 与离子式C6H15O2S2+相应, 该离子式与福多司坦差异较大, 推断并非一步反应产物。在福多司坦二级质谱中m/z 91对应离子式为C3H7OS+, 恰为有关物质1分子组成的一半, 推断其为福多司坦在碱性条件下碳硫键断裂后重新组合生成二硫键后的产物。其[M+H]+离子主要碎片包括m/z 165、147、107和73。m/z 165和147为[M+H]+连续脱去水分子后的产物。m/z 165脱去一分子丙烯醇产生m/z 107。m/z 73在福多司坦二级质谱中也存在。结合文献报道[9], 推测有关物质1的生成机制为:在碱性条件下氢氧根攻击羰基的α氢, 引起碳硫键断裂产生巯基负离子, 在氧气作用下巯基负离子氧化成自由基, 之后自由基对接生成二硫化物。有关物质1的二级质谱图与可能的裂解途径见图 5, 可能的生成机制见图 6。
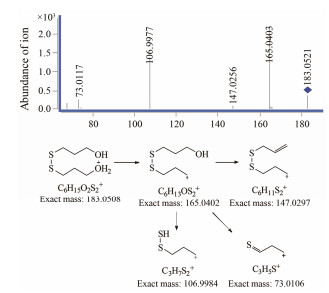
|
Figure 5 MS/MS spectra of related substance 1 [M+H]+ (m/z 183) ion and its fragmentation pathways |
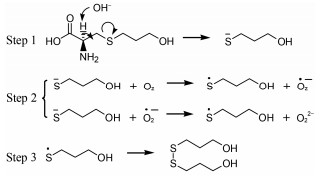
|
Figure 6 Proposed formation mechanism of related substance 1 |
ESI+-TOF测得有关物质3的[M+H]+的准确相对分子质量为180.068 4, 与离子式C6H14NO3S+相应, 元素组成与福多司坦相同。有关物质2在未破坏的原料药中即存在, 其含量在强制降解实验中没有增加, 故推断是福多司坦合成过程中的副反应产物。其[M+H]+离子主要碎片包括m/z 163、105、87和59, 与福多司坦碎片差异较大。m/z 59在福多司坦二级质谱中也存在, 对应正丙醇基团, 但离子强度极弱, 而在有关物质3二级质谱图中, m/z 59为主要碎片之一, 说明在有关物质3结构中更容易丢失该基团。结合合成工艺[3]与文献[10]报道, 推断有关物质3是福多司坦合成过程中半胱氨酸巯基与丙烯醇2位碳对接的产物, 与福多司坦结构中的正丙醇部分相比, 异丙醇结构更易在质谱中形成较稳定的仲碳正离子。m/z 163为有关物质3中性丢失一个氨分子产生, 之后连续丢失异丙醇基团和水分子, 形成m/z 105和87。有关物质3二级质谱图与可能的裂解途径见图 7, 可能的反应式见图 2。
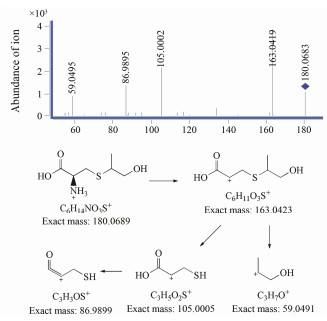
|
Figure 7 MS/MS spectra of related substance 3 [M+H]+ (m/z 180) ion and its fragmentation pathways |
ESI+-TOF测得[M+H]+离子的准确相对分子质量分别为196.063 2和196.063 1, 均与离子式C6H14NO4S+相应, 元素组成比福多司坦多一个氧原子, 与文献[7]报道的氧化产物相同, 为福多司坦结构中的硫醚氧化为亚砜后的产物。有关物质4和5的二级质谱也相同, 主要碎片离子均为m/z 109、91和88。[M+H]+离子靠羧基侧碳硫键断裂产生m/z 109和88, m/z 91为m/z 109的脱水产物。推测有关物质4和5为氧硫键方向不同产生的非对映异构体, 相似的非对映异构氧化产物在羧甲司坦中也有发现[11]。有关物质4和5二级质谱图与可能的裂解途径见图 8。
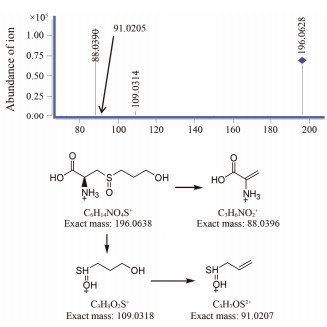
|
Figure 8 MS/MS spectra of related substance 4 and 5 [M+H]+(m/z 196) ion and its fragmentation pathways |
ESI+-TOF测得[M+H]+离子的准确相对分子质量为341.120 2, 与离子式C12H25N2O5S2+相应, 元素组成比两个福多司坦分子之和少一个水分子。推测酸破坏杂质是福多司坦分子间脱水缩合产物, 由于福多司坦同时含有羧基、羟基和氨基, 可能的缩合产物有酯、酰胺和酸酐。二级质谱主要有m/z 324、307、296、234、192、163、117和88的碎片离子。m/z 324和307与母离子连续脱去两个氨分子相应, 表明两个氨基未发生酰胺化反应。m/z 88离子强度很高, 在氧化产物中同样存在, 为2-氨基丙烯酸结构, 表明至少有1个羧基未参与脱水缩合, 因此不太可能是酸酐结构。所以, 有关物质5最有可能为福多司坦分子间的酯化产物, 在酸性条件下羟基与羧基发生酯化反应是一种常见的化学反应。m/z 296和234分别为m/z 324重排丢失CO和碳硫键断裂产物。m/z 192为m/z 341碳氧键断裂产物。m/z 163和117为福多司坦基本结构单元。有关物质6二级质谱图与可能的裂解途径见图 9。
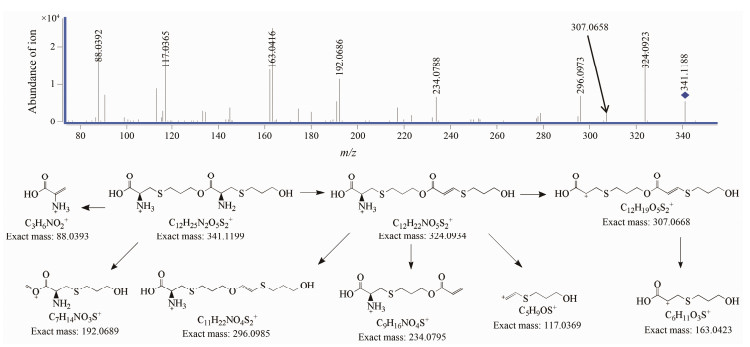
|
Figure 9 MS/MS spectra of related substance6 [M+H]+ (m/z 341) ion and its fragmentation pathways |
本研究采用HILIC色谱柱, 建立了一个亲水作用色谱液质联用方法。流动相采用亲水作用色谱法常用的乙腈-乙酸铵体系。乙腈比例为影响分离的关键因素, 比例越高, 保留越强, 越有利于改善分离。在水相中加入适量的乙酸铵有助于改善峰形, 提高分离度。通过一系列条件摸索, 确定了流动相采用乙腈-20 mmol·L-1乙酸铵溶液(89:11) 等度洗脱, 除氧化产物未能完全分离外, 福多司坦与其他杂质均能有效分离。与反相色谱相比, 化合物在亲水作用色谱条件下出峰顺序, 分离效果均有较大不同。如福多司坦氧化产物在反相色谱中保留极弱, 只有一个色谱峰[8], 而在亲水作用色谱条件下保留较强, 且可以检测到两个色谱峰。因此, 在强极性药物研究中, 亲水作用色谱法可以与反相色谱法相配合, 对杂质谱做更全面的解析。
本研究检出福多司坦原料药中6个主要杂质(1个工艺杂质和5个强制降解产物), 并对其中5个做了结构鉴定。根据杂质来源可分为2类, 即工艺杂质和降解产物。有关物质3为合成过程中加成反应副产物。有关物质1和2为碱破坏产物, 有关物质1为碱水解后二聚重排产物; 有关物质4和5为硫醚氧化为亚砜的产物, 互为非对映异构体; 有关物质6为酸性条件下酯化反应形成的福多司坦二聚物。有关物质1、3和6尚未见文献报道。
| [1] | Takahashi K, Kai H, Mizuno H, et al. Effect of fudosteine, a new cysteine derivative, on mucociliary transport[J]. J Pharm Pharmacol, 2001, 53: 911–914. DOI:10.1211/0022357011776090 |
| [2] | Itoh Y, Mizuno H, Kiyohara C, et al. Expectorant comprising hydroxyalkylcysteine derivative:US, 5047428 A[P]. 1991. |
| [3] | Itoh Y, Kuriyama T, Ogawa M. Production of S-hydroxypropylL-cysteine:JP, 8119932[P]. 1996. |
| [4] | Japanese Pharmacopoeia Commission. The Japanese Pharmacopoeia[S]. 17ed. Tokyo:Ministry of Health and Welfare Press, 2016:968-969. |
| [5] | Xu Q, Liu J, Wang Y, et al. Study on development and validation of an HPLC method for determination of content and related substances of fuduositan oral solution and its stability[J]. Chin J Pharm Anal (药物分析杂志), 2006, 26: 1457–1460. |
| [6] | Hu SG. Determination of related substance in fudosteine capsules by HPLC[J]. China Pract Med (中国实用医药), 2007, 2: 26–27. |
| [7] | Su P. Determination of fudosteine oral liquid and related substances by HPLC[J]. China Pharm (中国药师), 2010, 13: 824–826. |
| [8] | Gupta PB, Rao BV, Sanasi PD, et al. Identification, isolation and characterization of process and degradation impurities of fudosteine and its stability indicating HPLC method validation[J]. Int J Adv Res, 2016, 4: 453–461. DOI:10.21474/IJAR01 |
| [9] | Wallace TJ, Schriesheim A, Bartok W. The base-catalyzed oxidation of mercaptans. Ⅲ. Role of the solvent and effect of mercaptan structure on the rate determining step1, 2[J]. J Org Chem, 1963, 28: 1311–1314. DOI:10.1021/jo01040a038 |
| [10] | Ware T, Jennings AR, Bassampour ZS, et al. Degradable, silyl ether thiol-ene networks[J]. RSC Adv, 2014, 4: 39991–40002. DOI:10.1039/C4RA06997H |
| [11] | Wahl O, Holzgrabe U. Impurity profiling of carbocisteine by HPLC-CAD, qNMR and UV/vis spectroscopy[J]. J Pharm Biomed Anal, 2014, 95: 1–10. |
 2017, Vol. 52
2017, Vol. 52