2. 河南大学护理学院, 河南 开封 475004;
3. 河南大学第一附属医院, 河南 开封 475004
2. Nursing College, Henan University, Kaifeng 475004, China;
3. First Affiliated Hospital, Henan University, Kaifeng 475004, China
越来越多的证据表明, 肿瘤化疗或放疗后复发的主要原因是肿瘤组织内含有数量不一的肿瘤干细胞(cancer stem cells, CSCs)[1]。与普通的肿瘤细胞相比, 肿瘤干细胞呈现出增殖速度减慢, 药物外排能力增强, 耐药和侵袭能力增加等特征[2]。肝癌是人类常见恶性肿瘤, 已经发现肝癌组织内也有少量的肿瘤干细胞[3]。在肝癌组织内, 肿瘤干细胞受肿瘤微环境的影响, 未分化的肿瘤干细胞与已分化的普通肿瘤细胞之间存在相互转换现象, 包括“干性”(stemness)获得与失去的过程[4]。然而具体是其中哪些化学或细胞因子调控肿瘤干细胞的这种可塑性, 目前还不清楚[5]。肝癌组织内部是一个缺氧酸性环境, 内含有较高浓度的一氧化氮和亚硝酸盐[6]。亚硝酸盐在酸性环境下可以还原为一氧化氮, 一氧化氮可以促进肿瘤干细胞数量增加和干细胞表征增强[7]。亚硝酸盐本身在细胞上作用的靶点主要是线粒体呼吸链复合物, 通过与氧气竞争性结合位点, 造成细胞内缺氧, 进而促使细胞缺氧因子累积, 诱导细胞发生上皮间质转化(epithelial-mesenchymal transition, EMT), 而EMT可以诱导已分化的肿瘤细胞转化为肿瘤干细胞[8]。课题组前期发现, 亚硝酸盐有诱导肝癌细胞发生EMT, 促进增殖和侵袭作用[9], 外源性给予亚硝酸盐会导致小鼠肝癌组织内部亚硝酸盐蓄积, 促进癌细胞肺转移[10]。综合文献和课题组前期发现, 作者推测亚硝酸盐有可能直接参与肝癌干细胞数量的调控和“干性”的调节。
鉴定肿瘤干细胞的方法主要有流式细胞术检测边缘群, 半悬浮培养观察细胞球形成以及检测干细胞标志物等[11]。为此, 本研究用半悬浮培养法获取的人肝癌SMMC-7721细胞球作为球形成细胞, 常规培养的细胞为亲本细胞, 观测了亚硝酸盐处理后这两种细胞群体中具有干细胞特征的细胞数量变化以及干细胞表型的变化, 以探讨亚硝酸盐对人肝癌肿瘤干细胞的调控作用。
材料与方法 材料和主要仪器人肝癌SMMC-7721细胞株购自中国医学科学院基础医学研究所, 生长在含10%胎牛血清(FBS)、1%青链霉素的DMEM高糖培养基中, 5% CO2、37 ℃恒温培养箱中培养。亚硝酸钠(sodium nitrite, SN)购自天津市晨福化学试剂厂(分析纯); DMEM高糖培养基、DMEM/F12培养基购自Gibco公司; FBS、青链霉素混合液、结晶紫染料购自杭州四季青生物公司; 二甲基亚砜(DMSO)、噻唑兰3-(4, 5-dimethyl-2-thiazolyl)-2, 5-diphenyl-2-H-tetrazolium bromide, MTT)、顺铂(cisplatin)、人重组表皮生长因子(EGF)、人重组碱性成纤维生长因子(bFGF)、B27、活性氧检测试剂盒购自Sigma公司; Transwell小室购自BD公司; CD90兔抗人单克隆抗体、EpCAM兔抗人单克隆抗体、CD133兔抗人单克隆抗体、兔抗人HIF-1α (hypoxia inducible factor-1α)、β-actin单克隆抗体、ECL Western blot化学发光检测试剂盒及二抗购自Abcam公司; 超低吸附6孔板购自美国Corning公司; NovoCyte流式细胞仪(ACEA, 美国); BCA蛋白质定量试剂盒(北京康为世纪公司); DYY-7C型电泳仪、WD-9413B凝胶成像分析仪(北京市六一仪器厂)。
球形成细胞获取及传代将肝癌SMMC-7721细胞在含10% FBS、1%青链霉素的DMEM高糖培养基中培养, 置于37 ℃、5% CO2恒温培养箱中。待细胞长满瓶底面积80%时, 换DMEM/F12无血清培养基(含1%青链霉素、20 ng·mL-1 EGF、10 ng·mL-1 bEGF、2% B27), 消化并吹打成单个细胞, 收集细胞悬液, 1 000 r·min-1离心5 min, 再以DMEM/F12无血清培养重悬。调整细胞浓度为每毫升1×104个接种于超低吸附6孔板, 每孔接种5 000个细胞, 再加入DMEM/F12无血清培养基2 mL, 将6孔板置于37 ℃、5% CO2恒温培养箱中培养。隔天换液, 观察细胞悬浮生长状态, 每天拍照记录细胞球形成的情况。培养1周后, 细胞球直径达50 μm时收集细胞悬液, 加入0.25%胰蛋白酶消化细胞球, 吹打分散成单个细胞, DMEM高糖培养基重悬细胞, 得到的细胞为球形成细胞。常规培养的细胞作为亲本细胞。
细胞周期检测调整细胞浓度为每毫升1×104个, 分4组:亲本细胞和球形成细胞对照组加入DMEM普通培养基, 亲本细胞和球形成细胞处理组培养基中加入浓度为150 μmol·L-1 NaNO2。细胞置于37 ℃、5% CO2恒温培养箱中培养。隔天换液, 6天后收集细胞, 75%乙醇固定4 h以上, 离心, 吸弃固定液, 加入含RNA酶的碘化丙啶(PI)溶液, 4 ℃避光孵育30 min, 流式细胞术检测细胞周期。
体外克隆形成实验细胞处理和分组同上。调整细胞浓度为每毫升1×104个接种于普通6孔板中, 每孔的总体积均为2 mL。将6孔板置于37 ℃、5% CO2恒温培养箱中培养。隔天换液, 每天观察细胞克隆的生长情况, 1周后, 弃培养液, 4%多聚甲醛固定30 min, PBS漂洗2次, 每孔加入结晶紫染料1 mL, 染色15 min, 随机选取3个视野, 计数每个视野下细胞数大于50的克隆形成数, 并拍照记录。
细胞球形成实验细胞分组和处理同上。制成单细胞悬液, DMEM/F12无血清培养基重悬细胞, 调整细胞浓度为每毫升1×104个, 接种于超低吸附6孔板中, 每孔的DMEM/F12无血清培养基和细胞悬液的总体积均为2 mL。将6孔板置于37 ℃、5% CO2恒温培养箱中培养。隔天换液, 每天观察各组细胞球形成情况, 1周后在倒置显微镜下观察, 随机选取3个视野, 计数细胞球直径大于50 μm的细胞数, 并拍照记录。
流式细胞术检测各组细胞肿瘤干细胞表面标志物待各组细胞生长至对数期时, PBS漂洗2遍, 0.25%胰蛋白酶消化细胞, 制成细胞浓度为每毫升1×104个的单细胞悬液, 用PBS缓冲液重悬细胞。按照说明书每组分别加入1:1 000、1:1 500、1:1 000的CD90、CD133、EpCAM流式抗体各1 mL, 充分混匀后常温孵育30 min, 流式细胞仪检测肿瘤干细胞标志物的表达量。
Western blot检测肿瘤干细胞表面标志物的表达消化收获各种处理的细胞, 用RIPA 200 μL充分裂解提取蛋白, BCA蛋白定量试剂盒进行蛋白定量, 均衡每组蛋白浓度后, 以12% SDS-PAGE凝胶电泳分离。转移蛋白至PVDF膜, 5%脱脂奶粉封闭过夜, 分别加入CD133 (1:2 000)、CD90 (1:1 500)、EpCAM (1:2 000) 一抗于4 ℃封闭袋中孵育过夜, 二抗孵育1 h。化学发光法显示结果, 压片曝光。凝胶图像分析系统拍照, 采用IPP软件对目的条带进行灰度分析。实验重复3次。
Transwell侵袭实验细胞分组和处理同上。当细胞生长到对数生长期, 消化收获细胞, 用无血清DMEM培养基洗3次, 各组分别接种1×105个细胞于已行matrigel包被的transwell小室中, 滤膜微孔直径为8 μm, 小室内的培养基为无血清的DMEM, 亲本细胞处理组和球形成细胞处理组加入相应剂量的亚硝酸钠, 体积200 μL, 然后于小室外即24孔板的孔内加入800 μL含10% FBS的DMEM培养基, 以提供细胞侵袭运动的趋化因子。每组3个复孔, 培养24 h后自24孔板中取出transwell小室, PBS轻轻冲洗3次, 用自备小棉签小心擦净小室底部微孔滤膜上层的细胞, 然后将小室置于甲醇固定液中放置10 min, 取出小室放于结晶紫中染色5 min; 沿小室底部边缘剪下滤膜, 显微镜下观察穿过matrigel及微孔至滤膜反面的细胞, 实验重复3次, 于200倍光学显微镜下计数5个视野的细胞, 取平均值。
MTT法检测各组耐药性实验收集各组生长至对数期的细胞并消化, 制成细胞浓度为每毫升1×104个接种于96孔板, 每孔加入培养基200 μL, 每组5个复孔, 重复6次, 并设置调零孔。各组在恒温培养箱中培养24 h后, 依次加入0、0.625、1.25、2.5、5和10 mg·L-1质量浓度梯度的顺铂, 继续培养24 h后, 每孔加入5 g·L-1 MTT 20 μL培养4 h后, 吸去培养液, 每孔加入150 μL DMSO于振荡器上振摇, 待紫色晶体完全溶解后, 在酶标仪上测定570 nm处的吸光度值(A值)。以含有等体积的培养液和DMSO的无细胞孔测得的吸光度值为空白对照。
移植瘤实验BALB/c裸鼠[合格证号SCXK (豫) 2010-0002] 5只, 由河南省实验动物中心提供, 裸鼠全部为雄性, 日龄28~35天, 体重18~22 g, 常规裸鼠饲养。动物实验得到河南大学医学院医学伦理委员会批准。收集球形成细胞, 计数, 调整细胞悬液浓度为每毫升1×105个。将球形成细胞分2组, 亚硝酸盐处理组用150 μmol·L-1 NaNO2孵育24 h, 对照组加等体积的培养液。每组取0.1 mL分别接种于同一只裸鼠左或右侧腋窝皮下, 每天观察小鼠一般情况, 隔日测量一次移植瘤体积。饲养至21天, 处死动物, 完整取出移植瘤称重, 立即行冰冻切片。同时计数肺表面白色的转移灶。
移植瘤冰冻切片检测活性氧(ROS)实验结束时取出移植瘤, 冰冻切片, 按试剂盒说明书对示踪剂DCFH-DA进行处理, 使用488 nm激发波长, 525 nm发射波长, 在DM2500徕卡荧光显微镜下拍照。
移植瘤组织免疫荧光法检测HIF-1α实验结束时取出移植瘤, 冰冻切片, 冷丙酮固定6 min, 自然干燥。3% H2O2室温孵育15 min, 10% BSA 4 ℃封闭过夜, PBS冲洗3次, 每张盖玻片加100 μL兔抗人HIF-1α工作液, 4 ℃过夜孵育, PBS洗3次, 加Alexa 594标记的山羊抗兔IgG二抗, DAPI复染, 37 ℃孵育30 min, PBS洗3次, 自来水冲洗, 自然干燥, 硅油封片, DM2500徕卡荧光显微镜下拍照。用Image-pro plus图像分析软件分析荧光强度。
统计学分析数据均采用均数±标准差(x±s)表示, 应用SPSS 13.0软件包处理, 正态分析和方差齐性检验后, 进行单因素方差分析处理组与对照组的差别, 处理组之间两两比较采用行×列表的卡方检验。P<0.05被认为统计学具有显著性。
结果 1 肝癌SMMC-7721细胞能够在无血清培养基中悬浮培养形成细胞球以无血清条件培养基于超低黏附6孔板中悬浮培养肝癌SMMC-7721细胞, 结果显示部分细胞随培养时间的延长开始克隆生长, 逐渐形成立体、悬浮生长的细胞球, 体积逐渐增大, 而未成球的细胞则逐渐凋亡; 当多个细胞球距离较近时会融合成更大的细胞球, 1周后细胞球体积达到最大, 以后不再增长(图 1)。
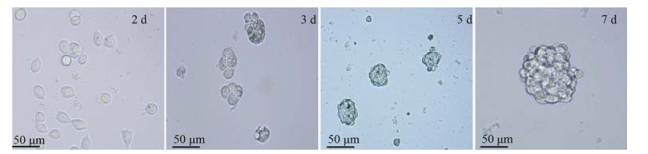
|
Figure 1 Induction of sphere cells from SMMC-7721 cell lines (magnification, 40×). Tumor sphere culture was performed in ultra-low attachment dishes for different times. Dark dots represent dead differentiated cells. Survived cancer stem cells have formed clusters named spheres. Formation of spheres was observed from day 3 to 7; the sphere size increased during this period |
肿瘤干细胞的一个显著特征就是多处于静止状态, 生长缓慢。图 2结果显示, 球形成细胞处于G0/G1期细胞明显多于亲本细胞。与未处理组相比, 经亚硝酸钠处理后, 无论是亲本细胞还是球形成细胞被阻滞于G0/G1期的细胞数明显增多, S期细胞减少, 而处于细胞分裂期的G2/M期则明显减少。与亲本细胞相比, 亚硝酸钠对球形成细胞G0/G1期的阻滞作用明显增强。在亚硝酸盐作用下, 球形成细胞G0/G1期的阻滞比未处理的球形成细胞增强。
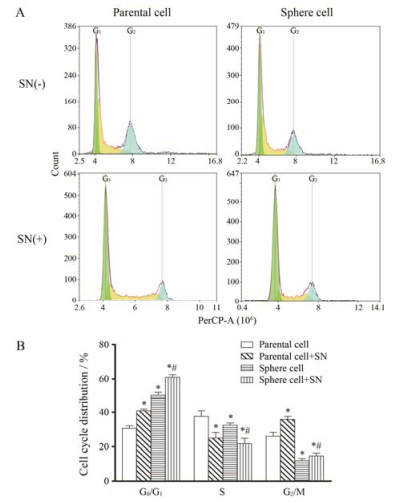
|
Figure 2 Effects of sodium nitrite (SN) on distribution of cell cycle in SMMC-7721 parental and sphere cells. A: The cells stained with propidium iodide were subjected to flow cytometric analysis to determine the cell distributions at each phase of the cell cycle; B: The quantified results of flow cytometry analysis showed that treatment with SN (150 μmol·L-1, 24 h) resulted in parental and sphere cells arrest in G0/G1 phase, compared with the parent cells, the proportion of G0/G1 phase cells were increased approximately 1.5 folds in sphere cells, while the G2/M phase proportion was significantly decreased. n = 3, x±s. *P < 0.05 vs parental cell group; #P < 0.05 vs sphere cell group |
细胞体外细胞克隆形成能力和球形成能力是判断细胞自我更新能力常用的指标。体外细胞克隆形成实验结果如图 3A和B所示, 球形成细胞的克隆形成个数高于亲本细胞; 与未处理的亲本细胞或球形成细胞相比, 经过亚硝酸钠处理后, 各组克隆形成个数显著提高; 同样, 亚硝酸钠处理后球形成细胞克隆形成个数显著高于亲本细胞。在亚硝酸盐作用下, 球形成细胞克隆形成个数比未处理的球形成细胞增多。说明亚硝酸钠能够增加SMMC-7721细胞的克隆形成个数, 增强肝癌干细胞克隆形成能力。球形成实验结果如图 3C和D所示, 球形成细胞的球形成个数高于亲本细胞; 与未处理的亲本细胞或球形成细胞相比, 经过亚硝酸钠处理后, 各组球形成个数显著提高; 同样, 亚硝酸钠处理后球形成细胞球形成个数显著高于亲本细胞。在亚硝酸盐作用下, 球形成细胞球形成个数比未处理的球形成细胞增多。结果提示, 亚硝酸钠能显著增强肝癌SMMC-7721细胞的球形成能力。亚硝酸钠对球形成细胞成球的促进作用明显大于亲本细胞, 提示球形成细胞可能富集了更多的肝癌干细胞。
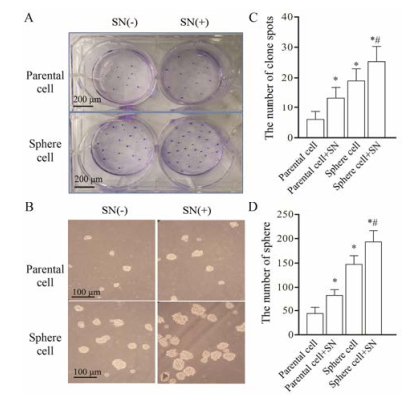
|
Figure 3 SN enhanced tumor the self-renewal capacity of SMMC-7721 parental and sphere cells. A: The numbers of colonies were counted after staining with crystal violet; B: The spheres were imaged under a light microscope (magnification, 100×); C: The histogram indicated the number of colonies; D: The quantified tumor spheres numbers of B. n = 3, x±s. *P < 0.05 vs parental cell group; #P < 0.05 vs sphere cell group |
图 4流式细胞术检测结果显示, 球形成细胞组CD133、CD90和EpCAM表达量明显高于亲本细胞; 与未处理的亲本细胞或球形成细胞组相比, 亚硝酸钠处理后明显增强各组CD133、CD90和EpCAM的表达量; 同样, 在亚硝酸钠处理后, 与亲本细胞组相比, 球形成细胞组CD133、CD90和EpCAM表达量增加更为明显。在亚硝酸盐作用下, 球形成细胞标志物表达水平比未处理的球形成细胞升高。
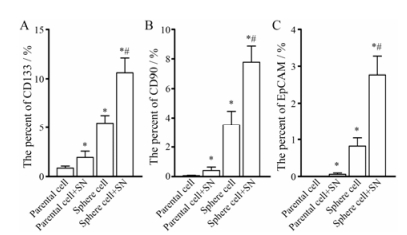
|
Figure 4 Figure 4 Effects of SN on the expressions of hepatoma stem cell related proteins in SMMC-7721 parental cells and sphere cells. Flow cytometry analysis showed that treatment with SN (150 μmol·L-1, 24 h) resulted in parental and sphere cells increased the expressions of CD133 (A), CD90 (B) and EpCAM (C), compared with the parent cells, and these marker were increased approximately three folds in SMMC-7721 sphere cells. n = 3, x±s. *P < 0.05 vs parental cell group; #P < 0.05 vs sphere cell group |
为进一步验证流式细胞术检测肿瘤干细胞标志物相关蛋白的表达结果, 本实验又利用Western blot方法检测了上述3种蛋白表达(图 5), 结果与图 4一致。
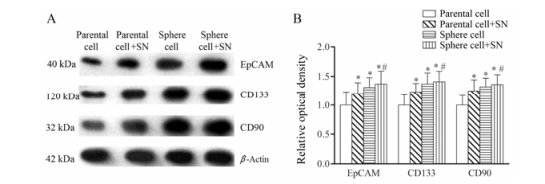
|
Figure 5 Effects of SN on the expressions of hepatoma stem cell related proteins in SMMC-7721 parental cells and sphere cells. A: Western blot data showed that the expressions of the CD133, CD90 and EpCAM proteins were upregulated in sphere cells compared with those in parental cells. Treatment with SN (150 μmol·L-1, 24 h) resulted in parental and sphere cells increased the expressions of markers, compared with the parent cells, and the above effects of nitrite on the spheres cells were significantly enhanced. B: The quantified results of A. n = 3, x±s. *P < 0.05 vs parental cell group; #P < 0.05 vs sphere cell group |
肿瘤细胞分泌的基质金属蛋白酶可以溶解基底膜, 有助于细胞侵袭转移。用matrigel包被的transwell小室, 模拟基底膜可以用于检测肿瘤细胞的侵袭能力。图 6结果显示, 球形成细胞穿膜细胞数明显多于亲本细胞; 与未处理的亲本细胞或球形成细胞相比, 亚硝酸钠处理后各组穿膜细胞数明显增多; 同样, 在亚硝酸钠处理后, 球形成细胞组的穿膜细胞数明显多于亲本细胞。在亚硝酸盐作用下, 球形成细胞侵袭能力比未处理的球形成细胞增强。结果提示, 球形成细胞侵袭能力明显强于亲本细胞, 亚硝酸钠可以显著提高SMMC-7721亲本细胞和球形成细胞的侵袭能力; 球形成细胞可能富集更多的肝癌干细胞, 从而导致其侵袭能力强于亲本细胞。
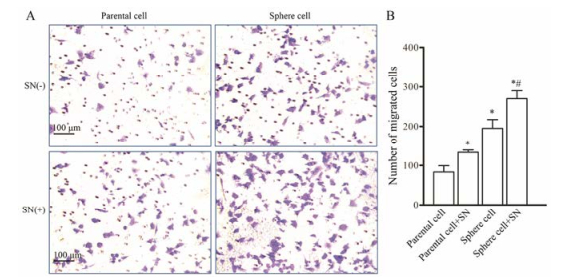
|
Figure 6 Effect of SN on the invasion ability of SMMC-7721 parental cells and sphere cells. A: Transwell invasion assays the cells invading the matrigel after 24 h of culture as shown by the microscopic images (magnification, 100×). Invading cells were fixed in formaldehyde and stained with crystal violet. B: The quantified results of A. n = 3, x±s. *P < 0.05 vs parental cell group; #P < 0.05 vs sphere cell group |
肿瘤干细胞耐受化疗药物损害是其很重要的一个特征。图 7显示, 在不同浓度顺铂(cisplatin)的作用下, 各组细胞的增殖均受到抑制, 但是可以看出, 亲本细胞受该药物的抑制作用明显高于其他3组。与未处理组相比, 经过亚硝酸钠处理后, 亲本细胞或球形成细胞活力明显增强。提示亚硝酸钠处理后, 各组细胞耐药能力明显增强。同样, 在亚硝酸钠处理后, 球形成细胞的细胞活力明显大于亲本细胞。在亚硝酸盐作用下, 球形成细胞耐药性比未处理的球形成细胞增强。说明亚硝酸钠对球形成细胞抵抗化疗药物损害能力方面的促进作用要明显大于亲本细胞。
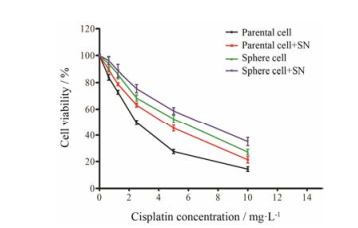
|
Figure 7 Effect of SN on the drug resistance of SMMC-7721 parental cells and sphere cells. The cells exposed previously to DMEM or SN (150 μmol·L-1) for 24 h, and then treated with a serial dose of cisplatin for 24 h, the viability of cells was reflected by the MTT absorbance (n = 3, x±s) |
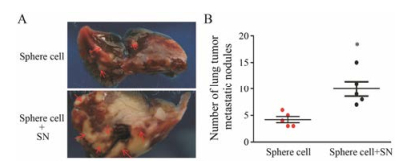
图 8A为实验结束时取出的同一只小鼠左右移植瘤, 共5只。肉眼可见4只小鼠亚硝酸钠处理组的球形成细胞移植瘤大于另一侧未处理组的球形成细胞形成的移植瘤, 图 8B是球形成细胞接种不同时间测量的移植瘤体积, 结果显示亚硝酸钠处理组的球形成细胞移植瘤体积在不同时间点均大于未处理组。图 8C统计结果显示, 亚硝酸钠处理组的球形成细胞移植瘤重明显高于未处理组。图 9为实验结束时取出的肺, 球形成细胞皮下种植均可引起肺转移, 但是亚硝酸钠处理组肺转移结节数明显多于未处理组。
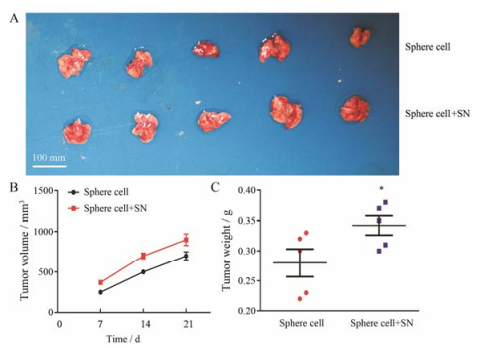
|
Figure 8 SN augments the tumorigenic properties of SMMC-7721 sphere cells in vivo. A: The untreated or SN pre-treated SMMC-7721 sphere cells were injected subcutaneously in the left and right flank of the same BALB/c nude mice, the xenograft tumor were showed. B: Effect of SN on volume of xenografts in mice bearing sphere cells. C: The plot shows the comparison of corresponding tumor weight (g), measured after harvesting on day 21, in the same mice. n = 5, x±s. *P < 0.05 vs sphere cell group |
|
Figure 9 Comparisons in the number of metastatic nodules in the lung. A: At the 21rd day following the interventions, BALB/c nude mice from each group were euthanized and the numbers of tumor nodules (red arrow) in the lung were showed. B: Sphere cells received SN treatments had significant higher findings in tumor metastatic nodules than the one without (P < 0.05). n = 5, x±s. *P < 0.05 vs sphere cell group |
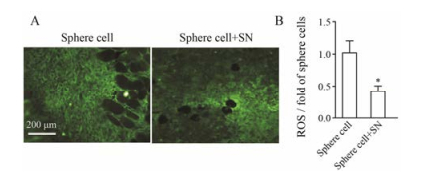
图 10A为荧光探针DCFH-DA检测的组织内ROS, 经统计分析, 亚硝酸钠预处理的球形成细胞移植瘤组织内荧光强度明显弱于未处理组(图 10B)。
|
Figure 10 Effect of SN on ROS production in xenografted tumors. A: The frozen section of xenografted tumors co-incubated with ROS assay kit for 2 h, and then detected by fluorescence microscope. B: Xenografted tumors ROS production was detected by Image-pro plus. n = 5, x±s. *P < 0.05 vs sphere cell group |
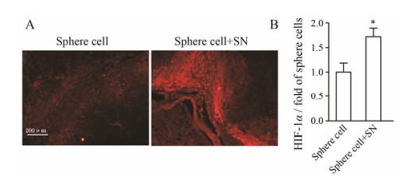
图 11A红色荧光为免疫荧光检测的组织内HIF-1α蛋白水平, 经统计分析, 亚硝酸钠预处理的球形成细胞移植瘤组织内荧光强度明显强于未处理组(图 11B)。
|
Figure 11 Effect of SN on HIF-1α expression in xenografted tumors. A: The frozen section of xenografted tumors immunofluorescence staining of HIF-1α, and then detected by fluorescence microscope. B: Xenografted tumors HIF-1α expression was detected by Image-pro plus. n = 5, x±s. *P < 0.05 vs sphere cell group |
肝癌是高度异质性的恶性肿瘤, CSCs只是其中数量很少的细胞群。与不具有干细胞特征的肿瘤细胞相比, CSCs通过DNA损伤修复、抑制凋亡通路和产生耐药蛋白等自我保护机制, 增强了肿瘤进展、转移、耐药和自我更新能力[12]。CSCs的干细胞特征性也被称为“干性” (stemness)。肝癌CSCs的“干性”通常包括体外形成克隆及肿瘤球、在体致瘤能力增强、高表达干细胞相关的生物学标志物等特征[13]。肝癌CSCs还表现细胞G0/G1期阻滞和较强的耐药性[14]。用无血清培养基悬浮培养获得细胞球, 球形成细胞富集了具有干细胞特性的细胞, 通常作为干细胞用于研究[15]。本实验也发现, 用无血清培养基低黏附培养1周获得的肿瘤细胞球, 与亲本细胞相比, G0/G1期细胞比例、自我更新能力、肝癌干细胞标志物表达、侵袭能力和耐药性都明显增加。用球形成细胞接种裸鼠皮下成瘤并发现了肺转移灶。结果提示, 本实验获得的细胞球富集了肝癌干细胞, 可以作为肝癌干细胞样细胞用于调控研究。
越来越多的实验证实, CSCs的数量不是一个稳定的状态, 已经分化的肿瘤细胞通过去分化的方式, 可重新获得干细胞特性[16]。本实验结果显示, 未经任何处理的SMMC-7721亲本细胞只包含极少数具有干细胞特性的细胞, 经亚硝酸盐处理后, 亲本细胞获得了较多的“干性”特征。球形成细胞体内移植瘤实验也显示, 经亚硝酸钠预处理的球形成细胞移植瘤体积、重量和肺转移结节数都比未处理组增加。结果提示, 亚硝酸盐具有诱导SMMC-7721细胞群体中一些非肿瘤干细胞转化为肿瘤干细胞的能力。肿瘤微环境刺激CSCs自我更新、血管新生和重塑免疫, 提供其他有利于肿瘤侵袭转移力和CSCs动态变化的良好环境[17]。肿瘤微环境还是一个缺氧酸性环境, 内部含有较高水平的亚硝酸盐。亚硝酸盐在酸性环境下可以被还原为一氧化氮。一氧化氮具有诱导普通癌细胞向肿瘤干细胞转化的能力[18]。其次, 亚硝酸盐作用的靶点是线粒体呼吸链, 通过与氧分子竞争性结合呼吸链复合物, 造成细胞内缺氧, HIF-1α累积, 细胞内ROS水平下降[19]。这种现象本研究在球形成细胞体内移植瘤冰冻切片也得到了初步印证。HIF-1α积累和ROS水平下调有利于非肿瘤干细胞向肿瘤干细胞转化[20]。另外, 课题组前期发现, 亚硝酸盐通过上调HIF-1α的表达, 诱导SMMC-7721细胞EMT[10], 而EMT被证实是已分化的肝癌细胞向肿瘤干细胞转化的一种主要形式[21]。
CSCs的“干性”也不是一个稳定的状态。当生物体发育进入终末阶段时, 正常的干细胞会利用一套完善的反馈系统, 限制细胞“干性”以确保机体进入分化末期, 在这个过程中, 一部分基因会“沉默”, 而另一部分基因则开始表达, 使细胞在发育的不同阶段具备特异性的表型。较高“干性”和较低“干性”的胚胎干细胞之间可自发的相互转化[22]。CSCs的“干性”受细胞内外细胞因子的调控。有实验发现, IL-6和IL-8有增强肝癌CSCs自我更新和体内成瘤能力[23]; TGF-β通过下游靶基因EpCAM在多种肝癌CSCs“干性”维持方面发挥作用[24]。本实验显示, 在亚硝酸盐作用下, 球形成细胞“干性”明显比亲本细胞增强。有实验证实, 亚硝酸钠可以促进细胞TNF-α、IL-1β和IL-6等细胞因子分泌增加[25]。课题组[9]前期也发现, 亚硝酸盐具有刺激SMMC-7721细胞分泌TGF-β的作用。本实验还显示, 在亚硝酸盐作用下, 球形成细胞“干性”明显比未处理的球形成细胞增强, 提示亚硝酸盐也可能增加球形成细胞的细胞因子分泌。结合上述文献分析, 亚硝酸盐可能具有调控干细胞基因, 诱导细胞因子分泌来上调肝癌SMMC-7721干细胞“干性”的作用。
本研究所用亚硝酸钠浓度选为150 μmol·L-1 (相当于16 mg·L-1)的依据是:正常人餐后唾液亚硝酸盐浓度为170 mg·L-1, 到胃内可被稀释10倍以上[26], 这就意味着人餐后胃内亚硝酸盐浓度有可能达到17 mg·L-1, 非常接近于本实验处理组所用亚硝酸钠的浓度。
综上所述, 人肝癌SMMC-7721细胞在低黏附无血清悬浮培养条件下培养1周, 可以获得富集CSCs的细胞球。亚硝酸盐通过抑制人肝癌SMMC-7721细胞内的氧消耗, 减少ROS产生, 促进HIF-1α累积, 通过EMT方式, 致使一部分已分化的肝癌细胞转化为CSCs。亚硝酸盐还可能通过刺激CSCs细胞因子分泌, 使干细胞样细胞“干性”增强, 从而促进SMMC-7721细胞侵袭、转移和耐药能力。
| [1] | Li M, Wu CF, Zhang JY, et al. Biological characteristics of drug induced tumor cells and its medicine prevention and treatment[J]. Acta Pharm Sin (药学学报), 2016, 51: 182–188. |
| [2] | Orecchioni S, Bertolini F. Characterization of cancer stem cells[J]. Methods Mol Biol, 2016, 1464: 49–62. DOI:10.1007/978-1-4939-3999-2 |
| [3] | Jiang Y, Gao H, Liu M, et al. Sorting and biological characteristics analysis for side population cells in human primary hepatocellular carcinoma[J]. Am J Cancer Res, 2016, 6: 1890–1905. |
| [4] | Ma HY, He M, Wei MJ. Research progress on targeting effect and regulating mechanisms of the stemness of cancer stem cells[J]. Acta Pharm Sin (药学学报), 2016, 51: 189–196. |
| [5] | Jayachandran A, Dhungel B, Steel JC. Epithelial-to-mesenchymal plasticity of cancer stem cells:therapeutic targets in hepatocellular carcinoma[J]. J Hematol Oncol, 2016, 9: 74. DOI:10.1186/s13045-016-0307-9 |
| [6] | Frérart F, Lobysheva I, Gallez B, et al. Vascular caveolin deficiency supports the angiogenic effects of nitrite, a major end product of nitric oxide metabolism in tumors[J]. Mol Cancer Res, 2009, 7: 1056–1063. DOI:10.1158/1541-7786.MCR-08-0388 |
| [7] | Yongsanguanchai N, Pongrakhananon V, Mutirangura A, et al. Nitric oxide induces cancer stem cell-like phenotypes in human lung cancer cells[J]. Am J Physiol Cell Physiol, 2015, 308: C89–C100. DOI:10.1152/ajpcell.00187.2014 |
| [8] | Park SJ, Kim JG, Kim ND, et al. Estradiol, TGF-β1 and hypoxia promote breast cancer stemness and EMT-mediated breast cancer migration[J]. Oncol Lett, 2016, 11: 1895–1902. |
| [9] | Wang YD, Fu JM, Shi Q, et al. Sodium nitrite induces epithelial-mesenchymal transition of SMMC-7721 cells[J]. Acta Pharm Sin (药学学报), 2011, 46: 507–512. |
| [10] | Xu HR, Lin B, Wang SQ, et al. Sodium nitrite improves epithelial-mesenchymal transition of hepatoma cells in mice bearing H22[J]. Acta Pharm Sin (药学学报), 2012, 47: 1470–1476. |
| [11] | Boo L, Ho WY, Ali NM, et al. miRNA transcriptome profiling of spheroid-enriched cells with cancer stem cell properties in human breast MCF-7 cell line[J]. Int J Biol Sci, 2016, 12: 427–445. DOI:10.7150/ijbs.12777 |
| [12] | Safa AR. Resistance to cell death and its modulation in cancer stem cells[J]. Crit Rev Oncog, 2016, 21: 203–219. DOI:10.1615/CritRevOncog.v21.i3-4 |
| [13] | Xia H, Li F, Hu X, et al. pH-Sensitive Pt nanocluster assembly overcomes cisplatin resistance and heterogeneous stemness of hepatocellular carcinoma[J]. ACS Cent Sci, 2016, 2: 802–811. DOI:10.1021/acscentsci.6b00197 |
| [14] | Hashimoto N, Tsunedomi R, Yoshimura K, et al. Cancer stemlike sphere cells induced from de-differentiated hepatocellular carcinoma-derived cell lines possess the resistance to anti-cancer drugs[J]. BMC Cancer, 2014, 14: 722. DOI:10.1186/1471-2407-14-722 |
| [15] | Cao L, Zhou Y, Zhai B, et al. Sphere-forming cell subpopulations with cancer stem cell properties in human hepatoma cell lines[J]. BMC Gastroenterol, 2011, 11: 71. DOI:10.1186/1471-230X-11-71 |
| [16] | Islam F, Qiao B, Smith RA, et al. Cancer stem cell:fundamental experimental pathological concepts and updates[J]. Exp Mol Pathol, 2015, 98: 184–191. DOI:10.1016/j.yexmp.2015.02.002 |
| [17] | Oskarsson T, Batlle E, Massagué J. Metastatic stem cells:sources, niches, and vital pathways[J]. Cell Stem Cell, 2014, 14: 306–321. DOI:10.1016/j.stem.2014.02.002 |
| [18] | Puglisi MA, Cenciarelli C, Tesori V, et al. High nitric oxide production, secondary to inducible nitric oxide synthase expression, is essential for regulation of the tumour-initiating properties of colon cancer stem cells[J]. J Pathol, 2015, 236: 479–490. DOI:10.1002/path.4545 |
| [19] | Ren X, Ding Y, Lu N. Nitrite attenuated peroxynitrite and hypochlorite generation in activated neutrophils[J]. Eur J Pharmacol, 2016, 775: 50–56. DOI:10.1016/j.ejphar.2016.02.020 |
| [20] | Gammon L, Biddle A, Heywood HK, et al. Sub-sets of cancer stem cells differ intrinsically in their patterns of oxygen metabolism[J]. PLoS One, 2013, 8: e62493. DOI:10.1371/journal.pone.0062493 |
| [21] | Yang X, Ye J, Yan H, et al. MiR-491 attenuates cancer stem cells-like properties of hepatocellular carcinoma by inhibition of GIT-1/NF-κB-mediated EMT[J]. Tumour Biol, 2016, 37: 201–209. DOI:10.1007/s13277-015-3687-5 |
| [22] | Francescangeli F, Contavalli P, De Angelis ML, et al. Dynamic regulation of the cancer stem cell compartment by Cripto-1 in colorectal cancer[J]. Cell Death Differ, 2015, 22: 1700–1713. DOI:10.1038/cdd.2015.19 |
| [23] | Wang CQ, Sun HT, Gao XM, et al. Interleukin-6 enhances cancer stemness and promotes metastasis of hepatocellular carcinoma via up-regulating osteopontin expression[J]. Am J Cancer Res, 2016, 6: 1873–1889. |
| [24] | Bellomo C, Caja L, Moustakas A. Transforming growth factor β as regulator of cancer stemness and metastasis[J]. Br J Cancer, 2016, 115: 761–769. DOI:10.1038/bjc.2016.255 |
| [25] | Alyoussef A, Al-Gayyar MM. Thymoquinone ameliorated elevated inflammatory cytokines in testicular tissue and sex hormones imbalance induced by oral chronic toxicity with sodium nitrite[J]. Cytokine, 2016, 83: 64–74. DOI:10.1016/j.cyto.2016.03.018 |
| [26] | Lundberg JO, Gladwin MT, Ahluwalia A, et al. Nitrate and nitrite in biology, nutrition and therapeutics[J]. Nat Chem Biol, 2009, 5: 865–869. DOI:10.1038/nchembio.260 |
 2017, Vol. 52
2017, Vol. 52


