2. 广州新济药业科技有限公司, 广东 广州 510006
2. Guangzhou Neworld Pharmaceutical Co., Ltd., Guangzhou 510006, China
常见的益生菌有双歧杆菌和乳杆菌[1]。益生菌制剂可用于急性腹泻、慢性腹泻、慢性便秘、肠易激综合征、肝损伤[2]、神经系统疾病[3]和特应性疾病[4]等疾病的治疗, 具有广阔的市场前景。但益生菌在制剂制备过程中易失活, 且益生菌在胃酸环境中会大量死亡, 因此益生菌的高存活率和高稳定性始终是益生菌制剂的巨大挑战[5]。只有较大数量的存活益生菌通过宿主的上行消化系统后, 在肠道释放并定植于肠道黏膜才能发挥功效。因此益生菌制剂产品对人体产生积极作用需要满足两个条件:一是益生菌制剂在生产、运输和储存过程中维持较高的活菌率, 国内外普遍认为活菌制剂在临床使用时至少需要达到1×106~1×107 cfu·g-1(mL-1) (cfu: colony-forming units)的活菌数[6]; 二是能够在通过胃液等不良环境后有大量的活菌到达肠道。冷冻干燥技术是传统益生菌产品的常用制备技术, 它基于“饥饿存活”原理来降低益生菌的水分含量, 使得益生菌处于休眠状态以延长保存期, 但是这类产品对储存的环境要求高, 且对胃酸没有耐受力, 因此在很多应用方面受到限制。
微胶囊技术, 又称微胶囊化, 是指利用性能较稳定的天然或合成高分子材料作为壁材, 将性能不稳定的固体、液体等物质包埋在一个封闭“容器”中的技术[7]。微胶囊内部物质称为芯材, 包埋基质或包裹材料称为囊材。通过微囊化可以隔绝芯材与外界环境, 避免氧气、水分和光照等对敏感成分的不良影响, 提高药物的稳定性, 可以将芯材由液态向固态转变, 可以控制芯材的释放[8], 掩盖芯材的不良口味等。微胶囊适合于包载稳定性差的大分子蛋白、多肽类和益生菌等药物[9]。常见的益生菌微囊化的制备方法[10]有喷雾干燥法、喷雾冷却法[11]、空气悬浮法、挤压法和乳化法。其中, 挤压法具有操作简单, 不需要有机试剂, 制备的微胶囊机械强度大等优点, 因此受到越来越多的关注。
本文旨在利用挤压法, 结合微囊化技术, 选取保加利亚乳杆菌来制备新型益生菌制剂, 通过优化制备处方工艺, 以达到较高的包埋率, 使该制剂在常温下具有较长的保质期, 并且能够在通过胃酸等不良环境后依然具有较高的活菌数。
材料与方法材料 海藻酸钠(青岛明月海藻集团有限公司); 氯化钙(分析纯, 天津市科密欧化学试剂有限公司); 海藻糖(99%)、维生素C (分析纯>99%)、谷氨酸钠(分析纯>99%) (上海阿拉丁试剂有限公司); 脱脂乳(市售食品级, Fonterra Co-operative Group Ltd.); 卡式试剂(分析纯, 广州化学试剂厂)。
主要仪器 全自动点胶机(980A, 奥斯邦中国有限公司); 倒置显微镜(BDS20, 重庆奥特光学仪器有限责任公司); 冷冻干燥机(Christ Alpha 1-4LSC, 北京博劢行仪器有限公司); 全自动菌落计数仪(G1, 杭州迅数科技有限公司); 激光粒度分析仪(Mastersize 2000, Malven Instruments Ltd.); 场发射扫描电子显微镜(SEM, JSM-6330F, 日本电子株式会社)。
挤压法制备保加利亚乳杆菌微胶囊 取紫外照射灭菌30 min后的海藻酸钠粉末, 缓缓加入60 ℃剧烈搅拌的灭菌纯化水或含冻干保护剂(脱脂乳、海藻酸钠、维生素C和谷氨酸钠)水溶液, 继续搅拌使之溶解, 冷却至室温备用。将保加利亚乳杆菌在MRS液体培养基厌氧培养24 h后, 离心收集菌泥, 与浓度为3%海藻酸钠溶液(含冻干保护剂)按一定比例混匀, 平衡30 min。将浓度为1×109 cfu·mL-1海藻酸钠菌悬液加入点胶机物料筒, 在一定压力和高度下逐滴加入2% CaCl2溶液中, 静置固化30 min, 收集凝胶珠, 用0.85%生理盐水洗涤3次。将制备好的凝胶珠于-80 ℃预冻1 h, 然后在冷阱温度-50 ℃、真空度约为25 Pa条件下冷冻干燥约48 h, 得到保加利亚乳杆菌微胶囊。
形态结构观察及粒径分布测定 用扫描电子显微镜观察冻干菌粉表面形态。取冻干菌粉适量, 用双面胶附于铜片上, 喷金置于15 kV加速电压下的扫描电子显微镜观察形态。用倒置显微镜观察冻干微胶囊表面形态。取冻干微胶囊若干, 置于载玻片上, 倒置显微镜选择适当放大倍数观察并拍照。
随机选取海藻酸钠凝胶珠100粒, 用游标卡尺测量粒径, 计算平均粒径。按照《中国药品检验标准操作规范(2010版)》要求, 激光粒度分析仪光散射法湿法(无水乙醇作为介质)测定冻干菌粉粒径, 干法测定冻干后微胶囊粒径。
水分测定 由于冻干菌粉吸湿性强, 在25 ℃、相对空气湿度(relative humidity, RH)<45%条件下按照《中国药品检验标准操作规范(2010版)》费休氏水分测定法测定冻干菌粉含水量。烘干法测定冻干后微胶囊含水量。
吸湿性考察 配制相对湿度分别为75% NaCl和92% KNO3饱和盐溶液, 置于干燥器中, 室温(25 ℃)放置24 h, 备用。称取冻干菌粉和冻干微胶囊样品1 g, 放入盛有不同相对湿度饱和溶液的干燥器中, 室温放置15天, 于2、4、6、8、10、12、24、36 h和2、3、4、8、12天分别取出称重, 计算样品的吸湿增重百分比(n = 3)。绘制冻干菌粉和冻干微胶囊的吸湿平衡曲线。
耐酸性能实验 称取3 g冻干菌粉和3 g冻干微胶囊, 分别加入盛有121 ℃高压灭菌15 min后的0.1 mol·L-1 HCl溶液100 mL和1 L中, 溶出介质温度为(37± 0.5) ℃。将冻干菌粉置于恒温水浴摇床中100 r·min-1振摇2 h, 吸取3 mL, 用倾注平板稀释法来测定活菌数(n = 3)。将冻干微胶囊置于溶出仪中, 浆法转速75 r·min-1, 2 h后滤取冻干微胶囊, 吸干表面HCl, 加入柠檬酸钠解囊液, 37 ℃、200 r·min-1振摇45 min后待冻干微胶囊全部溶解, 吸取1 mL测定活菌数(n = 3)。
高湿实验 称取冻干菌粉及冻干微胶囊3 g, 置于25 ℃、RH 60%稳定性箱, 于5、10和15天分别取样测定活菌数(n = 3), 以考察冻干菌粉及冻干微胶囊在高湿环境下的存活率。
耐热性能实验 称取3 g冻干菌粉及冻干微胶囊, 充氮气作为保护气, 压盖后密封保存; 另取3 g冻干菌粉复溶于灭菌的0.85%生理盐水10 mL中, 涡旋使之完全溶解, 分别置于40 ℃、45 ℃、50 ℃、55 ℃、60 ℃和70 ℃条件下2 h后, 分别测定保加利亚乳杆菌活菌数(n = 3), 考察冻干菌粉、冻干微胶囊及复溶冻干菌粉耐热性能。
长期稳定性考察 称取冻干菌粉及冻干微胶囊3 g, 充氮气作为保护气, 压盖密封后装入铝袋塑封保存于25 ℃、RH 60%的恒温恒湿实验箱, 于5、10、15、30、60和90天取样品测量活菌数(n = 3), 考察冻干菌粉和冻干微胶囊长期稳定性。
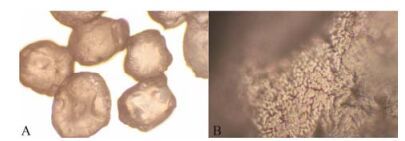
结果与讨论 1 保加利亚乳杆菌冻干菌粉及冻干微胶囊的表征 1.1 形态结构及粒径分布如图 1所示, SEM照片显示冻干菌粉轻微研磨后呈片状颗粒, 表面未见明显保加利亚乳杆菌菌体, 说明冻干过程对菌体具有良好的包埋效果。图 2是微胶囊冻干后的倒置显微镜观察图, 从图中可以看出, 微胶囊冻干后有一定程度的皱缩, 但没有裂纹产生, 囊壁结构保持完整。冻干菌粉轻微研磨后粒径呈正态分布, d(0.5)为50.042μm, 多分散指数(polydispersity index, PDI)为0.603。挤压法最佳工艺条件制备的保加利亚乳杆菌微胶囊, 由于粒径较大, 用游标卡尺测得粒径为1.75± 0.18 mm (n = 100)。冻干后测得的粒径呈正态分布, d(0.5)为887.419μm, PDI为0.208, 分布范围较窄, 说明最佳工艺条件下制备的微胶囊冻干前后均保持粒径均一。

|
Figure 1 Scanning electron microscope images of freeze-dried L. Bulgaricus |
|
Figure 2 Morphology of microcapsule by inverted microscope. A: Magnification 10×5; B: Magnification 10×40 |
冻干后水分含量直接影响菌体的状态, 一般菌种保藏控制冻干样品水分含量1.5%~3.0%比较适宜, 维持较低的水分含量, 菌种才能维持休眠状态, 但水分含量低于0.5%可能引起冻干过程中DNA链的断裂导致菌种死亡。室温下控制环境相对湿度RH<45%, 用费休氏水分测定法冻干后菌粉水分含量为(3.27± 0.21) % (n = 3)。由于冻干微胶囊无法直接用费休氏水分测定法测量, 选用烘干法105 ℃至恒重, 测得水分含量为(3.94± 0.17) % (n = 3)。Zayed等[12]研究表明冻干唾液乳酸菌菌粉水分含量在2.8%~5.6%有利于延长菌粉保存时间。冻干菌粉和冻干微胶囊均维持较低的水分含量, 水分含量在2.8%~5.6%之间, 有利于菌体保持休眠状态。
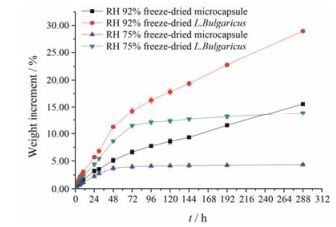
1.3 吸湿性测定为达到长时间保存菌体的目的, 需要将冻干菌粉和冻干微胶囊维持低水平的水分含量, 以达到长时间保藏的目的。因此, 考察样品吸湿性对冻干菌粉和冻干微胶囊的性质有重要意义。由图 3可知, 由于冻干保护剂脱脂乳和海藻糖等具有吸湿性, 在RH 75%和92%条件下冻干菌粉吸湿性明显高于冻干微胶囊。在RH 75%条件下, 冻干微胶囊最终吸湿增重率为4.32%, 而冻干菌粉吸湿增重率为13.84%, 为前者的3.2倍。这是因为冻干微胶囊表面相对致密, 且脱脂乳和海藻糖等分散在冻干微胶囊内部, 导致冻干微胶囊抗湿性能相对较高; 在RH 92%条件下, 冻干菌粉和冻干微胶囊吸湿增重率均不断迅速上升, 但后者增重速率也明显低于前者。吸湿性实验表明, 挤压法结合冷冻干燥法制备微胶囊相对于单纯冷冻干燥制得的菌粉对外界湿度的敏感度明显降低。
|
Figure 3 Weight increment of freeze-dried microcapsule and freeze-dried L. Bulgaricus under different humidity conditions. n = 3, x± s. RH: Relative humidity |
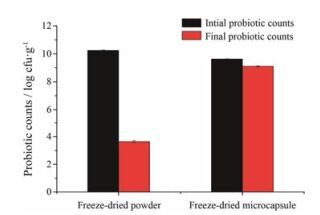
当口服益生菌制剂进入胃肠道, 首先到达pH值为1.0~2.0胃液中, 只有耐受胃酸(低pH)环境顺利抵达小肠并且释放, 才能发挥益生菌制剂改善肠道菌群的作用。因此, 模拟胃肠道环境[13]以考察口服益生菌制剂的稳定性是很有必要的。由图 4可知, 冻干微胶囊经过模拟胃液处理2 h后, 冻干微胶囊中存活的活菌数为1.24×109 cfu·g-1, 而冻干菌粉中活菌数为4.3×104 cfu·g-1。虽然冻干微胶囊活菌数下降为原来的29.51%, 但与冻干菌粉相比, 活菌数是其28 840倍, 而且大于1×107 cfu·g-1, 达到了益生菌制剂的要求。有研究报道[14]未经二次包衣海藻酸钠凝胶珠无法良好地抵御胃酸的作用, 导致活菌数下降了几个数量级。由于挤压法制备微胶囊粒径较大, 所以在模拟胃液中与介质接触的表面积相对较小, 模拟胃液对其损伤相对较小。说明微囊化可以明显改善益生菌在胃液中的存活率, 更多数量的活菌可以顺利通过胃液, 到达并定植于肠道黏膜。
|
Figure 4 Probiotic survival rate of freeze-dried powder and microcapsule in SGF. n = 3, x± s. SGF: Stimulated gastric fluid; cfu: Colony-forming units |
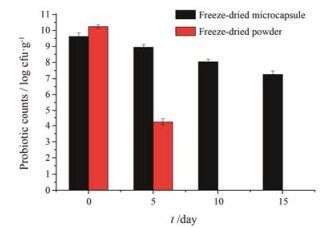
将冻干菌粉和冻干微胶囊置于25 ℃、RH 60%条件下, 对比空气水分对冻干菌粉和冻干微胶囊中保加利亚乳杆菌存活率的影响。如图 5所示, 冻干微胶囊RH 60%条件下放置15天保加利亚乳杆菌活菌数下降为原来的1%, 而冻干菌粉在第10天几乎已经无法测得活菌数。表明微囊化明显提高保加利亚乳杆菌对高湿环境的抵御能力。这主要是由于冻干菌粉在高湿环境下吸收大量水分, 导致水分含量升高, 菌体不处于休眠状态、新陈代谢加速和营养缺乏等因素, 迅速大量死亡; 而冻干微胶囊吸湿性明显低于冻干菌粉, 冻干微胶囊内部水分含量较低, 菌体依然保持休眠状态, 能够保持较高的活菌数。但冻干菌粉和冻干微胶囊储存过程仍应该避免高湿环境, 以延长其存活期。
|
Figure 5 Probiotic survival of freeze-dried powder and microcapsule in high humidity condition. n = 3, x± s |
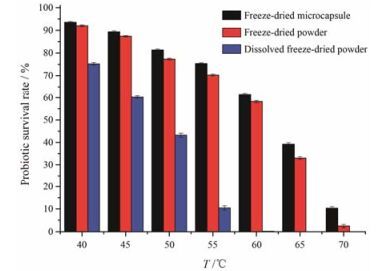
益生菌制剂在储存过程或进一步处理过程中, 会遇到一些极端环境。高温实验可以确定冻干菌粉或冻干微胶囊耐受的最高温度。由图 6可知, 当菌种已定, 营养条件不变时, 保加利亚乳杆菌的存活率随温度的升高而明显降低。复溶冻干菌粉会使菌体复苏, 菌体不处于休眠状态, 在高温下迅速死亡。冻干菌粉和冻干微胶囊的保加利亚乳杆菌存活率明显高于复溶冻干菌粉, 表明冻干过程可以明显提高菌体对温度的耐受能力。但冻干菌粉和冻干微胶囊储存过程仍应该避免高温环境, 以延长其存活期。且与冻干菌粉相比, 冻干微胶囊中益生菌的存活率更高, 说明微囊化可以提高保加利亚乳杆菌对高温环境的抵御能力, 有效提高保加利亚乳杆菌在高温环境下的存活率。
|
Figure 6 Probiotic survival rate of freeze-dried powder and microcapsule at different temperatures. n = 3, x± s |
益生菌制剂的稳定性是评价其质量的重要指标之一, 稳定性考察通常有经典恒温法或加速实验法。本实验采用25 ℃经典恒温法, 测定冻干菌粉和冻干微胶囊的贮存稳定性。由表 1可知, 在25 ℃、RH 60%条件下储存3个月, 冻干微胶囊活菌数从4.2×109 cfu·g-1降至5.7×108 cfu·g-1, 而冻干菌粉从1.77×1010 cfu·g-1降至5.3×108 cfu·g-1, 存活率分别为5.67%和0.37%。虽然冻干微胶囊组初始活菌数低于冻干菌粉组, 但冻干微胶囊失活速率明显低于冻干菌粉, 在25 ℃、RH 60%条件下冻干微胶囊组的理论保质期比冻干菌粉组延长了54.52%~77.30%。说明微囊化技术结合冷冻干燥技术较单纯冷冻干燥可以明显延长菌体的存活时间。
| Table 1 Survival of freeze-dried powder (FP) and freeze-dried microcapsule (FM) during storage at 25 ℃, RH 60% condition. n = 3, x± s |
本文采用微胶囊技术制备保加利亚乳杆菌活菌制剂。确定保加利亚乳杆菌微胶囊最优工艺流程和条件为:将保加利亚乳杆菌与3%的海藻酸钠溶液混合(菌悬液浓度约为1×109 cfu·mL-1), 通过点胶机滴至2% CaCl2溶液, 固化30 min后冷冻干燥得微胶囊。通过对冻干菌粉和冻干微胶囊进行一系列表征及稳定性考察, 表明冻干微胶囊在高湿环境、高温环境和模拟胃液中的存活率, 以及储存稳定性均明显优于冻干菌粉。说明微囊化技术可以明显延长菌体的存活时间, 改善保加利亚乳杆菌的稳定性及对不良环境的耐受能力, 从而提高保加利亚乳杆菌的治疗效果。
| [1] | Salminen S, Bouley C, Boutron-Ruault MC, et al. Functional food science and gastrointestinal physiology and function[J]. Br J Nutr, 1998, 80: S147–S171. DOI:10.1079/BJN19980108 |
| [2] | Ewaschuk J, Endersby R, Thiel D, et al. Probiotic bacteria prevent hepatic damage and maintain colonic barrier function in a mouse model of sepsis[J]. Hepatology, 2007, 46: 841–850. DOI:10.1002/(ISSN)1527-3350 |
| [3] | Li D, Wang P, Wang P, et al. The gut microbiota: a treasure for human health[J]. Biotechnol Adv, 2016, 34: 1210–1224. DOI:10.1016/j.biotechadv.2016.08.003 |
| [4] | Kalliomäki M, Salminen S, Arvilommi H, et al. Probiotics in primary prevention of atopic disease: a randomised placebo-controlled trial[J]. Lancet, 2001, 357: 1076–1079. DOI:10.1016/S0140-6736(00)04259-8 |
| [5] | Mattila-Sandholm T, Myllärinen P, Crittenden R, et al. Technological challenges for future probiotic foods[J]. Int Dairy J, 2002, 12: 173–182. DOI:10.1016/S0958-6946(01)00099-1 |
| [6] | Burgain J, Gaiani C, Linder M, et al. Encapsulation of probiotic living cells: from laboratory scale to industrial applications[J]. J Food Eng, 2011, 104: 467–483. DOI:10.1016/j.jfoodeng.2010.12.031 |
| [7] | Santillo A, Albenzio M, Bevilacqua A, et al. Encapsulation of probiotic bacteria in lamb rennet paste: effects on the quality of Pecorino cheese[J]. J Dairy Sci, 2012, 95: 3489–3500. DOI:10.3168/jds.2011-4814 |
| [8] | Wang HJ, Li XR, Huang YQ, et al. In vitro and in vivo pharmaceutical behaviors of lycopene microcapsules[J]. Acta Pharm Sin(药学学报), 2005, 40: 787–791. |
| [9] | Li S, Hou XP. Studies on the formation mechanism of alginate-chitosan microcapsule and its drug-loading and release properties on macromolecular drug[J]. Acta Pharm Sin(药学学报), 2003, 38: 380–383. |
| [10] | Anal AK, Singh H. Recent advances in microencapsulation of probiotics for industrial applications and targeted delivery[J]. Trends Food Sci Tech, 2007, 18: 240–251. DOI:10.1016/j.tifs.2007.01.004 |
| [11] | Champagne CP, Fustier P. Microencapsulation for the improved delivery of bioactive compounds into foods[J]. Curr Opin Biotech, 2007, 18: 184–190. DOI:10.1016/j.copbio.2007.03.001 |
| [12] | Zayed G, Roos YH. Influence of trehalose and moisture content on survival of Lactobacillus salivarius subjected to freeze-drying and storage[J]. Process Biochem, 2004, 39: 1081–1086. DOI:10.1016/S0032-9592(03)00222-X |
| [13] | Hang ZY, Sun YQ, Hu HY, et al. Techniques and methods evaluation on pharmaceutical stability of liposomes[J]. Acta Pharm Sin(药学学报), 2016, 51: 356–361. |
| [14] | Chávarri M, Marañón I, Ares R, et al. Microencapsulation of a probiotic and prebiotic in alginate-chitosan capsules improves survival in simulated gastro-intestinal conditions[J]. Int J Food Microbiol, 2010, 142: 185–189. DOI:10.1016/j.ijfoodmicro.2010.06.022 |
 2017, Vol. 52
2017, Vol. 52



