2. 成都中医药大学药学院, 四川 成都 611137;
3. 河南中医药大学第一附属医院, 河南 郑州 450000;
4. 郑州大学基础医学院临床药理研究所, 河南 郑州 450001;
5. 郑州大学第一附属医院, 河南 郑州 450052;
6. 河南中医药大学药学院, 河南 郑州 450008;
7. 中国医学科学院肿瘤医院, 北京 100021
2. School of Pharmacy, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China;
3. The First Affiliated Hospital of Henan University of Chinese Medicine, Zhengzhou 450000, China;
4. Clinical Pharmacology Institute, School of Basic Medical Sciences, Zhengzhou University, Zhengzhou 450001, China;
5. The First Affiliated Hospital of Zhengzhou University, Zhengzhou 450052, China;
6. School of Pharmacy, Henan University of Chinese Medicine, Zhengzhou 450008, China;
7. Cancer Hospital, Chinese Academy of Medical Sciences, Beijing 100021, China
近年来中药肝毒性问题日益突出, 严重影响了临床用药安全性。壮骨关节丸(Zhuangguguanjie wan, ZGW)是我国临床常用的骨关节病治疗药物, 但国家食品药品不良反应监测中心分别于2001年和2008年通报了ZGW致肝损伤现象。ZGW由补骨脂、淫羊藿、狗脊、续断、桑寄生、独活、熟地黄和骨碎补8味常用补肝肾药和木香、鸡血藤、乳香、没药组方而成, 从组方来看ZGW中均为传统无毒中药, 因此其导致肝损伤的原因和机制目前还不明确。
根据Lü等[1]采用数据挖掘方法对1.8万余篇文献进行研究, 中医治疗风湿骨病主要应用以祛风湿药和活血药为主。而通过组方分析发现的处方组成与大数据挖掘发现的中医常用方药组成有较大差异, 所含祛风湿和活血中药较少, 促进免疫作用的补肝肾中药较多, 占2/3, 宜用于肝肾亏虚为主的痹证。本课题组前期利用临床病例和脂多糖(lipopolysaccharide, LPS)介导的药物特异质肝损伤评价模型等研究证实了补肝肾中药何首乌诱导的肝损伤为免疫特异质肝损伤, 其肝损伤的产生与机体的免疫状态相关, 并筛查获得其机体免疫易感因素, 明确了其临床易感人群[2, 3]。在此基础上, 利用LPS介导的药物特异质肝损伤评价模型阐明了何首乌肝损伤的作用机制[4]并提出了中药特异质肝损伤“免疫应激三因致毒”机制假说[5, 6]。
根据ZGW致肝损伤的临床应用文献及临床病例, 结合ZGW的组方特点, 推测ZGW致肝损伤可能与何首乌诱导的肝损伤一致, 也是由机体免疫异常活化和药物共同作用导致的免疫特异质肝损伤, 为此, 参考前期何首乌特异质肝损伤的研究基础, 本文采用LPS致特异质肝损伤模型, 研究ZGW肝损伤与机体免疫状态的关系并对其机制进行初步探讨。
材料与方法动物 雄性SD大鼠, SPF级, 180~190 g, 由军事医学科学院实验动物中心提供, 合格证号为SCXK-(军) 2012-0004。饲养于中国人民解放军第302医院实验动物中心, 自由饮食、饮水, 室内保持12 h照明, 12 h黑暗, 通风良好、环境安静。
药物与试剂 ZGW(批号: 1512007S)购于华润三九医药股份有限公司; LPS (批号: 046M4045V)购于Sigma公司; 水合氯醛(批号: 20150923) 购于宇龙海藻有限公司; 福尔马林固定液(批号: 20160608) 购于北京益利精细化学品有限公司; PE-CyTM5 Mouse Anti-Rat CD4 (批号: 5274535)、FITC Mouse Anti-Rat CD3 (批号: 4233838)、PE Mouse Anti-Rat CD25 (批号: S023766)、Alexa Fluor 647 Mouse Anti-Rat CD8a(批号: 6053868) 和流式细胞分析用溶血素(批号: 349202) 均购于BD公司; 二甲苯(批号: 20160510) 购于北京化工厂; 双氧水(批号: 10011218) 购于国药集团化学试剂有限公司; BSA (货号: A8020) 购于Solarbio公司; EDTA (pH 8.0) 抗原修复液(批号: 20160915)、免疫组化CD3一抗(货号: GB13014)、CD4 (货号: GB13064) 和CD8 (货号: GB13068) 均购于武汉谷歌生物科技有限公司; 免疫组化二抗HRP山羊抗兔鼠通用(货号: K5007) 和免疫组化试剂盒DAB显色剂(货号: K5007) 均购于Dako公司; Protease Inhibitor Cocktail I (20-201)、BCA Protein Assay Kit (71285-3CN)、MILLIPLEX MAP Lysis buffer for Multiplexing (43-040) 和MILLIPLEX Catalog ID. (RECYTMAG-65K-27.Rat)均购于默克化工技术(上海)有限公司。
仪器 FW-500高速万能粉碎机(北京科伟永兴仪器有限公司); ME204电子天平(梅特勒-托利多仪器有限公司); 迈瑞BS-300全自动生化分析仪(上海富众生物科学有限公司); Neofuge1600R低温台式高速离心机(上海力申科学仪器有限公司); Leica EG1150组织包埋机(上海莱卡仪器有限公司); Rm-2235石蜡切片机(德国莱卡公司); ECLIPSE80i显微镜(日本尼康公司); Luminex 200蛋白芯片多功能液相芯片分析仪[美国默克化工技术(上海)有限公司]; Milliplex磁珠检测系统、Milliplex多功能液相芯片分析平台、Mettler Toledo AL204分析天平(瑞士梅特勒-托利多公司); Thermo Micro 21R高速冷冻离心机(深圳华瑞达贸易发展有限公司); FACSCalibur流式细胞(BD公司)。
药品制备 将购买的ZGW用粉碎机粉碎, 过筛(100目)备用, 临用前用0.5%羧甲基纤维素钠(carboxymethylcellulose sodium, CMC)配制成混悬液。
ZGW的特异质肝损伤评价 将SD大鼠随机分为4组:正常对照组、ZGW组(3.8 g·kg-1)、LPS组(2.8 mg·kg-1, 参考文献PMID: 12730616) 和ZGW (3.8 g·kg-1) + LPS (2.8 mg·kg-1), 将大鼠称重。对照组和LPS组灌胃CMC, ZGW组和ZGW+LPS组灌胃CMC配制的ZGW混悬液, 灌胃2 h后LPS组和ZGW+LPS组尾静脉注射2.8 mg·kg-1 LPS, 在尾静脉注射LPS 10 h时, 使用10%水合氯醛(给药体积为3 mL·kg-1)麻醉大鼠, 下腔静脉取血, 4 ℃、3 500 r·min-1, 离心10 min, 取上清。取大鼠肝脏组织1.5 cm × 1 cm × 0.5 cm, 立即浸入10%福尔马林溶液固定, 剩余肝组织放入-80 ℃冰箱冻存。
肝功能指标检测 利用全自动生化分析仪, 按照使用说明书检测血清ALT和AST活力。
肝脏病理学检查 取10%福尔马林溶液固定大鼠肝脏组织, 进行常规病理切片, HE染色, 观察病理变化。
细胞因子检测 将肝组织从-80 ℃冰箱中取出, 冰上操作, 剪取一定重量肝组织, 加入含蛋白抑制剂的裂解液(9 mL: 1 g), 利用高速粉碎机粉碎为匀浆液, 4 ℃、4 500 ×g离心20 min, 取上清。按照BCA试剂盒说明书进行蛋白定量并进行蛋白调平, 采用Milliplex蛋白芯片Kit对大鼠肝组织裂解液中的嗜酸性粒细胞趋化因子(eotaxin)、趋化因子-10 (inter feron-inducible protein-10, IP-10)、单核细胞趋化蛋白1 (monocyte chemotactic protein 1, MCP-1)、调节活化正常T细胞表达和分泌的趋化因子(regulated upon activation normal T cell expressed and secreted factor, RANTES)、嗜中性趋化因子(GRO/KC)、CX3CL1趋化因子(fractalkine)、脂多糖诱导的CXC趋化因子(LIX)、巨噬细胞炎性蛋白1α (macrophage inflammatory protein, MIP-lα)、巨噬细胞炎性蛋白-2 (macrophage inflammatory protein-2, MIP-2)、肿瘤坏死因子(tumor necrosis factor, TNF-α)、粒细胞集落刺激因子(granulocyte colony stimulating factor, G-CSF)、粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor, GM-CSF)、表皮细胞生长因子(epidermal growth factor, EGF)、血管内皮生长因子(vascular endothelial growth factor, VEGF)、白介素-1α (interleukin-1α, IL-1α)、白介素-1β (interleukin-1β, IL-1β)、白介素-2 (interleukin-2, IL-2)、白介素-4 (interleukin-4, IL-4)、白介素-5 (interleukin-5, IL-5)、白介素-6 (interleukin-6, IL-6)、白介素-10 (interleukin-10, IL-10)、白介素-12 (p70) [interleukin-12 (p70), IL-12 (p70)]、白介素-13 (interleukin-13, IL-13)、白介素-17A (interleukin-17A, IL-17A)、白介素-18 (interleukin-18, IL-18)、干扰素-γ (interferon-γ, IFNγ)和瘦素(leptin)等27种细胞因子进行检测与筛选。
免疫细胞检测 ① 血液免疫细胞亚群检测:给药前眼眶取血1 mL, 采用流式细胞术检测血液免疫细胞亚群比例; 尾静脉注射LPS 10 h后, 使用10%水合氯醛将大鼠麻醉, 下腔静脉取血, 采用流式细胞术检测血液中免疫细胞亚群比例。② 肝脏组织免疫细胞检测:取10%福尔马林溶液固定大鼠肝脏组织, 采用免疫组化技术检测肝脏组织中的免疫细胞数量。
统计学分析 采用SPSS 17.0统计软件进行分析, 计量资料多组间比较采用单因素方差分析(one-way ANOVA), 两组间比较用t检验, P < 0.05表示具有显著性差异。
结果 1 肝功能变化与正常对照组比较, 单独灌胃ZGW组及单独尾静脉注射LPS组ALT、AST活力均无明显改变(P > 0.05);与LPS组比较, 灌胃ZGW联合尾静脉注射LPS组ALT、AST活力均显著升高(P < 0.05, P < 0.01), 说明ZGW引起的肝损伤属于特异质肝损伤。结果见图 1。
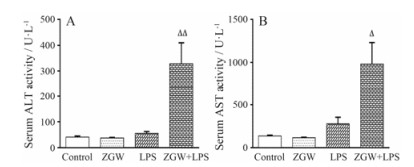
|
Figure 1 Influence of co-treatment with lipopolysaccharide (LPS) and Zhuangguguanjie wan (ZGW) on serum alanineaminotransferase (ALT)(A) and aspartate aminotransferase (AST) (B) activities. Control group was intragastrically administered with carboxymethylcellulose sodium (CMC) and injected of saline; ZGW group was intragastrically administered with ZGW (3.8 g·kg-1) and injected of saline; LPS group was intragastrically administered with CMC and injected of LPS (2.8 mg·kg-1); ZGW+LPS group was intragastrically administered with ZGW (3.8 g·kg-1) and injected of LPS (2.8 mg·kg-1). n = 10, x± s. △P < 0.05, △△P < 0.01 vs LPS group |
在光镜下, 对照组可见肝小叶结构正常, 肝细胞索自中央静脉呈放射状排列, 伸向肝小叶周边部, 肝窦含有红细胞, 肝血窦间隙清晰, 偶见炎细胞浸润; LPS组可见肝组织内部分中央静脉周围炎细胞浸润, 肝细胞肿大, 胞浆疏松, 呈网状、半透明; ZGW组可见肝细胞索自中央静脉呈放射状排列, 伸向肝小叶周边部, 肝窦含有红细胞, 被覆星状细胞, 偶见炎细胞浸润; ZGW+LPS组可见肝细胞散在变性, 肝小叶排列紊乱, 肝细胞呈单个或不规则的岛屿状或团块状坏死。结果见图 2A~D。
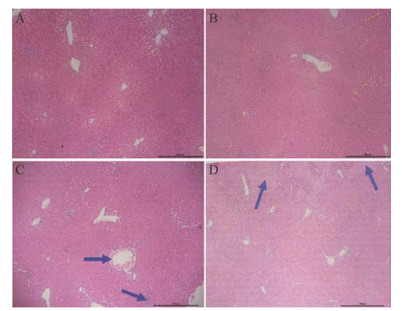
|
Figure 2 Representative microphotographs of livers isolated from rats. CMC-treated (control) (A) and ZGW (3.8 g·kg-1, ig)-treated (B) rats had no histopathological changes. Treatment with LPS (2.8 mg·kg-1, i.v.) alone (C) caused slight infiltration of inflammatory cells in portal area but no evident hepatocytes injury. Co-treatment with ZGW (3.8 g·kg-1) and LPS (2.8 mg·kg-1) (D) caused hepatocyte massive necrosis. HE staining (×200) |
与对照组比较, LPS组有9个细胞因子的表达显著改变, 分别为趋化因子IP-10 (P < 0.001)、RANTES (P < 0.01);免疫介质类MIP-1α (P < 0.001);生长因子类G-CSF (P < 0.001);白细胞介素类IL-lα (P < 0.001)、IL-1β (P < 0.001)、IL-4 (P < 0.01)、IL-5 (P < 0.05) 和IL-10 (P < 0.01)。
与LPS组比较, LPS联合ZGW组有14个细胞因子表达显著改变, 分别为趋化因子eotaxin (P < 0.001)、IP-10 (P < 0.001)、GRO/KC (P < 0.05)、fractalkine (P < 0.001)、LIX (P < 0.01);免疫介质类MIP-1α (P < 0.001)、TNF-α (P < 0.05);白细胞介素类IL-lα (P < 0.001)、IL-1β (P < 0.001)、IL-5 (P < 0.001)、IL-6 (P < 0.01)、IL-10 (P < 0.001)、IL-13 (P < 0.001) 和IL-18 (P < 0.001)。所有27种细胞因子的结果见图 3A~Φ。
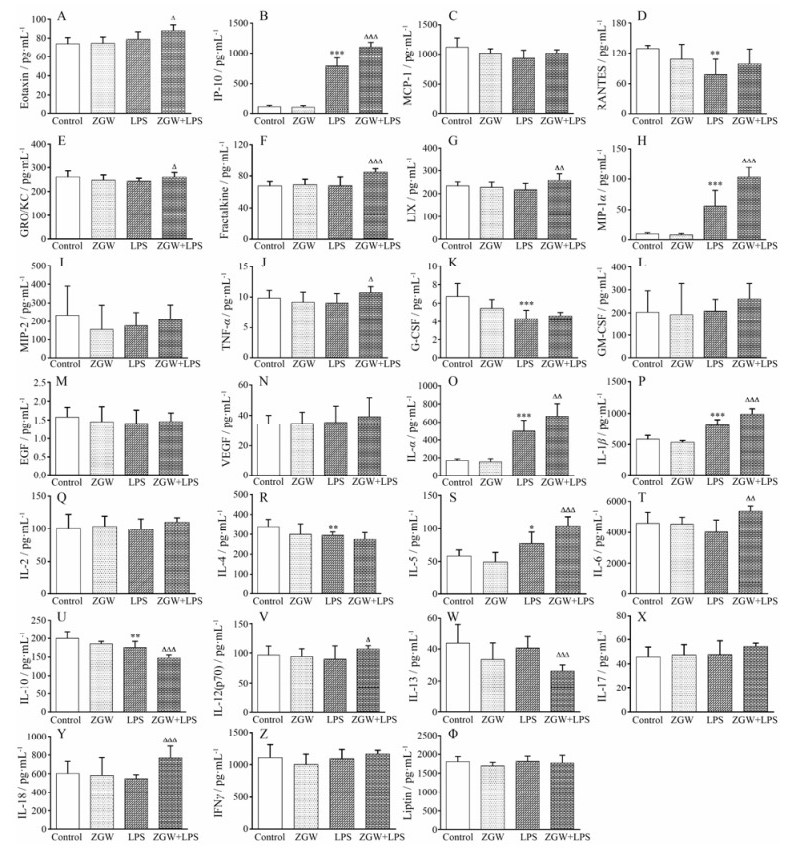
|
Figure 3 Influence of co-treatment with LPS and ZGW on hepatic cytokines. A-Φ represent the contents of eotaxin, IP-10, MCP-1, RANTES, GRO/KC, fractalkine, LIX, MIP-1α, MIP-2, TNF-α, G-CSF, GM-CSF, EGF, VEGF, IL-1α, IL-1β, IL-2, IL-4, IL-5, IL-6, IL-10, IL-12 (p70), IL-13, IL-17, IL-18, IFNγ, leptin, respectively, after different treatment. n = 10, x± s. *P < 0.05, **P < 0.01, ***P < 0.001 vs control group; △P < 0.05, △△P < 0.01, △△△P < 0.001 vs LPS group |
给药后区域各组与给药前区域相应组比较, LPS可显著降低淋巴细胞(lymphocyte)总数(P < 0.001)、CD3+ T细胞/lymphocyte比例(P < 0.001)、CD8+/ CD3+比例(P < 0.001) 和CD8+/CD4+比值(P < 0.001), 而CD4+/CD3+比例(P < 0.001) 和调节性T细胞CD4+CD25+/CD3+比例(P < 0.001) 显著增加; ZGW可显著降低CD8+/CD3+比例(P < 0.05)、CD8+/CD4+比值(P < 0.05), 但可显著升高CD4+/CD3+比例(P < 0.05); ZGW+LPS可显著降低lymphocyte总数(P < 0.001)、CD3+ T细胞/lymphocyte比例(P < 0.01)、CD8+/CD3+比例(P < 0.001)、CD8+/CD4+比值(P < 0.001), 但可显著升高CD4+CD25+/CD3+比例(P < 0.001)、CD4+/CD3+比例(P < 0.001)。
给药后区域内部各组比较, 与对照组比较, LPS可显著降低lymphocyte总数(P < 0.001)、CD3+ T细胞/lymphocyte比例(P < 0.01)、CD8+/CD3+比例(P < 0.001) 和CD8+/CD4+比值(P < 0.001), 但可显著增加CD4+CD25+/CD3+比例(P < 0.001)、CD4+/CD3+比例(P < 0.001)。结果见图 4A~F。
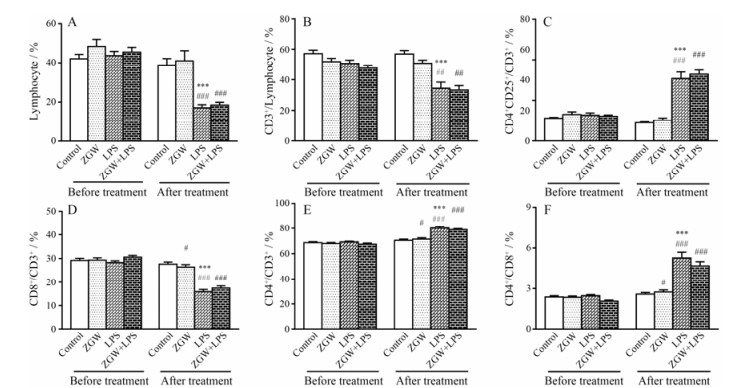
|
Figure 4 Influence of co-treatment with LPS and ZGW on blood immune cells. n = 10, x± s. ***P < 0.001 vs control group in the after treatment area; #P < 0.05, ##P < 0.01, ###P < 0.001 vs before treatment |
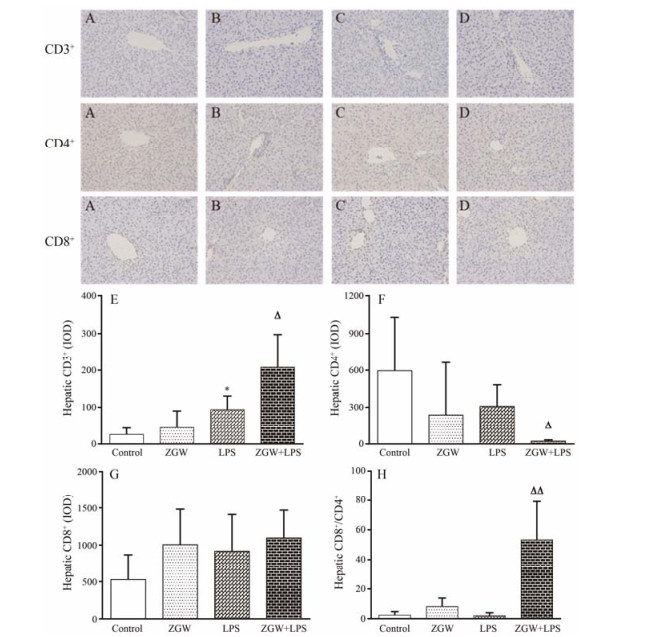
与对照组比较, LPS组肝脏中CD3+显著增高; 与LPS组比较, ZGW+LPS组肝脏中CD3+显著升高、CD4+显著下降, CD8+/CD4+的比值显著升高。结果见图 5。
|
Figure 5 Influence of co-treatment with LPS and ZGW on hepatic immune cells. A: CMC-treated (control); B: ZGW-treated alone; C: LPS-treated alone; D: Co-treatment with ZGW and LPS. Immunohistochemistry (×200); E-H represent the contents of hepatic CD3+, hepatic CD4+, hepatic CD8+ and the ratio of hepatic CD8+/CD4+ respectively, after different treatment. n = 10, x± s. *P < 0.05 vs control group; △P < 0.05, △△P < 0.01 vs LPS group |
药物肝损伤可分为固有型肝损伤和特异质肝损伤[7, 8], 固有型肝损伤是与药物自身及其代谢产物对机体产生的直接作用, 损伤程度与剂量、时间呈相关性; 而特异质肝损伤主要与机体因素有关, 具有偶发性和隐匿性, 是药物与特定机体状态的综合作用结果。ZGW中各味中药日用量均显著低于药典中最高日用剂量, 仅有少部分患者服用ZGW发生肝损伤, 符合特异质肝损伤的特点。实验结果表明ZGW单独给药组对ALT和AST活力无明显影响, 肝组织病理检查也未见显著损伤, 但相同剂量的ZGW联合LPS组中ALT和AST活力较LPS组均显著升高(P < 0.05, P < 0.01), 而且肝组织病理检测表明ZGW联合LPS组的肝细胞变性及坏死程度均较LPS组严重, 表明在LPS诱导的免疫活化条件下ZGW可引起免疫应激介导的药物特异质肝损伤。
药物特异质肝损伤有免疫特异质和代谢特异质两种类型, 前者与机体的免疫应激状态有关[9-11], ZGW中具有促进免疫作用的补肝肾中药占处方的2/3, 临床用于机体免疫水平较低的骨关节炎、骨质疏松等病症安全性较好, 但用于免疫水平较高的类风湿性关节炎和脊柱炎等病症时肝损伤风险较高, 因此作者试图从免疫学角度去揭示ZGW的特异质肝损伤机制, 而无毒剂量的LPS致免疫敏化动物模型是评价药物免疫特异质肝损伤公认的方法之一[12, 13]。
CD4+ T细胞根据自身所分泌的细胞因子不同分为Th1和Th2两个亚群, Th1细胞主要分泌细胞因子IFNγ、IL-2和IP-10等[14], 促进细胞免疫; Th2细胞主要分泌细胞因子IL-4和IL-10等[15], 为抗炎细胞, 同时可促进体液免疫。临床和实验研究中常以细胞因子的相对比值(IFNγ/IL-4) 来评估Th1和Th2亚群的平衡状态[16]。本实验检测到在LPS诱导的免疫活化模型中, Th1型细胞因子IP-10含量较正常对照组显著上升, 而Th2型细胞因子IL-4和IL-10的含量较正常对照组显著下降, 表明该模型Th1/Th2平衡向Th1偏移, 处于免疫活化状态。在LPS基础上给予ZGW后, Th1型细胞因子IP-10含量较LPS组进一步升高, 而Th2型细胞因子IL-10较LPS组进一步降低, 平衡进一步偏向Th1型, 细胞免疫反应进一步增强, 表明正常对照组、LPS组和LPS+ZGW组的肝组织细胞免疫活化程度呈递增状态。
T细胞CD4+/CD8+比值作为免疫调节的指标之一, 正常值约为0.68~2.47, 大于2.47常见于免疫性疾病[17], 其值可以反映机体的免疫状态。实验结果表明, 全血CD4+/CD8+比值正常对照组为2.59, ZGW组为2.75, 而LPS组为5.27, 提示LPS刺激下机体已处于免疫应激状态, 同时肝脏组织中T淋巴细胞显著增加。趋化因子可趋化免疫细胞的迁移[18], 本实验检测到肝脏中趋化因子IP-10和MIP-1α及T淋巴细胞在正常对照组、LPS组和LPS+ZGW组中呈现逐级递增状态, 同时发现参与肝损伤过程的TNF-α、IL-6、IL-12 (p70) 和IL-18等[19-21]细胞因子在LPS组与正常对照组间无明显差异, 而在LPS+ZGW组中显著升高(P < 0.05), 由此推测ZGW在LPS免疫活化状态下趋化因子通过进一步募集和激活免疫细胞, 产生大量TNF-α、IL-6、IL-12 (p70) 和IL-18等炎性因子加重肝损伤。
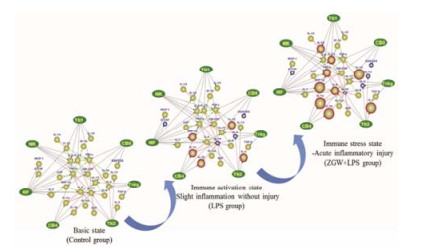
白介素是在白细胞或免疫细胞间相互作用的淋巴因子, 在传递信息、激活与调节免疫细胞, 介导T、B细胞活化、增殖与分化及炎症反应中起重要作用。IL-1主要由活化的单核-巨噬细胞产生, 主要有IL-1α和IL-1β亚型[22]。局部低浓度时协同刺激抗原提呈细胞(antigen presenting cell, APC)和T细胞活化, 促进B细胞增殖和分泌抗体, 进行免疫调节。大量产生时可诱导肝脏急性期蛋白合成。IL-4主要由Th2细胞、肥大细胞及嗜碱性粒细胞产生, 可抑制Th1细胞活化, 具有抗炎作用[23]。IL-5主要由活化的CD4+ T细胞产生, 对B细胞和嗜酸性粒细胞的增殖分化有重要调节作用[24]。IL-10是一种多功能负性调节因子, 主要由Th2细胞、活化的B细胞、单核细胞和巨噬细胞产生, 发挥下调炎症反应和拮抗炎性介质的作用[25]。本实验检测到在正常对照组、LPS组和ZGW+LPS组中炎症抑制因子IL-4、IL-10呈逐级降低的趋势, 促炎因子IL-1α、IL-1β和IL-5呈逐级升高的趋势, 再次表明正常对照组、LPS组和LPS+ZGW组的免疫细胞因子呈免疫活化递增的趋势, 如图 6所示。
|
Figure 6 Immune stress-mediated idiosyncratic liver injury by ZGW. The green ellipsoidal balls represent immune cells. The cyan round balls represent immune factors. Red circle around cyan round balls: increased or elevated; Blue circle around cyan round balls: decreased or inhibited |
本研究结果表明, ZGW对正常动物无明显肝损伤作用, 但在LPS诱导的免疫活化条件下ZGW可引起肝脏损伤, 属于免疫应激介导的特异质肝损伤。当机体免疫处于免疫活化状态时, ZGW募集T淋巴细胞向肝脏聚集, 导致细胞因子过表达和过度炎症反应, 从而诱发药物特异质肝损伤。
| [1] | Lü YB, Li L, Wang ZF, et al. The medication regularity of traditional Chinese medicine against rheumatoid arthritis, gout and osteoarthritis[J]. World Sci Technol Modern Tradit Chin Med(世界科学技术-现代中医), 2010, 12: 833–836. |
| [2] | Wang Q, Mei H, Zhang YL, et al. The associations between idiosyncratic adverse drug reactions and HLA alleles and their underlying mechanism[J]. Acta Pharm Sin(药学学报), 2013, 48: 799–808. |
| [3] | Li CY, Li XF, Tu C, et al. The idiosyncratic hepatotoxicity of Polygonum multiflorum based on endotoxin model[J]. Acta Pharm Sin(药学学报), 2015, 50: 28–33. |
| [4] | Li CY, Tu C, Gao D, et al. Metabolomic study on idiosyncratic liver injury induced by different extracts of Polygonum multiflorum in rats integrated with pattern recognition and enriched pathways analysis[J]. Front Pharmacol, 2016, 7: 483. |
| [5] | Wang JB, Cui HR, Bai ZF, et al. Precision medicine-oriented safety assessment strategy for traditional Chinese medicines: disease-syndrome-based toxicology[J]. Acta Pharm Sin(药学学报), 2016, 51: 1681–1688. |
| [6] | Wang JB, LI CY, Zhu Y, et al. Integrated evidence chain-based identification of Chinese herbal medicine-induced hepatotoxicity and rational usage: exemplification by Polygonum multiflorum(He shou wu)[J]. Chin Sci Bull(科学通报), 2016, 61: 971–980. |
| [7] | Zhang SY, Zhu XG, Zhang GP, et al. Study on acute and chronic toxicities of Polygoni multiflori Radix Praeparata extracts[J]. J Toxicol(毒理学杂志), 2013, 274: 261–264. |
| [8] | Navarro VJ, Senior JR. Drug-related hepatotoxicity[J]. New Engl J Med, 2006, 354: 731–739. DOI:10.1056/NEJMra052270 |
| [9] | Amacher DE. The primary role of hepatic metabolism in idiosyncratic drug-induced liver injury[J]. Expert Opin Drug Metab Toxicol, 2012, 8: 335–347. DOI:10.1517/17425255.2012.658041 |
| [10] | Zhang X, Zhang X, Chen X, et al. Involvement of the immune system in idiosyncratic drug reactions[J]. Drug Metab Pharmacokinet, 2011, 26: 47–59. DOI:10.2133/dmpk.DMPK-10-RV-085 |
| [11] | Shaw PJ, Beggs KM, Sparkenbaugh EM, et al. Trovafloxacin enhances TNF-induced inflammatory stress and cell death signaling and reduces TNF clearance in a murine model of idiosyncratic hepatotoxicity[J]. Toxicol Sci, 2009, 111: 288–301. DOI:10.1093/toxsci/kfp163 |
| [12] | Ramm S, Morissey B, Hernandez B, et al. Application of a discovery to targeted LC-MS proteomics approach to identify deregulated proteins associated with idiosyncratic liver toxicity in a rat model of LPS/diclofenac co-administration[J]. Toxicology, 2015, 331: 100–111. DOI:10.1016/j.tox.2015.03.004 |
| [13] | Waring JF, Liguori MJ, Luyendyk JP, et al. Microarray analysis of lipopolysaccharide potentiation of trovafloxacin-induced liver injury in rats suggests a role for proinflammatory chemokines and neutrophils[J]. J Pharmacol Exp Ther, 2006, 316: 1080–1087. |
| [14] | Antonelli A, Ferrari SM, Giuggioli D, et al. Chemokine(C-X-C motif)ligand(CXCL)10 in autoimmune diseases[J]. Autoimmun Rev, 2014, 13: 272–280. DOI:10.1016/j.autrev.2013.10.010 |
| [15] | Fietta P, Delsante G. The effector T helper cell triade[J]. Riv Biol, 2009, 102: 61–74. |
| [16] | Hirahara K, Nakayama T. CD4+ T-cell subsets in inflammatory diseases: beyond the Th1/Th2 paradigm[J]. Int Immunol, 2016, 28: 163–171. DOI:10.1093/intimm/dxw006 |
| [17] | Jia ZS, Yu L. Detection of T lymphocyte subsets and its clinical significance[J]. Int J Lab Med(国外医学临床生物化学与检验学分册), 1992, 13: 157–160. |
| [18] | Zheng H. Functions of chemokines and their receptors[J]. Acta Immunol J(免疫学杂志), 2004, 20: 1–5. |
| [19] | Eguchi A, Wree A, Feldstein AE. Biomarkers of liver cell death[J]. J Hepatol, 2014, 60: 1063–1074. DOI:10.1016/j.jhep.2013.12.026 |
| [20] | Schmidt-Arras D, Rose-John S. IL-6 pathway in the liver: from physiopathology to therapy[J]. J Hepatol, 2016, 64: 1403–1415. DOI:10.1016/j.jhep.2016.02.004 |
| [21] | Kolarski V, Todorov A, Petrova D. Cytokines and the liver in health and disease[J]. Vutr Boles, 2000, 32: 19–24. |
| [22] | Kwak A, Lee Y, Kim H, et al. Intracellular interleukin(IL)-1 family cytokine processing enzyme[J]. Arch Pharm Res, 2016, 39: 1556–1564. DOI:10.1007/s12272-016-0855-0 |
| [23] | Ul-Haq Z, Naz S, Mesaik MA. Interleukin-4 receptor signaling and its binding mechanism: a therapeutic insight from inhibitors tool box[J]. Cytokine Growth Factor Rev, 2016, 32: 3–15. DOI:10.1016/j.cytogfr.2016.04.002 |
| [24] | Takatsu K, Kouro T, Nagai Y. Interleukin 5 in the link between the innate and acquired immune response[J]. Adv Immunol, 2009, 101: 191–236. DOI:10.1016/S0065-2776(08)01006-7 |
| [25] | Mingomataj EÇ, Bakiri AH. Regulator versus effector paradigm: interleukin-10 as indicator of the switching response[J]. Clin Rev Allergy Immunol, 2016, 50: 97–113. DOI:10.1007/s12016-015-8514-7 |
 2017, Vol. 52
2017, Vol. 52


